猪附红细胞体SYBR Green I荧光定量PCR检测方法的建立
2017-11-17伍生军倪婷婷张守发许应天孙兴忠薛书江
伍生军, 倪婷婷, 张守发, 许应天, 孙兴忠, 薛书江*
(1.延边大学农学院,吉林 延吉 133002;2.白城市动物疫病预防控制中心,吉林 白城 137000)
猪附红细胞体SYBRGreenI荧光定量PCR检测方法的建立
伍生军1, 倪婷婷1, 张守发1, 许应天1, 孙兴忠2, 薛书江1*
(1.延边大学农学院,吉林 延吉 133002;2.白城市动物疫病预防控制中心,吉林 白城 137000)
为建一种快速、高效、灵敏的猪附红细胞体(M.suis)检测方法。本研究根据GenBank中的猪附红细胞体α-烯醇化酶(Eno)基因(序列号:AB265823.1),设计并合成了1对引物P5和P6,通过常规PCR方法对Eno基因中的一段序列进行扩增,并将其纯化后的PCR产物克隆入pMD-18T载体中,从而构建重组质粒。以阳性重组质粒为模板,建立了猪附红细胞体SYBR GreenⅠ荧光定量PCR检测方法,并对其灵敏性、特异性进行检测。在1.44×106~1.44×102拷贝/μL范围内具有较好的线性关系,相关系数R2=0.965,检测到的浓度下限为1.44拷贝/μL。特异性试验中仅对猪附红细胞体的检测结果呈阳性,而对猪肺炎支原体、弓形虫、猪链球菌、猪呼吸与繁殖综合征病毒的检测结果均呈阴性。重复性试验结果表明,其组内和组间变异系数均小于2.0%。用该检测方法对49份猪附红细胞体疑似血液样品进行检测,所建立的荧光定量PCR方法检测的阳性率为40.8%(20/49),高出常规PCR方法检测的阳性率1.33倍。SYBR GreenⅠ荧光定量PCR检测方法的成功建立,为猪附红细胞体感染的早期诊断及定量分析提供了可靠依据。
猪附红细胞体;SYBR Green Ⅰ;荧光定量PCR;Eno基因
猪附红细胞体病是由寄生在动物红细胞表面、血浆和骨髓等部位的病原体—附红细胞体所引起的1种人兽共患传染病。贫血、黄疸、发热等是该病的主要致病症状,正常状况下发病率和死亡率较低,隐性感染率较高,多伴随其他疾病以混合感染形式出现。慢性病例能降低母猪的繁殖能力,同时导致育肥猪生长迟缓,增加呼吸性和肠道性疾病的发病率[1-3]。近年来,猪附红细胞体病的流行给各地方畜牧产业带来巨大的损失。目前,该病诊断的常规检测方法主要有血液压片镜检、血液涂片染色镜检、血清学方法和PCR等[4-6]。传统的镜检法出于红细胞变形、染料沉淀和非病原微生物染色干扰等因素常出现假阳性结果[7],而Gwaltney S M等最早建立的M.suis的PCR诊断方法对动物传染病只能进行定性分析,而无法做到实时定量分析[8]。近年来国内兴起的荧光定量技术具有高度特异性、光谱技术的高敏感性和精确性等特点,被广泛应用于医疗、药物研究、病原菌的检测等体外扩增技术[9-10]。常用的荧光定量技术主要有SYBR Green Ⅰ荧光定量PCR法和Taqman探针荧光定量PCR法。张长莹、李丹丹等分别针对不同病原体建立了Taqman探针荧光定量PCR法,但该方法操作繁琐,如Taqman探针的设计过程等;同时,对实验经费和仪器设备的要求较高[11-12]。而孙俊颖、曹贝贝、赵丽等和徐卫松等建立的SYBR Green Ⅰ 荧光定量PCR法在实际应用中更快捷,且经济实用[13-16]。故本试验以Eno基因保守序列为靶基因,设计相应引物,成功建立了快速检测猪附红细胞体的SYBR Green Ⅰ荧光定量PCR法。
1 材料与方法
1.1材料
1.1.1 主要试剂
pMD 18-T载体、凝胶回收试剂盒和SYBR Premix ExTaq酶均为宝生物(大连)生物工程公司产品。
1.1.2 样品及菌株
猪附红细胞体阳性血液样本采自吉林省延边某猪场;弓形虫(T.gondii)、猪链球菌(S.suis)、猪肺炎支原体(M.hyopneumoniae)、猪呼吸与繁殖综合征病毒(PRRSV)由延边大学农学院预防兽医学实验室保存。
1.2方法
1.2.1 引物设计与合成
根据猪附红细胞体基因组(登录号:NC_015153)中的Eno基因序列,设计1对引物如下,由上海生工生物工程有限公司合成。预期扩增产物片段大小约为170 bp。
P5:5′-AGGTAACCCAACCGTAGCAT-3′;
P6:5′TCTTAACTCCCTTTCCTCCAA-3′。
1.2.2 荧光定量PCR反应条件的优化
优化后的扩增循环参数设置如下:95 ℃,5 min;95 ℃ 10 s、95 ℃ 30 s,共40个循环数;延伸时采集荧光信号;采用优化后的Taq酶及引物添加浓度。
1.2.3 重组质粒标准品的制备
用常规PCR扩增目的基因片段,经琼脂糖凝胶电泳检测后将所需目的片段回收,克隆至pMD 18-T载体,最后转入感受态细胞中,37 ℃摇均直至菌液混浊后提取质粒。根据拷贝数=[质量(g)/分子质量(Da)]×6.0×1023,阿伏伽德罗常数6.02×1023转换成该核酸片段拷贝数/μL。将质粒标准品进行10倍梯度稀释(1.44×107~1.44×100拷贝/μL)。
1.2.4 标准曲线的建立
将标准重组质粒用灭菌去离子水作1.44×106~1.44×102拷贝/μL梯度稀释,各取1 μL进行扩增。以起始模板拷贝数的对数为X轴,Ct值为Y轴建立标准曲线,分析测得Ct值,确定检测范围。
1.2.5 特异性试验
用本试验建立的SYBR Green Ⅰ荧光定量PCR方法对M.suis DNA检测分析,并以弓形虫、猪链球菌、猪肺炎支原体和猪繁殖与呼吸综合症病毒等的DNA样本作为对照组,验证该方法的特异性。
1.2.6 敏感性试验
对选取的8个稀释梯度1.44×107~1.44×100拷贝/μL的重组质粒标准品进行荧光定量PCR扩增,确定该方法的浓度检测下限。
1.2.7 重复性试验
选取稀释浓度为2.26×105、2.26×104和2.26×103拷贝/μL的重组质粒,分别以此为模板进行荧光定量PCR分析,每个样品进行3次重复性实验,根据所得标准曲线计算初始模板DNA含量,最后与实际测得模板量对比,得以鉴定此方法的重复性。
1.2.8 临床样本检测
用常规PCR方法和SYBR Green Ⅰ荧光定量PCR方法,对采自吉林省延边共49份猪血液样品进行检测,并对2者的检出率进行比较。
2 结果与分析
2.1荧光定量PCR反应条件的优化
优化后的反应体系中,各组分含量为:上下游引物各1.2 μL,重组质粒模板2 μL,SYBR Premix ExTaq10.4 μL,ddH2O 5.2 μL,扩增参数为95 ℃,5 min;95 ℃ 10 s、60 ℃ 30 s,共40个循环数,该条件下Ct至最小,扩增效果最好。
2.2标准曲线的建立
以获得的Ct值为Y轴,标准品的拷贝数为X轴,制作出标准曲线。样品初始拷贝数与Ct值之间的线性关系为:Ct=-3.138 x+39.65,标准曲线的斜率为-3.138,相关系数为0.965,轴截距为39.65,结果显示,模板浓度在1.44×106~1.44×102拷贝/μL范围内具有较好的线性关系。此外,得到的溶解曲线只有目的基因扩增片段产生的单一特异峰,无非特异扩增峰或引物二聚体,阴性对照也为水平线,且熔解温度Tm为(81.5±0.5) ℃(图1)。
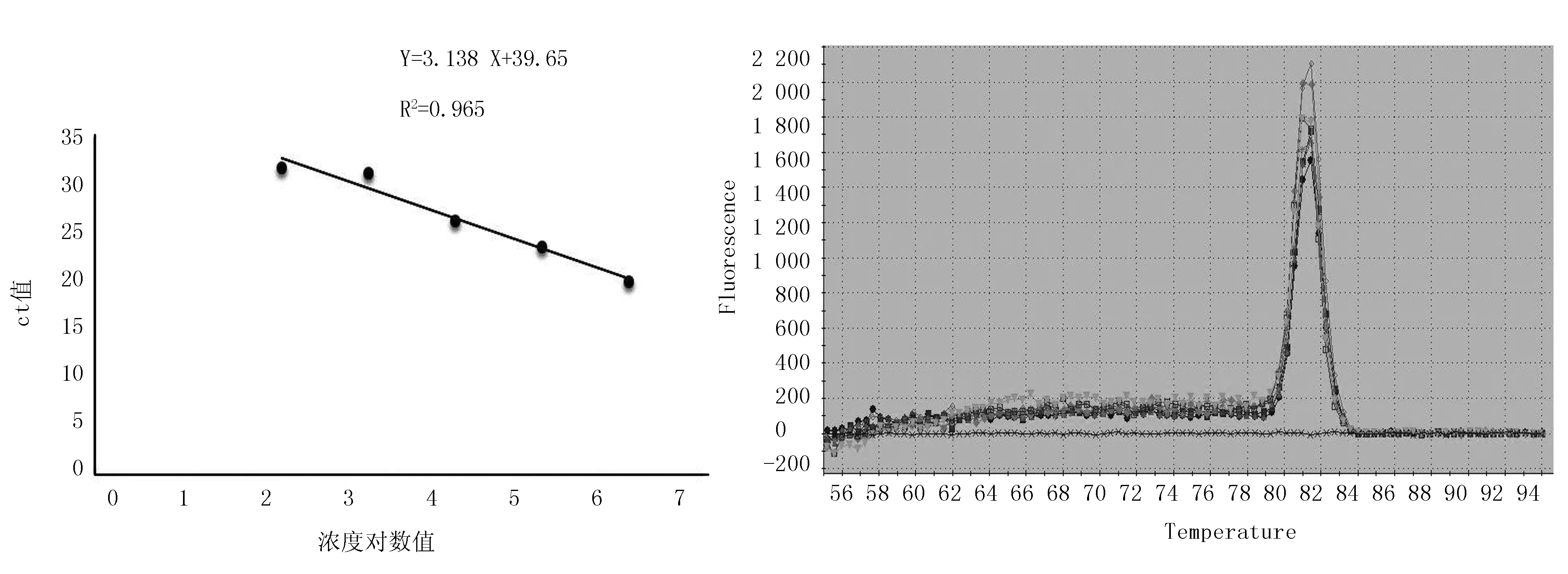
图1 M.suis荧光定量PCR扩增标准曲线及溶解曲线
2.3特异性试验
以4种参考菌株为模板作为对照组,荧光定量PCR进行扩增,结果显示只有M.suis能扩增出特异性荧光“S”型曲线,而对照组则未能扩增出特异性“S”型曲线(图2)。

1~3:猪附红细胞体;4:弓形虫;5:猪链球菌;6:猪肺炎支原体;7:猪呼吸与繁殖综合征病毒
2.4敏感性试验
以1.44×107~1.44×100拷贝/μL的标准品为模板进行荧光定量PCR扩增,检测结果显示该方法检测的灵敏度为1.4拷贝/μL(图3)。

1~8:1.44×107~1.44×100拷贝/μL;NTC:阴性对照组
2.5重复性试验
以1.44×105、1.44×104、1.44×103拷贝/μL的标准品进行组内、组间重复性试验,其变异系数CV值均小于2%,表明该方法具有较好的重复性(表1)。

表1 SYBR Green I荧光定量PCR的组内和组间重复性试验结果
2.6临床样品检测结果
分别用荧光定量PCR和常规PCR方法对采集到的49份疑似M.suis血液样品进行检测,结果显示,本试验建立的荧光定量PCR方法对M.suis的阳性检出率较常规PCR更高(表2)。
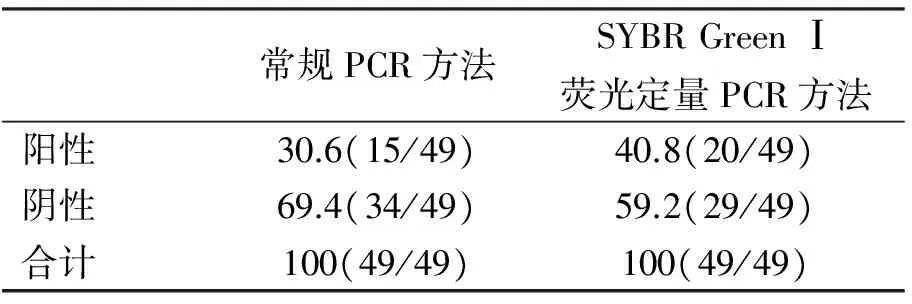
表2 临床样品检测结果
3 讨论与结论
Oehlerking和Messick等于2011年分别发布了KI_3806型和Illinois型猪附红细胞体的基因组序列(非体外培养),2者都包含了编码Eno蛋白的基因[17-18]。Eno蛋白普遍存在于多种细菌表面,并能够加强细菌对宿主的黏附能力。经鉴定,猪附红细胞体Eno不仅是一种表面蛋白,并且发现Eno是结合纤维蛋白溶酶原的表面蛋白,在细胞黏附和侵袭方面起着重要的作用[19]。因此,为了更准确地对猪附红细胞体进行定量检测,本研究选择猪附红细胞体Eno基因为靶基因,建立了SYBR Green Ⅰ荧光定量PCR方法。该方法主要通过SYBR Green Ⅰ荧光染料在靶基因延伸的阶段,非特异性地结合到DNA双螺旋结构中的小沟,进而收集荧光信号。根据所检测到的荧光强度,可以实时检测到PCR 产物量[20]。此外,整个反应过程是由仪器自动控制并进行结果分析,避免了后续电泳的步骤,减少污染。虽然该方法容易受到引物二聚体的影响,特异性不如探针法,但是通过设计精确的特异性引物和试验条件的优化,可以提高该方法的特异性,进而满足临床试验的需要[21]。故本试验选择猪附红细胞体相对保守的Eno基因为靶基因,建立了荧光定量PCR方法。
结果表明,本研究所建立的SYBR Green Ⅰ荧光定量PCR方法不仅特异性强,灵敏度高,而且操作简便,经济实用。该方法的建立将为猪附红细胞体病的检测和防控提供新的技术手段。
[1] 张振兴,李玉峰.嗜血支原体病研究进展[J].畜牧与兽医,2013,45(12):1-5 .
[2] 程跃红,余华,邓小红,等.猪支原体病的流行及防控策略[J].安徽农业科学,2013,41(36):13921-13924.
[3] 张永富,马国文,武克炳,等.猪传染性胃肠炎和流行性腹泻混合感染的诊断与防治[J].内蒙古民族大学学报(自然科学版),2016,31(03):240-243.
[4] 赵永军,战洪波,王亮,等.犬贾第虫MM/Sac-C/1基因的克隆及序列分析[J].内蒙古民族大学学报(自然科学版),2016,31(04):311-316.
[5] 杨琦玥,陈通,李键,等.猪NLRC5基因克隆及序列特征分析[J].西南民族大学学报(自然科学版),2016,41(01):39-46.
[6] 郑鸣,王老七,边传周,等.猪圆环病毒Ⅱ型河南地方株ORF4的克隆及原核表达[J].河南科技学院学报(自然科学版),2014,42(04):52-61.
[7] 张晋强,薛翼鹏,李晓云,等.猪嗜血支原体病原染色检测法的比较研究[J].中国预防兽医学报,2015,37(04):258-261.
[8] Gwaltney S M,Hays M P,Oberst R D.Detection of Eperythrozoon suis using the polymerase chain reaction [J].J Vet Diagn Investing,1993,5(01):40-46.
[9] 凌淑萍,赵健,陈国,等.荧光定量PCR检测猪肝中猪链球菌2型的基因组DNA提取方法的比较[J].安徽农业科学,2016,44(09):168-170.
[10] 凌淑萍,赵健,陈国,等.荧光定量PCR检测猪链球图表 1菌2型主要毒力因子方法的建立[J].安徽农业科学,2016,44(08):138-140.
[][]
[11] 张长莹,张莉莉,李玉峰,等.猪嗜血支原体PCR及荧光定量PCR检测方法的建立和比较[J].中国预防兽医学报,2011,33(06):443-447.
[12] 李丹丹,徐义刚,邱索平,等.霍乱弧菌实时荧光定量PCR快速检测方法的建立[J].黑龙江畜牧兽医,2016,11:106-108.
[13] 孙俊颖,刘志成,孙敏华,等.鸡毒支原体SYBR GreenⅠ荧光定量PCR检测方法的建立[J].中国预防兽医学报,2015,12(12),938-942.
[14] 曹贝贝,韩丽,于鹏飞,等.猪流行性腹泻病毒SYBR GreenⅠ荧光定量RT-PCR 检测方法的建立[J].中国预防兽医学报,2015,6(06):461-464.
[15] 赵丽,赵绪永,陈红英,等.PPV SYBR Green I实时荧光定量PCR检测方法的建立及应用[J].西北农林科技大学学报,2012,40(05):19-23.
[16] 徐卫松,刘中原,程慧芳,等.链球菌 SYBR Green I实时荧光定量PCR检测方法的建立[J].中国预防兽医学报,2014,36(11):877-880.
[17] Oehlerking J, Kube M, Felder K M, et al. Complete genome sequence of the hemotrophic Mycoplasma suis strain KI3806. Journal of bacteriology,2011,193(09):2369-2370.
[18] Messick J B, Santos A P, Guimaraes A M S. Complete genome sequences of two hemotropic mycoplasmas, Mycoplasma haemofelis strain Ohio2 and Mycoplasma suis strain Illinois[J].Journal of bacteriology,2011,193(08):2068-2069.
[19] Hoelzle L. Haemotrophic mycoplasmas: Recent advances in Mycoplasma suis[J].Veterinary Microbiology,2008,130(03):215-226
[20] Esgleas M, Li Y, Hancock M A, et al. Isolation and characterization of α-enolase, a novel fibronectin-binding protein from Streptococcus suis[J].Microbiology,2008,154(09):2668-2679
[21] 陈英剑,胡成进,赵苗青,等.SYBR Green 实时荧光定量 PCR 技术平台的建立[J].实用医药杂志,2005,21(11):997-999.
DevelopmentofarealtimePCRbasedonSYBRGreenIassayfordetectionofMycoplasmasuis
WU Shengjun1, NI Tingting1, ZHANG Shoufa1, XU Yingtian1, SUN Xingzhong2, XUE Shujiang1*
(1.AgriculturalCollegeofYanbianUniversity,YanjiJilin133002,China;2.BaichengAnimalDiseaseControlCenter,BaichengJilin137000,China)
The experiment was conducted to establish a rapid, efficient and sensitive method for the detection of Mycoplasma disease. A pair of primers P5 and P6 were designed and synthesized according to the Eno gene of M. suis in GenBank (the accession number:AB265823.1). The sequence of α-enolase (Eno) gene was amplified with conventional PCR method, and the purified PCR product was cloned into the pMD-18T vector and sequenced. The real time PCR assay based on SYBR Green I were established with the positive recombinant plasmid DNA as template, and the sensitivity and specificity were also determined. The results showed that the standard curve of the real time PCR displayed a linear correlations in a range from 1.44×106copies/μL to 1.44×102copies/μL of recombinant plasmid. The correlation coefficient was 0.965. The assay was highly sensitive forM.suisdetection with a limit detection concentration of 1.44 copies/μL. The specificity assay showed that no amplification was found for other microbes exceptM.suis. The coefficient of variations was less than 2% in the replicate test.Total 49 blood samples were detected using the established real time PCR and conventional PCR methods. The positive rate using real time PCR method was 40.8% (20/49), which was 1.33 times than that of conventional PCR. The real time PCR based on SYBR Green I method was successfully established, which provided reliable method for the earlyMycoplasmadisease diagnosis and quantitative analysis ofM.suisinfection.
Mycoplasmasuis; SYBR Green I; real time PCR; Eno gene
2017-05-12
国家自然科学基金(31460657);吉林省科技厅青年科研基金(20150520129JH)
伍生军(1993—),男,湖南常德人,在读硕士,研究方向为动物疫病分子免疫学研究。薛书江为通信作者,
E-mail:200103061@ybu.edu.cn
1004-7999(2017)03-0074-05
10.13478/j.cnki.jasyu.2017.03.013
A
