血管内皮细胞敲除Rheb基因杂合子小鼠模型建立及意义
2017-11-16丁燕赖丽芬奈文青单兰兰陈顺枝吴洪渊唐钰戴萌
丁燕,赖丽芬,奈文青,单兰兰,陈顺枝,吴洪渊,唐钰,戴萌
(1南方医科大学南方医院,广州510515;2湖南医药学院第一附属医院;3南方医科大学武汉临床医学院)
血管内皮细胞敲除Rheb基因杂合子小鼠模型建立及意义
丁燕1,2,3,赖丽芬1,奈文青1,单兰兰1,陈顺枝1,吴洪渊1,唐钰1,戴萌1
(1南方医科大学南方医院,广州510515;2湖南医药学院第一附属医院;3南方医科大学武汉临床医学院)
目的建立血管内皮细胞敲除Rheb基因杂合子小鼠模型,旨在进一步研究Rheb基因在胚胎血管形成中的作用。方法将5只Rhebflox/flox雄鼠与15只Rhebflox/+雌鼠进行交配,共繁殖出子代小鼠76只(基因型为Rhebflox/flox或Rhebflox/+)。将76只子代小鼠与20只血管内皮细胞特异性表达Tek- Cre重组酶的小鼠(以下称Cre小鼠)进行交配,得到基因型为Tek- Cre×Rhebflox/+及单纯Rhebflox/+子代小鼠共140只。采用PCR法对140只小鼠鼠尾组织Rhebflox及Tek- Cre基因型进行鉴定,并记录其2月龄体长及体质量;采用Western blotting法检测Tek- Cre×Rhebflox/+小鼠与单纯Rhebflox/+小鼠肝组织Rheb蛋白表达。结果共得到基因型为Tek- Cre×Rhebflox/+小鼠72只、单纯Rhebflox/+小鼠68只,其体长分别为(18.50±0.13)、(18.80±0.10)cm,体质量分别为(29.50±0.15)、(30.10±0.21) g,二者比较P均>0.05;肝组织Rheb蛋白相对表达量分别为0.21±0.17、0.66±0.12,二者比较P<0.05。结论成功构建血管内皮细胞敲除Rheb基因杂合子小鼠模型,将为研究Rheb基因在胚胎血管形成中的作用奠定基础。
基因敲除;Cre/LoxP条件性基因敲除技术;Rheb基因;杂合子;小鼠
mTOR信号激活是细胞生长、增殖及蛋白质翻译和其他细胞代谢过程所必需的[1,2]。Rheb基因是mTOR信号激活的关键基因,并参与胚胎发育阶段的血管构建,对血管系统的成熟和正常重建至关重要。研究报道,Rheb基因敲除与心血管疾病密切相关[3],但Rheb基因敲除纯合子小鼠有胚胎致死性[4],且血管内皮细胞敲除TSC1、激活mTOR信号可导致胚胎血管生成缺陷[5],说明Rheb基因对维持小鼠胚胎发育至关重要。目前国内外主要从分子和蛋白水平研究Rheb基因在胚胎血管形成中的作用[6]。2015年10月~2016年6月,本研究采用Cre/LoxP条件性基因敲除技术构建血管内皮细胞敲除Rheb基因的杂合子小鼠模型,旨在进一步研究Rheb基因在胚胎血管形成中的作用。
1 方法与结果
1.1 材料 实验动物:血管内皮细胞特异性表达Tek- Cre重组酶的小鼠(以下称Cre小鼠,基因型为Tek- Cre+/-杂合子)5只,购于美国Jackson实验室[7],4周龄,3雌2雄,体质量(14.50±0.13)g;Rhebflox/flox雄鼠5只,购于美国Jackson实验室,4周龄,体质量(14.27±0.15)g;Rhebflox/+雌鼠15只,购于美国Jackson实验室,4周龄,体质量(14.58±0.14)g;C57野生型小鼠10只,8雌2雄,4周龄,体质量(13.85±0.17)g。饲养及繁殖条件:将小鼠置于实验中心洁净的层流动物房内,室内温度为25 ℃,湿度为50%~70%。主要试剂:DNTP试剂,购自美国Invitrogen公司;Tag酶购自宝生物工程(大连)有限公司,PCR引物均由上海英骏生物技术有限公司设计合成。
1.2 Rhebflox/flox纯合子及Rhebflox/+杂合子小鼠养殖及基因型鉴定 将5只Rhebflox/flox雄鼠与15只Rhebflox/+雌鼠进行交配,顺利繁殖出子代小鼠76只,毛发均为黑色。小鼠出生约1周,眼科剪剪取鼠尾约5 mm,采用PCR法进行基因型鉴定。方法如下:将鼠尾放入编好号码的EP管中,加入100 μL裂解A液,10 000 r/min离心3 min;放入96 ℃金属水浴锅中,水煮1 h;再加入100 μL裂解B液,10 000 r/min离心3 min。PCR引物序列:上游引物:5′- GCCCAGAACATCTGTTCCAT- 3′,下游引物:5′- GGTACCCACAACCTGACACC- 3′。PCR反应体系共20 μL:2×PCR mix 10 μL,上游引物2 μL,下游引物2 μL,模板4 μL,ddH2O 2 μL。PCR反应条件:94 ℃、3 min,94 ℃、30 s,58 ℃、1 min,72 ℃、1 min,循环35次;72 ℃、5 min,4 ℃保存。反应结束,将模板DNA取出,用微量移液枪取8 μL PCR产物,行琼脂糖凝胶电泳,电泳产物在琼脂糖凝胶成像系统拍照。Rhebflox/flox纯合子小鼠可见850 bp条带,野生型小鼠可见650 bp条带,Rhebflox/+杂合子小鼠可见850、650 bp两条条带。其基因型鉴定结果见图1。结果共繁殖出Rhebflox/flox纯合子小鼠36只,Rhebflox/+杂合子小鼠40只。

注:1、2、3、5、6、9为Rhebflox/flox纯合子;4、7、8、10为Rhebflox/+杂合子。
图1小鼠Rhebflox基因型鉴定结果
1.3 Cre小鼠养殖及基因型鉴定 将5只Cre小鼠(毛发均为灰色)与10只C57野生型小鼠(毛发均为黑色)进行交配,顺利繁殖出子代小鼠36只,其中灰色15只、黑色21只。参照1.2的方法进行Tek- Cre基因型鉴定。Tek- Cre引物序列:上游引物:5′- GCGGTCTGGCAGTAAAAACTATC- 3′,下游引物:5′- GTGAAACAGCATTGCTGCCACTT- 3′。PCR反应体系共20 μL:2×PCR mix 10 μL,上游引物2 μL,下游引物2 μL,模板4 μL,ddH2O 2 μL。PCR反应条件:94 ℃、3 min,94 ℃、30 s,51.7 ℃、1 min,72 ℃、1 min,循环35次;72 ℃、2 min,4 ℃保存。参照1.2的方法进行琼脂糖凝胶电泳,并于琼脂糖凝胶成像系统拍照。其基因型鉴定结果见图2。Cre小鼠可见100 bp条带,野生型小鼠无此条带。结果共繁殖出Cre小鼠20只。
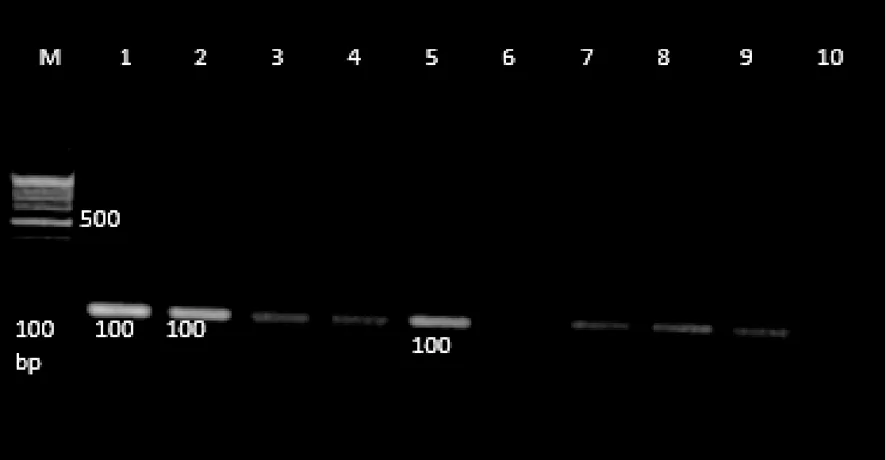
注:1、2、5为Cre型;3、4、6、7、8、9、10 为野生型。
图2小鼠Tek-Cre基因型鉴定结果
1.4 血管内皮细胞敲除Rheb基因杂合子小鼠养殖及基因型鉴定 将36只Rhebflox/flox小鼠、40只Rhebflox/+小鼠分别与20只Cre小鼠进行交配,得到基因型为Tek- Cre×Rhebflox/+的小鼠和单纯Rhebflox/+小鼠共140只,其中基因型为Tek- Cre×Rhebflox/+的小鼠为本实验所需建立的血管内皮细胞敲除Rheb基因杂合子小鼠。参照1.2、1.3的方法鉴定140只子代小鼠的Rhebflox及Tek- Cre基因型。结果显示,基因型为Tek- Cre×Rhebflox/+小鼠72只,单纯Rhebflox/+小鼠68只。2月龄的Tek- Cre×Rhebflox/+小鼠与单纯Rhebflox/+小鼠体长分别为(18.50±0.13)、(18.80±0.10)cm,体质量分别为(29.50±0.15)、(30.10±0.21)g;二者体长、体质量比较P均>0.05。采用Western blotting法检测Tek- Cre×Rhebflox/+小鼠与单纯Rhebflox/+小鼠肝组织Rheb蛋白表达。方法如下:取2月龄两种小鼠各3只,处死后取适量肝组织,用解剖剪剪碎,蛋白裂解液充分裂解,自动研磨机充分研磨。100 ℃水浴10 min,调整样品上样量为10 μL,然后行SDS- PAGE,并将电泳产物转印至PVDF膜上。5%脱脂奶粉室温封闭1 h,剪下相应条带的PVDF膜,分别加入兔抗Rheb(1∶1 000)、鼠抗GAPDH(1∶5 000),4 ℃摇床过夜。次日1×TBST洗膜3次,在辣根过氧化物酶标记的山羊抗兔IgG和山羊抗鼠IgG中室温孵育1 h,1×TBST洗涤3次,暗室中曝光显影。以GAPDH为内参,以Rheb蛋白电泳条带灰度值与GAPDH蛋白电泳条带灰度值的比值作为Rheb蛋白相对表达量。结果显示,Tek- Cre×Rhebflox/+小鼠与单纯Rhebflox/+小鼠肝组织Rheb蛋白相对表达量分别为0.21±0.17、0.66±0.12,二者比较P<0.05;证实成功敲除了Tek- Cre×Rhebflox/+小鼠的血管内皮细胞Rheb基因。见图3。
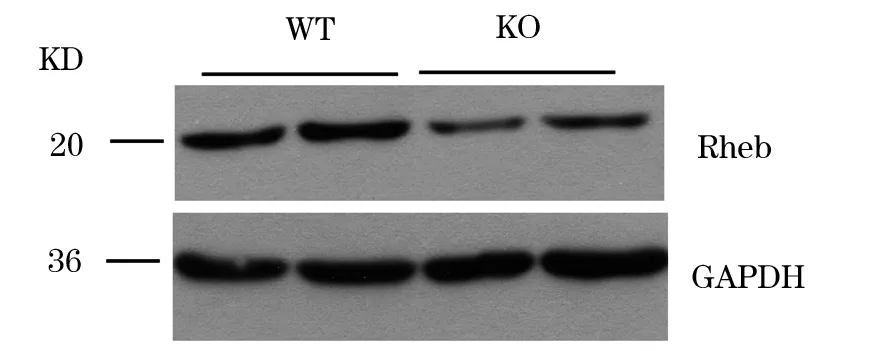
注:KO为Tek- Cre×Rhebflox/+小鼠,WT为单纯Rhebflox/+小鼠。
图3Tek-Cre×Rhebflox/+小鼠与单纯Rhebflox/+小鼠肝组织Rheb蛋白表达电泳图
2 讨论
研究表明,Rheb基因缺失可引起血管炎症反应加重,诱发微循环障碍[7~12]。心脏敲除Rheb基因的小鼠可出现各种心血管疾病[13]。目前对于Rheb基因作用的研究仅局限于细胞和分子水平[14],关于血管内皮细胞敲除Rheb基因的小鼠模型研究较少,无法从动物整体水平分析Rheb基因在维持血管屏障功能中的作用[15]。mTOR信号与血管内皮损伤相关疾病密切相关[16],在血管形成中发挥重要作用,而Rheb基因是mTOR信号激活的关键基因[17]。因此,构建仅在血管内皮细胞上敲除Rheb基因的小鼠模型对于进一步研究Rheb基因的功能极为重要。
研究证实,基因型为Rhebflox/+的杂合子小鼠血管内皮细胞及其组织中Rheb基因仍正常存在,这可能影响血管内皮细胞的功能[15]。根据Cre/LoxP条件性基因敲除技术原理,基因型为Tek- Cre×Rhebflox/+的小鼠血管内皮细胞Rheb基因被敲除,而其他细胞及组织内的Rheb基因仍可正常存在。因此,构建基因型为Tek- Cre×Rhebflox/+的杂合子小鼠对于进一步研究Rheb基因在微血管中的作用具有重要意义。本研究结果显示,通过Cre/LoxP条件性基因敲除技术共繁殖出基因型为Tek- Cre×Rhebflox/+小鼠72只、单纯Rhebflox/+小鼠68只,二者体长及体质量比较差异无统计学意义,说明血管内皮细胞敲除Rheb基因对小鼠的体长和体质量没有影响。Tek- Cre×Rhebflox/+小鼠Cre基因鉴定结果可见100 bp条带,证实其为Cre小鼠;Rhebflox基因鉴定结果可见850、650 bp两条条带,证实其为Rhebflox/+小鼠。上述结果证实基因型为Tek- Cre×Rhebflox/+的小鼠为本实验所需建立的血管内皮细胞敲除Rheb基因杂合子小鼠。肝组织内富含血管,故本研究以肝组织为检测标本。结果显示,Tek- Cre×Rhebflox/+小鼠肝组织Rheb蛋白相对表达量明显低于单纯Rhebflox/+小鼠,证实成功敲除了Tek- Cre×Rhebflox/+小鼠血管内皮细胞的Rheb基因。
综上所述,本研究成功构建血管内皮细胞敲除Rheb基因的杂合子小鼠模型,并经基因型及蛋白水平验证。本研究为进一步探讨血管内皮细胞敲除Rheb基因在胚胎发育阶段的血管构建及其对脉管系统成熟和正常重建过程中的作用奠定了基础。
[1] Zheng X, Liang Y, He Q, et al. Current models of mammalian target of rapamycin complex 1 (mTORC1) activation by growth factors and amino acids[J]. Int J Mol Sci, 2014,15(11):20753- 20769.
[2] 王志钢,吴应积,旭日干.mTOR信号通路与细胞生长调控[J].生物物理学报,2007,23(5):333- 342.
[3] Sciarretta S, Zhai P, Shao D, et al. Rheb is a critical regulator of autophagy during myocardial ischemia: pathophysiological implications in obesity and metabolic syndrome[J]. Circulation, 2012,125(9):1134- 1146.
[4] Goorden SM, Hoogeveen- Westerveld M, Cheng C, et al. Rheb is essential for murine development[J]. Mol Cell Biol, 2011,31(8):1672- 1678.
[5] Ma A, Wang L, Gao Y, et al. Tsc1 deficiency- mediated mTOR hyperactivation in vascular endothelial cells causes angiogenesis defects and embryonic lethality[J]. Hum Mol Genet, 2014,23(3):693- 705.
[6] Liu D, Martin V, Fueyo J, et al. Tie2/TEK modulates the interaction of glioma and brain tumor stem cells with endothelial cells and promotes an invasive phenotype[J]. Oncotarget, 2010,1(8):700- 709.
[7] Kawakami Y, Ii M, Matsumoto T, et al. SDF- 1/CXCR4 Axis in Tie2- Lineage cells including endothelial progenitor cells contributes to bone fracture healing[J]. J Bone Miner Res, 2015,30(1):95- 105.
[8] You JS, Anderson GB, Dooley MS, et al. The role of mTOR signaling in the regulation of protein synthesis and muscle mass during immobilization in mice[J]. Dis Model Mech, 2015,8(9):1059- 1069.
[9] Ueno S, Ueno T, Iwao Y. Role of the PI3K- TOR- S6K pathway in the onset of cell cycle elongation during Xenopus early embryogenesis[J]. Dev Growth Differ, 2011,53(8):924- 933.
[10] Coultas L, Chawengsaksophak K, Rossant J. Endothelial cells and VEGF in vascular development[J]. Nature, 2005,438(7070):937- 945.
[11] Tyagi R, Shahani N, Gorgen L, et al. Rheb inhibits protein synthesis by activating the PERK- eIF2alpha signaling cascade[J]. Cell Rep, 2015,15(10):684- 693.
[12] Yang S, Xia C, Li S, et al. Defective mitophagy driven by dysregulation of rheb and KIF5B contributes to mitochondrial reactive oxygen species (ROS)- induced nod- like receptor 3 (NLRP3) dependent proinflammatory response and aggravates lipotoxicity[J]. Redox Biol, 2014(3):63- 71.
[13] Xu N, Guan S, Chen Z, et al. The alteration of protein prenylation induces cardiomyocyte hypertrophy through Rheb- mTORC1 signalling and leads to chronic heart failure[J]. J Pathol, 2015,235(5):672- 685.
[14] Nitta N, Nakasu S, Shima A, et al. mTORC1 signaling in primary central nervous system lymphoma[J]. Surg Neurol Int, 2016,7(Suppl 17):S475- S480.
[15] Yoshida S, Hong S, Suzuki T, et al. Redox regulates mammalian target of rapamycin complex 1 (mTORC1) activity by modulating the TSC1/TSC2- Rheb GTPase pathway[J]. J Biol Chem, 2011,286(37):32651- 32660.
[16] Bruneau S, Nakayama H, Woda CB, et al. DEPTOR regulates vascular endothelial cell activation and proinflammatory and angiogenic responses[J]. Blood, 2013,122(10):1833- 1842.
[17] Zhao Q, Wang Z, Wang Z, et al. Aspirin may inhibit angiogenesis and induce autophagy by inhibiting mTOR signaling pathway in murine hepatocarcinoma and sarcoma models[J]. Oncol Lett, 2016,12(4):2804- 2810.
广州市科技计划项目(2013J4500040)。
戴萌(E- mail: dm42298@163.com)
10.3969/j.issn.1002- 266X.2017.36.010
Q78
A
1002- 266X(2017)36- 0034- 03
2016- 11- 25)
