3种中药提取物对鸡盲肠微生物体外发酵特性的影响
2017-11-16张大伟齐长海黄其田
王 政,张大伟,齐长海,黄其田,袁 江
(青岛根源生物技术集团有限公司,山东 青岛 266061)
3种中药提取物对鸡盲肠微生物体外发酵特性的影响
王 政*,张大伟,齐长海,黄其田,袁 江
(青岛根源生物技术集团有限公司,山东 青岛 266061)
试验旨在用体外发酵技术评价3种中药提取物对鸡盲肠微生物发酵特性的影响.以白羽肉鸡盲肠食糜为接种物,设置3个试验组和1个对照组,3个试验组分别以大蒜、马齿苋和黄柏水提物为发酵底物,中药水提物的添加水平为0.5 mg/mL,对照组无发酵底物,每个处理3个重复,37℃体外发酵24 h,测定微生物数量、pH、氨态氮(NH3‐N)和挥发性脂肪酸(VFA)含量.结果显示:大蒜组大肠杆菌(E. coli)数量显著低于其他各组,而乳酸杆菌数量显著高于其他各组(P<0.05).大蒜组乙酸、丁酸和总挥发性脂肪酸(TVFA)生成水平显著高于其他各组(P<0.05),但其支链VFA/TVFA、pH、NH3‐N含量显著低于其他各组(P<0.05).以上结果表明:大蒜水提物具有促进乳酸杆菌生长、提高肠道微生物代谢活性的潜在益生作用.
中药提取物;白羽肉鸡;盲肠微生物;体外发酵
我国拥有丰富的中药资源,中药中含有丰富的淀粉、蛋白质、脂类、纤维素等营养成分,以及萜类、黄酮类、皂甙类和生物碱等活性物质[1].动物胃肠道微生物区系的平衡对维持动物健康起着重要作用,寻找具有改善动物肠道微生物区系、促进动物肠道健康的天然中药一直是动物营养领域的研究热点.大蒜为半年生草本植物,百合科葱属,以鳞茎入药,大蒜提取物的主要成分是大蒜素(二烯丙基硫醚)[2],具有抗菌、提高动物免疫力的作用;马齿苋为一年生草本植物,马齿苋属,全草可入药,马齿苋含有丰富的植物多糖、黄酮、皂甙和维生素,具有清热利湿、解毒消肿、去除自由基和抗氧化的功效;黄柏为芸香科植物黄檗或黄皮树的干燥树皮,其主要活性成分为生物碱,其中小檗碱是含量最高的生物碱,具有抗菌消炎的作用.本文通过对大蒜、马齿苋和黄柏水提物对鸡盲肠微生物体外发酵特性的影响试验,筛选出具有改善动物肠道微生物区系、提高微生物代谢活性的中药提取物,为实际生产应用提供理论基础.
1 材料与方法
1.1 底物、培养基及接种物制备 底物为大蒜水提物、马齿苋水提物和黄柏水提物(西安瑞盈生物科技有限公司生产,有效含量均为10%).培养基的配制参考Barry等[3]操作方法:1 000 mL含9.240 g NaHCO3,0.470 g NaCl,0.100 g Na2SO4,7.125 g Na2HPO4.12H2O,0.450 g KCl,0.055 g CaCl2,0.047 g MgC12,3.680 g FeSO4.7H2O,1.900 g MNSO4.7H2O, 0.440 g ZNSO4.7H2O,0.120 g CoCl2.6H2O,98 mg CuSO4.5H2O, 17.4 mg Mo7(NH4)6O24.4H2O, 尿素0.400 g,pH调为7.0.称取底物(中药水提物)于160 mL血清瓶中,底物添加水平为0.5 mg/mL,每瓶加入100 mL培养基,血清瓶加盖橡胶塞后以铝盖密封并抽换气,充入CO2模拟动物后肠厌氧环境,115 ℃灭菌20 min后备用.接种物的制备:选取12只体重为2.5 kg左右的白羽肉鸡,颈部放血处死后,无菌采集盲肠内容物,立即放入充有CO2的无菌容器内,用灭菌的生理盐水1:9(质量体积比)稀释,振荡混匀,经4层灭菌纱布过滤,将滤液装入连续充入CO2的灭菌烧杯中备用.
1.2 试验设计 试验分为试验组(基础培养基+底物+接种物)和对照组(基础培养基+接种物),3个试验组分别以大蒜、马齿苋和黄柏水提物为发酵底物,每个处理3个重复,每瓶接种经过稀释的盲肠内容物10 mL,再将血清瓶置于37℃恒温培养箱中培养24 h.
1.3 指标测定
1.3.1 定量Real‐time PCR分析微生物数量 发酵结束后,取1 mL发酵液采用粪便基因组快速提取试剂盒(博迈德)提取样品DNA,然后采用杭州博日LiNe-GeNe.K实时定量PCR仪及其配套软件进行定量分析.总反应体系为20 μL:10 μL SYBR GreeN Premix(TakaRa),0.8 μL上下游引物和2 μL样品DNA.利用大肠杆菌、乳酸杆菌和芽孢杆菌的16S rRNA基因作为模板分别制作大肠杆菌、乳酸杆菌和总菌的标准曲线,样品DNA的检测采用3个重复,取平均值.用于测定样品中大肠杆菌和总细菌的16S rRNA基因拷贝数的PCR反应程序:50 ℃ 2 min,95 ℃ 10 min,而后 95 ℃ 15 s,60 ℃1 min 40个循环.测定样品中乳酸杆菌的16S rRNA基因拷贝数的PCR反应程序:50 ℃ 2 min,95 ℃10 min,而后95 ℃ 15 s,62 ℃ 1 min 40个循环.以上微生物的特异性引物序列见表1.

表1 定量PCR引物序列
1.3.2 发酵产物的测定 发酵结束后,将发酵液4 000 r/min离心5 min取上清液,用PHS-3C型pH计(上海精科)测定上清液pH.挥发性脂肪酸(VFA)含量的测定参照秦为琳[7]的方法,氨态氮(NH3-N)含量测定参照梁剑光等[8]的方法.
1.4 统计分析 试验数据经Excel初步处理后,利用SPSS 16.0统计软件进行方差分析,如果方差分析结果显著,则采用LSD法进行多重比较,以P<0.05为差异显著性判断标准.
2 试验结果
2.1 中药提取物对体外发酵微生物数量的影响 由表2可知,各处理组之间总菌数量无显著性差异(P>0.05).大蒜组乳酸杆菌数量显著高于其他各组(P<0.05),而其大肠杆菌数量显著低于其他各组(P<0.05),表明大蒜水提物有助于促进体外发酵体系乳酸杆菌的生长.

表2 中药提取物对体外发酵微生物数量的影响 lg
2.2 中药提取物对体外发酵VFA生成的影响 由表3可知,大蒜组乙酸、丁酸和总挥发性脂肪酸(TVFA)生成水平显著高于其他各组(P<0.05),表明大蒜水提物提高了体外发酵体系中微生物代谢活性;而大蒜组支链VFA/TVFA显著低于其他各组(P<0.05),表明体外发酵体系中蛋白质降解程度降低.
2.3 中药提取物对体外发酵pH和NH3-N含量的影响 由表4可知,大蒜组pH和NH3-N含量显著低于其他各组(P<0.05).
3 讨 论
3.1 中药提取物对体外发酵微生物数量的影响 本试验结果表明,大蒜组中大肠杆菌的数量显著低于其他组,乳酸杆菌数量显著高于其他组,而总菌数量与其他各组无显著差异,说明大蒜水提物可能有助于促进乳酸杆菌的生长.有研究表明,大蒜的主要抗菌成分为大蒜素,大蒜素及其代谢产物阿霍烯、二硫醚、三硫醚等多种成分能穿过细菌细胞膜,与半胱氨酸发生反应,使细菌缺乏半胱氨酸而不能发生生物氧化作用,从而干扰细菌正常新陈代谢[9].除大蒜素外,大蒜多糖也是大蒜重要的活性成分[10].JeNNifer等[11]研究表明,大蒜多糖属菊糖类的果聚糖,含果糖约85%,且具有类菊糖作用.曾艳华等[12]通过体外发酵证明大蒜多糖对拟杆菌、肠球菌和大肠杆菌具有抑制作用,而对双歧杆菌具有增殖作用.有研究表明大蒜水提物可缓解由大肠杆菌诱导的小鼠腹泻,减少腹泻次数,便质由稀转干,精神状态转好[13].本研究中大肠杆菌数量受到明显抑制,可能与大蒜素和大蒜多糖的抑菌作用有关,而乳酸杆菌数量显著升高可能与大蒜多糖的类菊糖作用有关.
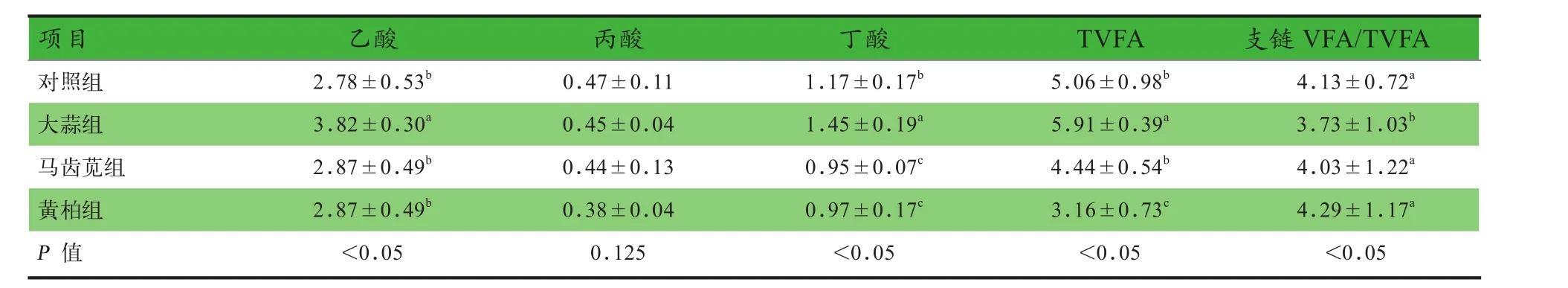
表3 中药提取物对体外发酵VFA生成的影响 mg/g
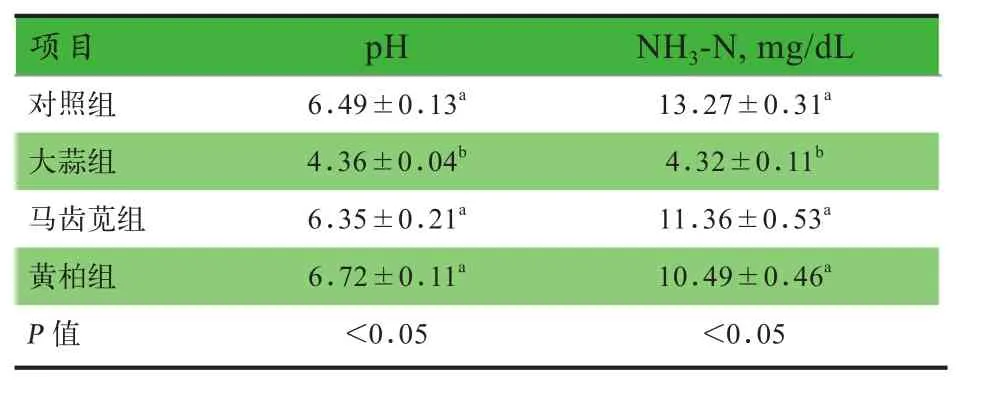
表4 中药提取物对体外发酵pH和NH3‐N含量的影响
3.2 中药提取物对体外发酵VFA生成的影响 单胃动物后肠微生物发酵碳水化合物产生VFA,但同时微生物分解食糜中的蛋白质也会产生部分支链脂肪酸[14],大部分VFA可以被肠道组织迅速吸收,为上皮细胞和其他组织提供能量.本试验中大蒜组乙酸、丁酸和TVFA生成水平显著高于其他各组,表明大蒜水提物提高了体外发酵体系中微生物的代谢活性,其中乙酸可作为脂肪合成的前体物质,并且能够为肌肉组织提供能量.而丁酸可以向宿主后肠肠道上皮细胞直接提供能量,促进肠长皮细胞的生长,加速受损肠粘膜的修复[15],丁酸是由动物后肠中 Roseburia iNtestiNalis、 Eubacterium rectale和Faecalibacterium PrausNitzii等微生物通过乳酸和乙酸转化生成.本试验中,大蒜组乙酸和丁酸在发酵后呈现升高的趋势,推测大蒜水提物促进了乙酸生成菌的增殖,乙酸含量的增加为乙酸利用菌提供底物,进一步促进了乙酸向丁酸的转化;微生物降解支链氨基酸会生成标志性产物支链VFA[16],支链VFA/TVFA反映出动物后肠蛋白质被微生物降解的情况,在本试验中大蒜组支链VFA/TVFA显著低于其他各组,表明体外发酵体系中大蒜水提物使蛋白质的降解程度降低.
3.3 中药提取物对体外发酵pH和NH3-N含量的影响 NH3-N含量反映了微生物对蛋白质降解和对NH3-N利用的综合能力.有研究显示,当蛋白质的摄入量增加时,肠道食糜和粪样中NH3-N含量也随之升高[17].一般认为NH3-N含量降低和VFA产量升高对动物健康有利,同时发酵产生的酸性物质可降低肠道pH.本试验大蒜组NH3-N含量和pH显著低于其他各组,表明大蒜水提物降低了体外发酵体系中蛋白质降解水平,可以减少有害代谢产物如NH3和H2S的生成,同时大蒜水提物促进了碳水化合物的发酵,生成大量的VFA如乙酸和丁酸,降低了发酵体系pH,从而抑制致病菌的生长,因此在动物饲料中添加大蒜水提物将有利于促进动物肠道健康.
4 结 论
在本试验条件下,大蒜水提物可降低体外发酵中大肠杆菌数量、促进乳酸杆菌生长,同时增加乙酸、丁酸和TVFA的生成水平,降低pH和NH3-N含量,有助于提高肠道微生物代谢活性.
[1] 侯晓梅, 陈敏青, 张慧蕾, 等. 中药提取物对桑黄深层发酵的影响[J]. 食品科技, 2013, 38(9): 185‐188.
[2] 李静, 吴卫东. 大蒜、生姜水浸提液对体外细菌抑制的对比比较[J]. 中国调味品, 2008, (12): 27‐29.
[3] Barry J L, Hoebler C, MacFarlane G T, et al. Estimation of the fermentability of dietary fibre in vitro: a European inter‐laboratory study[J]. Br J Nutr, 1995, 74: 303‐322.
[4] Xander W, Huijsdens, Ronald K, et al. Quantification of bacteria adherent to gastrointestinal mucosa by real‐time PCR[J]. J Clin Microbiol, 2002, 40(12): 4423‐4427.
[5] Byun R, Mangala A, Nadkarni, et al. Quantitative analysis of diverse Lactobacillus species present in advanced dental caries [J]. J Clin Microbiol, 2004, 42(7): 3128‐3136.
[6] Marisol C, Susana M. Martín‐Orúe, et al. Quantification of total bacteria, enterobacteria and lactobacilli populations in pig digesta by real‐time PCR[J]. Vet Microbiol, 2006, 114:165‐170.
[7] 秦为琳. 应用气相色谱测定瘤胃挥发性脂肪酸方法的研究改进[J]. 南京农业大学学报, 1982, 5(4): 110‐116.
[8] 梁剑光, 朱玲, 徐正军. 靛酚蓝‐分光光度法测定发酵液中氨态氮含量研究[J]. 食品与发酵工业, 2006, 32(9):134‐137.
[9] 晏莉, 黄起壬. 大蒜素药理作用及作用机理的探讨[J]. 实用临床医学, 2008, 9(1): 134.
[10] 黄雪松. 大蒜多糖的提取分离与分析[J]. 食品科学, 2005,25(9): 48‐51.
[11] Jennifer L, Causey B S, Joellen M, et al. Effects of dietary inulin on serum lipids, blood glucose and the gastrointestinal environment in hypercholesterolemic men[J]. Nutr Res, 2000, 20(2): 191‐201.
[12] 曾艳华, 张宁, 吴希阳, 等. 通过体外发酵研究不同聚合度的大蒜多糖对人体肠道菌群的影响[J]. 食品与发酵工业 , 2009, 35(10): 10‐13.
[13] 王国芳, 韩海荣, 聂尚丹. 大蒜水提物对小鼠腹泻治疗作用的实验研究[J]. 济宁医学院学报, 2009, 32(4): 244‐245.
[14] Besten G D, Eunen K V, Groen A K, et al. The role of short‐chain fatty acids in the interplay between diet, gut microbiota, and host energy metabolism[J]. J Lipid Res,2013, 54: 2325‐2340.
[15] Pryde S E, Duncan S H, Hold G L, et al. The microbiology of butyrate formation in the human colon[J]. FEMS Microbiol Lett, 2002, 217: 133‐139.
[16] Rist V T S, Weiss E, Eklund M, et al. Impact of dietary protein on microbiota composition and activity in the gastrointestinal tract of piglets in relation to gut health: a review [J]. Animal, 2013, 7(7): 1067‐1078.
[17] Luo Z, Li C B, Cheng Y F, et al. Effects of low dietary protein on the metabolites and microbial communities in the caecal digesta of piglets[J]. Arch Anim Nutr, 2015,69(3): 212‐226.
S816.32
A
10.19556/j.0258-7033.2017-11-149
2017-09-19;
2017-10-26
王政(1977-),男,河南人,博士,主要从事动物消化道微生物研究,E‐mail:wangzheng1977@126.com
*通讯作者
