中草药微生态制剂替代抗生素对黄羽肉鸡生产性能、免疫机能和脏器组织的影响
2017-11-16何彦侠侯月娥郭吉余钱雪桥王林川
田 浪,何彦侠,侯月娥,郭吉余,钱雪桥⋆,王林川
(1. 广东海大集团股份有限公司畜牧水产研究中心,广东 广州 511400;2. 华南农业大学兽医学院,广东 广州 510642)
中草药微生态制剂替代抗生素对黄羽肉鸡生产性能、免疫机能和脏器组织的影响
田 浪1,2,何彦侠1,侯月娥1,郭吉余1,钱雪桥1⋆,王林川2⋆
(1. 广东海大集团股份有限公司畜牧水产研究中心,广东 广州 511400;2. 华南农业大学兽医学院,广东 广州 510642)
为研究中草药微生态制剂替代抗生素对黄羽肉鸡生产性能、免疫机能及脏器组织的影响,试验选用500羽黄羽肉鸡混合雏,随机分为5组,A组饲喂基础日粮,B组饲喂基础日粮+饲用抗生素(含50 g/t金霉素+40 g/t杆菌肽锌),C组饲喂基础日粮+中草药(5 kg/t)、D组饲喂基础日粮+微生态制剂(0.1 kg/t),E组饲喂基础日粮+中草药微生态制剂(5.1 kg/t),每组10个重复,每个重复10羽,试验期50 d.结果表明:与抗生素组相比,中草药微生态制剂组日增重显著提高了8.2%(P<0.05),耗料增重比显著降低了6.0%(P<0.05),成活率(98.5%)提高了2.4%;中草药微生态制剂组的胸腺指数、脾脏指数、法氏囊指数等均显著高于抗生素组(P<0.05),但与单纯的中草药组、微生态制剂组差异不显著(P>0.05);中草药微生态制剂组提高了禽流感疫苗的抗体滴度和整齐度,并且促进肠道、肝脏、肾脏等脏器组织的健康发育.结果显示,中草药微生态制剂可以显著提高黄羽肉鸡生产性能,增强机体免疫功能和健康水平,提高成活率,可以替代抗生素用于黄羽肉鸡养殖.
中草药微生态制剂;黄羽肉鸡;生产性能;免疫机能;脏器组织
抗生素在畜牧业中促生长、防治疫病方面发挥了重要作用,但抗生素的长期使用、滥用等不规范应用也导致了药物残留、食品安全、公共卫生等系列负面问题.因此,为了实现健康养殖和安全食品,研发能替代抗生素的安全、环保、有效的饲料添加剂,成为肉鸡养殖业健康发展的必然要求.中草药具有增强机体免疫力、促进动物生长发育、提高饲料利用率和改善胴体品质等功能[1-2],而益生菌也是一种有潜力替代抗生素的新型饲料添加剂,已经研究阐明其改善肠道菌群平衡、修复炎症、调节免疫功能等多方面的作用机制[3-5].
农业部1773号公告《饲料原料目录》明确规定了饲用天然植物多达115种,以及2045号公告《饲料添加剂品种目录》允许的饲用微生物添加剂种类有34种.尽管近年来有不少关于中草药和益生菌分别在畜牧养殖业中的研究,但联合使用替代抗生素应用于黄羽肉鸡养殖的研究未见报道.本试验在前期研究基础上,主要筛选农业部《饲料原料目录》中的12种天然植物组成扶正祛邪、补益增免类中草药制剂,并配合由枯草芽孢杆菌、嗜酸乳杆菌、酪酸菌等组成的微生态制剂,研究其替代抗生素对黄羽肉鸡生产性能、免疫机能及脏器组织等方面的影响,为中草药微生态制剂在黄羽肉鸡中的应用提供试验依据.
1 材料与方法
1.1 试验材料 复方中草药中的金银花、连翘、板蓝根、藿香、黄芩、黄连等12味中草药购自玉林中药港,所有中草药经单独烘干(60~65℃)6 h, 细微粉碎,过120目筛,然后按一定比例均匀混合.微生态制剂由广东海大集团畜牧水产研究中心提供,主要成分为枯草芽胞杆菌(活菌数≥4X109个/g),嗜酸乳杆菌(活菌数≥5X109个/g)和酪酸菌(活菌数≥3X109个/g),总活菌数≥1010个/g.
中草药微生态制剂为98%复方中草药+2%微生态制剂.10%金霉素购自内蒙古金河股份有限公司,10%杆菌肽锌购自江苏天成保健品有限公司.
1.2 试验设计 挑选500羽健康、平均始重120 g、10日龄黄羽肉仔鸡,随机均分为1个对照组和4个试验组,每组10个重复,每个重复10羽.对照组肉鸡(A组)饲喂基础日粮,在4个试验组肉鸡基础日粮中分别添加抗生素(含50 g/t金霉素+40 g/t杆菌肽锌)(B组)、中草药制剂5 kg/t(C组)、微生态制剂100 g/(tD组)和中草药微生态制剂5.1 kg/(tE组),试验期50 d,其中试验第1~20天为试验Ⅰ期(肉鸡10~30日龄),试验第21~50天为试验Ⅱ期(肉鸡31~60日龄).试验日粮组成及营养成分见表1.
1.3 饲养管理 试验在广东海大集团试验基地进行,试验前20 d在层叠式育雏笼内完成,试验20 d后转入育成舍3层重叠式育成笼进行.所有试验肉鸡的饲养环境一致,饲养作息、免疫、卫生消毒等程序按照标准养殖制度,每天观察鸡群健康状况,及时淘汰病弱鸡.
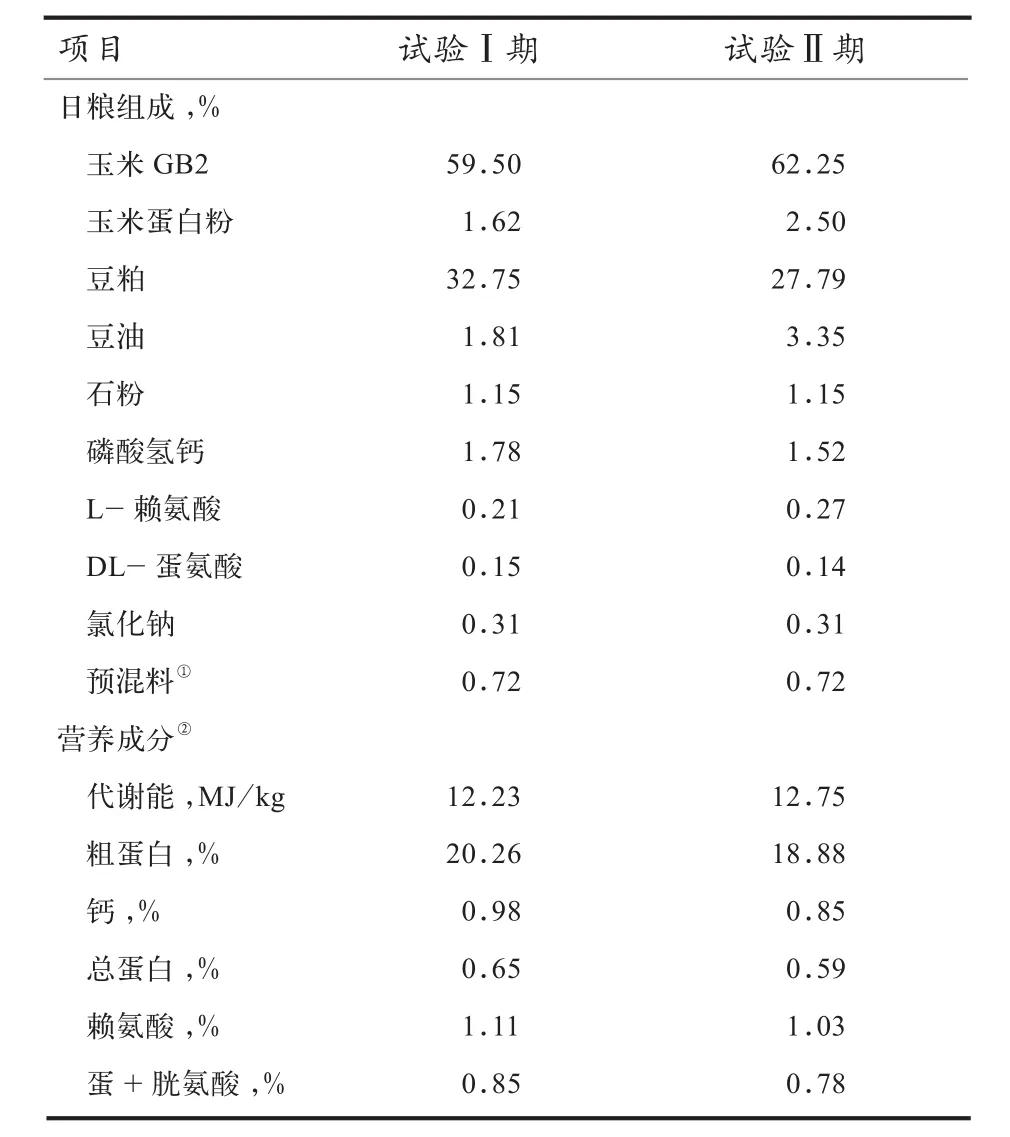
表1 基础日粮组成及营养成分(风干基础)
1.4 测定指标及方法
1.4.1 生长性能 分别于试验期第20天(试验Ⅰ期)、第50天(试验Ⅱ期)08∶00空腹称重,计算各组采食量、日增重和耗料增重比、成活率等指标.
1.4.2 免疫器官指数及脏器组织结构测定 试验期第32天时,每个重复随机选取1只中等大小的公鸡屠宰,放血致死后迅速剖开腹腔,取脾脏、胸腺、法氏囊并称重,计算各器官指数=器官重(g)/鸡活体重(kg).同时取十二指肠中段约2 cm肠段、肝脏、肾脏组织,用HE染色法制作组织切片,对比观察十二指肠绒毛形态,计算绒毛高度、隐窝深度、绒毛高度/隐窝深度(V/C),观察肝脏、肾脏组织结构变化情况.
1.4.3 血清抗体测定 鸡群16日龄时免疫禽流感H5-Re6灭活疫苗,分别于免疫后第14、21天,每个重复随机选取3只鸡采集血清,测定血清中禽流感疫苗抗体效价及计算离散度.
1.5 统计分析 试验数据采用统计软件SPSS16.0进行单因素方差分析(One-Way ANOVA),采用Duncan′s法进行均值比较,以P<0.05为显著水平,试验结果均以平均值±标准差表示.
2 结 果
2.1 中草药微生态制剂对黄羽肉鸡不同阶段生长性能的影响 由表2可见,与抗生素组相比,中草药微生态制剂组的耗料量提高了1.56%(P>0.05)、平均增重显著增加了8.2%(P<0.05),耗料增重比显著降低了6.0%(P<0.05),成活率提高了2.4%;与空白对照组相比,中草药微生态制剂组的耗料量显著降低了2.70%(P<0.05)、平均增重显著增加了9.85%(P<0.05),耗料增重比显著降低了12.54%(P<0.05),成活率提高了5.7%.与抗生素组相比,单独的中草药组和微生态制剂组的平均耗料量显著降低(P<0.05),平均增重显著提高(P<0.05),耗料增重比降低(P>0.05),但两组间差异不显著.
2.2 中草药微生态制剂对黄羽肉鸡免疫机能的影响 由表3可见,中草药微生态制剂组肉鸡的脾脏指数、胸腺指数、法氏囊指数均显著优于抗生素组(P<0.05),其中脾脏指数、胸腺指数同时显著优于空白对照组(P<0.05),法氏囊指数优于空白对照组(P>0.05).单独的中草药组和微生态组的脾脏指数、胸腺指数、法氏囊指数均优于抗生素组和空白对照组(P>0.05),其两组间差异也不显著.与抗生素组相比,空白对照组的3个免疫指数均略优(P>0.05).

表2 中草药微生态制剂组对黄羽肉鸡生长性能的影响
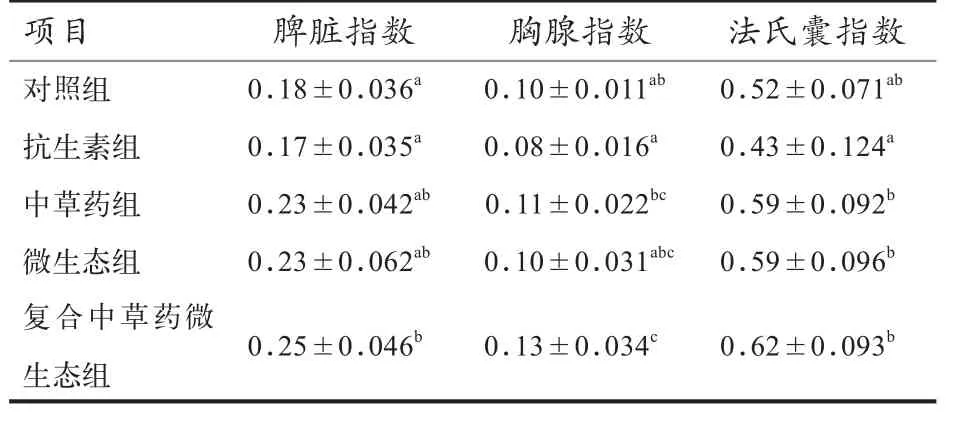
表3 中草药微生态制剂对42日龄黄羽肉鸡免疫器官的影响
由表4可见,疫苗免疫后14 d时,各组已产生抗体,其中中草药微生态制剂组、中草药组、益生菌组的抗体效价均显著高于抗生素组和空白对照组(P<0.05),其中以中草药微生态制剂组抗体效价最高,但3组间差异不显著(P>0.05),同时该组的抗体水平整齐度显著优于其他组(P<0.05).疫苗免疫后21 d时,各组均已产生具有免疫保护力的较高抗体水平,与抗生素组和空白对照组相比,中草药微生态制剂组的抗体效价和抗体整齐度均显著提高(P<0.05).
2.3 中草药微生态制剂对黄羽肉鸡脏器组织结构的影响 由图1可见,对照组十二指肠绒毛较短,黏膜上皮细胞有明显坏死、脱落现象,肠腔内有炎性粘液,而抗生素组肠绒毛较对照组变粗、变短,有上皮细胞脱落及坏死.与抗生素组和对照组相比,中草药组、微生态制剂组、中草药微生态组肠绒毛均明显更长和完整,上皮细胞脱落及坏死现象少,肠腔干净无炎性粘液,尤其是中草药微生态组肠绒毛明显变长、变粗,排列整齐且清晰有光泽.由表5可见,与抗生素组相比,微生态制剂组肠绒毛长度增加最显著(P<0.05),其V/C显著增加,中草药微生态制剂组肠绒毛长度、V/C均显著增加;抗生素组肠隐窝深度较其余4个试验组显著增加.
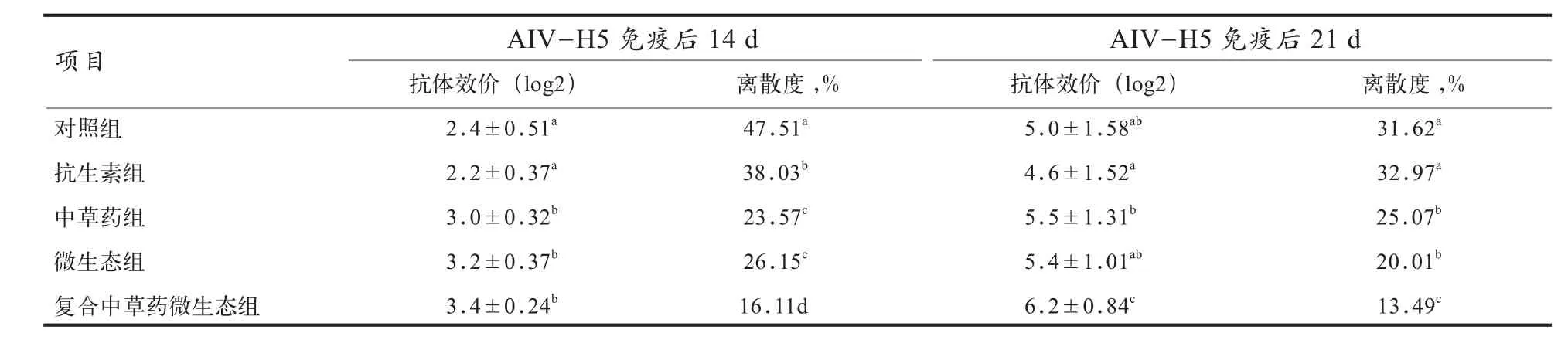
表4 中草药微生态制剂对黄羽肉鸡禽流感H5疫苗血清抗体的影响
由图2可见,各组肝脏组织为正常形态.对照组肝小叶中央静脉扩张,静脉及组织内发生部分血细胞浸入现象;抗生素组门管区有少量炎性渗出,组织内亦有浸入少许红细胞;中草药组、微生态制剂组、中草药微生态组肝脏组织均轮廓清晰,无血细胞浸入,肝血窦增大,肝细胞索分界明显,内皮枯否氏细胞数量增多.
由图3可见,各试验组肾脏组织细胞结构总体比较清晰、完整.空白对照组和抗生素组均可见少数血细胞和单核细胞浸入,部分肾小球增大及肾小管上皮细胞肥大,而中草药组、微生态制剂组、中草药微生态组均无此现象发生,肾小管上皮细胞结构正常、轮廓清晰,排列完整.
3 讨 论
3.1 中草药微生态制剂对肉鸡生长性能的影响 大量试验证明,天然中草药和微生态制剂具有替代抗生素、增强鸡体健康水平、提高成活率和生长速度等功效,更有利于生产出健康、安全、优质的禽肉蛋品[6-7].Guo等[8]研究结果发现,14种中药组成的复方中草药散剂取代维吉尼亚霉素在7~21 d能够提高肉鸡生产性能.Wang等[9]研究表明,益生菌组或其与益生元联合组在28~41日龄获得最好的增重效果,说明益生菌有潜力作为肉鸡中后期催肥的抗生素替代品.
本试验发现,中草药微生态制剂组比单独的中草药组或益生菌组具有更优的生产性能,说明中草药组与益生菌组具有协同增效作用,其机理可能是益生菌进入鸡肠道增殖后,除了与病原菌竞争营养物质和结合位点,同时产生多种消化酶类,促进了中草药充分发酵及其活性成分的释放,共同达到促进动物生长的目的[10];与抗生素组相比,中草药微生态制剂组增加采食量和显著提高饲料转化利用率达到了更优的生产性能,与上述国内外研究报道有一致性,说明中草药微生态制剂在肉鸡养殖上具有替代抗生素的潜力.
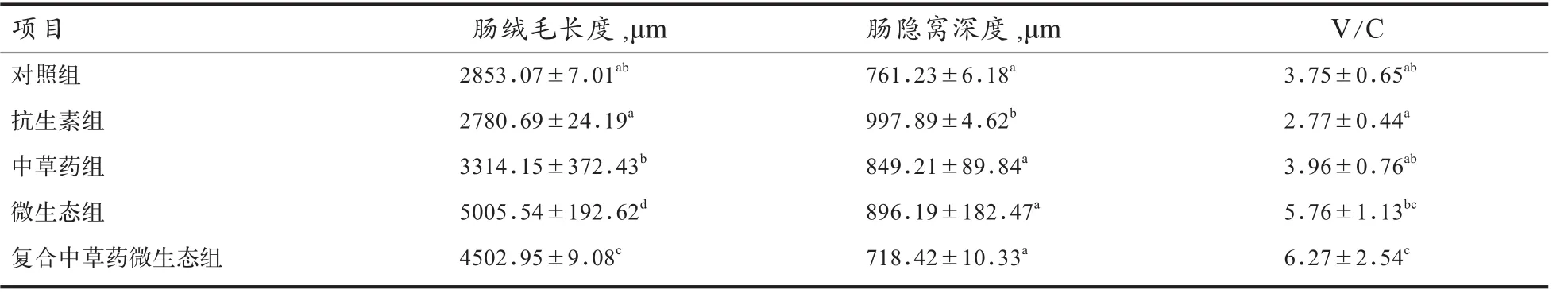
表5 中草药微生态制剂对黄羽肉鸡十二指肠发育的影响

图2 中草药微生态制剂对黄羽肉鸡肝脏的影响(400X)
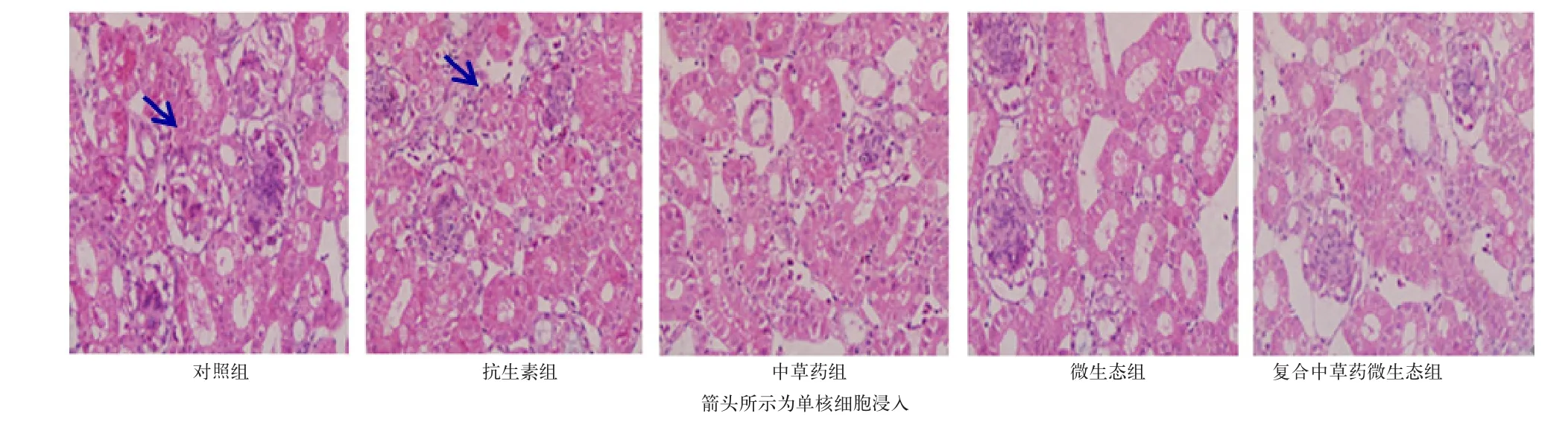
图3 中草药微生态制剂对黄羽肉鸡肾脏的影响(400X)
3.2 中草药微生态制剂对动物免疫器官及功能的影响 Rivas等[11]提出用禽类胸腺、法氏囊、脾脏的重量评价雏鸡免疫状态,其绝对质量和相对质量体现了机体细胞免疫和体液免疫机能.中草药多糖提取物对鸡的免疫提高与修复的作用机理:刺激免疫器官的生长发育;增强细胞免疫和体液免疫;诱导细胞因子分泌;促进T细胞、NK细胞补体的形成[12].Shokraneh等[13]在肉鸡饮水中添加不同剂量的库拉索芦荟提取物,发现各提取物添加组比对照组显著增加体重和肠道乳酸菌数量,对新城疫和禽流感疫苗的抗体滴度提高最佳.Seidavi等[14]研究结果表明,益生菌和酶混合物能够影响22~42 d肉鸡的血清IgG数量,显著增加脾脏指数.
本试验研究发现,中草药微生态制剂组的脾脏指数、胸腺指数、法氏囊指数均显著优于抗生素组,同时均优于对照组和单独的中草药组和益生菌组,说明中草药微生态制剂能够促进鸡体中枢及外周免疫器官的发育,进而提高肉鸡的免疫应答能力.本试验进一步测定的中草药微生态制剂组的AIV疫苗抗体水平及离散度均显著优于对照组和抗生素组,该结论与Chen等[15]的报道一致,表明中草药微生态制剂组能够有效提高疫苗抗体水平及其整齐度,为鸡群提供更可靠的免疫保护保障.
3.3 中草药微生态制剂对脏器组织结构的影响 肠道是机体重要的消化系统、免疫系统和保护屏障系统,肝脏是机体内最大的代谢和解毒器官,肾脏是泌尿系统的重要器官.因此,肠道、肝脏和肾脏的健康状况直接决定了鸡体的健康水平.Zheng等[16]研究发现,屎肠球菌对肉鸡肝脏的作用机理可能是改变营养物质的分配和提升最佳的养分利用率.Zhang等[17]研究发现,丁酸菌组用大肠杆菌攻毒后空肠绒毛高度显著高于抗生素组及对照组,表明丁酸菌能够促进免疫反应,提高肠道屏障功能.
本研究发现,中草药微生态制剂组的肠绒毛长度、V/C均较抗生素组和对照组有显著提高,表明中草药微生态制剂能促进肠道健康发育,直接解释了中草药微生态制剂提高生长速度、降低耗料增重比等改善生产性能的机理;同时由于肠道亦是机体重要的免疫器官,本试验的中草药微生态制剂通过促进肠道健康发育进一步增强了免疫功能,该结论也通过AIV疫苗抗体水平得到了验证.本试验中草药微生态制剂组较抗生素组、对照组的肝脏组织发育更好,说明中草药微生态制剂促进了肝脏的造血和储血能力,从而增强了机体的代谢和免疫功能,这与Zheng等[16]研究益生菌对肝脏作用机理的分析有互补一致性.同时,中草药微生态制剂组肾脏组织细胞结构较抗生素组、对照组更好,说明中草药微生态制剂同时促进了肾脏的代谢功能,有效缓解养殖过程中多种应激.
同时,本试验发现抗生素组的肝脏和肾脏均有炎性渗出、上皮细胞脱落、毛细血管出血等现象,而中草药微生态制剂组无此病理现象,结合抗生素组免疫指数和肠隐窝值差于对照组,直接证明了肉鸡养殖中长期添加抗生素会造成机体的毒副损伤及免疫抑制等,直接影响了机体健康水平、免疫功能和生产性能,加之耐药性的弊端,应尽早减少或取消在养殖过程中长期添加抗生素的传统做法,加快研发和推广更安全、有效的抗生素替代品具有必要性和紧迫性.
4 结 论
本研究发现,饲粮中添加中草药微生态制剂可以发挥中草药和益生菌的协同功效,提高黄羽肉鸡生产性能和成活率,增强免疫功能,促进肠道、肝脏和肾脏等重要组织器官的健康发育,且效果优于抗生素(金霉素+杆菌肽锌).中草药微生态制剂可替代抗生素应用于黄羽肉鸡饲粮中,添加量为5.1 kg/t.尽管单独应用益生菌或中草药均可较对照组显著改善黄羽肉鸡生产性能,而应用复合中草药益生菌制剂的成本更高,但从替代抗生素角度及其整体效益分析,应用复合中草药微生态制剂更能保证养殖场获得更高的综合经济效益.
[1] 谢仲权,牛树琦. 天然物中草药饲料添加剂大全[M]. 北京:学苑出版社, 1996 :100‐105.
[2] 黄银姬, 黄保, 戴小瑜, 等. 中草药添加剂对肉仔鸡生产性能和免疫功能的影响[J]. 饲料研究, 2007, (8):58‐60.
[3] Fuller R. A review: Probiotics in man and animals[J]. J Appl Bacteriol, 1989, 66:365‐378.
[4] Bondarenko V M, Chuprinina R P, Aladysheva Z I, et al.Probiotics and mechanisms of their curative action[J]. Eksp Klin Gastroentero, 2004, (3):83‐87.
[5] Boirivant M, Strober W. The mechanism of action of probiotics[J]. Curr Opin Gastroentero, 2007, 23(6):679‐692.
[6] 阳建辉, 李静, 李旭红. 中草药饲料添加剂作用机理及在养鸡生产中应用效果分析[J]. 岳阳职业技术学院学报,2012, 27(3): 87‐89.
[7] Park Y H, Hamidon F, Rajangan C, et al. Application of probiotics for the production of safe and high‐quality poultry meat[J]. Korean J Food Sci Anim Resour, 2016,36(5):567‐576.
[8] Guo F C, Kwakkel R P, Soede J, et al. Effect of a Chinese herb medicine formulation, as an alternative for antibiotics,on performance of broilers[J]. Br Poult Sci, 2004,45(6):793‐797.
[9] Wang X, Famell Y Z, Peebles E D, et al. Effects of prebiotics, probiotics, and their combination on growth performance, small intestine morphology, and resident Lactobacillus of male broilers[J]. Poult Sci, 2016,95(6):1332‐1340.
[10] Mountzouris K C, Tsitrsikos P, Palamidi I, et al. Effects of probiotic inclusion levels in broiler nutrition on growth performance, nutrient digestibility, plasma immunoglobulins, and cecal microflora composition[J].Poult Sci, 2010, 89(1):58‐67.
[11] Rivas A L, Fabricant J. Indications of immunedepression in chickens infected with various strains of Mare′s disease virus[J]. Avian Dis, 1988, 32(1):1‐8.
[12] Guo F C, Williams B A, Kwakkell R P, et al. In vitro fermentation characteristics of two mushroom species,an herb, and their polysaccharide fractions, using chicken cecal contents as inoculum[J]. Poult Sci, 2003,82(10):1608‐1615.
[13] Shokraneh M, Toghyani M, Landy N, et al. Influence of drinking water containing Aloe vera (Aloe barbadensis Miller) gel on growth performance, intestinal microflora,and humoral immune responses of broilers[J]. Vet World,2016, 9(11):1197‐1203.
[14] Seidavi A, Dadashbeiki M, Alimohammadi‐Saraei M H, et al. Effects of dietary inclusion level of a mixture of probiotic cultures and enzymes on broiler chickens immunity response[J]. Environ Sci Pollut Res Int, 2016,12(13):1‐8.
[15] Chen H L, Li D F, Chang B Y, et al. Effects of Chinese herbal polysaccharides on the immunity and growth performance of young broilers[J]. Poult Sci, 2003,82(3):364‐370.
[16] Zheng A, Luo J, Meng K, et al. Probiotic (Enterococcus faecium) induced responses of the hepatic proteome improves metabolic efficiency of broiler chickens (Gallus gallus)[J]. BMC Genomics, 2016, 17(1):1‐12.
[17] Zhang L, Zhang L, Zhan X, et al. Effects of dietary supplementation of probiotic, Clostridium butyricum, on growth performance, immune response, intestinal barrier function, and digestive enzyme activity in broiler chickens challenged with Escherichia coli K88[J]. J Anim Sci Biotechnol, 2016, 7(1):1‐7.
Effects of Composite Herbal-probiotics agents Substitute for Antibiotic on Growth performance, immune function and organs & tissue development of Yellow Broilers
TIAN Lang1,2, HE Yan‐xia1, HOU Yue‐e1, GUO Ji‐yu1, QIAN Xue‐qiao1*, WANG Lin‐chuan2*
(1. Animal Husbandry and Fisheries Research Center, Guangdong Haid Group Co., Ltd., Guangdong Guangzhou 511400,China; 2. College of Veterinary Medicine, South China Agricultural University, Guangdong Guangzhou 510642, China)
The present study was aimed to study the effects of applying composite herbal‐probiotics agents in the feed on growth performance, immune function and organs & tissue development in Yellow‐feathered broilers. Five hundred Yellow‐feathered broilers at 10‐day‐old were divided into 5 groups. Group A was fed a basal diet, group B was fed the basal diet+50 g/t aureomycin and 40 g/t bacitracin zinc, group C was fed the basal diet+5 kg/t composite herbal agents,group D was fed the basal diet+0.1 kg/t probiotics agents and group E was fed the basal diet+5.1 kg/t composite herbal‐probiotics agents. Each group included 10 replicates(10 birds per replicates), and the experiment lasted 50 days. Results showed that group E got the best experimental results of all groups, ADG was increased by 8.2%(P<0.05), the feed‐gain ratio was decreased by 6.0%(P<0.05), and survival rate increased by 2.4% compared with the antibiotic group B. Group E also got significantly increased immune organ indexes and antibody titer of Avian influenza vaccine(P<0.05), and enhance development of the duodenum, liver and kidney. In conclusion, the results suggest that the composite herbal‐probiotics additives can improve growth performance, increase health degree, immunity and survival rate of Yellow‐feathered broilers, and has the potential to replace antibiotics for broiler breeding.
Composite herbal‐probiotics agents; Yellow‐feathered broilers; Growth performance; Immune function; Organ and tissue
S831.5
A
10.19556/j.0258-7033.2017-11-090
2017-06-30;
2017-08-24
广州市博士后科研启动项目(项目代码230.30)
田浪(1981-),男,四川自贡人,博士,主要从事畜禽动物疫病防控研究,E-mail:tianlang@haid.com.cn
*通讯作者:钱雪桥,副教授,E-mail:qxq@haid.com.cn;王林川,教授,E-mail:lcwang@scau.edu.cn
