内蒙古绒山羊毛囊干细胞的成神经诱导及初步鉴定
2017-11-16刘迎春陈钰萌周欢敏
刘迎春,王 宏,陈钰萌,高 峰,周欢敏
(1.内蒙古农业大学生命科学学院,内蒙古 呼和浩特 010018;2.内蒙古自治区生物制造重点实验室,内蒙古 呼和浩特 010018;3.内蒙古农业大学动物科学学院,内蒙古 呼和浩特 010018)
内蒙古绒山羊毛囊干细胞的成神经诱导及初步鉴定
刘迎春1,2,王 宏1,2,陈钰萌1,2,高 峰3*,周欢敏1,2
(1.内蒙古农业大学生命科学学院,内蒙古 呼和浩特 010018;2.内蒙古自治区生物制造重点实验室,内蒙古 呼和浩特 010018;3.内蒙古农业大学动物科学学院,内蒙古 呼和浩特 010018)
本研究旨在探究内蒙古绒山羊毛囊干细胞的成神经诱导及初步鉴定.实验采用尼氏染色法对毛囊干细胞向神经细胞分化的情况进行鉴定,利用RT-PCR技术对诱导后的毛囊干细胞进行基因水平检测.结果表明:内蒙古绒山羊毛囊干细胞经成神经诱导后,细胞中有类似神经元的细胞出现,并且细胞周围出现许多微管样的结构,经尼氏染色呈阳性.诱导后神经细胞标记基因β-TubulinIII和NSE呈阳性表达,表明内蒙古绒山羊毛囊干细胞具有分化为神经细胞的潜能.
内蒙古绒山羊;毛囊干细胞;诱导分化;RT-PCR
干细胞(Stem Cells)是一种存在于体内具有自我更新和多向分化潜能的特殊细胞,其有能力演变为整个机体的细胞[1].毛囊干细胞(Hair Follicle Stem Cells,FSC)是存在于毛囊里的原始细胞,其有潜能增殖分化为表皮、汗腺和皮脂腺等多种上皮组织[2].在体外培养的毛囊干细胞还可以分化为脂肪细胞[3]、血细胞[4]等.由于干细胞在体外经化学诱导后具有跨胚层分化的能力,所以体外诱导法是鉴定干细胞的常用方法.因此,本实验在已分离纯化的内蒙古绒山羊毛囊干细胞基础上,利用体外诱导法来诱导毛囊干细胞分化为神经细胞,旨在鉴定分离纯化得到的内蒙古绒山羊毛囊干细胞具有跨胚层分化的能力.
1 材料与方法
1.1 毛囊干细胞的解冻与复苏 自液氮中取出已分离纯化的P3代毛囊干细胞(实验室提供)[5],迅速放入37℃水浴锅,镊子夹住震荡直至没有明显的冰块时取出.用75%酒精擦净管口后迅速移进超净工作台,取细胞液,移到1.5 mL离心管,1 500 r/min离心5 min,弃除上清液,干细胞培养液(DMEM/F12+10%10FBS +1%PS+EGF 20 ng/mL + ITS 10 μl/mL)重悬细胞,后将细胞接种到事先用IV型胶原包被的60 mm培养皿中,移入37℃、5% CO2培养箱培养.
1.2 毛囊干细胞的传代培养 细胞长到70%~80%融合时,使用两步酶消化法传代培养.弃掉细胞培养液,加适量的含有双抗(青霉素+链霉素)的PBS溶液清洗2遍后弃掉,向培养皿中加入1 mL 0.25%胰蛋白酶消化细胞,待消化1~5 min向培养皿中加入等体积干细胞培养液停止消化.将上述细胞悬液转移入1.5 mL的离心管中,1 500 r/min离心5 min,弃除上清,干细胞培养液重悬细胞,细胞计数(细胞计数板法,细胞数/mL=4个大格细胞总数/4X104个/mL).
1.3 毛囊干细胞成神经诱导 取上述传代的细胞接种于12孔板中;显微镜观察待细胞贴壁生长为50%~60%融合的时候,随机分为对照组和实验组,实验组加入神经预诱导液(DMEM/F12 +10%FBS +1 mmol/L β-巯基乙醇),对照组加入普通培养液(DMEM/F12 +10%10FBS +1%PS),置37℃、5%CO2培养箱中诱导24 h.24 h后取适量PBS清洗1遍,实验组加入神经诱导液(DMEM/F12 +10%FBS+3 mmol/L β-巯基乙醇),对照组不变,置37℃、5%CO2培养箱中继续培养,每天更换培养液1次,每天注意在荧光显微镜下观察细胞生长形态的变化,并使用尼氏染色试剂盒染色鉴定神经细胞.

表1 神经细胞标记基因引物序列
1.4 毛囊干细胞诱导分化为神经细胞特异表达基因鉴定 神经元特异性烯醇化酶(NSE)和神经微管蛋白Ⅲ(β-tubulin Ⅲ)为神经细胞的特异表达基因,利用Priemer 5.0软件设计合成引物,并由上海生工公司合成(表1).首先用RNAiso Plus裂解已诱导的毛囊干细胞,然后提取总RNA并反转录为cDNA,通过PCR体系和1% 琼脂糖凝胶电泳进行鉴定.
2 结果与分析
2.1 毛囊干细胞的传代与复苏 将解冻后的毛囊干细胞培养2 d,显微镜下观察细胞贴壁后,有明显铺路石状生长的细胞即为毛囊干细胞;高倍显微镜继续观察,发现毛囊干细胞的细胞核较大,占细胞大部分位置,即核质比大,同时可以观察到核仁,可见细胞有明显的幼稚细胞的状态(图1).

图1 毛囊干细胞的传代与复苏
2.2 毛囊干细胞成神经诱导 诱导前,对毛囊来源干细胞进行尼氏染色,发现部分毛囊来源干细胞中有少量尼氏颗粒的存在,但是没有发现神经细胞的结构特征(图2A、2A′).经过神经预诱导液诱导24 h,部分细胞开始慢慢变圆,细胞两极伸出细长突起,状似双极神经元细胞,而且细胞旁有生长出很多微管样的结构形态;更换正式神经诱导液后诱导24 h,细胞旁的这种结构有所增多(图2B).继续诱导24 h,有更多的细胞旁边延伸出突起(图2C).有的细胞伸出数条树突状突起,类似星形胶质细胞,细胞周围出现微管样结构有所增加,发现有类神经元细胞,经尼氏染色呈阳性.

图2 毛囊来源干细胞成神经诱导(200X)
2.3 毛囊干细胞诱导分化为神经细胞标记基因鉴定 RT-PCR法检测神经细胞特异表达基因β-Tubulin III 和NSE都呈现阳性结果,利用特异性引物扩增3个目的基因片段,电泳显示条带清晰且单一,无非特异扩增,可知β-Tubulin III 的片段大小约为145 bp,NSE的片段大小约为253 bp,与设计的片段大小符合(图3).
3 讨 论
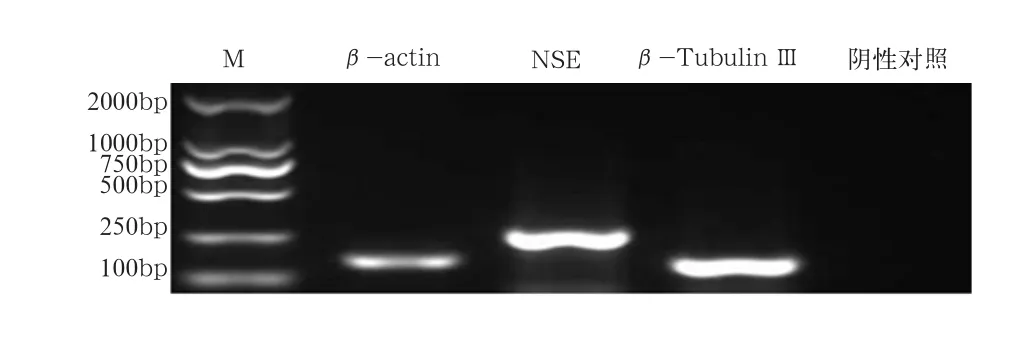
图3 毛囊干细胞成神经诱导(基因检测)
现如今,干细胞的研究逐步受到科研人员的重视,随着对干细胞的研究不断深入,发现毛囊干细胞也具有干细胞的普遍特点:慢周期性;在超微结构和生化特征方面保留着未分化细胞的特征;具有自我更新和多向分化潜能;可分裂产生过渡放大细胞;发现的部位较隐蔽、安全,营养环境较好;体外克隆形成率高[6].因此,毛囊干细胞的体外分离和培养成为深入探究毛囊干细胞的一个重要内容.
毛囊干细胞在体外经化学诱导具有跨胚层分化的能力,可以采用诱导分化的方法来鉴定所分离的细胞.检测毛囊干细胞的多向分化潜能,能够成为鉴定干细胞的一个重要的判断标准.在不同的实验条件下培养细胞,毛囊干细胞可表达其多向分化潜能,可以向多数不同的细胞组织定向分化.Drewa等[7]通过条件培养基将毛囊来源干细胞诱导分化为尿路上皮细胞.另一项研究发现毛囊干细胞可以在TGF-β1的诱导下分化为平滑肌细胞[8].最新研究发现毛囊来源干细胞在体外还可以诱导分化为血管内皮细胞[9].也有研究证明人多潜能毛囊干细胞具有向神经元样细胞分化的潜能[10].毛囊干细胞成神经诱导后可以表达一些神经元细胞或星形胶质细胞的特异标志物: NSE和β-tubulinⅢ.NSE是一种参与糖酵解途径的烯醇化酶,存在于神经组织和神经内分泌组织中[11].β-tubulinⅢ是编码β微管蛋白家族的Ⅲ类成员,β微管蛋白是异源二聚化和组装形成微管的2个核心蛋白家族(α和β微管蛋白)之一,该蛋白质主要在神经元中表达,可能参与神经发生和轴突引导和维持[12].本实验中,在加入神经诱导液之前毛囊干细胞多呈铺路石状紧密排列且生长均一;加入神经诱导液诱导后细胞样拉长,呈长梭型并且生长不均一,随着诱导时间的不断加长细胞聚集性生长,开始由长梭形变成不规则形状,其中可发现有类神经元细胞,经过尼氏染色后呈阳性.在诱导3 d后利用RT-PCR技术鉴定NSE和β-tubulin Ⅲ基因的表达量,通过诱导后可以发现NSE和β-tubulin Ⅲ 表达呈阳性.
4 小 结
在本实验条件下,体外分离培养的内蒙古白绒山羊毛囊干细胞经特定诱导可以定向分化为神经样细胞,具有分化神经细胞的能力.
[1] Amoh Y, Li L, Campillo R, et al. Implanted hair follicle stem cells form Schwann cells that support repair of severed peripheral nerves[J]. Proc Natl Acad Sci USA,2005, 102 (49): 17734‐17738.
[2] Waters J M, Richardson G D, Jahoda C A, et al. Hair follicle stem cells[J]. Semin Cell Dev Biol, 2007, 18(2):245‐254.
[3] Toma J G, Akhavan M, Fernandes K J, et al. Isolation of multipotent adult stem cells from the dermis of mammalian skin[J]. Nat Cell Biol, 2001, 3 (9):778‐784.
[4] Lako M, Armstrong L, Cairns P M, et al. Hair follicle dermal cells repopulate the mouse heamatopoietic system[J]. J Cell Sci, 2002, 115 (20): 3967‐3974.
[5] 王宏. 内蒙古白绒山羊毛囊来源干细胞的分离鉴定及其褪黑素受体基因cDNA的克隆[D]. 呼和浩特: 内蒙古农业大学, 2014.
[6] 伍津津. 毛囊干细胞与组织工程研究进展[J]. 中国医学文摘(皮肤科学), 2016, 33 (4): 415‐423.
[7] Drewa T, Joachimiak R, Bajek A, et al. Hair follicle stem cells can be driven into a urothelial‐like phenotype: An experimental study[J]. Int J Urol, 2013, 20 (5): 537‐542.
[8] Liu X, Song L, Liu J, et al. miR‐18b inhibits TGF‐β1‐induced differentiation of hair follicle stem cells into smooth muscle cells by targeting SMAD2[J]. Biochem Biophys Res Commun, 2013, 438 (3): 551‐556.
[9] Xu Z C, Zhang Q, Li H. Differentiation of human hair follicle stem cells into endothelial cells induced by vascular endothelial and basic fibroblast growth factors[J]. Mol Med Rep, 2014, 9 (1):204‐210.
[10] 谭晓华. 人多潜能毛囊干细胞的分离培养及其向神经元样细胞诱导分化的研究[D). 长春: 吉林大学, 2010.
[11] Wang N, Xu Y, Qin T, et al. Myocardin‐related transcription factor‐A is a key regulator in retinoic acid‐induced neural‐like differentiation of adult bone marrow‐derived mesenchymal stem cells[J]. Gene, 2013, 523(2):178‐186.
[12] 李英, 高杰, 商亚敏, 等. 小儿骨髓间质干细胞体外诱导分化为神经元样细胞[J]. 中国组织工程研究, 2016, 20(32): 4745‐4750.
S827.3
A
10.19556/j.0258-7033.2017-11-052
2017-05-31;
2017-07-03
国家自然科学基金(31160445)
刘迎春(1978-),女,副教授,研究方向为干细胞信号通路,E-mail:liuyingchun1994@aliyun.com
* 通讯作者:高峰(1978-),男,教授,E-mail:gaofeng1994@sina.com
