分析速率平衡图像 提升学生思维素养
2017-11-14苏美华
苏美华
摘要:选取浙江省各地区选考模拟卷中易错的速率平衡图像题目,从多种外界因素共同作用于速率和平衡、同一外界因素先作用于速率后作用于平衡、同一外界因素同时作用于速率和平衡、速率与平衡的关系等方面分类总结,挖掘题目中蕴含的思维素养,通过分析和解决问题来提升学生的思维素养。
关键词:化学学科核心素养;化学平衡;化学反应速率;图像;思维素养
文章编号:1005–6629(2017)10–0077–04 中图分类号:G633.8 文献标识码:B
化学学科核心素养具体指宏观辨识与微观探析、变化观念与平衡思想、证据推理与模型认知、科学探究与创新意识、科学精神和社会责任五个方面。其中证据推理与模型认知蕴含着思维素养。思维素养决定着知识技能的掌握程度,也决定着问题解决的水平深度。如何在教学中主动地提升学生的思维素养?笔者以浙江省化学选考第30题考查的部分内容为例,选取各地区选考模拟卷第30题中有关速率和平衡的图像题目进行分类研究,有针对性地培养学生的各项思维品质,在解决各类问题过程中提升学生的思维素养。
1 分析多因素作用于速率和平衡
化学反应速率是衡量化学反应进行快慢的物理量。化学反应速率的大小主要取决于反应物的性质,也受外界因素的影响。化学平衡状态是指可逆反应在一定条件下进行到一定程度时,正反应和逆反应速率相等,反应物和生成物的浓度不再发生变化的状态[1]。化学平衡状态只有在一定的条件下才能保持。当平衡体系条件改变时,正、逆反应速率发生改变,正、逆反应速率不相等时,原有的平衡状态被破坏,一段时间后会达到新的平衡状态[2]。
外界因素如浓度、温度、压强、催化剂、反应物接触面积、固体颗粒大小等改变,会引起化学反应速率的变化。但各个外界因素对可逆反应正、逆方向速率的影响程度不尽相同。一些条件改变引起正、逆速率改变程度不同,原平衡被破坏,该影响速率的因素也是影响平衡的因素。一些条件改变虽然引起正、逆速率改变,但改变的程度相同,该因素是影响速率的因素却不是影响平衡的因素。因此,影响速率的因素不一定是影响平衡的因素。例如,催化剂同等程度影响正逆反应速率,不影响平衡。对方程式两边气体计量数相同的反应,改变压强,速率改变,但正、逆方向速率同时、同等程度改变,平衡不受影响。在速率平衡图像中,如果涉及多个因素,这类问题较复杂,学生不仅需要具备有关速率和平衡理论的基础知识,还需要全面考察、分析问题,透过纷繁的现象,发现问题的本质,才能获得问题的正确答案。
例1 (台州市2017年2月选考科目教学质量评估试题30题节选)汽车尾气的主要成分有CO、SO2、氮氧化物等,科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。已知TiO2催化尾气降解原理为: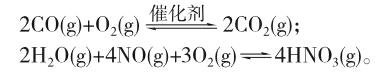

分析:题中将温度和催化剂两因素共同作用于平衡,由于催化剂不影响平衡,因此使用不同催化剂在同一温度下的平衡转化率应该相同,即三线合一。题图表明,平衡后,降解率随温度升高而下降,所以若将TiO2改为催化效果更好的TiO2纳米管,反应速率加快,实验进行相同一段时间,平衡应该出现在较低温度,该平衡点降解率较高。综合上述两点,可以作答如图1-2。
通过分析温度、催化剂因素对速率的影响来分析同一段时间平衡点出现的温度范围,再通过温度对平衡的影响来分析该温度点的降解率大小,问题便迎刃而解。经历一系列的分析过程,学生对温度既影响速率又影响平衡有了较全面的认识和理解,对催化剂不影响平衡,但因影响速率从而影响达到平衡的时间也有了较深入的认识。
2 剖析单因素作用于速率或平衡
外界因素改变,速率和平衡都可能发生改变,学生往往容易将速率和平衡混为一谈,不能辩证分析速率理论和平衡理论的本质区别,不能从实际出发将速率或平衡问题独立分析判断,造成解决问题困难,甚至无从下手。例如,反应的转化率或者产率随温度发生变化的图像,到底是用速率理论还是平衡理论去分析,学生常常犯难。笔者引导学生思考、辨别、领悟,形成基本的思维模式:速率理论适用于反应的整个过程,而平衡理论只适用于反应达到平衡以后。学生经过独立思考、反思,不难获得反应的转化率或者产率随温度发生变化的图像的分析思路:达到平衡以前,应用速率理论,温度越高,速率越快,转化率或产率越高;达到平衡以后,应用平衡理论,温度升高,平衡向吸热方向移动,若正反应吸热,转化率或产率增大,若正反应放热,转化率或产率下降。
例2 (2016学年第一学期温州十校联合体高三期末考试化学学科试题30题节选)研究氮氧化物反应机理,对于控制汽车尾气、保护环境有重要意义。NH3还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应的热化学方程式为:4NH3(g)+6NO(g)=5N2(g)+6H2O(g),ΔH=-1811.63kJ/mol;反应在恒容密闭容器中进行,在其他条件相同时,选用不同的催化剂,反应产生N2的物质的量随时间变化如图2-1所示。
(1)在催化剂A的作用下,经过相同时间,测得脱氮率随反应温度的变化情况如图2-2所示,据图可知,在相同的时间内,300℃之前,温度升高脱氮率逐渐增大,300℃之后温度升高脱氮率逐渐减小(催化剂均失效),其可能的原因是 。
(2)其他条件相同时,请在图2-2中补充在催化剂B作用下脱氮率随温度变化的曲线。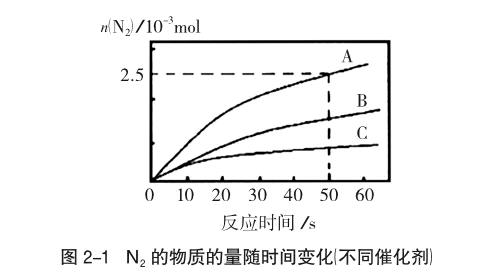
分析:图像表明,温度较低时,脱氮率随温度升高而升高;温度较高时,脱氮率随温度升高而下降。脱氮率随温度变化呈现相反的变化规律,显然不能全程应用平衡理论来解释。温度较低时,反应速率较慢,在相同的时间内反应尚未达到平衡,脱氮率由速率决定。温度较高时,反应速率较快,在相同的时间内反应已经达到平衡,脱氮率高低要考虑平衡移动的影响。即(1)参考答案:300℃前反应未平衡,脱氮率决定于速率,温度越高速率越快,所以脱氮率增大;300℃之后反应达平衡,脱氮率决定于平衡的移动,该反应正反应是放热反应,升高温度平衡逆向移动,脱氮率减小。(2)中,催化剂改变只影响速率,不影响平衡,所以平衡时脱氮率不变,催化剂B比催化剂A的催化效率低,同一温度下,反应速率慢,经过相同时间要达到平衡,必然温度更高,使用催化剂B比催化剂A达到平衡时脫氮率更低,但最终的脱氮率在相同温度下相同,如图2-3。endprint
