抗PD-L1 CAR基因的构建及CAR-T的功能活性研究
2017-11-14,,,,
,,,,
(浙江理工大学,a.生命科学学院;b.浙江省家蚕生物反应器和生物医药重点实验室,杭州 310018)
抗PD-L1 CAR基因的构建及CAR-T的功能活性研究
白静a,b,张洁雯a,b,施炜星a,陈健a,b,吕正兵a,b
(浙江理工大学,a.生命科学学院;b.浙江省家蚕生物反应器和生物医药重点实验室,杭州 310018)
鉴于嵌合抗原受体T细胞(chimeric antigen receptor T cells, CAR-T)疗法应用于肿瘤治疗的临床试验已取得很大突破,设计了程序性死亡配体-1(programmed death ligand-1, PD-L1)特异性CAR-T细胞以体外杀伤肺癌细胞。通过克隆表达PD-L1(73-739),并纯化PD-L1蛋白以免疫BALB/c小鼠制备获得PD-L1单克隆抗体;克隆PD-L1单克隆抗体单链可变区片段,与CD28、4-1BB、CD3-ζ链的基因体外融合构建第三代CAR基因,并克隆于慢病毒载体pCDH-CMV-EF1-copGFP上,包装成慢病毒。该慢病毒感染CD8+T细胞,扩增5 d,测定CAR的表达,表达率可达到22%以上。PD-L1靶向的肿瘤细胞杀伤作用分析显示,抗PD-L1 CAR-T细胞有一定的体外杀伤活性。
肺癌;程序性死亡配体-1;嵌合抗原受体;单克隆抗体;过继细胞治疗
0 引 言
肿瘤,尤其是恶性肿瘤,是目前威胁人类生命健康的最主要疾病之一。其中肺癌已成为比较常见的恶性肿瘤。在我国,无论是肺癌的发病率还是死亡率均高居首位[1]。随着科学技术的发展,肿瘤治疗的手段不断创新,免疫治疗已成为继手术、放疗、化疗后的第四种行之有效的治疗手段,而它的临床试验进展更令人瞩目,因此,肿瘤免疫治疗在2013年被《Science》杂志评为年度十大科学突破第一位[2]。CAR-T细胞治疗,是嵌合抗原受体(chimeric antigen receptors,CAR)修饰的T细胞治疗,是免疫治疗一个重要方面,该技术是通过基因修饰的手段,将患者的T细胞在体外修饰,活化和扩增后,再回输到患者体内[3]。经过不断的研究与改进,CAR基因已由第一代发展到第三代;第一代仅CD3复合物(ζ链)胞内结构域融合形成嵌合受体[4-5],第二代引入一个共刺激因子(如CD28)[6],第三代CAR又增加一个共刺激因子引入(如CD134(OX40)、CD137(4-1BB))[7]。Zhao等[8]通过应用CD28和CD137两个共刺激因子构建第三代CAR,第三代CAR-T细胞展示出较强的杀肿瘤功能,并增强T细胞在体内作用的持久性。
PD-L1分子,亦称B7-H1、CD274[9-10],是PD-1的主要配体,并在很多恶性肿瘤中高表达[11-17],在免疫应答负调控中发挥重要作用。PD-1/PD-L1信号通路的激活,有助于形成肿瘤微环境,使肿瘤细胞逃避机体的免疫监视和杀伤,而阻断该信号通路,可以促进肿瘤抗原特异性T细胞的增殖,发挥杀伤肿瘤细胞的作用[18]。PD-1单克隆抗体与CAR-T技术结合,在免疫缺陷小鼠体内进行试验,验证该联合疗法消除肿瘤的可行性[19]。PD-L1是PD-1的配体,PD-L1单克隆抗体优势也比较明显,如特异性强,副作用低,肿瘤控制时间长等,它已成为治疗非小细胞肺癌(NSCLC)有效手段,并在临床试验中取得突破性进展[20-22]。本文设想将PD-L1作为CAR-T治疗的靶抗原,抗PD-L1 CAR-T既能阻断PD-1/PD-L1信号通路,提高T细胞介导的肿瘤免疫治疗,又可以直接特异性地杀死肿瘤细胞,而且构建的第三代CAR基因可以增加T细胞在体内的存活时间,增强T细胞的杀伤活性和持久性。本文提出把PD-L1作为CAR-T细胞的靶点,验证抗PD-L1 CAR-T细胞在体外对肿瘤细胞有杀伤活性,为后续的体内试验研究和临床试验提供理论依据。
1 材料与方法
1.1 材料与试剂
菌种TG1、BL21(DE3),质粒pcDAN3.1-PD-L1(73-739)、pETduet-His-SUMO、pCDH-CMV-MCS-EF1-copGFP、pLP1、pLP2、pLP-VSVG,细胞株293T、A549、NCL-H1048及小鼠骨髓瘤细胞SP2/0均由本实验室提供;小鼠采用SPF级BALB/c雌性小鼠(购于上海斯莱克实验动物有限责任公司);生物分子试剂非特殊说明均购于Takara;蛋白Marker(Thermo);Anti-His6抗体(Roche);BCA蛋白定量试剂盒(Biomiga);TMB单组份显色液(Solarbio);弗氏完全佐剂、弗氏不完全佐剂、HAT、HT、四甲基联苯胺、PEG、8-N-鸟嘌呤均购于Sigma;CD8+T细胞分选磁珠(Miltenyi);培养基RPMI-1640、DMEM,FBS,IL-2,均购于Gibco;Ficoll-Paque PREMIUM sterile solution(GE healthcare)、IFN-γ检测试剂盒(Life technologies)。
1.2 pETduet-His-SUMO-PD-L1(73-739)重组质粒的构建及PD-L1蛋白的表达与纯化
1.2.1 pETduet-His-SUMO-PD-L1(73-739)重组质粒的构建
通过限制性内切酶EcoR I和NotI对含有pcDNA3.1-PD-L1(73-739)基因的质粒和pETduet-His-SUMO载体分别进行双酶切获得PD-L1(73-739)基因片段和载体片段,采用凝胶回收试剂盒(Axygen)回收目的片段,通过T4DNA Ligase将回收的酶切产物于16~24 ℃连接,并转化至大肠杆菌TG1感受态;转化菌液均匀涂布于含Amp的LB固体培养基上,37 ℃培养箱,倒置培养10 h。挑选单斑菌落,继续扩大培养10 h,提取重组质粒,双酶切鉴定获得pETduet-PD-L1(73-739),并送至上海生工生物工程有限公司测序验证。
1.2.2 PD-L1蛋白的表达与纯化
将pETduet-PD-L1(73-739)重组质粒转化到BL21(DE3)感受态细胞中,1 mmol/L IPTG诱导表达,使用蛋白割胶回收试剂盒(Sangon)纯化,SDS-PAGE凝胶电泳检测目的蛋白,浓缩胶浓度为5%,分离胶浓度为15%,电泳时间1.5 h,考马斯亮蓝溶液染色2.0 h,脱色至目的条带清晰后拍照记录。随后利用Western blotting验证,将SDS-PAGE凝胶上的PD-L1蛋白转移到PVDF膜上,经脱脂奶粉封闭后,加入1∶5000倍稀释的Anti-His6,孵育1.0 h,TBST洗膜3次,每次15 min,用化学发光检测系统采集图像。
1.3 PD-L1单克隆抗体制备
1.3.1 动物免疫
实验方法参照文献[23-24]改进,1 mg/mL的PD-L1纯化蛋白与等体积弗氏完全佐剂混匀免疫BALB/c雌性小鼠,每隔两周进行一次免疫,进行腹部或皮下注射,共免疫4次,一周后收集小鼠脾细胞。
1.3.2 细胞融合
将1×106个脾脏细胞和1×105的SP2/0细胞充分混合,在1 mL的37 ℃预热PEG溶液(pH值为8.0~8.2)作用下融合1 min,再加入RPMI-1640培养基终止PEG作用,1000 rpm离心3 min,重复洗涤两次,细胞接种密度调至2.5×106/mL,50 μL/孔并接种到96孔细胞培养板中;37 ℃,5% CO2培养箱培养,4.0~6.0 h后每孔加入50 μL 2×HAT培养基培养[23]。
1.3.3 杂交瘤细胞的筛选
细胞融合后生长10 d左右,检测克隆阳性孔,对阳性克隆的杂交瘤细胞经过三轮有限稀释法进一步筛选,获得5株杂交瘤细胞株,分别利用PD-L1蛋白和经过固定处理NCL-H1048细胞(高表达PD-L1蛋白)作为包被抗原,筛选获得一株最优杂交瘤细胞株[25]。
1.3.4 腹水单克隆抗体制备与纯化
提前一周将400 μL弗氏不完全佐剂注射到小鼠体内进行诱导,扩大培养杂交瘤细胞,调整细胞浓度8×105个/mL,取1 mL腹腔注射小鼠体内,一周后,收取腹水,8000 rpm离心10 min;ELISA法确定单克隆抗体的亚型,二抗羊抗鼠分型二抗1∶5000稀释使用,确定抗体亚型,选择Protein G填料(索莱宝)纯化抗体,ELISA法检测抗体效价,Western blotting技术鉴定。
1.4 PD-L1特异性CAR基因的构建


表1 PCR引物设计
注:表中下划线部分为EcoR I和NotI。
将轻链(κ链)编码区和重链恒定区的序列由人源IgG编码区轻链(κ链)和重链恒定区序列替换,将人源化单克隆抗体基因与CD28、4-1BB、CD3-ζ链的基因序列组合。PD-L1特异性CAR基因载体结构设计如图1所示,产生编码嵌合抗原受体的CAR基因,由苏州泓讯生物技术有限公司合成,克隆到pCDH-CMV-MCS-EF1-copGFP载体上。

图1 PD-L1特异性CAR基因载体结构简图注:pCMV为CMV启动子;pEF1为EF1启动子。
1.5 CAR-T细胞的制备
使用脂质体3000将穿梭载体pCDH-CMV-MCS-EF1-copGFP-CAR与pLP1、pLP2、pLP-VSVG参照试剂盒(Invitrogen)共转染至293T细胞,流式细胞仪检测绿色荧光细胞百分比,转染后继续培养72 h,收集上清液,PEG法浓缩并纯化慢病毒,感染293T细胞进行滴度测定,滴度等于细胞数、感染率、稀释倍数的乘积,病毒浓缩液按MOI为10感染CD8+T细胞,细胞培养基使用含10% FBS的RPMI-1640培养基(IL-2为60 U/mL,IL-7为30 U/mL),培养5 d后,利用流式细胞仪检测CAR的表达率。
1.6 CAR-T细胞的体外杀伤活性检测
ELISA法检测毒性杀伤上清液中IFN-γ的分泌量:A549细胞作为阴性对照细胞,NCL-H1048细胞作为阳性靶细胞,实验组设计效靶细胞比为1∶1,每个反应孔各100 μL,细胞浓度1×106/mL,细胞板在37 ℃孵育10~20 h,1500 rpm离心4 min,检测毒性杀伤后上清液中IFN-γ的分泌量,可参照产品使用说明书。
1.7 实验数据统计分析
使用GraphPad Prism 6.0软件进行统计分析。p<0.05表示具有统计学意义,p<0.001表示存在极显著差异。
2 结果与分析
2.1 构建的pETduet-PD-L1(73-739)重组质粒进行双酶切鉴定
将连接产物转化TG1,涂板,挑选pETduet-PD-L1(73-739)单克隆菌落扩大培养后,提取质粒进行双酶切鉴定。将酶切产物进行1%琼脂糖凝胶电泳,结果如图2所示。从图2中可以看出,目的条带大小与预期的一致,因此重组质粒pETduet-PD-L1(73-739)构建成功。

图2 重组质粒的鉴定注:M:DL10000,泳道1:pETduet-PD-L1的双酶切产物。
2.2 His-PD-L1融合蛋白纯化产物的鉴定
收集扩大培养的pETduet-PD-L1(73-739)菌体,采用切胶回收的方法纯化His-PD-L1融合蛋白,并对回收产物进行15% SDS-PAGE凝胶电泳检测和Western blotting验证,结果如图3所示。从图3中可以看出,目的条带与预期相符。

图3 PD-L1割胶回收产物鉴定注:图(a)中电泳凝胶检测M1:26610 marker,泳道1:割胶回收的蛋白纯化产物;图(b)中鉴定M2:26616 marker,泳道2:蛋白纯化产物。
2.3 杂交瘤细胞的筛选
免疫后小鼠,分离脾细胞,与小鼠骨髓瘤细胞经细胞融合技术获得杂交瘤细胞株,三轮有限稀释后,共得到五株稳定表达PD-L1单克隆抗体的细胞株,分别为B10-8、B4-F3、B4-E1、B10-A4、A4-E6。ELISA检测,结果如图4(a)中所示,B10-8与B4-F3相对较高,其他三种也显示相对较高的水平;图4(b)是利用高表达PD-L1的NCL-H1048细胞株进行处理作包被抗原,结果显示B10-8与B10-A4两株细胞株显示出较高的水平。综上所述,选择细胞株B10-8进行单克隆抗体腹水制备抗体。

图4 杂交瘤细胞的筛选
2.4 单克隆抗体的制备与鉴定
将制备的杂交瘤细胞腹腔注射到小鼠体内,一周后获得腹水,将腹水按1∶200,1∶1000,1∶5000,1∶10000,1∶20000,1∶60000,1∶240000;用PBS等比例稀释后,测定抗体效价。结果如图5所示,B10-8的效价可达到1∶240000。

图5 PD-L1单克隆抗体的腹水效价
利用ELISA,检测杂交瘤细胞上清液中的抗体亚型,抗体使用羊抗鼠分型二抗,以及1∶5000稀释的兔抗羊HRP,酶标仪测定OD450nm读数,结果如图6所示。细胞株所分泌的单克隆抗体IgG2b亚型,轻链为κ链,因此确定选用亲和层析填料Protein G纯化抗体。
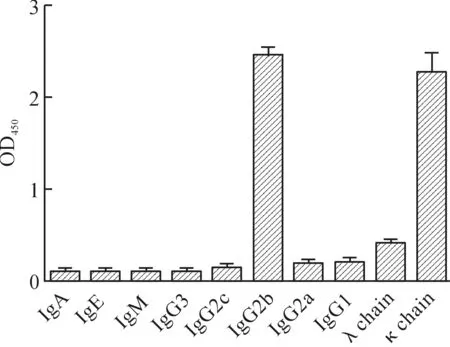
图6 B10-8单克隆抗体的亚型分析
利用原核表达纯化的PD-L1蛋白与筛选得到的单克隆抗体腹水进行Western blotting鉴定。样品与PBS按1∶100稀释,结果如图7所示,纯化后的单克隆抗体与PD-L1蛋白产生特异性反应,目的条带的显示位置与预期相符。

图7 PD-L1单克隆抗体Western blotting鉴定注:M:26616 marker;泳道1:B10-8单克隆抗体纯化产物。
2.5 病毒包装与滴度测定
将慢病毒质粒pCDH-CMV-MCS-EF1-copGFP-CAR与PLP1、PLP2、PLP-VSVG四种质粒转染至293T细胞,培养3 d后,收集细胞并通过流式细胞仪测定绿色荧光细胞百分比,293T细胞的病毒感染率如图8所示。从图8中可以看出,可达到95.66%(R2区域所示),携带目的基因的穿梭载体对293T细胞的转染率每板均能达到90%以上,四质粒转染293T细胞,满足慢病毒包装前提。
收集含有病毒上清液100 mL,经PEG8000浓缩后得到病毒浓缩液300 μL,取适量病毒浓缩液,梯度稀释至10倍、100倍、1000倍、2000倍用于感染293T细胞,未感染的293T细胞作为空白对照,用于感染CD8+T细胞。病毒浓缩液稀释10倍的感染率为88%,稀释100倍感染率为75.88%,稀释1000倍感染率为40.53%,稀释2000倍感染率为26.45%(图9)。浓缩后病毒滴度约为5×107TU/mL。

图8 293T细胞的病毒感染率
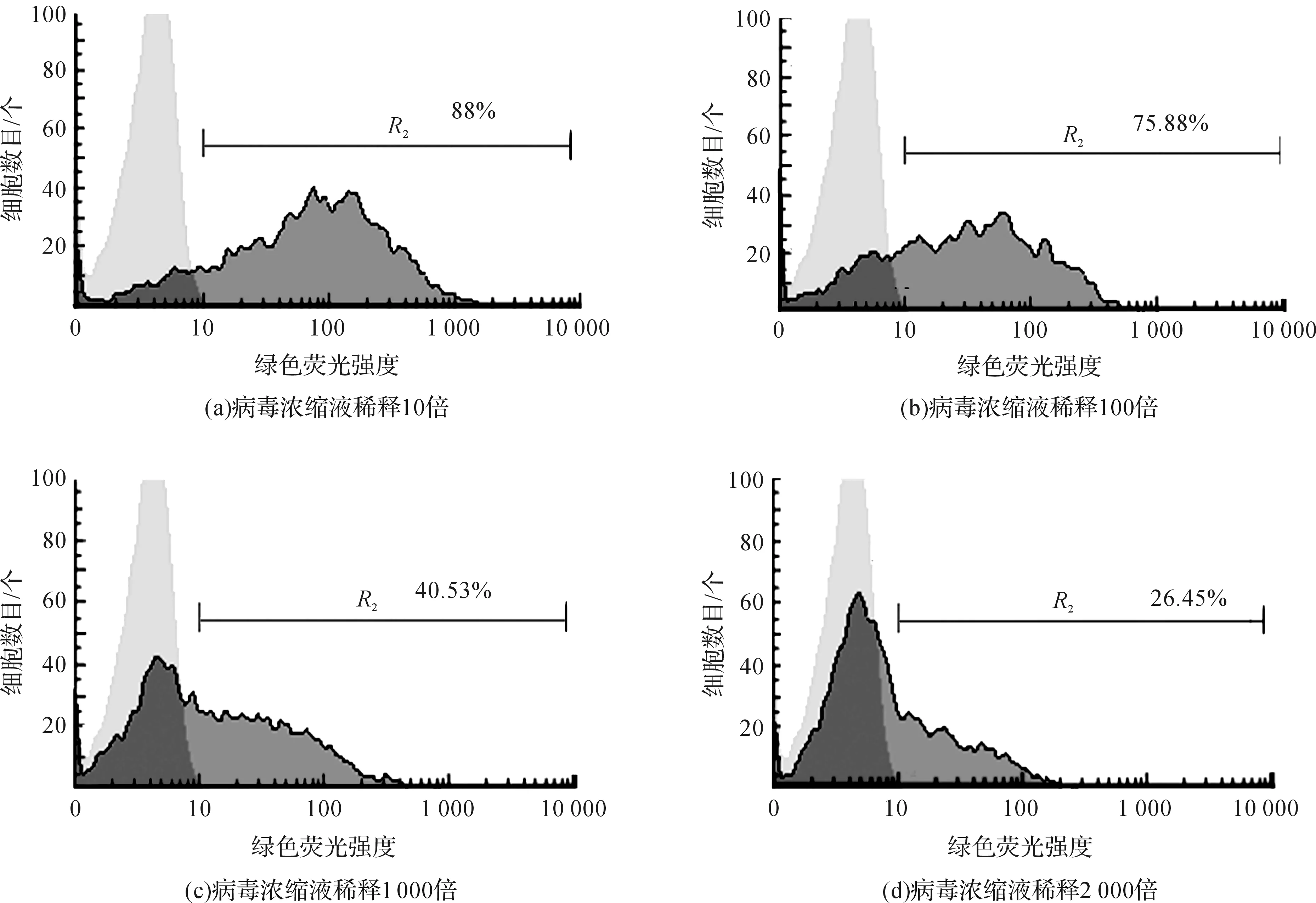
图9 梯度稀释病毒浓缩液对293T细胞的感染率
2.6 慢病毒感染T细胞CAR的表达率
选取数目为0.5×106个CD8+T细胞,作为初始细胞进行激活诱导,诱导1~2 d后,加入病毒浓缩液感染,4 d后,测定感染率结果表明:表达率达到22%,随着T细胞的不断扩增,培养20 d后,CAR的表达率仅达到不足10%,分析原因,可能为未感染病毒T细胞扩增速度较快,CAR-T细胞扩增速度相对将慢,因此表达率有所降低。感染20 d后,对照组细胞扩增近50倍,实验组细胞扩增不足40倍,原因可能是在加入病毒感染后,病毒以及病毒液中混着的蛋白杂质对T细胞的有影响,且在细胞培养过程中,尤其在病毒感染4 d后,换液处理时观察到CAR-T实验组细胞有不同程度细胞死亡裂解存在。
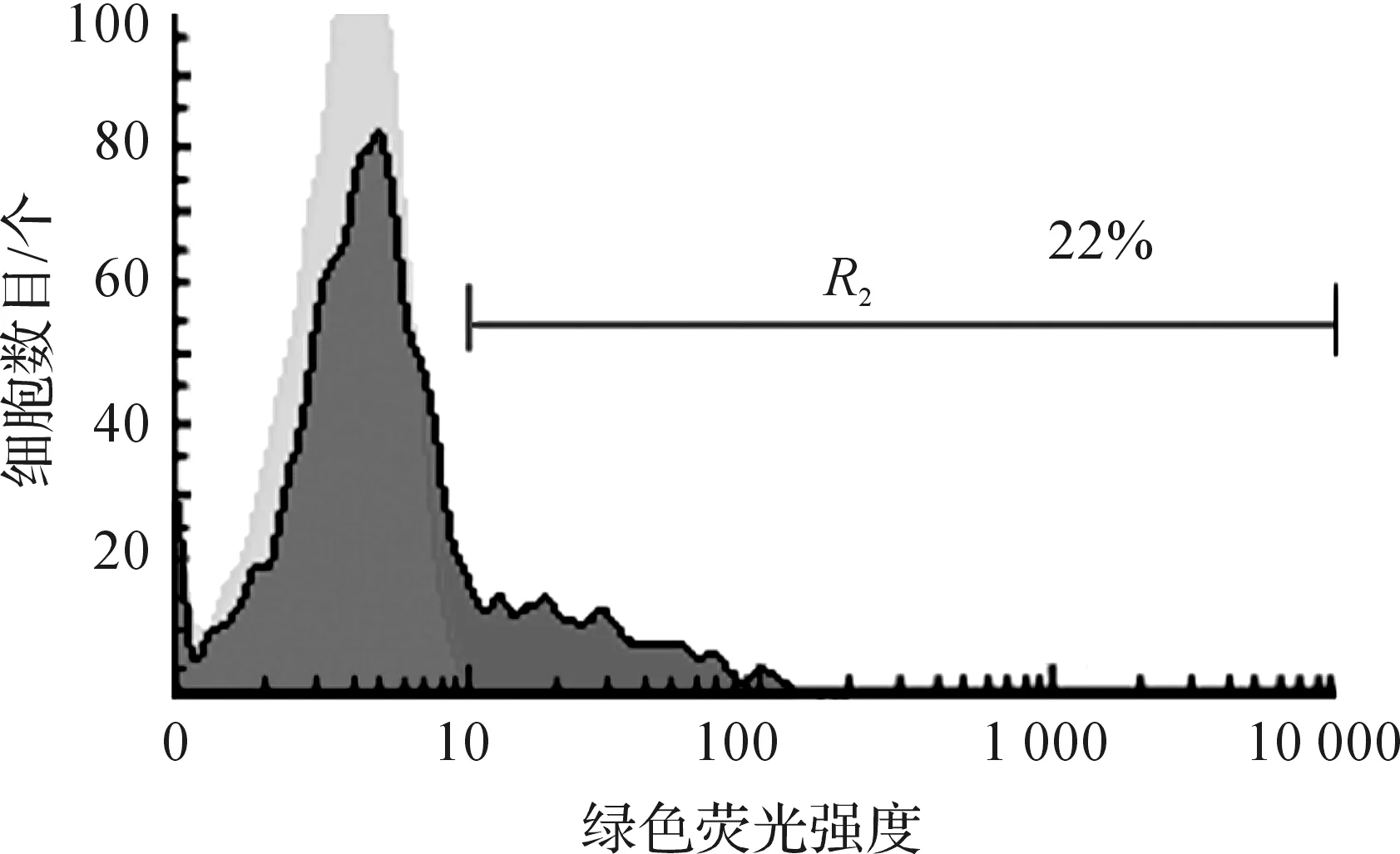
图10 CAR的表达率
2.7 CAR-T细胞体外毒性检测
通过ELISA检测效靶细胞上清液的IFN-γ的分泌量,分泌量越大,证明CAR-T细胞杀伤靶细胞作用越明显。IFN-γ的分泌量如图11所示,从图中可以看出,在各组效靶细胞的杀伤过程中释放的IFN-γ量有着很大的差距,其中以CAR-T细胞对NCL-H1048细胞的杀伤中分泌的IFN-γ量最大,证明杀伤力最强;CAR-T对A549细胞显示一定杀伤活性,而T细胞对于两种靶细胞显示极微弱的杀伤活性,实验组与对照组相比,两者的杀伤活性差异极其显著。
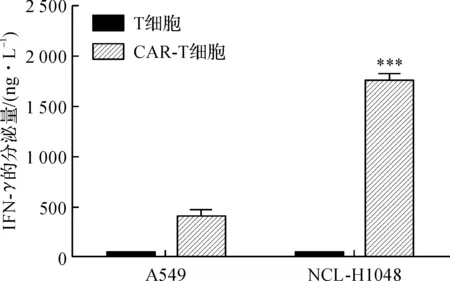
图11 IFN-γ的分泌量注:***,p<0.001。
3 讨 论
在肿瘤的免疫治疗中,解决肿瘤微环境免疫抑制的难题也越来越引起关注,目前,阻断PD-1/PD-L1途径的疗法已成为重要的手段,并取得一定的进展,PD-L1单克隆抗体在临床试验中治疗效果明显,在NSCLC的治疗中表现出良好的耐受性,对PD-L1阳性病患治疗效果更显著[21,26]。经大量研究和临床数据显示,现阶段,PD-L1仍为PD-1/PD-L1通路阻断剂类药物最有前景的生物标志物之一。本文制备了PD-L1单克隆抗体,制备单克隆抗体的抗原选择多样,本文利用原核表达系统表达PD-L1蛋白作为免疫原,为提高融合蛋白的水溶性及表达量,促进靶蛋白正确折叠等,在表达载体pETduet上插入了SUMO标签[27-28],获得质量相对高的PD-L1蛋白。免疫小鼠后,利用细胞融合技术,融合小鼠B淋巴细胞和骨髓瘤细胞,经克隆、筛选获得1株持续、稳定分泌特异性抗人PD-L1单克隆抗体的杂交瘤细胞株B10-8,腹水纯化抗体效价达1∶240000,亚型分析属IgG2b,轻链为κ链,并证实单克隆抗体与高表达PD-L1蛋白的肺癌细胞NCL-H1048有较强的亲和力。然而,随着临床应用的发展,鼠源单抗用于人体治疗容易被人类免疫系统所识别,产生人抗鼠抗体反应[29],因此,本文将单克隆抗体的基因片段在保留对特异抗原表位高亲和力的基础上实现了人源化的改造,减少异源抗体的免疫原性,有效解决传统杂交瘤技术所存在的问题。
随着免疫治疗策略的推进,大量研究表明,联合疗法策略的开展为机体的抗肿瘤反应获得更好的疗效[30-32]。本文将PD-L1单克隆抗体免疫检查点抑制剂技术与CAR-T疗法结合,应用于肺癌的治疗,构建了PD-L1特异性的CAR基因,以CAR修饰T细胞增强了T细胞的靶向性、杀伤性和持久性。该基因中包含CD28和CD137共刺激因子结构域,在肿瘤微环境中,激活T细胞的免疫反应,CD28可以使T细胞产生耐受,CD137可有效增强T细胞的繁殖,进一步提高T细胞的增殖活性、细胞毒性和存活时间等[7,33]。CAR-T细胞的制备过程中,需要将抗体序列及T细胞受体信号途径的编码分子相关的序列导入至T细胞中,目前用于临床试验导入外源基因的方式大致有逆转录病毒、慢病毒、mRNA电转入等方式。逆转录病毒感染的主要是分裂期细胞,对于非分裂细胞感染能力极弱。在此基础上发展出的慢病毒,则对分裂和非分裂细胞均具有较好的感染能力,采用传统直接转染的方式难以将外源基因导入至T淋巴细胞中,因此绝大部分CAR-T细胞制备时,采用的慢病毒系统[34]。本文选用慢病毒质粒pCDH-CMV-MCS-EF1-copGFP,转染效率达到95.66%,转染效率很高。包装后获得慢病毒,感染T细胞效率达到22%,感染效率较低,在以后的研究中,应对此改进,提高CAR靶点的密度。CD8+T细胞,主要分泌IFN-γ等细胞因子,调节免疫功能,使T细胞分化成细胞毒性的T细胞,经过ELISA检测效靶细胞上清液的IFN-γ的分泌量,结果显示CAR-T细胞对NCL-H1048细胞杀伤活性最强,与对照组相比,杀伤作用明显,进而说明,PD-L1特异性的CAR-T细胞对PD-L1高表达的肿瘤细胞具有更强的杀伤力。
CAR-T疗法是当前过继性淋巴细胞回输治疗最新的免疫技术,该技术受到广泛的关注和研究,并从基础免疫研究发展为临床应用,有望成为彻底治愈癌症的免疫新疗法。本文选择PD-L1作为CAR-T细胞靶点可能会产生脱靶效应,因为PD-L1虽在肿瘤组织上高表达,但在一些正常组织上也有表达,存在T细胞在体内攻击正常组织的忧患。但随着CAR-T研究的深入和技术的改进,比如控制回输CAR-T细胞的数量,引进自杀基因,或在PD-L1CAR基因上引进另一种肿瘤抗原基因形成特异性更强、无脱靶效应的双头CAR-T等[35-36],PD-L1 CAR-T细胞可能的副作用可以被控制或减少。本文制备PD-L1特异性的CAR-T细胞,可有效识别并杀伤肺癌细胞,为CAR-T细胞疗法提供了很好的细胞模型,但尚需进一步在动物模型中得到验证,为肿瘤的治疗提供一种更有效的CAR-T细胞。
4 结 论
本文首先制备PD-L1单克隆抗体,运用基因改造技术合成PD-L1特异性的第三代CAR基因,并制备PD-L1特异性的CAR-T细胞。PD-L1靶向的肿瘤细胞杀伤作用分析显示,该CAR-T细胞能够有效地识别并杀伤表达PD-L1蛋白的NCL-H1048肺癌细胞,为下一步构建肺癌实体瘤小鼠模型进行体内杀伤实验奠定研究基础。
[1] 林城,陈雄,刘静南,等.PD-1/PD-L1信号通路在非小细胞肺癌免疫逃逸及其治疗中的研究进展[J].中国肺癌杂志,2014(10):734-740.
[2] COUZIN F J. Breakthrough of the year 2013. Cancer immunotherapy[J]. Science,2013,342(6165):1432-1433.
[3] KALOS M, JUNE C H. Adoptive T cell transfer for cancer immunotherapy in the era of synthetic biology[J]. Immunity,2013,39(1):49-60.
[4] ESHHAR Z, WAKS T, GROSS G, et al. Specific activation and targeting of cytotoxic lymphocytes through chimeric single chains consisting of antibody-binding domains and the gamma or zeta subunits of the immunoglobulin and T-cell receptors[J]. Proceedings of the National Academy of Sciences of the United States of America,1993,90(2):720-724.
[5] HEUSER C, HOMBACH A, LOSCH C, et al. T-cell activation by recombinant immunoreceptors: impact of the intracellular signalling domain on the stability of receptor expression and antigen-specific activation of grafted T cells[J]. Gene Therapy,2003,10(17):1408-1419.
[6] LIPOWSKA B G, GILHAM D E, HAWKINS R E, et al. Targeted immunotherapy of cancer with CAR T cells: achievements and challenges[J]. Cancer Immunology, Immunotherapy: CII,2012,61(7):953-962.
[7] PAK T S, ROSENBERG S A, MORGAN R A. Treating cancer with genetically engineered T cells[J]. Trends in Biotechnology,2011,29(11):550-557.
[8] ZHAO Z, CONDOMINES M, STEGEN S J, et al. Structural Design of Engineered Costimulation Determines Tumor Rejection Kinetics and Persistence of CAR T Cells[J]. Cancer Cell,2015,28(4):415-428.
[9] DONG H, ZHU G, TAMADA K, et al. B7-H1, a third member of the B7 family, co-stimulates T-cell proliferation and interleukin-10 secretion[J]. Nature Medicine,1999,5(12):1365-1369.
[10] FREEMAN G J, LONG A J, IWAI Y, et al. Engagement of the PD-1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte activation[J]. The Journal of Experimental Medicine,2000,192(7):1027-1034.
[11] VELCHETI V, SCHALPER K A, CAVAJAL D E, et al. Programmed death ligand-1 expression in non-small cell lung cancer[J]. Laboratory Investigation,2014,94(1):107-116.
[12] BOLAND J M, KWON E D, HARRINGTON S M, et al. Tumor B7-H1 and B7-H3 expression in squamous cell carcinoma of the lung[J]. Clinical Lung Cancer,2013,14(2):157-163.
[13] SPRANGER S, SPAAPEN R M, ZHA Y, et al. Up-regulation of PD-L1, IDO, and T(regs) in the melanoma tumor microenvironment is driven by CD8(+) T cells[J]. Science Translational Medicine,2013,5(200):200ra116.
[14] THOMPSON R H, KUNTZ S M, LEIBOVICH B C, et al. Tumor B7-H1 is associated with poor prognosis in renal cell carcinoma patients with long-term follow-up[J]. Cancer Research,2006,66(7):3381-3385.
[15] SFANOS K S, BRUNO T C, MEEKER A K, et al. Human prostate-infiltrating CD8+T lymphocytes are oligoclonal and PD-1+[J]. The Prostate,2009,69(15):1694-1703.
[16] SOLIMAN H, KHALIL F, ANTONIA S, PD-L1 expression is increased in a subset of basal type breast cancer cells[J]. PloS One,2014,9(2):e88557.
[17] LIU Y, CARLSSON R, AMBJORN M, et al. PD-L1 expression by neurons nearby tumors indicates better prognosis in glioblastoma patients[J]. The Journal of Neuroscience,2013,33(35):14231-14245.
[18] ZOU W, CHEN L. Inhibitory B7-family molecules in the tumour microenvironment[J]. Nature Reviews Immunology,2008,8(6):467-477.
[19] JONH L B, KERSHAW M H, DARCY P K. Blockade of PD-1 immunosuppression boosts CAR T-cell therapy[J]. Oncoimmunology,2013,2(10):e26286.
[20] TOPALIAN S L, HODI F S, BRAHMER J R, et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer[J]. The New England Journal of Medicine,2012,366(26):2443-2454.
[21] BRAHMER J R, TYKODI S S, CHOW L Q, et al. Safety and activity of anti-PD-L1 antibody in patients with advanced cancer[J]. The New England Journal of Medicine,2012,366(26):2455-2465.
[22] HAMID O, CARVAJAL R D. Anti-programmed death-1 and anti-programmed death-ligand 1 antibodies in cancer therapy[J]. Expert Opinion on Biological Therapy,2013,13(6):847-861.
[23] SAKATA R, SHOYAMA Y, MURAKAMI H. Production of monoclonal antibodies and enzyme immunoassay for typical adenylate cyclase activator, Forskolin[J]. Cytotechnology,1994,16(2):101-108.
[24] SHELVER W L, SMITH D J, BERRY E S. Production and characterization of a monoclonal antibody against the beta-adrenergic agonist ractopamine[J]. Journal of Agricultural and Food Chemistry,2000,48(9):4020-4026.
[25] LI S, WEI Z, CHEN J, et al. Oral administration of a fusion protein between the cholera toxin B subunit and the 42-amino acid isoform of amyloid-beta peptide produced in silkworm pupae protects against Alzheimer’s disease in mice[J]. PloS One,2014,9(12):e113585.
[26] BOYERINAS B, JOCHEMS C, FANTINI M, et al. Antibody-dependent cellular cytotoxicity activity of a novel anti-PD-L1 antibody avelumab (MSB0010718C) on human tumor Cells[J]. Cancer Immunology Research,2015,3(10):1148-1157.
[27] BUTT T R, EDAVETTAL S C, HLL J P, et al.SUMO fusion technology for difficult-to-express proteins[J]. Protein Expression and Purification,2005,43(1):1-9.
[28] MALAKHOV M P, MATTERN M R, MALAKHOVA O V, et al. SUMO fusions and SUMO-specific protease for efficient expression and purification of proteins[J]. Journal of Structural and Functional Genomics,2004,5(1-2):75-86.
[29] WEINER L M. Fully human therapeutic monoclonal antibodies[J]. Journal of Immunotherapy,2006,29(1):1-9.
[30] SAGIV B I, KOHRT H E, CZERWINSKI D K, et al. Therapeutic antitumor immunity by checkpoint blockade is enhanced by ibrutinib, an inhibitor of both BTK and ITK[J]. Proceedings of the National Academy of Sciences of the United States of America,2015,112(9):E966-972.
[31] UEHA S, YOKOCHI S, ISHIWATA Y, et al. Robust antitumor effects of combined anti-CD4-depleting antibody and anti-PD-1/PD-L1 immune checkpoint antibody treatment in mice[J]. Cancer Immunology Research,2015,3(6):631-640.
[32] PARDOLL D M. The blockade of immune checkpoints in cancer immunotherapy[J]. Nature Reviews Cancer,2012,12(4):252-264.
[33] JENSEN M C, RIDDELL S R. Designing chimeric antigen receptors to effectively and safely target tumors[J]. Current Opinion in Immunology,2015,33:9-15.
[34] HOYOS V, SAVOLDO B, DOTTI G. Genetic modification of human T lymphocytes for the treatment of hematologic malignancies[J]. Haematologica,2012,97(11):1622-1631.
[35] GRICO R, OLIVEIRA G, STANGHELLINI M T, et al. Improving the safety of cell therapy with the TK-suicide gene[J]. Frontiers in Pharmacology,2015,6:95.
[36] CARTELLIERI M, FELDMANN A, KORISTKA S, et al. Switching CAR T cells on and off: a novel modular platform for retargeting of T cells to AML blasts[J]. Blood Cancer Journal,2016,6(8):e458.
ConstructionofPD-L1CARGeneandResearchofFunctionalActivityofCART-Cells
BAIJinga,b,ZHANGJiewena,b,SHIWeixinga,CHENJiana,b,LÜZhengbinga,b
(a.College of Life Science; b.Key Laboratory of Silkworm Bioreactor and Biomedicine of Zhejiang Province, Zhejiang Sci-Tech University, Hangzhou 310018, China)
In view of that great breakthrough has made in clinical experiment of applying Chimeric antigen receptor T cells (CAR-T) therapy, programmed death ligand-1 (PD-L1) specific CAR-T cells were designed to realize killing lung cancer cells in vitro. PD-L1 monoclonal antibody was obtained by cloning and expression ofPD-L1(73-739)and purifying PD-L1 protein with immune BALA/c mice; the variable region fragmentation of PD-L1 monoclonal antibody was cloned, fused with genes ofCD28, 4-1BBandCD3-ζchains to construct the third generation ofCARgene, and cloned onto lentiviral vector pCDH-CMV-EF1-copGFP to package as lentivirus. The lentivirus was infected with CD8+T cells, amplified for 5 days, and determined CAR expression (the expression rate can reach up to 22%). The analysis of the function of PD-L1 target of killing tumor cells showed that anti-PD-L1 CAR-T cells are of certain in vitro cytotoxicity.
lung cancer; PD-L1; CAR; monoclonal antibody; adoptive cell therapy
10.3969/j.issn.1673-3851.2017.11.023
2017-03-03 网络出版日期: 2017-10-10
国家高技术研究发展计划项目(2012ZX09102301-009);浙江省自然科学基金项目(13H090015)
白 静(1990-),女,河北沧州人,硕士研究生,主要从事细胞免疫疗法方面的研究。
吕正兵,E-mail:zhengbingl@126.com
Q28
A
1673- 3851 (2017) 06- 0901- 08
(责任编辑:唐志荣)
