5,6-位烷氧基保护和3-/3,8-位三苯胺拓展1,10-菲咯啉衍生物与银离子识别
2017-11-13彭雨新甘逸涛钱惠芬
彭雨新 甘逸涛 陶 涛 钱惠芬*, 黄 伟
5,6-位烷氧基保护和3-/3,8-位三苯胺拓展1,10-菲咯啉衍生物与银离子识别
彭雨新1,2甘逸涛3陶 涛3钱惠芬*,1,2黄 伟*,2
(1南京工业大学化学与分子工程学院,南京 210009)
(2南京大学化学化工学院,配位化学国家重点实验室,南京 210093)
(3南京信息工程大学环境科学与工程学院,南京 210044)
在1,10-菲咯啉的5,6-位引入烷氧基后,分子的反应活性明显提升,同时获得的三苯胺基(TPA)衍生物的溶解性也明显提高。晶体结构分析表明:烷氧基团是以六元环形式的乙撑二氧结构接入1,10-菲咯啉环的5,6-位。化合物TPA1和TPA2均对Ag+表现出选择性识别作用。其中,TPA1与Ag+作用后虽然荧光减弱不明显,但其发射波长明显红移(47 nm)。而TPA2和Ag+作用后,415和542 nm处荧光发射峰同时淬灭。化合物TPA3虽然也能与Ag+发生相互作用使荧光减弱,但是其荧光减弱幅度不大,很容易受到其它杂离子干扰影响,不适用于离子识别研究。
三苯胺;1,10-菲咯啉;晶体结构;离子识别
1,10-菲咯啉作为一种广泛应用的螯合配体,它具有螯合性质的两个氮原子能够与多种过渡金属离子配位得到稳定的配合物[1]。同时,1,10-菲咯啉还是一种重要的有机合成中间体,基于此类分子拓展合成的衍生物在有机和聚合物电致发光器件[2]、光电导材料[3]、光伏太阳能电池[4]和场效应晶体管[5]等领域有潜在的应用价值。通常,1,10-菲咯啉可供修饰的位点很多,一般可以通过亲电或者亲核取代反应在1,10-菲咯啉的不同位置引入不同的基团,从而改变其分子结构及其物理化学性质[6]。目前这类修饰主要集中在 1,10-菲咯啉的 2,9-,5,6-和4,7-位[7],而3,8-位1,10-菲咯啉的拓展却相对较少,而5,6-位和3/3,8-位同时拓展的研究就更少[8]。
三苯胺基团是一种理想的电子给体(Donor),将该类分子与电子受体(Acceptor)相结合可以获得具有Donor-Acceptor结构的化合物,目前这类含有三苯胺基团的Donor-Acceptor分子依然是光电子器件的研究热点[9]。我们前期的研究表明,将三苯胺基团引入到1,10-菲咯啉的不同位点,将会对所得有机扩展芳杂环的能级产生显著的影响[10]。本文我们在1,10-菲咯啉的 5,6-位引入烷氧基,其目的是:(1)增加分子的溶解性,改善Suzuki偶联反应的活性,提高目标化合物的产率;(2)在不影响其母体结构 (具螯合性质的2个氮原子)的情况下,通过烷氧基的给电子特性并综合单边/双边TPA取代基的引入,综合调节该类分子的电子特性,进而研究对金属离子的选择性识别作用。
1 实验部分
1.1 试剂和仪器
除非特别说明,一般所使用的溶剂和药品都是分析纯,试剂均为商业渠道购得后未经处理直接使用,没有经过更深地纯化。柱层析和薄层层析色谱均采用的是300~400目的GF254硅胶。1H NMR和13C NMR谱图通过Bruker AM-500核磁共振仪测得。电离质谱 (电子源能量为70 eV)由GCT TOF mass spectrometer(Micromass,Manchester,UK)测得。C,H和N元素分析是在PerkineElmer 240C型元素分析仪上测定。所有荧光数据通过F-4600荧光光谱仪在常温条件下测得。
1.2 化合物合成与表征
部分已知化合物3-溴-1,10-菲咯啉-5,6-二酮,3,8-二溴-1,10-菲咯啉-5,6-二酮和化合物TPA1的合成方法和细节,均按照文献报道进行[11]。合适于X射线单晶衍射的黄色溶剂复合物单晶TPA1·2CH2Cl2,通过在室温条件下缓慢挥发5 d获得(挥发溶剂:二氯甲烷、甲醇和水)。
化合物 1:将 3-溴-1,10-菲咯啉-5,6-二酮(2.00 g,6.92 mmol)、对甲苯磺酸(0.12 g,0.69 mmol)和 30 mL乙二醇投入圆底烧瓶中,再加入50 mL甲苯。在130℃下搅拌反应,同时通过共沸分去生成的水,反应12 h后,冷却至室温,经减压蒸馏除去有机溶剂后得到黄棕色固体。再加入100 mL三氯甲烷使其溶解,分别用饱和碳酸氢钠溶液、饱和食盐水和蒸馏水洗涤,合并的有机相经无水硫酸镁干燥后减压除去有机溶剂。使用二氯甲烷作为洗脱剂经柱层析分离得到白色固体 1(2.11 g,81%)。1H NMR(500 MHz,CDCl3):δ 8.90 (s,2H),8.19 (d,J=1.4 Hz,2H),4.24(dd,J=10.4,5.1 Hz,4H),3.65(dd,J=10.3,5.0 Hz,4H)。13C NMR (125 MHz,CDCl3):δ 152.55,148.36,136.88,132.24,122.07,91.92,61.35。 EI-TOF-MS理论值[C16H13BrN2O4]+(m/z):376.0,378.0,实测值:376.0,378.0。 元素分析理论值(C16H13BrN2O4,%):C,50.95;H,3.47;N,7.43。 实 测 值 (%):C,50.78;H,3.61;N,7.26。
化合物 TPA2:将化合物 1(1.00 g,2.65 mmol)、催 化 剂 [Pd(PPh3)4](0.02 g,0.02 mmol)、三 苯 胺 硼 酸(0.72 g,2.65 mmol)、Cs2CO3(0.86 g,2.65 mmol)和 60 mL 1,4-二氧六环/水(V1,4-二氧六环/V水=5)加入到圆底烧瓶中。在氩气保护下,该混合溶液回流反应24 h后冷却至室温,用三氯甲烷做萃取剂,经饱和碳酸氢钠、饱和食盐水和蒸馏水洗涤后,用无水硫酸镁干燥。减压蒸去有机溶剂,粗产品用正己烷/二氯甲烷(V正己烷/V二氯甲烷=2)作洗脱剂经柱层析分离得到淡黄色固体TPA2(1.11 g,78%)。合适于X射线单晶衍射的黄色溶剂复合物单晶TPA2·2H2O,通过在室温条件下缓慢挥发7 d获得(挥发溶剂:三氯甲烷、甲醇和水)。柱层析分离后所得的粉末产物(不含溶剂)用来做以下分析测试波谱表征。1H NMR(500 MHz,CDCl3):δ 9.10 (s,2H),8.23 (s,2H),7.58 (d,J=7.6 Hz,4H),7.31~7.28(m,8H),7.19~7.15(m,12H),7.11~7.06 m,4H),4.27(d,J=4.3 Hz,4H),3.72(d,J=3.8 Hz,4H)。13C NMR (75 MHz,CDCl3):δ 151.35,150.51,149.19,148.52,148.32,147.21,136.86,134.01,131.23,130.38,130.18,129.31,127.78,124.74,124.13,123.37,123.19,92.44,61.27。 EI-TOF-MS 理论值 [C34H27N3O4]+(m/z):541.2,实测值:541.1。元素分析理论值(C34H27N3O4,%):C,75.40;H,5.02;N,7.76 。 实测值(%):C,75.27;H,5.29;N,7.64 。
化合物2:重复化合物1的实验步骤,用3,8-二溴-1,10-菲咯啉-5,6-二酮(2.00 g,5.45 mmol)代替 3-溴-1,10-菲咯啉-5,6-二酮。粗产品用二氯甲烷做洗脱剂经柱层析分离得到白色固体2(1.94 g,78%)。合适于X射线单晶衍射的无色溶剂复合物单晶2·CHCl3,通过在室温条件下缓慢挥发2 d获得(挥发溶剂:三氯甲烷)。柱层析分离后所得的粉末产物(不含溶剂)用来做以下分析测试波谱表征。1H NMR(500 MHz,CDCl3):δ 8.90 (dd,J=18.4,2.6 Hz,2H),8.20(d,J=2.3 Hz,2H),8.08~8.00(m,1H),7.46(dd,J=7.8,4.6 Hz,1H),4.24 (s,4H),3.66 (s,4H)。13C NMR(125 MHz,CDCl3):δ 152.41,151.48,149.86,149.07,136.71,134.27,132.22,130.71,124.76,121.74,92.26,91.97,61.35,61.23。EI-TOF-MS理 论 值 [C16H12Br2N2O4]+(m/z):455.9,453.9,457.9,实 测 值 :455.9,453.9,457.9。 元素分析理论值(C16H12Br2N2O4,):C,42.13;H,2.65;N,6.14。 实测值(%):C,41.97;H,2.77;N,6.11。
化合物TPA3:重复化合物TPA2的实验步骤,用化合物2(1.00 g,2.19 mmol)代替化合物1。粗产品用三氯甲烷做洗脱剂经柱层析分离得到黄色固体 TPA3(1.29 g,75%)。1H NMR(500 MHz,CDCl3):δ 9.08(s,1H),8.89(d,J=7.6 Hz,1H),8.21(d,J=8.2 Hz,1H),8.07 (d,J=8.1 Hz,1H),7.57 (d,J=7.6 Hz,2H),7.43~7.41(m,1H),7.31~7.28(m,4H),7.18~7.15(m,6H),7.09~7.06(m,2H),4.25(d,J=4.3 Hz,4H),3.68(d,J=3.7 Hz,4H)。13C NMR(75 MHz,CDCl3):δ 149.24,148.58,147.55,147.23,131.93,131.20,129.32,128.06,127.7 6,124.73,124.31,123.36,123.22,122.89,122.77,92.58,61.33。 EI-TOF-MS 理论值 [C52H40N4O4]+(m/z):784.3,实测值:784.1。元素分析理论值 (C52H40N4O4,%):C,79.57;H,5.14;N,7.14%。 实测值 (%):C,79.34;H,5.39;N,7.04。
1.3 化合物 2·CHCl3,TPA1·2CH2Cl2和 TPA2·2H2O单晶结构测定
选取大小合适的单晶置于Bruker Smart APEXⅡCCD仪上收集X射线衍射数据。光源采用经过石墨单色化的Mo Kα射线(λ=0.071 073 nm)。以ω-2θ扫描方式收集衍射点,全部强度数据经Ψ扫描进行经验吸收校正。晶体结构解析采用直接法。全部非氢原子经Fourier合成及差值电子密度函数修正,使用最小二乘法对坐标和各向异性温度因子进行修正。化合物TPA2·2H2O中水上的氢原子通过傅立叶合成(Fourier syntheses)得到,其它氢原子均通过理论加氢确定。在SHELXTL-2000中完成所有的计算[12]。 2·CHCl3,TPA1·2CH2Cl2和 TPA2·2H2O的晶体学数据列于表1中。
CCDC:1574320,2·CHCl3;1574321,TPA1·2CH2Cl2;1574322,TPA2·2H2O。
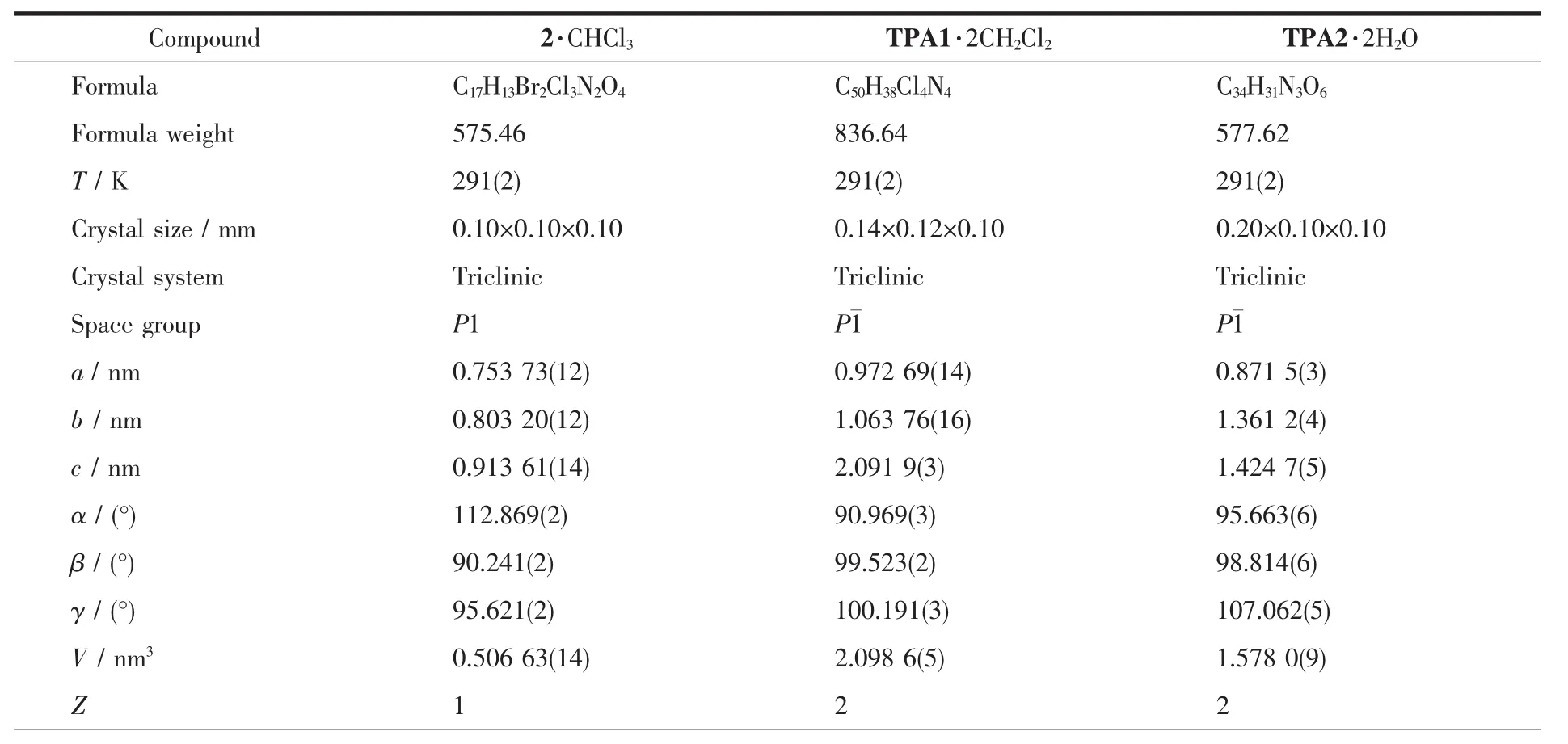
表1 化合物2·CHCl3,TPA1·2CH2Cl2和TPA2·2H2O的晶体学数据Table 1 Crystallographic data of compounds 2·CHCl3,TPA1·2CH2Cl2and TPA2·2H2O
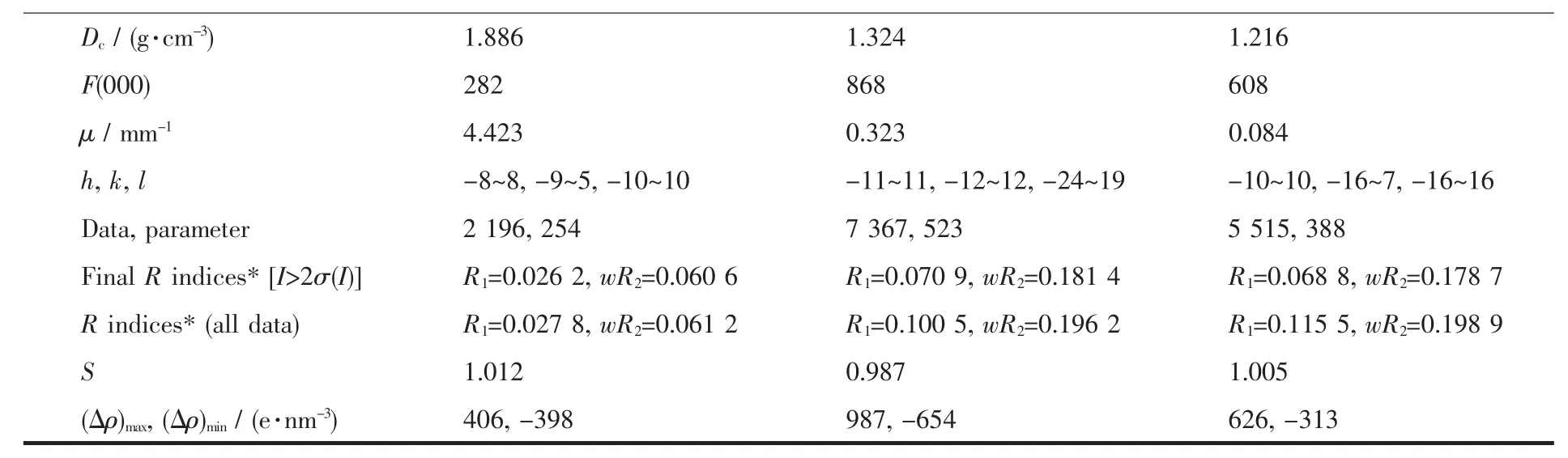
续表1
2 结果与讨论
2.1 合 成
如图1所示,化合物TPA1通过Suzuki偶联反应,由3,8-二溴-1,10-菲咯啉和三苯胺硼酸试剂,在Cs2CO3存在下,[Pd(PPh3)4]催化偶联得到, 产率为35%。因为含有卤素的二酮类化合物,在芳杂环体系的拓展过程中,不利于使用偶联反应的条件,通常的方法是在偶联反应之前,先对其进行烷氧基保护以实现增溶改性[13]。因此,我们在1,10-菲咯啉5,6-位引入2个烷氧保护基团分别得到烷氧基修饰的1,10-菲咯啉中间体1和2。具体而言,化合物1和2是在对甲苯磺酸催化下,分别将3-溴-1,10-菲咯啉-5,6-二酮以及3,8二溴1,10-菲咯啉-5,6-二酮分别和乙二醇反应获得。将化合物1和2进一步与三苯胺硼酸试剂在 [Pd(PPh3)4]催化下偶联,分别得到目标化合物TPA2和TPA3。值得一提的是,烷氧基的引入不仅使得目标分子的溶解性明显改善,而且偶联反应的产率也明显增加,例如TPA3的产率已经高达75%。
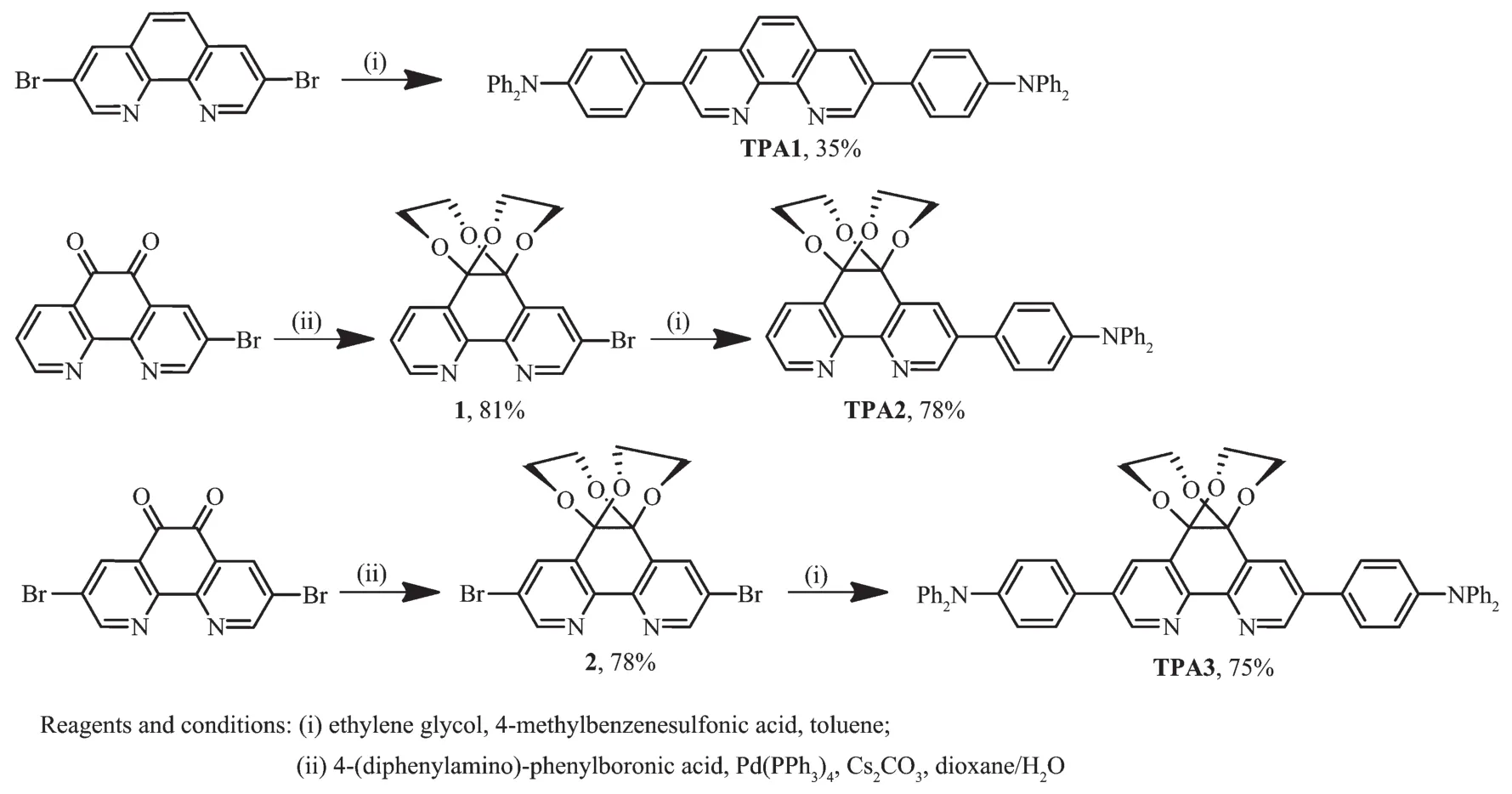
图1 3-/3,8-位三苯胺拓展的1,10-菲咯啉衍生物TPA1~3的合成路线Fig.1 Synthetic routes for 3-/3,8-triphenylamine extended 1,10-phenanthroline derivatives TPA1~3
2.2 化合物 2·CHCl3,TPA1·2CH2Cl2和 TPA2·2H2O的晶体结构描述
与传统的表征手段相比,X射线单晶衍射能够更加直观的呈现出化合物的分子结构特征。从2·CHCl3和 TPA2·2H2O的晶体结构可以看到(图 2),采用乙二醇引入保护基团的方法,得到的化合物不具有五元环双缩酮结构,而是由2个乙撑二氧基团并入1,10-菲咯啉环的5,6-位的扭曲结构,这是因为六元环较五元环在热力学上更为稳定,同时这也与之前类似文献中Neckers等报道的结果不同[14]。因为1H NMR测试不能准确的区分出该类化合物产物究竟是双缩酮结构还是乙撑二氧基结构,而结合单晶衍射能清晰确认化合物的结构,从而更深入了解它们结构与性质的关系。
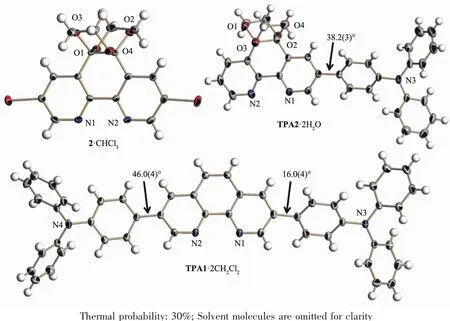
图2 溶剂复合物2·CHCl3,TPA1·2CH2Cl2和TPA2·2H2O的椭球结构图Fig.2 ORTEP diagrams of the molecular structures of 2·CHCl3,TPA1·2CH2Cl2and TPA2·2H2O
在 2·CHCl3和 TPA2·2H2O 结构中,1,10-菲咯啉环的5,6-位的CC键都发生了扭曲,它们的扭转角分别为 39.1(8)°和 41.5(6)°,这也使得 1,10-菲咯啉环的平面性被破坏。在TPA2·2H2O结构中,1,10-菲咯啉和其相邻的三苯胺基团中的一个苯环二面角为38.2(3)°,显示分子整体平面性较差。值得一提的是,TPA1·2CH2Cl2结构中,1,10-菲咯啉和其相邻的2个端位三苯胺基团中的一个苯环二面角分别为46.0(4)°和 16.0(4)°,说明在这种溶剂复合物的固体状态下,该分子不是严格意义上的对称结构。
2.3 化合物TPA2和TPA3的荧光发射光谱
化合物TPA2和TPA3的荧光发射光谱均在浓度为 1.0×10-5mol·L-1的乙醇/水(1∶2,V/V)混合溶液中测定,荧光发射光谱的激发波长为350 nm。引入烷氧基团到1,10-菲咯啉环后,不仅改善了溶解性,同时最大荧光发射峰也发生了明显的红移(化合物TPA1和TPA3的最大荧光发射峰分别为502和524 nm),从蓝色荧光发光范围红移到了黄色荧光发光区域,并且荧光光强度也有了明显增强 (图3),这有利于后续开发新的荧光化学传感器。值得注意的是,相比化合物TPA2的荧光发射光谱,化合物TPA3在415 nm处的发射峰红移了20 nm,但542 nm处的发射峰却蓝移了18 nm。这是因为415 nm处对应的是1,10-菲咯啉环本身的荧光发射,由于受到2个三苯胺给电子基团的影响,使其激发态能级下降的程度较化合物TPA2更为明显[15],因而荧光发射峰发生红移,但是542 nm处的发射峰对应的是分子整体的荧光发射,由于增加了一个三苯胺基团,使得整个分子骨架受到影响,分子的平面性和刚性会有所下降,因而发射峰发生蓝移。
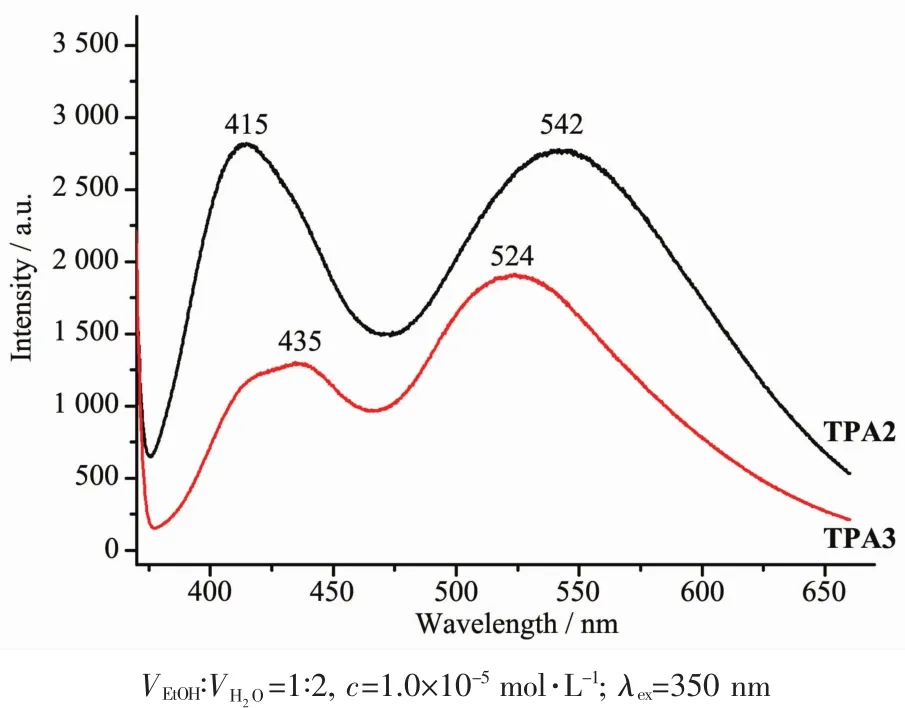
图3 化合物TPA2和TPA3的乙醇/水溶液的荧光发射光谱Fig.3 Fluorescence emission spectra for TPA2 and TPA3 in ethanol/H2O solution
2.4 化合物TPA1~TPA3的离子识别
首先我们对TPA1进行了离子识别测试实验,将含有1 mol配体的溶液分别与含有5 mol各种金属离子的溶液 (K+、Na+、Li+、Ca2+、Mg2+、Cu2+、Zn2+、Hg2+、Fe2+、Fe3+、Cr2+、Cd2+、Co2+、Ag+、Mn2+、Ni2+、Pb2+)混合,测定荧光发射谱的变化情况[16]。如图4a所示,TPA1与Ag+作用后,最大荧光发射峰红移了47 nm。三苯胺基团的引入不仅实现增强1,10-菲咯啉衍生物荧光发射的目的,同时还可能提供了一定的位阻效应,达到识别特定的金属离子这一目的。当Ag+与化合物TPA1配位时,配合物分子结构刚性受金属离子影响有所变化,同时受Ag+电子轨道耦合影响,配合物激发态能级降低,因而荧光发射峰红移。
为了更好地考察化合物TPA1对Ag+的识别作用,我们进一步进行了Ag+与配体的荧光滴定实验。将含有1 mol配体TPA1的溶液分别与含0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.2、1.4、1.6、1.8、2.0 mol Ag+的溶液混合,测定荧光发射光谱变化[17]。如图4b所示,可以看到随着Ag+浓度的增加,502 nm处的荧光发射峰明显减弱了,而与之对应的,在549 nm处出现了一个新的荧光发射峰,并且荧光发射强度也有所增加,这对实现痕量检测是非常有利的。
我们进一步展开了对化合物TPA2和TPA3的离子识别性质研究,虽然化合物TPA2和TPA3的溶解性均有了明显改善,但是受到烷氧基保护基团的影响,双三苯胺基团取代的1,10-菲咯啉衍生物TPA3并没有像TPA1那样表现出明显对Ag+的选择性识别作用。如图5b所示,虽然在与众多金属离子 (K+、Na+、Li+、Ca2+、Mg2+、Cu2+、Zn2+、Hg2+、Fe2+、Fe3+、Cr2+、Cd2+、Co2+、Ag+、Mn2+、Ni2+、Pb2+)的作用结果中,仅有Ag+使得化合物TPA3表现出了较大幅度荧光减弱现象,并且最大发射波长略有红移(10 nm),但是从实际检测的角度来说,这还不足以达到可以应用的水平。这可能是由于烷氧基的引入之后,使得1,10-菲咯啉上的C-C双键变为C-C单键,破坏了1,10-菲咯啉环原本的刚性、平面性以及高度共轭性,使得2个吡啶环所在平面夹角变大,因而不能很好的与金属离子配位,特别是和Ag+的结合,使其发射峰红移明显减弱。与TPA3不同的是,化合物TPA2与同样系列的金属离子的作用结果中,仅有Ag+能使得415和542 nm处2个荧光发射峰均发生淬灭。如图5a所示,虽然除了Ag+之外,Cu2+、Zn2+、Fe2+、Cd2+、Co2+、Mn2+、Ni2+也能使化合物TPA2的荧光发射产生不同程度地淬灭,但是它们只能使542 nm处的发射峰减弱或消失,而对415 nm处的发射峰几乎不产生明显影响,因此实际检测中能够利用这一点简单排除杂离子的干扰,实现对Ag+的特异性识别。

图4 化合物TPA1与多种金属离子作用后荧光发射光谱 (a)和化合物TPA1与不同浓度Ag+荧光滴定图 (b)Fig.4 Fluorescence emission spectra of TPA1 in the presence of various metal ions (a),and different concentration of silver ions (b)
通过对这2类1,10-菲咯啉衍生物离子识别性质的研究,我们发现双三苯胺取代的1,10-菲咯啉衍生物TPA1能够选择性地识别出Ag+,通过引入烷氧基后我们成功改善了1,10-菲咯啉衍生物的溶解性,但是由于受到所引入烷氧基的影响,1,10-菲咯啉的共轭体系被破坏,使得双三苯胺取代衍生物TPA3不能很好地与Ag+结合。然而单三苯胺取代衍生物却反常地表现出与Ag+良好的结合性,这可能是单取代衍生物空间位阻较小,虽然1,10-菲咯啉环产生了一定程度的扭曲,但较大的可配位空间仍然让Ag+能与化合物TPA2有效地结合在一起,达到荧光淬灭的效果。该结果正好反映出不同推拉电子效应取代基的引入以及分子平面性和刚性的变化对1,10-菲咯啉衍生物离子识别性能的巨大影响。

图5 化合物TPA2(a)和化合物TPA3(b)与多种金属离子作用后荧光发射光谱Fig.5 Fluorescence emission spectra of TPA2 (a)and TPA2 (b)in the presence of various metal ions
3 结 论
本文设计并合成了数个三苯胺基取代的1,10-菲咯啉衍生物,并对它们的晶体结构、荧光光谱及离子识别特性进行了相应的研究和比较。相关单晶结构表明,1,10-菲咯啉-5,6-二酮的5和6位引入双乙二醇形成相应的缩酮时,乙二醇的烷氧基呈现出2个乙撑二氧基团并入1,10-菲咯啉环5,6-位的双六元环扭曲结构,而不是Neckers等报道的五元环双缩酮结构。1,10-菲咯啉5,6-位引入烷氧基后,该类衍生物的溶解性有了明显的改善,由于烷氧基团的给电子效应,化合物TPA2和TPA3的荧光发射谱发生了明显的红移,且发光效率也有所增强,这对实现荧光化学传感非常有利。通过对化合物TPA1、TPA2和TPA3的离子识别的研究结果表明,化合物TPA1和TPA2均对Ag+表现出选择性识别作用,化合物TPA1与Ag+作用后虽然荧光减弱不明显,但其发射波长明显红移(47 nm)。而化合物TPA2和Ag+作用后,415和542 nm处荧光发射峰同时淬灭。而化合物TPA3虽然也能与Ag+发生互相作用使荧光减弱,但是其荧光减弱幅度不大且发射峰位移不明显,很容易受到其它杂离子干扰影响而不适用于离子识别研究。
Supporting information is available at http://www.wjhxxb.cn
[1]Daniel C,Gourlaouen C.Coord.Chem.Rev.,2017,344:131-149
[2] (a)Han H B,Cui R Z,Jing Y M,et al.J.Mater.Chem.C,2017,5:8150-8159(b)Wei X F,Tan W Y,Zou J H,et al.J.Mater.Chem.C,2017,5:2329-2336
[3]Wu Y Y,Wang P ,Wang Y H,et al.J.Mater.Chem.A,2013,1:9862-9868
[4] (a)Jiang L,Chen W C,Zheng J W,et al.ACS Appl.Mat.Interfaces,2017,9:26958-26964(b)Gavriluta A ,Fix T,Nonat A,et al.J.Mater.Chem.A,2017,5:14031-14040
[5]Bai Z P,Gao Y N,Zhu P H,et al.Inorg.Chem.,2010,49:9005-9011
[6](a)Shi S,Liu J,Yao T M,et al.Inorg.Chem.,2008,47:2910-2912(b)Ren P P,Wang R J,Pu S Z,et al.J.Phys.Org.Chem.,2014,27:183-190(c)Batista R M F,Costa S P G,Belsley M,et al.Dyes Pigm.,2009,80:329-336
[7](a)CollinJP,KayhanianR,SauvageJ P,et al.Chem.Commun.,1997:775-776(b)Yang P J,Yang X J,Wu B.Eur.J.Inorg.Chem.,2009:2951-2958(c)Peng Y X,Wang N,Dai Y,et al.RSC Adv.,2015,5:6395-6406(d)Batista R M F,Costa S P G,Lodeiro C,et al.Tetrahedron,2008,64:9230-9238(e)Kassio P S Z,Neyde Y M I.Dalton Trans.,2017,46:9951-9958
[8]Wang X Xu,Tao T,Geng J,et al.Chem.Asian J.,2014,9:514-525
[9](a)Tao Y T,Wang Q,Ao L,et al.J.Phys.Chem.C,2010,114:601-609(b)Usta H,Sheets W S,Denti M,et al.Chem.Mater.,2014,26:6542-6556
[10]Peng Y X,Xu D,Wang N,et al.Tetrahedron,2016,72:3443-3453
[11](a)Bodige S,MacDonnell F M.Tetrahedron Lett.,1997,38:8159-8160(b)Liu X Q,Zhou X,Shu X,et al.Macromolecules,2009,42:7634-7637(c)Liu Y,Wang Y F,Guo H P,et al.J.Phys.Chem.C,2011,115:4209-4216
[12](a)SAINT Ver.4,Software Reference Manual.Madison:Siemens Analytical X-Ray Systems,2000.(b)Sheldrick G M.SADABS,Program for Empirical Absorption Correction of Area Detector Data,University of Göttingen,Germany,2000.(c)SHELXTLVer.6.10,ReferenceManual.Madison:Siemens Analytical X-Ray Systems,2000.
[13]Ritter K,Pehlken C,Sorsche D,et al.Dalton Trans.,2015,44:8889-8905
[14](a)Estrada L A,Neckers D C.Org.Lett.,2011,13:3304-3307(b)Shirai Y,Osgood A J,Zhao Y,et al.J.Am.Chem.Soc.,2006,128:4854-4864
[15](a)Roquet S,Cravino A,Leriche P O,et al.J.Am.Chem.Soc.,2006,128:3459-3466(b)Mikroyannidis J A,Kabanakis A N,Sharma S S,et al.Org.Electron.,2011,12:774-784(c)Shen P,Sang G Y,Lu J J,et al.Macromolecules,2008,41:5716-5722
[16](a)Batey H D,Whitwood A C,Duhme-Klair A K,et al.Inorg.Chem.,2007,46:6516-6528(b)Shin D H.Ind.Eng.Chem.Res.,2006,45:656-662(c)Engel Y,Dahan A,Rozenshine-Kemelmakher E,et al.J.Org.Chem.,2007,72:2318-2328
[17](a)Mandal S,Ghosh S,Banerjee C,et al.J.Phys.Chem.B,2013,117:12212-12223(b)Elmes R B P,Turner P,Jolliffe K A.Org.Lett.,2013,15:5638-5641(c)Wang J F,Chu Q H,Liu X M,et al.J.Phys.Chem.B,2013,117:4127-4133
5,6-Alkoxyl Protected and 3-/3,8-Triphenylamine Extended 1,10-Phenanthroline Derivatives and Their Selective Silver Ion Recognition
PENG Yu-Xin1,2GAN Yi-Tao3TAO Tao3QIAN Hui-Fen*,1,2HUANG Wei*,2
(1College of Chemistry and Molecular Engineering,Nanjing Tech University,Nanjing 210009,China)
(2State Key Laboratory of Coordination Chemistry,School of Chemistry and Chemical Engineering,Nanjing University,Nanjing 210023,China)
(3Collaborative Innovation Center of Atmospheric Environment and Equipment Technology,School of Environmental Science and Engineering,Nanjing University of Information Science&Technology,Nanjing 210044,China)
The introduction of alkoxyl groups to 5,6-positions of 1,10-phenanthroline can not only lead to the enhancement of the reaction activity,but also increase the solubility of the targeted compounds.Crystal structure analyses reveal that the two alkoxyl groups at 5,6-positions of 1,10-phenanthroline adopt double six-membered ethylenedioxy cyclic conformation.Both TPA1 and TPA2 show selective recognition toward the silver ion.No obvious fluorescence quenching is found after the treatment of TPA1 and Ag+,in which a red shift of 47 nm in the fluorescence emission spectrum is observed.On the other hand,the two emission peaks at 415 and 542 nm in the fluorescence emission spectra are quenched when TPA2 is reacted with Ag+.However,the fluorescence quenching effect for Ag+is not obvious in the case of TPA3,which makes it not a good candidate for the metalion recognition.CCDC:1574320,2·CHCl3;1574321,TPA1·2CH2Cl2;1574322,TPA2·2H2O
triphenylamine;1,10-phenanthroline;crystal structure;ion recognition
O614.122
A
1001-4861(2017)11-2075-08
10.11862/CJIC.2017.252
2017-09-13。收修改稿日期:2017-09-21。
国家自然科学基金(No.21171088)资助项目。
*通信联系人。E-mail:qhf@njtech.edu.cn,whuang@nju.edu.cn
