基于生物矿化的纳米载药体系
2017-11-13唐睿康
肖 云 唐睿康
基于生物矿化的纳米载药体系
肖 云1,3唐睿康*,1,2
(1浙江大学化学系,生物物质与信息调控中心,杭州 310027)
(2浙江大学求是高等研究院,杭州 310027)
(3浙江大学转化医学研究院,杭州 310027)
基于生物矿化的纳米载药体系具有制备简单、良好的生物相容性和控制药物释放的能力、易被修饰且具备多功能性和靶向性等优点,在临床中拥有巨大的应用前景。本文系统阐述了基于生物矿化的纳米载体的构建原理和分类,重点介绍了它们的靶向性策略和刺激响应释放策略,并展望了其在临床治疗中的应用。
生物矿化;纳米;载药体系;磷酸钙
0 引 言
近年来,一系列新型药物进入市场,它们在表现出优异治疗功能的同时,也凸显出在临床应用中不可忽视的缺点,例如蛋白和多肽类药物在生理环境中较短的体内半衰期,阿霉素、顺铂等小分子药物对于健康细胞和组织具有严重的毒副作用[1]。为了能够实现药物有效合理的临床应用,新型载药体系成为了研究的重点。纳米药物载体是指纳米材料通过与药物分子结合,改变药物进入机体的方式和体内的分布、控制药物的释放速度进而将药物输送到靶向器官的药物投递系统[2-4]。但是大部分纳米载药体系仍然未在临床实践中取得成功,原因在于材料的生物相容性欠佳、生理不稳定性和靶向性较差。
生物矿化是指生物体在有机机制的调控下形成矿物的过程[5-7]。自然界中,生物体自发进行矿化作用,形成各种有机-无机纳米复合材料,诸如贝壳、珍珠、蛋壳、硅藻、牙齿、骨骼等生物矿物材料,它们有着近乎完美的结构组织和优异的生物性能[8-9]。与人工合成的纳米材料相比,这些生物合成的纳米矿物具有天然的生物相容性和稳定性;同时,纳米生物矿物在生命体内不会被轻易视为外源性的物质,可以避免严重免疫反应以及免疫系统的快速清除,因此,在药物负载、传输和可控释放领域有巨大的应用前景。本文概述了基于生物矿化的纳米载药体系的构建和功能化策略,并展望了该载药体系的在临床疾病治疗中的潜力。
1 基于生物矿化的载体构建策略
1.1 构建原理
生物矿化的显著特点是通过有机大分子和无机物离子在界面处的相互作用,从分子水平到宏观水平上实现对晶体取向、尺寸、结构、形状、晶型与排列的精确组装和控制,进而形成复杂的分级杂化体结构[5,9]。 生物矿化主要分为 4 个过程:首先,有机大分子(蛋白质、多糖、核酸、生物膜、脂质体等)预组装形成有序的反应环境,该环境决定了无机物成核的位置;其次,有机-无机界面的分子相互识别控制晶体成核和生长,主要是通过有机基质分子在界面处的晶格几何特征、静电作用、极性、立体化学互补及氢键相互作用、空间对称性和形貌等方面影响和控制无机物的成核的位点、结晶物相、晶形、取向及形貌等;然后,有机基质分子继续调控晶体生长,通过时间及空间上的调控使无机晶体有序组装形成亚单元;最后,矿化亚单元进一步组装形成具有多级结构的生物硬组织材料。
1.2 基于生物矿化的药物载体
1.2.1 磷酸钙
作为生物硬组织最重要的组成部分[10-11],磷酸钙材料具有良好的生物相容性和生物可降解性,因而在药物输送领域具有广阔的应用前景[12-13]。磷酸钙纳米材料作为药物载体具有诸多优势,首先其作为人体的重要组成成分,具有安全无毒的特点;其次,多数病灶部位处于酸性环境条件下,磷酸钙具有极强的pH敏感性,在酸性环境下极易降解,从而将所携带的药物释放到靶向部位,提高药物的利用率,增强治疗效果,减轻病人痛苦;另外,磷酸钙降解产物Ca2+和PO43-在体内均普遍存在,因此具有较低的免疫原性[14]。 He 等[15]利用吐温 Tween80 和聚乙二醇PEG6000为添加剂制备得到稳定的纳米尺寸的囊泡,洗涤后得到空心纳米磷酸钙颗粒。该方法合成的磷酸钙为无定型磷酸钙 (ACP),对比结晶型磷酸钙 (HAP),该方法合成的空心颗粒在载药性能和药物释放性能方面都有很大优势。Yu等[16]利用Ca(OH)2为模板在室温或水热环境下成功制备了HAP纳米棒组装的多孔多面体,并使用布洛芬(IBU)和血红蛋白(Hb)作为模型来研究该HAP多面体的载药性能。实验结果表明,HAP多面体具有很好的药物/蛋白质负载能力和释放能力,在药物和蛋白质递送中有良好的应用前景。
1.2.2 碳酸钙
碳酸钙是自然界中含量最高的生物矿物,其矿物主要存在于海洋生物和鸟类中,作为外壳和骨髓起保护支持作用[17-19]。碳酸钙作为药物控释载体,具有诸多优点。碳酸钙不仅制备处理过程简单,对环境无污染,同时还具有良好的生物相容性及生物可降解性;对人体无毒副作用,容易排出体外。更重要的是,碳酸钙具有pH敏感性,可以通过癌细胞内部的溶酶体或癌细胞外部的弱酸性微环境而触发药物释放[20-21]。上述优点使得碳酸钙成为较理想的药物载体。Wei等[20]先通过一步法合成碳酸钙纳米球,并利用原位的对称破裂以可溶性淀粉为模板将纳米颗粒自组装形成碳酸钙中空微球。该微球能够有效加载阿霉素(DOX),且在血液中保持稳定,细胞实验发现药物能够在核周围聚集然后进入细胞核内从而增强细胞毒性,达到抗癌效果。
1.2.3 氧化铁
生物铁氧化物分布广泛,且在生物体内起着多种作用,包括催化和磁性介质等[22-23]。氧化铁纳米粒子作为被广泛研究的纳米药物载体,具有耐腐蚀,成本低廉,制备简单,环境友好等特点,尤其是它的生物可降解性使氧化铁纳米粒子在纳米药物领域得到充分的发展[24-25]。氧化铁纳米粒子主要包括α-Fe2O3,γ-Fe2O3和Fe3O4,虽然它们合成的原料都基本一样,但是根据合成方法的不同,它们在大小、形态和磁性能上均有差异,这就为氧化铁纳米粒子在药物载体体系中提供更广阔的平台。Cheng等[26]制备了孔径为2~4 nm的中空 Fe3O4纳米粒子,该孔径有利于药物扩散到中空结构中。在低pH值(<6)条件下,空隙在酸刻蚀下孔隙加宽、药物释放。Quinto等[27]在14 nm氧化铁纳米颗粒表面包覆磷脂-聚乙二醇(PEG)得到超顺磁纳米颗粒,通过亲疏水和静电相互作用可以实现药物高效负载,并控制PEG的分子长度改变药物在载体上的负载量。
1.2.4 硅矿物
硅矿物是除含钙矿物以外,丰度最高的生物矿物。它们广泛分布在水生生物和植物中,起到提供机械强度与支撑、抵抗病原菌和耐热保水等作用。硅纳米药物载体被公认为是最具有发展潜力的几种纳米药物载体之一[28]。硅纳米材料生物毒性低,具有良好的生物相容性,且其结构稳定,易官能化[29]。特别是介孔硅纳米材料其较大的孔穴体积,十分有利于药物负载[30]。此外,硅纳米材料表面的亲水性使得它更利于被细胞内化;合成过程简便、成本低,可以满足日后临床和商业化的要求[31]。
Liu等[32]设计了一种光控的二氧化硅纳米笼体系,即在介孔二氧化硅上包覆光致变色螺吡喃,疏水性药物可以通过红外照射引发的螺吡喃分子的亲疏水性转换,进而控制药物的负载与释放。此外,光照可以激发姜黄素生成活性氧(ROS),从而进一步提高治疗效率。Minko等[33]使用二氧化硅纳米颗粒同时将DOX和Bcl-2 siRNA(Bcl-2蛋白是引发细胞抗药性的决定性因素)传递到具有抗药性的癌细胞中,使DOX抑癌细胞效果增强。
2 靶向性策略
2.1 被动靶向性
药物载体的被动靶向主要是基于肿瘤的EPR(Enhanced permeability and retention)效应,即肿瘤组织内部増强的通透性和滞留效应[34-35]。这是由于与正常组织中的血管相比,实体瘤肿瘤部位的血管丰富,结构完整性较差,血管壁间隙较宽(大约100~800 nm),因此粒径合适的载药纳米颗粒会通过新生血管选择性的累积在肿瘤组织。当纳米载体的尺寸过大 (>200 nm)时,易于被体内的网状内皮系统(RES)所捕获而作为异物排出体外,导致粒子在血液中的循环时间短,累积在肿瘤组织处的量减少,不利于纳米粒子在肿瘤部位的富集。因此,当纳米粒子的尺寸在30~200 nm时,纳米载体通过EPR效应递送到肿瘤组织的效率最高,是设计抗肿瘤药物载体的最佳尺寸。
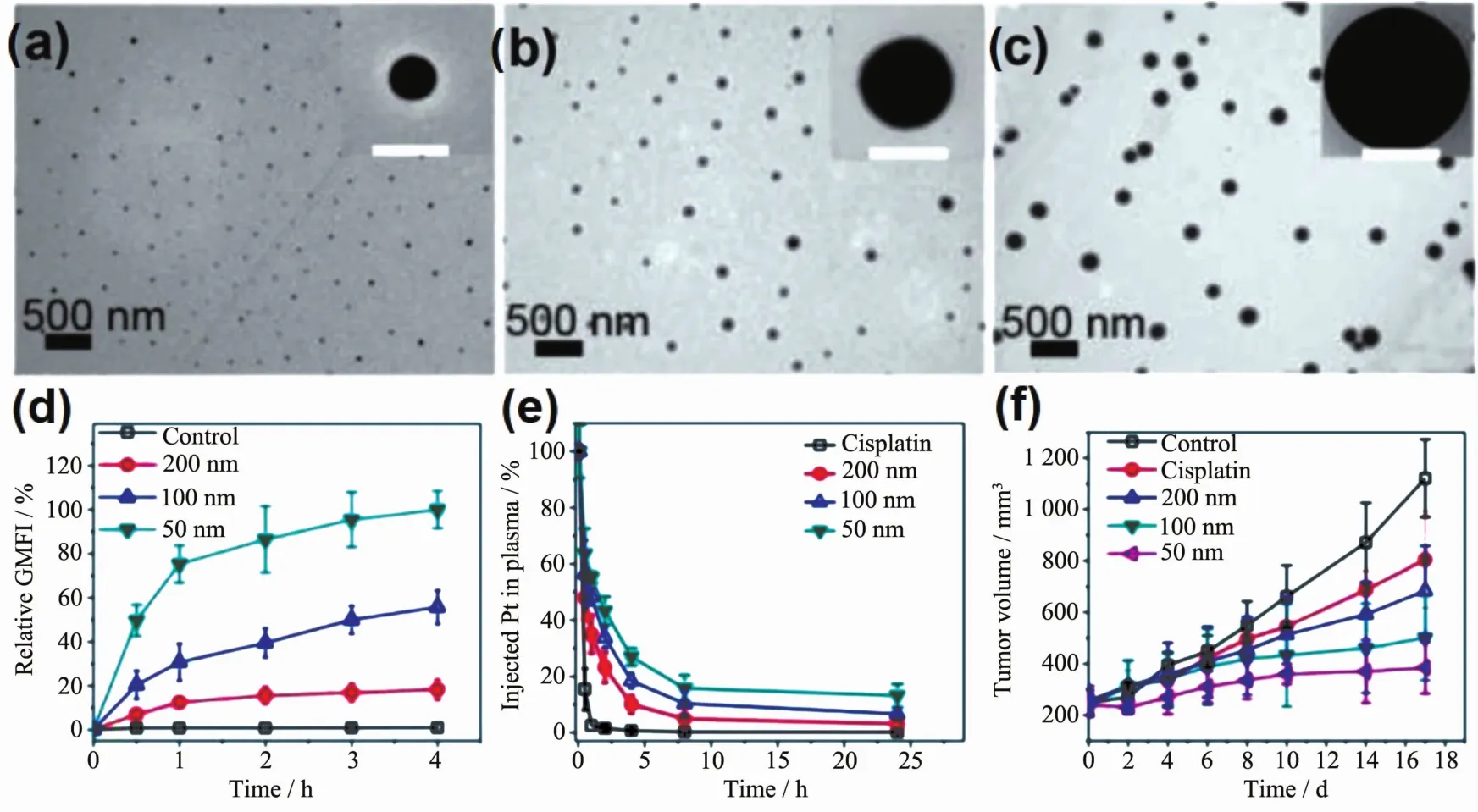
图1 (a~c)50、100和200 nm矿化顺铂颗粒的电镜照片;(d)不同尺寸粒子相对荧光强度随时间的变化;(e)不同注射时间血液循环中的Pt的百分含量;(f)不同尺寸粒子的抑制肿瘤效果[39]Fig.1 (a~c)Transmission electron microscopy (TEM)of the particles (from left to right:50,100 and 200 nm),inset,high resolution images (bar=100 nm);(d)Relative geometrical mean fluorescence intensity (GMFI)increases with time;(e)Variation of percentage Pt dose in blood following the administration;(f)Growth curves of A549 tumors treated by cisplatin and different biomineralized cisplatin[39]
但是,生理环境下由于纳米颗粒与生物分子发生作用从而改变了原有的合成尺寸性质[36]。例如纳米颗粒在血液中很容易被蛋白质组分吸附而改变材料的尺寸和聚集态,进而影响它们在生物体内的作用[37-38]。然而在生物体系中,生物矿化产生的纳米矿物往往表现出较强的分散性与稳定性。因此,通过控制仿生矿化的纳米材料尺寸从而精确调控药物体内行为。Tang课题组[39]利用血清蛋白调控矿化顺铂颗粒的生长,在生理条件下构建了稳定且具有不同尺寸(50,100和200 nm)的纳米矿化顺铂颗粒。研究发现50 nm的矿化颗粒显示出最快的细胞摄取速度和最高的细胞积累量(图1b),并且具有更长的血液循环时间和更高的肿瘤靶向性。
2.2 主动靶向性
作为生物本源的矿物材料不仅具有优异的生物相容性,还可作为进一步靶向修饰的基底。纳米载体的另一种靶向策略是主动靶向,即通过叶酸[40]、抗体[41]、小分子多肽[42]、糖类[43]等对纳米粒子进行修饰从而达到特异性的识别并结合靶向细胞的目的。修饰后的纳米粒子可以与靶细胞表面对应的受体发生特异性结合,使药物有选择性的积累在病变部位而降低对正常细胞的毒副作用,并通过受体介导的内吞作用促进细胞摄入纳米载体。临床应用中,将主动靶向和被动靶向结合在一起,药物载体先通过EPR效应在肿瘤部位富集,再与细胞表面特异性抗原或受体结合,使药物高效集中在癌细胞内,提高了药物的利用率,降低对正常组织和细胞的毒副作用,增强药物抗肿瘤的效果。
Wang等[44]设计了一种具有双靶向功能的空心的yolk-shell结构的磁性纳米载体(MMNs),该载体由1个磁性的Fe3O4内核、MgSiO3外壳与中间空腔部分组成,内部空心结构可以提供高的药物负载,并通过交联叶酸分子(FA)赋予纳米颗粒靶向性。使其可以通过磁场操控而富集在肿瘤部位,同时叶酸分子能明显提高纳米颗粒在肿瘤部位的富集,当结合两种靶向作用时,负载DOX药物后的磁性纳米载体对耐药性肿瘤具有非常好的靶向性和治疗效果(图2)。He等[45]制备了基于碳酸钙的巨噬细胞靶向递送系统,通过修饰糖基化羧甲基壳聚糖赋予碳酸钙纳米颗粒巨噬细胞靶向能力,在癌症免疫治疗中具有应用前景。
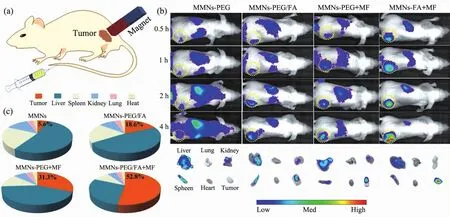
图2 (a)小鼠静脉注射及磁靶向的示意图;(b)不同处理小鼠的活体红外成像及主要器官的红外成像;(c)注射8 h后的不同处理组的小鼠器官部位的荧光定量分析[44]Fig.2 (a)Scheme of the magnetic targeting;(b)Live infrared imaging of different group;(c)Fluorescence quantitative analysis of mouse organ sites in different groups after 8 hours of injection[44]
3 刺激响应性释放
3.1 外部刺激响应
载体携带药物进入细胞后,药物能否从药物载体中释放出来,也是药物载体需要考虑的重要因素。根据靶向部位特殊的环境和材料本身对外界环境的响应性,科学家们设计出了一系列具有环境响应性的纳米药物载体体系,包括对外界环境刺激响应性和肿瘤内部环境刺激响应性[46]。外界刺激响应性纳米药物载体即对外界环境变化敏感的载药体系,外 界 环 境 一 般 包 括 温 度[47]、电 场[48]、磁 场[49]、 超声[50]和光照[51]等。 当施加这些刺激信号时,纳米载体自身的化学形态或物理性质等会发生变化,从而在特定部位选择性地释放出药物。
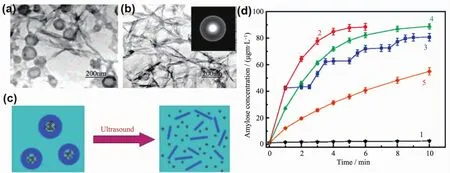
图3 (a)超声1 min的电镜照片TEM;(b)超声5 min的电镜照片;(c)超声响应示意图 (d)不同实验条件下,空心纳米球的淀粉释放动力学曲线:(1)无超声波作用;(2)150 W连续超声波处理;(3)150 W 超声作用1 min,间隔1.5 min;(4)100 W连续超声波处理和(5)50 W连续超声波处理[52]Fig.3 (a)TEM of an interim stage,the coexistence of original hollow spheres,and transferred pin-like crystallites(1 min of ultrasonic application);(b)TEM and SAED of the final stage (5 min ultrasonic application)of the transformation;(c)Scheme of a suggested drug release system;(d)Curves of release kinetics of amylose from the hollow nanospheres under different experimental conditions:(1)no ultrasonic application;(2)continuous ultrasonic treatment(150 W);(3)1 min treatment of ultrasound (150 W),the interval of duties was 1.5 min;(4)continuous ultrasonic treatment(100 W);and (5)continuous ultrasonic treatment (50 W)[52]
Cai等[52]在常温条件下,利用CTAB作为添加剂合成了中空的球形磷酸钙纳米颗粒,该纳米颗粒作可以有效负载药物,并探究了其在超声条件下的释放能力,研究发现可以通过控制超声波的强度实现药物的可控释放(图 3)。 Kobayashi等[53]使用磁性的氧化铁纳米粒子,利用交变磁场使纳米载体可以在靶向部位富集,从而提高了药物的利用率。
3.2 内部刺激响应
除了利用外部条件调节药物的释放,还可以根据 pH 值[54]、酶[55]、氧 化 还 原 电 位[56]等 细 胞 自 身 的 特点,设计针对细胞内部环境响应的药物载体。通过机体内部响应性的药物输送系统运载治疗药物到达靶向细胞或特定的组织,增加了靶向部位的药物累积量,提高治疗效率。
pH值响应型纳米药物载体是应用最为广泛的一类。由于肿瘤细胞生长非常快,这使得其周围的血管系统不能提供足够的生长物质和氧气,因此肿瘤细胞不再通过线粒体进行有氧代谢,而是加强无氧酵解转变成乳酸,乳酸的大量累积从而导致癌细胞中的pH值显著下降,低于正常组织的pH值[57],pH值响应型纳米药物载体便是根据这种差异达到药物的有效传输及可控释放。基于生物钙源的生物矿物载体是非常理想的pH值响应载体,Yu课题组[58]设计了一种基于无定型碳酸钙(ACC)的药物释放体系,该载体可以在pH<6.5选择性释放药物,对肿瘤细胞具有持续的抑制作用。
此外,还原响应型纳米药物载体一般是通过在合成过程中引入二硫键而实现控制药物释放的目的,通过硫醇与二硫的互变来实现药物的可控释放。谷胱甘肽(GSH)是一种存在于大多数细胞内的还原剂,肿瘤细胞内谷胱甘肽的浓度是正常细胞的数倍,可以利用这种浓度差实现氧化还原敏感性药物的释放。Lee 等[59]制备了基于荧光共振能量转移(FRET)的多功能还原型介孔氧化硅纳米药物载体(图4a)。他们将连接了香豆素的介孔氧化硅纳米颗粒作为药物载体,将FITC标记的环糊精作为氧化还原反应的分子阀。在非还原条件下,香豆素与FITC之间形成二硫键,香豆素在405 nm的激发后其发射波直接被FITC吸收而发射出的绿光;当GSH存在时二硫键被切割而引发药物释放,在405 nm的激发光照射下只能得到香豆素所发射的波长的蓝光,借此还可以监测载体中药物的释放(图4b,c)。
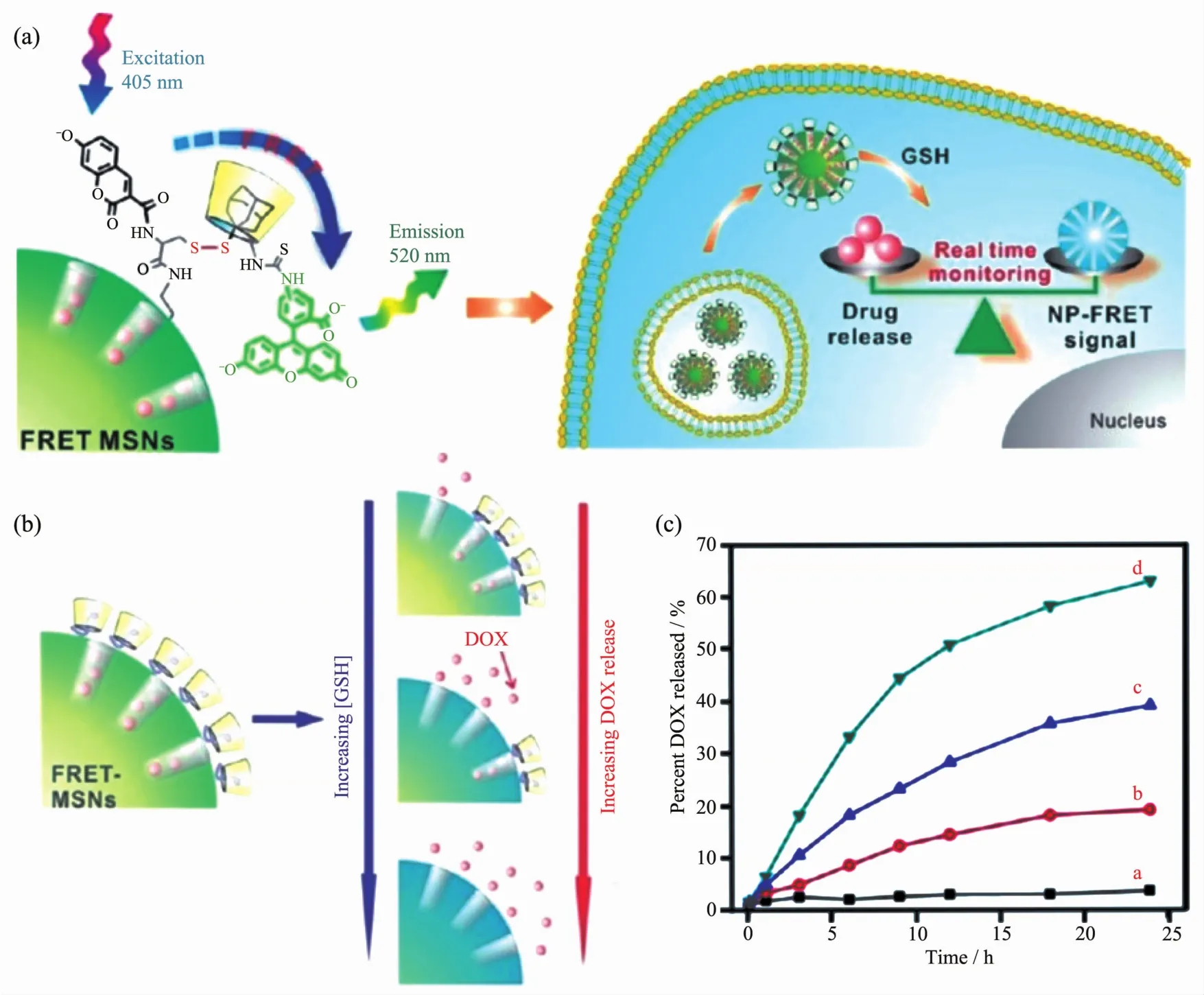
图4 (A)载体的氧化还原响应型示意图;(B)不同浓度的GSH释放DOX的示意图以及FRET信号的相应变化以及FRET-MSN的颜色;(C)随着GSH浓度的增加,在不同时间点从FRET-MSN中释放的DOX百分比(a)没有GSH,(b)0.1 mmol·L-1GSH,(c)1 mmol·L-1GSH 和 (d)5 mmol·L-1GSH)[59]图4 (A)Schematic representation of the redox responsive FRET-MSNs;(B)Scheme showing the release of DOX at different concentrations of GSH and the corresponding change in FRET signal as well as color of FRET-MSNs;(C)Percent DOX released from the FRET-MSNs at different time points following treatment with increasing concentrations of GSH (a)no GSH,(b)0.1 mmol·L-1GSH,(c)1 mmol·L-1GSH,and (d)5 mmol·L-1GSH)[59]
4 应 用
4.1 恶性肿瘤的治疗
恶性肿瘤即癌症,是由于控制细胞增殖机制失常而引起的疾病,它的特点是无限制生长,同时侵入周围正常组织甚至经由体内循环系统或淋巴系统转移到身体其它部分[60]。近年来癌症的发病率和死亡率不断增加,已经严重威胁人类健康和生命,癌症治疗已经成为当前医学研究领域所面临的一个重大挑战[61-62]。
顺铂是临床上使用最为广泛的抗肿瘤药物之一,对于肠癌、前列腺癌、肺癌以及乳腺癌等多种肿瘤都能表现出很强的抑制作用,其作用靶点主要是细胞核内[63]。一般认为,顺铂是通过与DNA交联导致细胞死亡而起到抗癌作用的。在临床应用中肿瘤对顺铂的耐药性是亟待解决的问题[64]。在产生耐药性的各种因素中,细胞对于顺铂的摄取量不足是最为关键的因素,这主要是由于细胞膜上负责顺铂输送的铜转运蛋白表达量下降引起的[65]。Tang课题组[66]以磷酸钙作为载体实现顺铂的细胞内传递,有效规避了细胞对顺铂的耐药性。研究发现磷酸钙载体主要通过细胞内体(endosome)介导的内吞方式,而不再依附顺铂转运蛋白,进而逆转了由于转运蛋白下调而形成的顺铂耐药性。相对于其他纳米载体,仿生矿化方法的特点是生物相容性好、方法简便、费用低廉,因此具有很好的可行性并更容易发展到临床应用。
阿霉素类药物是由链霉菌产生的蒽环类抗生素,被FDA认证为最有效的癌症化疗药物之一。它们能与DNA分子相互作用,嵌入到DNA链的碱基对间,从而抑制生物大分子的合成,杀伤癌细胞,进而达到治疗癌症的效果[67]。然而它的临床应用也受到了肿瘤耐药性的影响,它的耐药机理比顺铂更为复杂,被称为多药耐药性(multiple drug resistance,MDR)[68-69]。引起的主要原因是耐药相关的基因在细胞中高度表达,而使细胞有效地逃过药物的杀伤作用。Tang课题组[70]以磷酸钙作为载体将表阿霉素(EPI)和靶向耐药基因的siRNA传递到细胞内,通过协同作用克服肿瘤细胞的多药耐药性。磷酸钙载体能够抑制细胞内的药物快速清除机制以及抗凋亡机制,同时能很高效的将药物输送到细胞核,因此在耐药细胞内表现出极强的抗肿瘤活性(图5)。
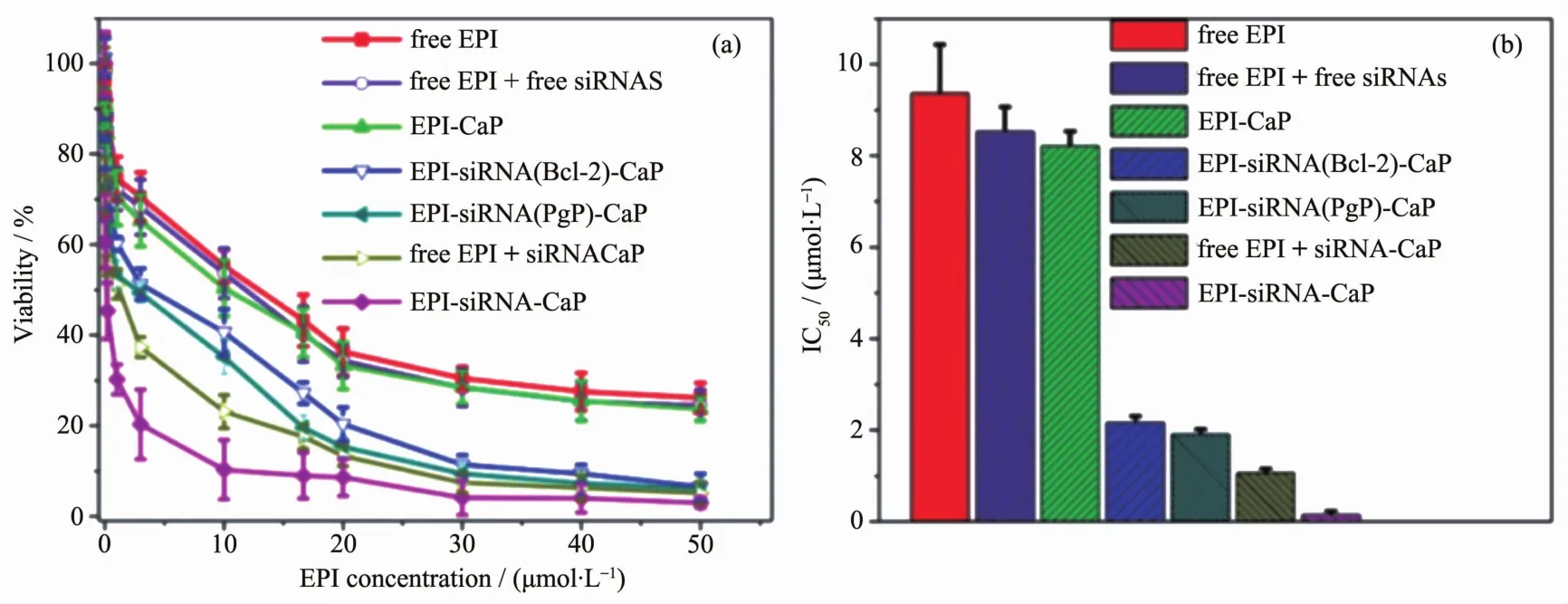
图5 (a)不同EPI的药物形式对于细胞活性的影响;(b)不同EPl的药物形式对细胞作用的IC50值[70]Fig.5 (a)Dose-response curves of the different formulations that contain EPI;(b)Cytotoxicity,represented by IC50of different formulations that contain EPI[70]
4.2 感染性疾病的治疗
感染性疾病每年直接造成大概1 500万人死亡,占每年总死亡人数(5 700万)的25%以上,对全球健康造成了极大的威胁[71-72]。单克隆抗体由于其高度的特异性,有效的被免疫系统招募,较低的脱靶毒性等特性,被认为是抗感染治疗有效的候选药物[73]。目前,对于细胞内的单克隆抗体治疗成功应用所存在的一个主要挑战是需要在靶细胞内提供足够的单克隆抗体以实现病毒的中和。但是,由于单克隆抗体尺寸较大,无法正常的穿透活细胞,因此其通常只能针对细胞外靶蛋白(细胞表面或分泌的蛋白),而不能有效的作用于细胞内的靶标,这限制了细胞内的抗体治疗[74]。Song等[75]选取登革热和流感等4种抗体,利用矿化的磷酸钙纳米抗体实现了中和/非中和单克隆抗体的细胞内递送,该抗体保留了天然抗体的基本生物学功能。同时,递送进入细胞内的抗体即使在病毒感染已经建立的细胞中仍然能够有效的抑制细胞内子代病毒的复制。同时,细胞外不具有中和能力的非中和单克隆抗体进入细胞后同样具有了细胞内抑制病毒复制的能力。该研究拓展了抗体特别是非中和抗体在细胞内抑制病毒的应用前景,为细胞内病毒感染治疗提供了一种新的途径(图 6)。
4.3 肿瘤的诊断
作为影像学诊断的重要手段,核磁共振技术(MRI)具有无辐射、成像清晰、分辨率高等优势,在肿瘤的早期诊断和治疗监测中具有重要地位,对肿瘤患者的术前评估、手术方案的制定和术后随访具有重要意义[76]。目前,Gd的螯合物作为 MRI增强造影剂在临床上广泛应用,但是其对早期肿瘤和微转移诊断的敏感性不高,不能准确的区分肿瘤和正常组织的分界,并且增加肾脏系统性纤维化的风险[77]。纳米粒子载体的特殊尺寸和形貌使得它们能够在生物体内的特定位置大量聚集,与传统造影剂相比,更有利于在分子和细胞水平上对与疾病相关的特异性生物标记进行检测,因此在磁共振成像造影剂领域有很大的应用前景[78-79]。

图6 (a)采用PRNT50检测抗体矿化前后的中和能力;(b)登革病毒感染细胞建立感染后,加入矿化的Anti-E,未处理的Anti-E单克隆抗体以及不相关的抗体处理,空斑形成实验检测病毒滴度;(c)流感病毒感染细胞建立感染后,加入矿化的Anti-NP,未处理的Anti-NP单克隆抗体以及不相关的抗体处理,空斑形成实验检测病毒滴度;(d)登革病毒感染细胞后加入矿化的Anti-E单克隆抗体,未处理的Anti-E单克隆抗体以及不相关的单克隆抗体,WB(Western Blot)检测其中E蛋白的表达量;(e)流感病毒感染细胞建立感染后,加入矿化的Anti-NP,未处理的Anti-NP单克隆抗体以及不相关的单克隆抗体,WB 检测其中 E 蛋白的表达量,(n≥3,Student′s paired t-test,one-tailed,**P≤0.01)[75]Fig.6 (a)Plaque reduction neutralization assays (PRNT50);(b)DENV titers tested by Plaque Forming Unit(PFU)assays;(c)IAV titers tested by PFU assays.Protein expressions were examined by western blot in BHK cells (d)and MDCK cells (e),which were infected with DENV and IAV,respectively (GAPDH internal control).Error bars represent SDs(n≥3,Student′s paired t-test,one-tailed,**P≤0.01)[75]

图7 (A)抗体靶向多功能纳米载体构建示意图;(B)MR体外扫描 T2影像图;(C)MR信号强度图,(a)抗体靶向双载纳米粒,(b)非抗体靶向双载纳米粒,(c)Endorem分别与PC3细胞共孵育2 h[83]Fig.7 Schematic representing formulation of the delivery(A);T2-weighted imaging (B);MR signal intensity (C)of PC3 cells (1×106)after 2 h incubation with (a)scAbPSCA-Dtxl/SPIO-NPs,(b)PEG-PLGA-Dtxl/SPIO-NPs and (c)Endorem(a commercial contrast,Guerbet,France)at Fe concentration of 0,5,10,20,40,80 μg·mL-1;cells were then mixed with 2%agarose solution in PBS and scanned under a 1.5 T MRI scanner (Philips Intera,Netherlands,B.V.)at room temperature[83]
超顺磁性四氧化三铁纳米粒子(SPIO)具有低毒性、良好的生物相容性和磁共振信号敏感性等特点,是一种被美国FDA批准用于体内监测肝癌的转移磁共振的阴性造影剂[80-81]。Yang等[82]将阿霉素和SPIO包覆于三嵌段共聚物材料中形成多功能纳米药物载体,该多功能纳米药物载体具有理想的pH值敏感性,能定位控制释放肿瘤药物,更重要的是SPIO显像效果明显,在肿瘤的诊断治疗一体化中具有较大的应用潜力。Ling等[83]以多西紫杉醇(Dtxl)为肿瘤治疗药物,超顺磁性四氧化三铁(SPIO)为MR影像对比剂,制备了单链抗体靶向多功能纳米粒,该载体高效介导进入细胞后能很好的作为肿瘤细胞的靶向影像对比剂,在核磁共振成像中发挥重要作用(图 7)。
5 结论与展望
基于生物矿化的纳米载体在临床中具有十分广阔的应用前景。但是,目前的研究尚处于实验阶段,研究重点集中在以下几个方面:①优化生物矿物载体的制备工艺,获得结构统一、性质稳定的载体材料;②对载体进行进一步的设计与修饰,使其具有更精确的组织器官靶向性,使负载药物获得更优良、持久的药效;③降低修饰材料的毒副作用以达到临床应用的标准,阐明纳米矿物载体在体内发挥作用的条件及体内降解的机制。随着纳米技术、生物技术以及医学技术的发展,这些问题会逐步得以解决,从而使基于生物矿化的纳米载体成为一种可应用于临床的靶向性强、毒副作用低的新型纳米药物载体。
[1]Peer D,Karp J M,Hong S,et al.Nat.Nanotechnol.,2007,2(12):751-760
[2]Parveen S,Misra R,Sahoo S K.Nanomed.Nanotechnol.Biol.Med.,2012,8(2):147-166
[3]Cho K,Wang X,Nie S M,et al.Clin.Cancer Res.,2008,14(5):1310-1316
[4]De Jong W H,Borm P J.Int.J.Nanomed.,2008,3(2):133
[5]Mann S.Biomineralization:Principles and Concepts in Bioinorganic Materials Chemistry.Oxford:Oxford University Press on Demand,2001.
[6]Weiner S,Dove P M.Rev.Mineral.Geochem.,2003,54(1):1-29
[7]Yao S S,Jin B,Liu Z M,et al.Adv.Mater.,2017,29(14):1605903(19 pages)
[8]Veis A.Science,2005,307(5714):1419-1420
[9]Sarikaya M.Proc.Natl.Acad.Sci.,1999,96(25):14183-14185[10]LIU Cui-Lian(刘翠莲),TANG Rui-Kang(唐睿康).Chinese J.Inorg.Chem.(无机化学学报),2014,30(1):1-9
[11]Cai Y R,Tang R K.J.Mater.Chem.,2008,18 (32):3775-3787
[12]Matsumoto T,Okazaki M,Inoue M,et al.Biomaterials,2004,25(17):3807-3812
[13]Yang P P,Quan Z W,Li C X,et al.Biomaterials,2008,29(32):4341-4347
[14]Uskokovi V,Uskokovi D P.J.Biomed.Mater.Res.Part B,2011,96(1):152-191
[15]HE Wen-Hui(贺文慧),TANG Rui-Kang(唐睿康),XU Xu-Rong(徐 旭 荣 ).Chinese J.Inorg.Chem.(无 机 化 学 学 报 ),2011,27(7):1233-1238
[16]Yu Y D,Zhu Y J,Qi C,et al.J.Colloid Interface Sci.,2017,496:416-424
[17]Sarkar A,Mahapatra S.Cryst.Growth Des.,2010,10(5):2129-2135
[18]Faatz M,Grhn F,Wegner G.Adv.Mater.,2004,16(12):996-1000
[19]Xu X R,Cai A H,Liu R,et al.Prog.Chem.,2008,20(1):54-59
[20]Wei W,Ma G H,Hu G,et al.J.Am.Chem.Soc.,2008,130(47):15808-15810
[21]Ueno Y,Futagawa H,Takagi Y,et al.J.Controlled Release,2005,103(1):93-98
[22]Klem M T,Young M,Douglas T.Mater.Today,2005,8(9):28-37
[23]Pankhurst Q A,Connolly J,Jones S,et al.J.Phys.D:Appl.Phys.,2003,36(13):R167
[24]Veiseh O,Gunn J W,Zhang M Q.Adv.Drug Delivery Rev.,2010,62(3):284-304
[25]Berry C C,Curtis A S.J.Phys.D:Appl.Phys.,2003,36(13):R198
[26]Cheng K,Peng S,Xu C J,et al.J.Am.Chem.Soc.,2009,131(30):10637-10644
[27]Quinto C A,Mohindra P,Tong S,et al.Nanoscale,2015,7(29):12728-12736
[28]Vivero-Escoto J L,Slowing I I,Trewyn B G,et al.Small,2010,6(18):1952-1967
[29]Lin W S,Huang Y W,Zhou X D,et al.Toxicol.Appl.Pharmacol.,2006,217(3):252-259
[30]Tang L,Fan T M,Borst L B,et al.ACS Nano,2012,6(5):3954-3966
[31]Tan W H,Wang K M,He X X,et al.Med.Res.Rev.,2004,24(5):621-638
[32]Liu C Q,Zhang Y,Liu M,et al.Biomaterials,2017,139:151-162
[33]Chen A M,Zhang M,Wei D G,et al.Small,2009,5(23):2673-2677
[34]Matsumura Y,Maeda H.Cancer Res.,1986,46(12 Part 1):6387-6392
[35]Iyer A K,Khaled G,Fang J,et al.Drug Discovery Today,2006,11(17):812-818
[36]Walkey C D,Chan W C.Chem.Soc.Rev.,2012,41(7):2780-2799
[37]Lacerda S H D,Park J J,Meuse C,et al.ACS Nano,2010,4(1):365-379
[38]Walkey C D,Olsen J B,Guo H B,et al.J.Am.Chem.Soc.,2012,134(4):2139-2147
[39]Chen W,Liu X,Xiao Y,et al.Small.,2014,10 (18):3644-3649
[40]Sudimack J,Lee R J.Adv.Drug Delivery Rev.,2000,41(2):147-162
[41]Fay F,Scott C J.Immunotherapy,2011,3(3):381-394
[42]Danhier F,Vroman B,Lecouturier N,et al.J.Controlled Release,2009,140(2):166-173
[43]Liu Z H,Jiao Y P,Wang Y F,et al.Adv.Drug Delivery Rev.,2008,60(15):1650-1662
[44]Yao Y,Wang Y,Zhao R B,et al.J.Mater.Chem.B,2016,4(15):2691-2696
[45]He X Y,Liu B Y,Ai S L,et al.Mater.Today Chem.,2017,4:106-116
[46]Mura S,Nicolas J,Couvreur P.Nat.Mater.,2013,12 (11):991-1003
[47]Choi S W,Zhang Y,Xia Y N.Angew.Chem.Int.Ed.,2010,49(43):7904-7908
[48]Ge J,Neofytou E,Cahill T J,et al.ACS Nano,2011,6(1):227-233
[49]Hayashi K,Ono K,Suzuki H,et al.ACS Appl.Mater.Interfaces,2010,2(7):1903-1911
[50]Kim H J,Matsuda H,Zhou H S,et al.Adv.Mater.,2006,18(23):3083-3088
[51]Melancon M P,Zhou M,Li C.Acc.Chem.Res.,2011,44(10):947-956
[52]Cai Y R,Pan H H,Xu X R,et al.Chem.Mater.,2007,19(13):3081-3083
[53]Ito A,Shinkai M,Honda H,et al.J.Biosci.Bioeng.,2005,100(1):1-11
[54]Lee E S,Gao Z,Bae Y H.J.Controlled Release,2008,132(3):164-170
[55]Vemula P K,Cruikshank G A,Karp J M,et al.Biomaterials,2009,30(3):383-393
[56]Ma Y J,Dong W F,Hempenius M A,et al.Nat.Mater.,2006,5(9):724-729
[57]Ojugo A S,McSheehy P M,McIntyre D J,et al.NMR Biomed.,1999,12(8):495-504
[58]Zhao Y,Luo Z,Li M H,et al.Angew.Chem.Int.Ed.,2015,54(3):919-922
[59]Lai J P,Shah B P,Garfunkel E,et al.ACS Nano,2013,7(3):2741-2750
[60]Coussens L M,Werb Z.Nature,2002,420(6917):860-867
[61]Jemal A,Bray F,Center M M,et al.Ca-Cancer J.Clin.,2011,61(2):69-90
[62]Hanahan D,Weinberg R A.Cell,2000,100(1):57-70
[63]Siddik Z H.Oncogene,2003,22(47):7265-7279
[64]Kelland L.Nat.Rev.Cancer,2007,7(8):573-584
[65]Boulikas T,Vougiouka M.Oncol.Rep.,2003,10 (6):1663-1682
[66]Chen W,Xiao Y,Liu X Y,et al.Chem.Commun.,2013,49(43):4932-4934
[67]Tacar O,Sriamornsak P,Dass C R.J.Pharm.Pharmacol.,2013,65(2):157-170
[68]Szakács G,Paterson J K,Ludwig J A,et al.Nat.Rev.Drug Discovery,2006,5(3):219-234
[69]Sun T M,Zhang Y S,Pang B,et al.Angew.Chem.Int.Ed.,2014,53(46):12320-12364
[70]Chen W,Liu X Y,Xiao Y,et al.Small,2015,11(15):1775-1781
[71]Morens D M,Folkers G K,Fauci A S.Nature,2004,430(6996):242-249
[72]Daszak P,Cunningham A A,Hyatt A D.Science,2000,287(5452):443
[73]Reichert J M.BioDrugs,2007,21(1):1-7
[74]Sapparapu G,Sims A L,Aiyegbo M S,et al.Nanomedicine,2014,9(11):1613-1624
[75]Song Z Y,Liu L,Wang X Y,et al.Chem.Commun.,2016,52(9):1879-1882
[76]Fox M D,Raichle M E.Nat.Rev.Neurosci.,2007,8(9):700
[77]Caravan P,Ellison J J,McMurry T J,et al.Chem.Rev.,1999,99(9):2293-2352
[78]Sun C,Lee J S,Zhang M Q.Adv.Drug Delivery Rev.,2008,60(11):1252-1265
[79]Della Rocca J,Liu D M,Lin W B.Acc.Chem.Res.,2011,44(10):957-968
[80]Na H B,Song I C,Hyeon T.Adv.Mater.,2009,21(21):2133-2148
[81]Thorek D L,Chen A K,Czupryna J,et al.Ann.Biomed.Eng.,2006,34(1):23-38
[82]Yang X Q,Grailer J J,Rowland I J,et al.Biomaterials,2010,31(34):9065-9073
[83]Ling Y,Wei K,Luo Y,et al.Biomaterials,2011,32 (29):7139-7150
Nanoparticle Drug Delivery Systems Based on Biominaralization
XIAO Yun1,3TANG Rui-Kang*,1,2
(1Department of Chemistry,Center for Biomaterials and Biopathways,Zhejiang University,Hangzhou 310027,China)
(2Qiushi Academy for Advanced Studies,Zhejiang University,Hangzhou 310027,China)
(3Institute of Translational Medicine,Zhejiang University,Hangzhou 310027,China)
Biominaralization based nanoparticle drug delivery systems that have the advantages of simple preparation,perfect biocompatibility,controlled drug release and easy to be modified have attracted a wide attention in field of clinical applications.This paper systematically elaborated the construction principle and classification of nanocarrier based on biomineralization,and the targeting strategy as well as stimulus response strategy of the caririers are discussed.The outlook of the clinical application is also prospected.
biomineralization;nanoparticle;drug delivery;calcium phosphate
O611.6
A
1001-4861(2017)11-1937-10
10.11862/CJIC.2017.242
2017-07-20。收修改稿日期:2017-09-11。
国家自然科学基金(No.21625105)和浙江省自然科学基金(No.Y17B010009)资助项目。
*通信联系人。E-mail:rtang@zju.edu.cn
