丁香油抗炎镇痛效果的研究
2017-11-10杨冰李婷婷杨伊涵张炜李小军李玉桑从仁怀唐和斌
杨冰 李婷婷 杨伊涵 张炜 李小军 李玉桑 从仁怀 唐和斌


摘要:指出了丁香油是从中药丁香中提取出来的挥发油,文献报道其主要作用是抑菌消炎,但尚未见有报道研究其镇痛效果及可能机制。研究中用完全弗氏佐剂CFA注射大鼠足底皮肤诱致疼痛作为无菌性的可持续疼痛模型,检测了丁香油的消炎特别是镇痛作用;并在细胞水平上进一步验证了丁香油主要成分丁香酚对炎症的抑制作用。研究证明:丁香油通过抑制COX|2上调,可以减轻CFA注射大鼠诱发的足底肿胀、热痛觉过敏,表明丁香油具有进一步开发为改善慢性疼痛药物的潜质。
关键词:丁香油;抗炎;镇痛;COX|2
中图分类号:R285
文献标识码:A文章编号:16749944(2017)20018204
1引言
慢性疼痛显著地降低了罹患癌症和糖尿病等慢性疾病病人的生活质量,使得本来就重担在身的生活雪上加霜。因而,在临床研究中,如何能发现更有效的镇痛药是一个巨大的挑战[1,2]。另外,市售镇痛药常有很多副作用,如胃肠道反应、嗜睡、瘙痒、成瘾性和呼吸抑制等[3]。为此,寻找并发现新型高效的具有更高安全性的镇痛药也是医药界的一大难题。最近许多相关研究发现,某些中草药或中草药提取物能有效的治疗或缓解疼痛,如苦参提取物,青风藤提取物[4],以及传统上用于止痛的25种植物[5]。
本研究涉及的中药丁香是桃金娘科番樱桃属植物丁香的干燥花蕾,又名公丁香,别名丁子香等。味辛、性温,归脾、胃、肺、肾经;为食药两用中草药,也是名贵香料[6]。丁香油是从丁香中分离提取得到的芳香性挥发油,是主要的抑菌成份。丁香油主要成分已经鉴定出,分别是丁香酚、β-石竹烯和乙酰基丁香酚[7]。丁香油主要用于化妆品,食品芳香剂、防腐剂,临床主要用于牙痛、风湿性疼痛及一些菌性炎症[8]。
目前,尚未见评估丁香油改善炎性疼痛作用的研究。本研究利用大鼠的足底炎性疼痛模型,引入两种不同的评价方法来测试丁香油抗炎和镇痛作用。此外,还在细胞水平上检测了与炎症诱导密切相关的分子环氧化酶COX|2的表达水平[9]。
2实验材料和方法
2.1实验仪器
热痛仪(意大利Ugo Basile);足趾肿胀仪(成都泰盟);水置换体积计(PV-200;成都泰梦软件有限公司,中国成都);电泳仪(美国,BIO-RAD);等。
2.2實验试剂
完全弗氏佐剂(CFA,美国Sigma公司);生理盐水(武汉滨湖双鹤药业);双氯芬酸钠(北京诺华);丁香油和气相色谱-质谱(GCMS)丁香油的结果由无限极(中国)有限公司,广州。所有其他试剂均购自Sigma-Aldrich,USA。
2.3实验动物
在实验开始之前,将96只年轻雄性Wistar大鼠(190~250 g)在无病原体实验室饲养7 d,保证实验室12 h光-夜循环,温度为22~25℃。许可证号:SCXK(鄂)2008-0005,合格证编号:No.42000600004036。
2.4实验方法
2.4.1丁香油的分离提取
2.4.1.1蒸馏丁香油
将干燥丁香花蕾(购自中国广西药品广西中药广州药业中药厂)粉碎并与水以1 g∶10 mL混均。然后,在蒸汽蒸馏装置中蒸馏混合物8 h得丁香油。
2.4.1.2 GCMS分析丁香油
将丁香油(0.103 g)置于装有正己烷(色谱纯)的10 mL容量瓶中定容并混均。取上述溶液0.5 μL进样到GC。检测器为质谱选择性Agilent 5975 检测器,并耦合GCMS分析装置Agilent 7890(II)GC。用HP-5MS毛细管柱分离挥发性化合物。温度由40℃ (1 min) 以5℃/min升到220℃,并保持1 min;载气为氦气,流速为1.0 mL/min。分析丁香挥发油时,使用分流模式,比例为1∶60,喷射器温度为240℃,所有样品一式三份进行分析。用正烷烃计算保留指数(RI),通过比较其RI相对于从HP-5MS柱获得C4-C30正烷烃的值来鉴定组分;并将所得结果与NIST质谱提供的数据库进行比较,当质谱和RI值良好匹配时,确定正确识别组分。
2.4.2炎症性疼痛模型
将大鼠随机分为对照组(替代CFA的生理盐水注射)和CFA诱发的炎性疼痛组(CFA注射),不同组详细内容见“结果”部分。将150 μL CFA皮下注射到大鼠左后足底部,诱导炎症性疼痛;对照大鼠注射等体积生理盐水。注射CFA后,将对照组大鼠随机分为3组(对照组),分别在第1周,第2周或第3周结束时处死。同时将CFA组随机分为CFA处理组(CFA),CFA处理连续灌胃双氯芬酸钠组(CFA+diclo,30 mg/kg/d,诺华,北京),以及CFA处理连续灌胃丁香油组(CFA+ Clove Oil,10 mg/kg)。这些大鼠也分别第1周,第2周或第3周结束时处死。
2.4.3炎症评估
通过测量足底肿胀大小来评估炎症程度。用水置换体积计(PV-200;成都泰梦软件有限公司)测量每只大鼠左足与其右足的体积,每只足被测3次,取其平均值。
2.4.4疼痛评分测试
全部行为评估均按照国际疼痛研究协会(IASP)的道德准则进行。所有行为测试都在双盲条件下进行。并且,所有行为测试均在以下时间点进行:CFA注射后1,2或3周;评估疼痛评分也是在双盲情况下4人分别单独完成。具体方法及过程请参看本实验室前期文章。
2.4.5热痛觉过敏试验
为了确定给药处理后大鼠对热刺激的伤害感受反应情况,使用足退缩反应潜伏期(WRL)值来测量。即是,将动物放在具有玻璃地板的塑料室中,使其适应10 min;辐射热源置于大鼠每只后足所在的玻璃地板下方。使用足底测试仪(Ugo Basile Srl,Varese,Italy)测量足WRL值精确到0.1 s。校准光源强度,以在自然状态下动物在16~25 s范围内产生足退缩反应为度。大鼠两只后足每只测3次,取其平均值。计算每只后足的WRL值。测量时间设定为60 s。endprint
2.4.6细胞实验
选取NIH3T3细胞,用DMEM高糖培养基加入10% CS作為完全培养基,于37℃,5% CO2条件下进行培养。Western blot法测定细胞COX|2蛋白的表达水平:接种培养生长对数期NIH3T3细胞系于35 mm皿中,经不同浓度丁香酚干预2 h后,换液再加入400 ng/mL LPS和不同浓度丁香酚共处理24 h。提取细胞总蛋白,进行聚丙烯酰胺凝胶电泳,转移至PVDF滤膜,5%脱脂奶粉封闭,加入针对COX|2抗原的抗体;洗涤后加入相对应HRP标记的二抗,加入化学发光底物进行显色,分析目标蛋白条带光密度。
2.4.7统计分析
本文中所有行为测试结果(除非另有说明)以平均值±SEM的形式表示为CFA注射足以及对照足的值。在Origin8.0(Originlab Corp.,MA,USA)进行单因素方差分析,然后进行Bonferroni posttests统计分析。所有测试均为双尾,P<0.05被认为具有统计学意义,在所有图中*,**或***分别表示P<0.05、0.01或0.001。
3结果
3.1鉴定丁香油的组成
本研究中使用的丁香油主要化合物是丁香酚(78.69%)、β-石竹烯(11.74%)、α-石竹烯(1.59%)、石竹烯氧化物(1.11%)等。描述主要化合物的数据如表1所示,将分离鉴定出的成分与文献[7]对比发现,除文献中乙酰基丁香酚(5.60%)含量较多外,丁香酚(70.61%)、β-石竹烯(18.91%)、α-石竹烯(2.12%)差别不大;考虑到丁香的来源、分离提取的方法以及所使用的仪器,这些差别是可接受的,也表明我们的鉴定结果是可靠的。
3.2丁香油减轻CFA注射诱发的大鼠后足炎性肿胀
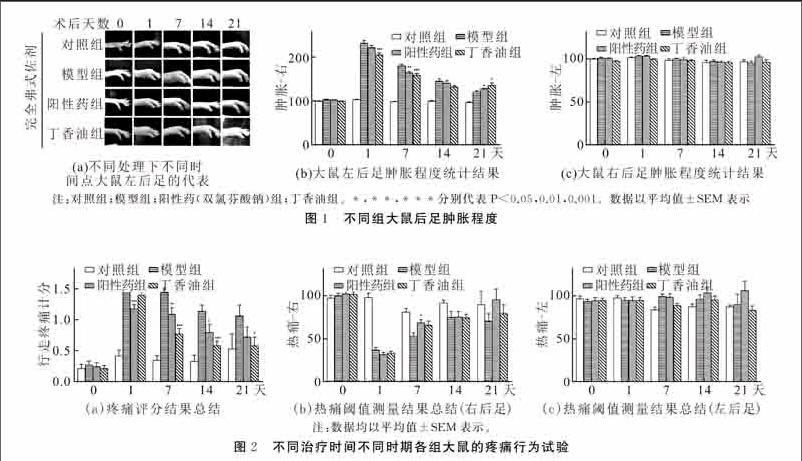
为了评价丁香油的抗炎和镇痛作用,将应用材料和方法部分描述的CFA注射大鼠模型进行研究。如图1(a)所示,在CFA注射前,在每组大鼠的右后足未观察到肿胀。在CFA注射后,与对照组相比,大鼠注射的后足显示出一定水平的肿胀(图1(b),模型组233.68 ± 6.83%,对照组为103.47 ± 1.11%, n=19),且肿胀程度呈时间依赖性降低。给予不同的治疗(阳性药组给药双氯芬酸钠,30 mg/kg/d,n=19;丁香油组给药丁香油,10 mg/kg/d 等同60 kg人给药100mg /d,n=19),与模型组相比,肿胀程度降低得更快。更重要的是,在丁香油存在下,大鼠后足肿胀程度降低比阳性药组明显增加,只在第21 d时肿胀程度降低不如阳性药组明显(第7d,丁香油组159.29±4.67%,阳性药组164.64±3.70%;第14d,丁香油组133.10±3.74%,而阳性药组为141.09±5.61%;第21 d,阳性药组128.41±1.86%,而丁香油组为135.37±5.46%)。且在实验过程中,每组大鼠的左后足均未观察到肿胀(图1c)。对比阳性药组和丁香油组的结果,我们发现丁香油的抗炎效果优于双氯芬酸钠的抗炎效果。
3.3应用丁香油部分恢复CFA注射大鼠诱发的疼痛
为了更好地表征不同给药处理下大鼠炎症相关的疼痛状态,本研究中引入了疼痛评分试验。疼痛评分试验的详细过程在前文已有描述。如图2(a)所示,模型组CFA注射后,其疼痛评分从第0d 0.27±0.06被提高到第1 d 1.70±0.07,且在实验过程中持续21 d保持在相对较高的水平(第21 d为1.06±0.18),表明CFA注射成功诱发大鼠后足显著并可持续的疼痛。阳性药双氯芬酸钠给药处理后,疼痛评分在第1 d下降至1.17±0.07,并进一步下降。在第21 d降至0.72±0.17。丁香油给药后,在第1 d将疼痛评分降低至1.39±0.12,然而,其后下降加快,在第21d将疼痛评分降低至0.58±0.13,与对照组(0.53±0.23)相当,但超过双氯芬酸钠给药的效果。表明丁香油能更好地减轻由CFA注射引起的炎性疼痛反应。
注:对照组;模型组;阳性药(双氯芬酸钠)组;丁香油组。 *,**,***分别代表P<0.05,0.01,0.001。数据以平均值±SEM表示
接着考虑利用传统的热痛痛阈检测来进一步评估丁香油改善炎性疼痛的作用。如图2(b)所示,观察到CFA注射后热诱导的疼痛反应快速而显著的增敏,并随试验时间的延长逐步回升。阳性药组给予双氯芬酸钠治疗后,大鼠的热痛阈值从第1d的33.22±2.67%到第14d的79.33±7.46%、第21d的100.86±13.16%,递增约3倍。而给予丁香油治疗后,大鼠的热痛阈值从第1d的34.87±2.45%到第14d的78.66±4.32%、第21d的83.69±11.11%,递增约2倍多。与阳性药组双氯芬酸钠的效果类似,丁香油对炎性疼痛也显示较好的效力。
注:数据均以平均值±SEM表示。
3.4丁香油应用在细胞水平上抑制COX|2表达
众所周知,丁香油具有抗致病性真菌、葡萄球菌、痢疾和大肠杆菌等多种微生物的功效;并早已应用于牙痛、皮肤病、菌类引起的炎症等。在本文前面已经证实,丁香油中主要成份为丁香酚,这与文献报道的结果是相符的。前人研究表明:丁香酚是丁香油中起作用的主要成份。目前,已经证明CFA注射可诱导大鼠COX|2表达[10~12]。LPS为较为常用的炎症诱导剂。为了检测丁香油的应用是否是通过抑制COX|2来减轻疼痛,我们拟用丁香酚和LPS刺激NIH3T3细胞,收集蛋白并用蛋白杂交检测COX|2的表达。如图3所示,COX|2的表达量在丁香酚和LPS处理后有所变化。单独LPS处理后NIH3T3细胞内COX|2表达显著上调;丁香酚和LPS共同刺激后,随丁香酚的浓度增加COX|2表达显著下调。提示丁香酚可抑制NIH3T3细胞的COX|2表达,且抑制能力与其浓度正相关;进一步提示丁香油是通过抑制CFA注射大鼠诱导的COX|2表达上调来减轻疼痛。endprint
4结论及讨论
4.1结论
本文已经证明丁香油可以通过抑制COX|2的表达上调来潜在地缓解CFA注射大鼠诱发的关节肿胀和热痛觉过敏,因此丁香油有望成为一种缓解慢性炎症和疼痛的潜在药。
注:不同浓度丁香酚和LPS处理鼠源NIH3T3细胞后蛋白杂交得到的COX|2表达及定量图。数据均以平均值 ± SEM表示
图3丁香油通过抑制COX|2表达来缓解疼痛
4.2讨论
丁香油主要成分为丁香酚,其也是药物活性的主要成分。丁香酚有多种药理药效作用,但也存在一些毒副作用:例如有一定的腐蚀性;有刺激性,其会引起呼吸综合症;误食后其会导致代谢性酸中毒[13]。有报道称,丁香酚用于牙痛时会引起慢性荨麻疹、接触性荨麻疹、变应性接触性皮炎等过敏反应[14]。在该研究中,丁香油用量较小;并且在实验中,大鼠用丁香油处理后,没有观察到其任何异常行为。因此,本研究中使用的丁香油至少对于实验动物是安全的。为了人类的进一步使用,应进行更多的毒性和安全性实验。
在本研究中,大鼠經CFA注射后成功地在热和触觉刺激下产生了应激反应(疼痛评分试验检测到大鼠在行走期间的恢复行为,其可被视为触觉应激反应),表明CFA注射可致如前所述的疼痛[15]。然而,与以前的研究不同,本研究中CFA注射大鼠后3周,依然检测到相对持久的异常性疼痛和热痛觉过敏。数据显示,在第3周特别是模型组的测试大多数没有恢复到对照组水平,表明CFA注射对大鼠的影响至少可持续3周。
双氯芬酸钠属于非甾体类抗炎药,其是最常用的镇痛药之一[16]。其作为抗炎镇痛药,它可能是前列腺素最有效的抑制剂;常用于治疗风湿性疾病[17]和术后止痛[18]等。然而,诸如头痛、头晕、皮疹、水肿以及对肾肝的潜在损伤等副作用限制了其临床应用。为此,人们进行了许多研究,尝试用其他物替代双氯芬酸钠,如维生素B和维生素E[19]。除副作用外,双氯芬酸钠(30 mg/kg/d)在抗炎方面不如该研究中观察到的丁香油那样有效。相比之下,丁香油在抗炎方面表现更好。
多年来,人们一直认为COX|2在炎症引起的疼痛中发挥重要作用,研究已经表明,大鼠经CFA注射后6 h,其COX|2蛋白和mRNA表达水平急剧升高[20]。然而,在本研究中已经在细胞水平证明COX|2的上调可被丁香酚抑制,这表明丁香油具有缓解炎症和慢性疼痛的作用。
参考文献:
[1]
Mogil J S, Davis K D, Derbyshire S W. The necessity of animal models in pain research[J]. Pain, 2010, 151(1):12~17.
[2]Johannes C B, Le T K, Zhou X, et al. The prevalence of chronic pain in United States adults: results of an Internet-based survey.[J]. Journal of Pain, 2010, 11(11):1230.
[3]旋静. 镇痛药的不良反应及处理的临床发展概况[J]. 中国医药指南, 2015(16):50~51.
[4]周志梅, 郭世民, 何静,等. 镇痛中药的研究进展[J]. 云南中医中药杂志, 2007, 28(4):52~54.
[5]Adebayo S A, Dzoyem J P, Shai L J, et al. The anti-inflammatory and antioxidant activity of 25 plant species used traditionally to treat pain in southern African[J]. Bmc Complementary & Alternative Medicine, 2015, 15(1):1~10.
[6]朱金段, 袁德俊, 林新颖. 丁香的药理研究现状及临床应用※[J]. 中国药物经济学, 2013(1):32~35.
[7]但春, 丁立生, 彭树林, 等. 丁香和升麻的化学成分研究[D]. 北京:中国科学院, 2006.
[8]李英嘉, 刘洪章. 丁香挥发油的研究进展[J]. 黑龙江农业科学, 2014(7):148~151.
[9]朱小燕, 郭曲练, 等. P300 介导调控神经病理性疼痛因子COX|2的表观遗传学研究[D]. 长沙:中南大学, 2013.
[10]Seybold V S, Jia Y P, Abrahams L G. Cyclo-oxygenase-2 contributes to central sensitization in rats with peripheral inflammation[J]. Pain, 2003, 105(1-2):47~55.
[11]Maciel I S, Silva R B, Morrone F B, et al. Synergistic effects of celecoxib and bupropion in a model of chronic inflammation-related depression in mice.[J]. Plos One, 2013, 8(9):e77227.
[12]Fang J Q, Fang J F, Liang Y, et al. Electroacupuncture mediates extracellular signal-regulated kinase 1/2 pathways in the spinal cord of rats with inflammatory pain[J]. BMC Complementary and Alternative Medicine, 2014, 14(1):1~12.endprint
[13]孔曉军, 李剑勇, 等. 阿司匹林丁香酚酯的致畸致突变研究[D]. 北京:中国农业科学院, 2013.05.
[14]Tammannavar P, Pushpalatha C, Jain S, et al. An unexpected positive hypersensitive reaction to eugenol[J]. Bmj Case Reports, 2013.
[15]王倩, 张娟, 周一,等. CFA注射致炎性疼痛过程中海马内BDNF的表达及作用研究[J]. 现代生物医学进展, 2014, 14(36):7001~7006.
[16]陆小松, 吴天兴, 曹杰,等. 双氯芬酸钠的研究进展[J]. 黑龙江畜牧兽医, 2016(5):81~84.
[17]盛桂华, 朱海亮, 等. 非甾体抗炎药双氛芬酸配合物的合成、结构表征及其生物活性研究[D]. 南京:南京大学, 2015.
[18]Mohammadi S S, Abdi M, Movafegh A. Comparing Transcervical Intrauterine Lidocaine Instillation with Rectal Diclofenac for Pain Relief During Outpatient Hysteroscopy: A Randomized Controlled Trial[J]. Oman Medical Journal, 2015, 30(3):157.
[19]Sena M M, Chaudhry Z F, Collins C H, et al. Direct determination of diclofenac in pharmaceutical formulations containing B vitamins by using UV spectrophotometry and partial least squares regression[J]. Journal of Pharmaceutical & Biomedical Analysis, 2004, 36(4):743~749.
[20]Fang J Q, Fang J F, Liang Y, et al. Electroacupuncture mediates extracellular signal-regulated kinase 1/2 pathways in the spinal cord of rats with inflammatory pain[J]. BMC Complementary and Alternative Medicine, 2014, 14(1):1~12.
Anti-inflammatory and Analgesic Effects of Clove Oil
Yang Bing1, Li Tingting1, Yang Yihan1, Zhang Wei1, Li Xiaojun1, Li Yusang1, Cong Ronghuai2, Tang Hebin1
(1.School of Pharmaceutical Sciences,South-central University for Nationalities,Wuhan,Hubei,430074,China;
2.Infinitus (China) Company Ltd., Guangzhou, Guangdong, 510665, China)
Abstract: Chronic pain, or sometimes referred to as sustainable pain, could cause physical and mental suffering and hence reduce the life quality of patients with chronic diseases such as cancer and diabetes. In recent years, Chinese Medicine, the treasure of Chinese traditional physic, has drawn more and more attentions for the search of effective drugs that can suppress chronic pain. The drug effect of Clove oil, a kind of volatile oil extracted from a Chinese traditional medicine, Ding Xiang, or Syzygiumaromaticum L., is mainly restricted in anti-bacterial activity according to current literatures. However, hardly any research has focused on the effect and detailed mechanism of its anti-inflammatory and analgesic effects. Therefore, in the current study, we used CFA-injected rats as a model of sterile chronic-pain and detected the anti-inflammatory and especially analgesic effects of clove oil. In addition, we proved in the cellular level that eugenol, the main ingredient of clove oil, could alleviate inflammation. All together, we have proven that clove oil could reduce the paw swelling and the pain hyper-sensation of rats injected with CFA by inhibiting the up-regulation of COX|2, all of which demonstrated a potential of clove oil to be further developed into a chronic pain killer.
Key words: clove oil; anti-inflammatory; analgesic effects; COX|2endprint
