恩诺沙星免疫亲和柱的制备与应用研究
2017-11-10朱新生强敏陆源王韦岗牛瑞王云
朱新生,强敏,陆源,王韦岗,牛瑞,王云
(1.镇江市产品质量监督检验中心,江苏镇江212132;2.江苏大学食品与生物工程学院,江苏镇江212013)
恩诺沙星免疫亲和柱的制备与应用研究
朱新生1,强敏1,陆源1,王韦岗1,牛瑞2,王云2
(1.镇江市产品质量监督检验中心,江苏镇江212132;2.江苏大学食品与生物工程学院,江苏镇江212013)
将制备获得的恩诺沙星(Enrofloxacin,ENR)多克隆抗体与Sepharose 4B进行偶联,获得恩诺沙星免疫亲和柱(immunoaffinity column,IAC),并对IAC柱的性能和应用前景进行评价。结果表明:恩诺沙星多克隆抗体效价为1.28×105、半抑制浓度为5.47 ng/mL;制备的IAC柱的柱容量为2.54 g/mL凝胶,IAC柱的平均回收率为98.9%,柱与柱之间的变异系数为3.0%;牛奶中ENR的加标回收率分别为96.5%~99.8%。
恩诺沙星;多克隆抗体;免疫亲和层析
恩诺沙星(Enrofloxacin,ENR)是畜禽和水产动物常用的一种氟喹诺酮类抗生素,能通过抑制细菌DNA螺旋酶来达到抗菌效果[1]。ENR进入畜禽机体后在体内分布广泛且速度快,而且其杀菌谱广,与其他药物无交叉耐药性,但是ENR在动物体内消除比较缓慢,半衰期较长[2]。在畜禽养殖业中,滥用ENR的现象相当普遍,造成动物制品中ENR残留,给人体健康带来威胁,如导致过敏反应、神经系统不良反应、精子质量下降等[3]。因此,世界各国对喹诺酮类抗生素的最高残留限量均做出了严格的限制。我国农业部规定禽肉及其制品中ENR的最高残留限量为0.1 mg/kg。为保护消费者的身体健康,迫切需要建立一种快速、准确的食品中ENR残留分析检测方法。
目前ENR常用的检测分析方法有液相色谱(high performance liquid chromatography,HPLC)[4]、液相色谱-质谱(liquid chromatography-mass spectrometry,LC/MS)[5-6]、毛细管电泳法[7]等。但由于实际样品中抗生素残留含量低、样品基质复杂,属于痕量分析的范畴,因此在进行仪器分析之前通常需要进行样品净化处理。常见的样品净化前处理的方法有固相萃取、液相微萃取等,但这些方法选择性低、耗时。免疫亲和层析技术,利用配体和靶标分子特异性可逆相互作用进行色谱分离,具有操作简便、选择性高等优点,在农兽药残留检测领域显示出良好的应用前景[8-9]。本研究将恩诺沙星多克隆抗体与CNBr-Sepharose 4B偶联制备获得免疫亲和柱(immunoaffinity column,IAC),并对其性能和应用前景进行评价。
1 材料与方法
1.1 试剂与仪器
恩诺沙星:Santa cruz公司;CNBr活化的sepharose 4B:GE公司;甲醇、乙腈(色谱纯):Thermo-Fisher公司;其他试剂均为化学纯:国药上海化学试剂有限公司。
UV-9600紫外分光光度计:北京瑞利分析仪器公司;高效液相色谱仪LC 20AT:日本岛津公司;5810R冷冻离心机:德国艾本德公司;全自动酶标仪Multiskan FC:美国Thermo公司。
1.2 抗体制备
采用N-羟基琥珀酰亚胺法(N-hydroxysuccinimide,NHS法)制备免疫原[8]。称取 20 mg ENR、12.5 mg碳二亚胺 (1-ethyl-(3-dimethylaminopropyl)carbodiimide,EDC)、10 mg NHS,充分溶解于 0.9 mL 二甲亚砜中,加入100 μL三乙胺,室温搅拌24 h,然后将其缓慢滴加到含有25 mg牛血清白蛋白(bovine serum albumin,BSA) 的 0.01 mmol/L pH 7.4 磷酸缓冲液(phosphate buffered saline,PBS)溶液中,室温搅拌 3 h;将上述反应好的溶液装入透析袋中,4℃条件下使用PBS溶液透析3天后,4 000 r/min离心20 min,收集上清液,冷冻干燥后,分装保存。
免疫原ENR-BSA用生理盐水配成浓度为1mg/mL的溶液。首次免疫1.0 mg/只,用弗氏完全佐剂将ENRBSA乳化后,采用背部皮下多点的注射方式;加强免疫用不完全佐剂进行乳化。第3次免疫7天后,耳缘静脉取血,采用酶联免疫吸附法(enzyme-linked im munosorbent assay,ELISA)测定免疫血清的效价和IC50值。
1.3 IAC的制备
IAC柱的制备参照文献[8]进行,具体步骤如下:
1)将纯化后的多抗置于偶联缓冲液(0.1 mol/L NaHCO3,0.5 mol/L NaCl,pH 8.3)中透析过夜,然后稀释到一定浓度备用;2)准确称取CNBr-Sepharose4B干胶0.1g在10mL 1 mmol/L HCl溶液中溶胀20 min。用10倍体积的偶联缓冲液洗涤,在4℃,4 000 r/min条件下离心1 min,离心2次;3)取洗涤后的2 mL湿胶迅速转移至含有2 mL一定浓度多抗的偶联缓冲液中,于室温下振摇1 h;4)用10倍体积以上的偶联缓冲液洗去未偶联的多抗;5)将凝胶置于5倍体积的0.1 mol/L Tris-HCl(pH 8.0)中,在室温下封闭 2 h;6)用 5 倍体积的0.1 mol/L 醋酸盐缓冲液(pH 4.0)、0.1 mol/L Tris-HCl(pH 8.0)交替洗涤3次,再用pH 7.4的0.01 mol/L PBS缓冲液洗涤2次后,装柱至凝胶体积为0.5 mL。装柱后向柱管加入1 mL 0.01 mol/L PBS缓冲液和10 μL 1%硫柳汞钠,封住口底后于4℃保存。
1.4 柱容量的测定
取10 mL 400 ng/mL(4 000 ng)ENR标准溶液过柱,每1 mL上样液收集一管,用HPLC法测定ENR含量,计算柱容量。
柱容量(ng ENR/g湿胶)=IAC柱吸附的ENR总量(ng)/湿凝胶质量(g)
1.5 IAC柱与柱之间重复性的测定
IAC柱之间的重复性用回收率进行评价,按照1.3的方法制备IAC柱,分别用2 mL 50、100、200 ng/mL(总量分别为 100、200、400 ng) 三种不同浓度的ENR标准品溶液依次过柱,每一个浓度两组平行,用0.01 mol/LPBS缓冲液充分洗涤后,再用90%甲醇-水溶液进行洗脱,收集洗脱液,40℃旋转蒸发仪上旋干,5 mL甲醇复溶后用HPLC法测定洗脱液中ENR的含量,计算柱与柱之间的重复性。
1.6 牛奶样品加标回收率的测定
在5 mL空白牛奶样品中分别加入浓度为5、10 ng/mL的ENR标准溶液(使用0.8%NaOH-PBS进行稀释),每组两个平行,将ENR标准溶液分别过柱,充分洗脱后,收集洗脱液,40℃旋转蒸发,用甲醇定容至5 mL,用HPLC法测定ENR的含量,计算加标回收率。
1.7 HPLC分析
色谱条件:Shimpack VP-ODSC18色谱柱(250 mm×4.6 mm)和UV检测器;流动相:乙腈和0.05 mol/L磷酸(19∶81,体积比);UV检测器检测波长为280 nm;进样量:20 μL;流速 1.0 mL/min。
2 结果与分析
2.1 ENR抗体的制备
免疫原ENR-BSA的紫外扫描图谱如图1所示。
载体蛋白BSA在277 nm处有特征吸收峰,ENR在282 nm和319 nm处有两个特征吸收峰,免疫原ENR-BSA则在280 nm和321 nm处有两个特征吸收峰。由于紫外吸收具有加合性,免疫原ENR-BSA不仅保留了载体蛋白和半抗原ENR的特征吸收峰,同时又有所迁移,说明半抗原ENR和载体蛋白偶联成功。
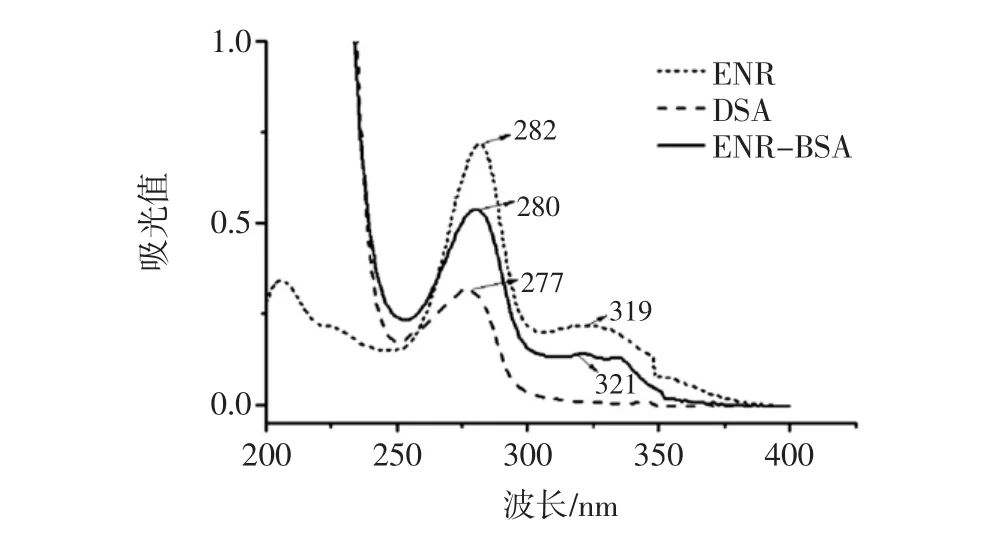
图1 ENR-BSA、BSA和ENR的紫外扫描图谱Fig.1 UV spectra of ENR-BSA,BSA and ENR
将所制备的免疫原ENR-BSA免疫动物,采用间接非竞争ELISA法对免疫血清的效价进行检测,结果如图2所示。
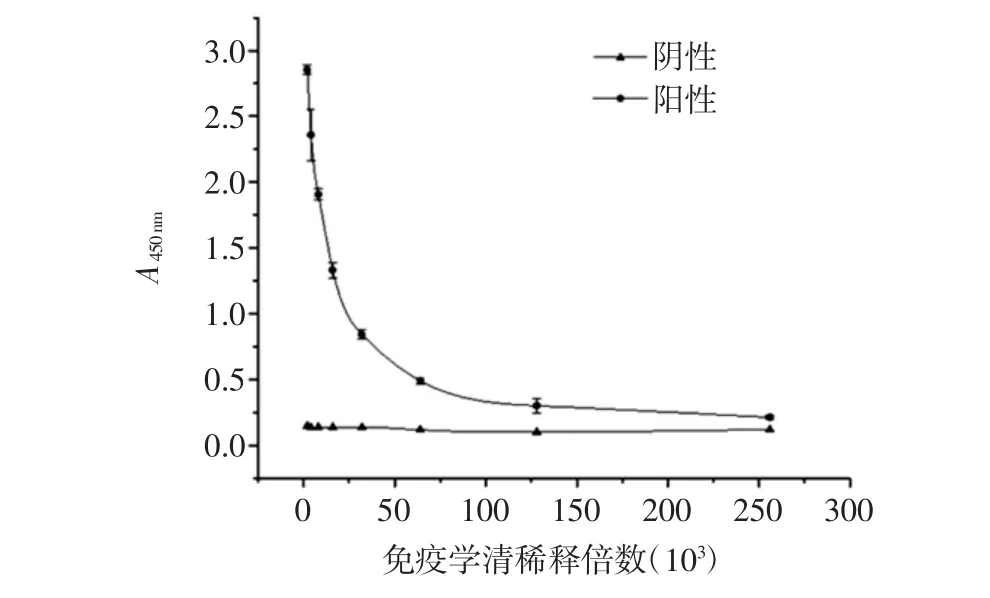
图2 免疫血清的效价曲线Fig.2 The titer curve of immune serum
随着稀释倍数的增加,阴性血清的A450值无显著变化,阳性血清的A450值随着稀释倍数的增加而降低,当免疫血清的稀释倍数为128 000时,与阴性血清的比值即P/N值大于2.1,即免疫血清的效价达到1.28×105。
多克隆抗体血清采用饱和硫酸铵法和正辛酸-饱和硫酸铵法进行纯化。纯化后的抗体采用ELISA法测定其抑制曲线及半数抑制浓度IC50值,结果见图3。

图3 多克隆抗体的抑制曲线Fig.3 The inhibition curve of polyclonal antibody
由图3可求得可以求得ENR多克隆抗体的半数抑制浓度IC50为5.47 ng/mL。
2.2 IAC的制备与评价
参照GE-Healthcare操作手册,将纯化后的ENR多抗与CNBr-Sepharose 4B共价偶联,制备获得ENR免疫亲和柱。10 mL 400 ng/mL ENR溶液连续过柱,每1 mL上样液收集一管,测定其中的ENR含量,计算被IAC柱吸附的ENR含量结果见图4。
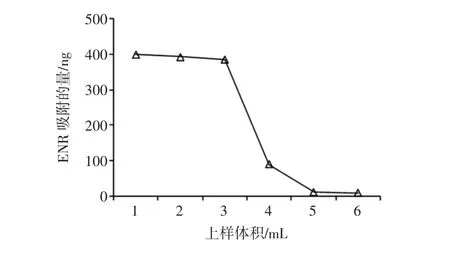
图4 IAC的柱容量Fig.4 Column binding capacity of the IAC
如图4所示,可得IAC柱容量为(400+393+386+90)/0.5=2.54 μg ENR/mL 凝胶。
将2 mL 50、100、200 ng/mL的ENR标准溶液分别过柱,每个浓度两个平行,用HPLC法对柱子回收率进行测定,评价该IAC柱与柱之间的重复性结果见表1。
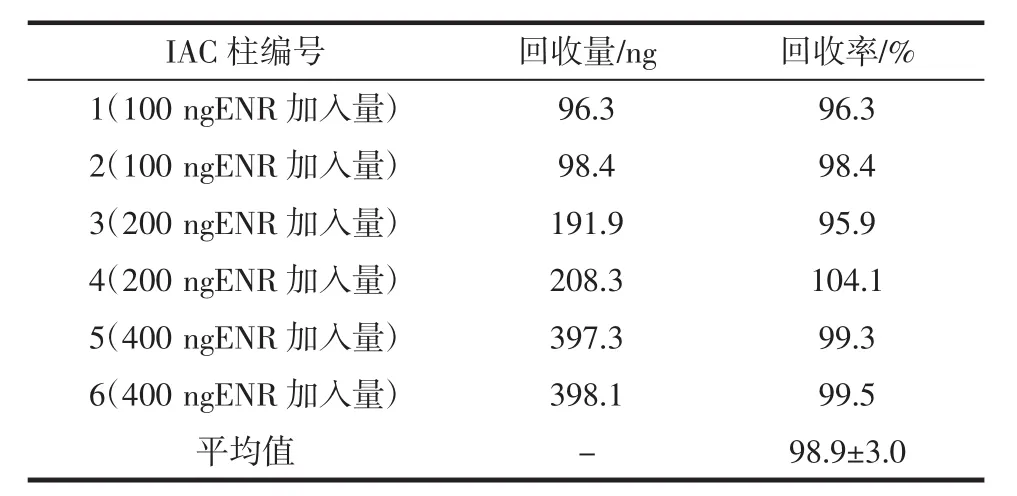
表1 IAC柱之间的重复性Table 1 Column-to-column variation of IACs
如表1所示,IAC柱的平均回收率为98.9%,柱与柱之间的变异系数为3.0%,说明IAC柱之间重复性良好。
2.3 IAC的应用评价
将所制备的IAC柱与HPLC法结合,在实际样品牛奶中进行加标回收的测定,过柱后ENR的回收率测定结果如表2所示。
由表2可知,其中牛奶样品分别加标5、10 ng/mL,加标总量分别为25 ng和50 ng时,其回收率分别为96.5%~99.8%、96.6%~99.6%,RSD值分别为1.9%和1.7%。
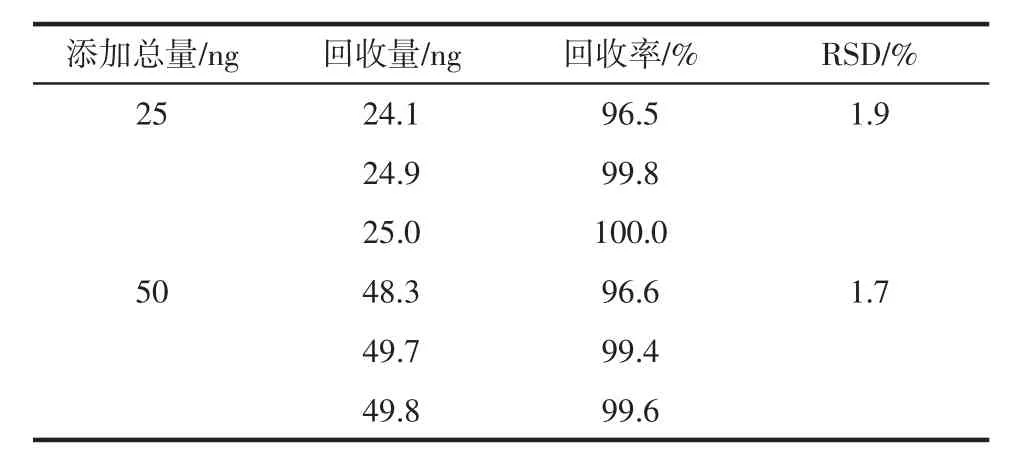
表2 牛奶样品中的加标回收Table 2 Recoveries of ENR from milk and relative standard deviation(RSD)
3 结论
制备获得了ENR多克隆抗体免疫亲和柱,并对其配合HPLC分析在实际样品中ENR残留检测的应用前景进行了评价。动物免疫获得的ENR多抗的IC50值5.47 ng/mL,具有较高的亲和性和特异性;抗体与Sepharose4B共价偶联获得的IAC柱的柱容量为2.54μg ENR/mL凝胶;IAC柱的平均回收率为98.9%,柱与柱之间的变异系数为3.0%,IAC柱与柱之间重复性良好;牛奶中ENR添加总量为5 ng和10 ng/mL时,加标回收率分别为96.5%~99.8%、96.6%~99.6%。
[1] 朱模忠.兽药手册[M].北京:化学工业出版社,2002:103-104
[2] Gore S R,Harms C A,Kukanich B,et al.Enrofloxacin pharmacokinetics in the European cuttlefish,Sepia officinalis,after a single i.v.injection and bath administration[J].Journal of Veterinary Pharmacology&Therapeutics,2005,28(5):433-439
[3]Aral F,Karacal F,Bab F.The effect of enrofloxacin on sperm quality in male mice[J].Research in Veterinary Science,2008,84(1):95-99
[4] 杨娜娜,王庚南,刘静,等.高效液相色谱测定鸡蛋中4种喹诺酮类药物[J].河北农业大学学报,2014,37(6):101-105
[5] 梁君妮,刘宁,曹鹏,等.HPLC-MS/MS测定饲料中16种氟喹诺酮类药物残留量[J].食品研究与开发,2013,34(22):39-42
[6] 吴小莲,向垒,莫测辉,等.超高效液相色谱-电喷雾串联质谱测定蔬菜中喹诺酮类抗生素[J].分析化学,2013,41(6):876-881
[7] 周梅仙,周业飞,刘文琪,等.高效毛细管电泳法分离检测鸡蛋中3种喹诺酮类抗菌药[J].西北农业学报,2013,22(3):38-43
[8] 徐燕,王云,张勋,等.去氢甲睾酮多克隆抗体免疫亲和柱制备研究[J].中国食品学报,2011,11(7):195-199
[9] 宋洁,赵笑天,潘亚利,等.免疫亲和净化-超高效液相色谱法同时测定猪肉和牛奶中的12种磺胺类药物[J].食品科技,2013,38(3):319-323
[10]郝莉花,陈复生.免疫亲和柱净化-UPLC-MS/MS测定花生中黄曲霉毒素B1[J].食品工业,2017,38(1):269-272
Preparation of Immunoaffinity Column and Its Application in Sample Cleanup for Enrofloxacin Residues Detection
ZHU Xin-sheng1,QIANG Min1,LU Yuan1,WANG Wei-gang1,NIU Rui2,WANG Yun2
(1.Zhenjiang Products Quality Supervision and Inspection Center,Zhenjiang 212132,Jiangsu,China;2.School of Food and Biological Engineering,Jiangsu University,Zhenjiang 212013,Jiangsu,China)
The production of polyclonal antibody (pAb)against enrofloxacin (ENR),the preparation of immunoaffinity column(IAC)and its potential application to the selective extraction of ENR residues from actual samples were described.The produced pAb exhibited good sensitivity to ENR with antiserum titre of 1.28×105and IC50value of 5.47 ng/mL.By coupling the produced antibody with CNBr-activated Sepharose 4B,an IAC was prepared.The maximum capacity of the column for ENR was approximately 2.54 g/mL gel.The average recovery of ENR standard solutions from IACs was 98.9%with the relative standard deviation(RSD)among columns of 3.0%.The IACs were then challenged with ENR-fortified milk samples,recoveries of ENR were found to be in the range of 96.5%-99.8%.
enrofloxacin;polyclonal antibody;immunoaffinity chromatography
10.3969/j.issn.1005-6521.2017.22.028
国家科技支撑计划(2015BAK45B00);镇江市农业科技支撑计划(NY2014024)
朱新生(1966—),男(汉),高级工程师,本科,主要从事食品安全检测研究。
2017-07-11
欢迎订阅2018年《食品研究与开发》
《食品研究与开发》是由天津市食品研究所有限公司和天津市食品工业生产力促进中心主办,国内外公开发行的食品专业科技期刊,1980年创刊,半月刊,采用国际流行开本大16开。其专业突出,内容丰富,印刷精美,是一本既有基础理论研究,又包括实用技术的刊物。本刊已被“万方数据库”、“中文科技期刊数据库”、《乌利希期刊指南》、美国《化学文摘》、英国国际农业与生物科学研究中心(CABI)、英国《食品科技文摘》(FSTA)等知名媒体收录,并被列入“中文核心期刊”、“中国科技核心期刊”、RCCSE中国核心学术期刊(A)。主要栏目有:基础研究、分离提取、研发与工艺、标准与检测、生物工程、营养保健、贮藏保鲜、质量安全、专题论述、食品机械等。
本刊国内统一刊号CN 12-1231/TS;国际刊号ISSN 1005-6521;邮发代号:6-197。全国各地邮局及本编辑部均可订阅。从本编辑部订阅全年刊物享八折优惠。2018年定价:30元/册,全年720元。
本编辑部常年办理邮购,订阅办法如下:
(1)邮局汇款。地址:天津市静海县静海经济开发区南区科技路9号;收款人:《食品研究与开发》编辑部;邮政编码:301600。
(2)银行汇款。开户银行:工商银行静海支行
账号:0302095119300204171;单位:天津市食品研究所有限公司。
《食品研究与开发》编辑部
www.tjfrad.com.cn
E-mail:tjfood@vip.163.com
电话(传真):022-59525671
