鄱阳湖湿地土壤酶及微生物生物量的剖面分布特征
2017-11-10于昊天黄时豪刘亚军寇文伯刘以珍
于昊天, 黄时豪, 刘亚军, 寇文伯, 刘以珍, 吴 兰*
1.南昌大学生命科学学院, 江西 南昌 330031 2.鄱阳湖环境与资源利用教育部重点实验室, 江西 南昌 330031
鄱阳湖湿地土壤酶及微生物生物量的剖面分布特征
于昊天1,2, 黄时豪1,2, 刘亚军1,2, 寇文伯1,2, 刘以珍1,2, 吴 兰1,2*
1.南昌大学生命科学学院, 江西 南昌 330031 2.鄱阳湖环境与资源利用教育部重点实验室, 江西 南昌 330031
为探明淡水沼泽湿地土壤微生物功能活性随土壤剖面深度的变化,以鄱阳湖区内典型的苔草湿地土壤为研究对象,选择剖面深度为1 m共5层(0~20、>20~40、>40~60、>60~80、>80~100 cm)的土壤,对土壤酶〔Bglu(β-葡萄糖苷酶)、NAG(乙酰氨基葡萄糖苷酶)、Bxyl(β-木糖苷酶)、Phos(酸性磷酸酶)、Phox(酚氧化酶)、Pero(过氧化物酶)〕活性、w(MBC)(微生物生物量碳含量)和w(MBN)(微生物生物量氮含量)及土壤理化性质进行研究. 结果表明,代表微生物功能活性的土壤酶和w(MBC)、w(MBN) 均随着剖面深度的增加而逐渐降低,表层(0~20 cm)土壤中的酶活性和w(MBC)、w(MBN)均显著高于深层土壤. 值得注意的是,不同土壤酶活性随着剖面深度的变化规律不一,但总体酶活性在土壤深度为>40~60 cm时达到稳定,并且仍都具有较高活性;表层土壤中w(MBC)为65.58~161.90 mgkg,w(MBN)为7.39~16.28 mgkg,二者占所研究剖面土壤总微生物碳氮含量的51%~69%. 进一步的相关性分析发现,土壤微生物功能特性与有机质AFDM(去灰分干重)、w(TOC)、w(TN)、含水量及pH存在显著的相关性,其中土壤w(TOC)、w(TN)是影响鄱阳湖湿地土壤微生物数量和活性的最主要因素. 研究显示,土壤深度对湿地土壤微生物功能特性及土壤性质具有显著影响,表层土壤中微生物功能活性最高,但湿地深层土壤中仍存在大量的微生物,由微生物参与的代谢活动仍然活跃,深层土壤微生物功能特性不容忽视.
天然湿地; 剖面土壤; 微生物生物量; 土壤酶; 微生物功能
湿地是处于陆地和水域之间的过渡带生态系统,其特殊的生态位置和独特的生态特征,使得湿地成为营养物质的重要汇集地之一[1]. 湿地土壤作为湿地生态系统的重要组成成分,承载着大量的碳、氮、磷等营养物质,为区域生态系统物质循环和能量转换提供原料和动力[2].
土壤酶活性可表征微生物存储和转化有机质及营养元素等功能活性的强弱,其中Bglu(β-葡萄糖苷酶)和Bxyl(β-木糖苷酶)能够水解土壤中的纤维素、木聚糖等多糖类物质,为微生物提供充足的碳源,是土壤碳循环的重要参与者[3-4];NAG(乙酰氨基葡萄糖苷酶)参与氨基酸类物质的降解,是微生物获取氮源的方式之一,参与土壤中碳、氮元素的转化[5];Phos(酸性磷酸酶)能够促进土壤中有机磷化合物的水解,其活性反应土壤供应有效磷的潜在能力[6];Phox(酚氧化酶)、Pero(过氧化物酶)主要参与土壤中的氧化还原反应,控制土壤有机质的分解[7]. 关于土壤酶活性和微生物生物量的研究,大多集中于森林生态系统和农田生态系统,对于天然淡水沼泽湿地生态系统的研究还相对较少,并且现有的研究多集中于表层土壤. 然而随着研究的深入,已有研究结果表明,表层(0~20 cm)土壤中,微生物的平均含量只占土壤总微生物量的1/3左右[8];Jobbagy等的研究也表明,深层土壤中碳的储存量大约占土壤中碳总储存量的50%左右[9],由此推测,土壤深层剖面中的微生物及其参与的营养元素代谢循环过程不容忽视.
该研究选取我国最大的天然淡水沼泽湿地——鄱阳湖湿地1 m深土壤剖面为研究对象,对其理化性质、土壤酶活性、微生物生物量进行比较,分析鄱阳湖湿地土壤中尤其是沿土壤剖面深度的微生物特性及土壤性质的变化,以期了解湿地土壤剖面深度对土壤生态系统结构、功能与过程的影响,为研究鄱阳湖生态系统生物地球化学循环尤其是为微生物群落对地下生态系统过程的影响、适应提供基础研究资料.
1 研究方法
1.1研究区概况
鄱阳湖是长江流域最大的通江、淡水湖泊,湖区湿地面积约 2 700 km2,生物资源丰富[10],受亚热带季风气候的影响,湖区内季节性水位变化明显,年均降水量在1 400~1 900 mm,年均气温17 ℃且日照充足. 鄱阳湖湿地周期性的水位变化和地面的干湿交替,使得湿生植物成为湖区湿地最主要的植被类型[11]. 灰化苔草(Carexcinerascens)是湖区湿地内分布最广、面积最大的湿生植物,面积达9.6×104hm2,占鄱阳湖水面积的28.8%,对鄱阳湖生态系统中营养元素的储存和转化起到非常重要的作用[12]. 因此该研究选取灰化苔草湿地剖面土壤作为研究对象.
1.2样地设置与样品采集
所设样地分别位于蚌湖(BH,29°05′55″N、115°59′08″E)、常湖池(CHC,29°06′14″N、115°58′47″E)、南矶山(NJS,28°56′58″N、116°20′17″E),样地间相距1~30 km,样地跨度大,样地土壤类型为草甸土. 在每个样地内部设置3个平行样方,相邻样方相距100 m. 每个样方面积为2 m×2 m,样方深度为1 m,根据土壤发生理论,并结合以往的分析研究方法,将剖面土壤分为5层(0~20、>20~40、>40~60、>60~80、>80~100 cm),每层采用五点采样法,并将其土壤混合作为1个样品,最后共有45个样品. 将采集好的土壤样品装袋低温运回实验室进行分装和预处理. 测定微生物生物量的鲜土保存于4 ℃冷库;测定土壤酶活性的样品保存于-80 ℃ 冰箱. 其余土壤自然风干后研磨,过0.3 mm筛,用于理化性质的测定.
1.3分析方法
土壤含水量采用恒重法测定;pH采用电位计法测定(水土比为3∶1);w(TP)采用矾钼黄分光光度法测定;w(TN)采用微量凯氏定氮法测定;w(TOC)采用重铬酸钾容量法测定;w(NO3--N)和w(NH4+-N)分别采用镀铜镉-重氮化偶合比色法和全自动流动分析仪法测定;用AFDM(去灰分干重)表征土壤有机质含量,测定方法为500 ℃马弗炉灼烧法[13].
土壤w(MBC)(微生物生物量碳含量)和w(MBN)(微生物生物量氮含量)的测定采用氯仿熏蒸-K2SO4浸提法[14]. Bglu、NAG、Bxyl和Phos四种水解酶活性和Phox、Pero两种氧化酶活性的测定方法:称取1 g土壤样品与125 mL乙酸钠缓冲液(50 mmolL)搅拌混合,25 ℃恒温培养2 h,4种水解酶采用微孔板荧光法[15],测定的激发光波长为365 nm,发射光波长为450 nm;两种氧化酶分别以左旋多巴(DOPA)和加DOPA的过氧化氢(H2O2)作为底物,用比色法进行活性的测定[18],测定的波长为450 nm. 酶活性单位为10-9mol(h·g)(以干土质量计).
数据分析在SPSS 22.0软件中完成,采用基于Tukey检验的方差分析法对土壤基本理化性质、微生物生物量和土壤酶活性的差异性进行统计分析,α=0.05. 同时对微生物功能特性和土壤性质进行相关性分析(基于Pearson相关系数).
2 结果与讨论
2.1湿地土壤理化性质
所测定的九项土壤理化参数结果如表1所示. 总体看来,含水量、w(TP)、w(NH4+-N)、w(NO3--N)在深度剖面上无显著差异(P>0.05). AFDM、w(TOC)、w(TN)随土壤深度的增加而逐渐降低,并且表层(0~20 cm)土壤与其他深层土壤之间存在显著的差异性(P<0.05). 表层土壤的AFDM、w(TOC)、w(TN)最高,分别占所研究整个剖面的22.7%、36.8%和28.8%,其最低值一般出现在>40~80 cm的土壤深度范围内. 在w(TOC)、w(TN)都随深度的增加而降低的情况下,C/N下降反映出w(TOC)下降更为明显.
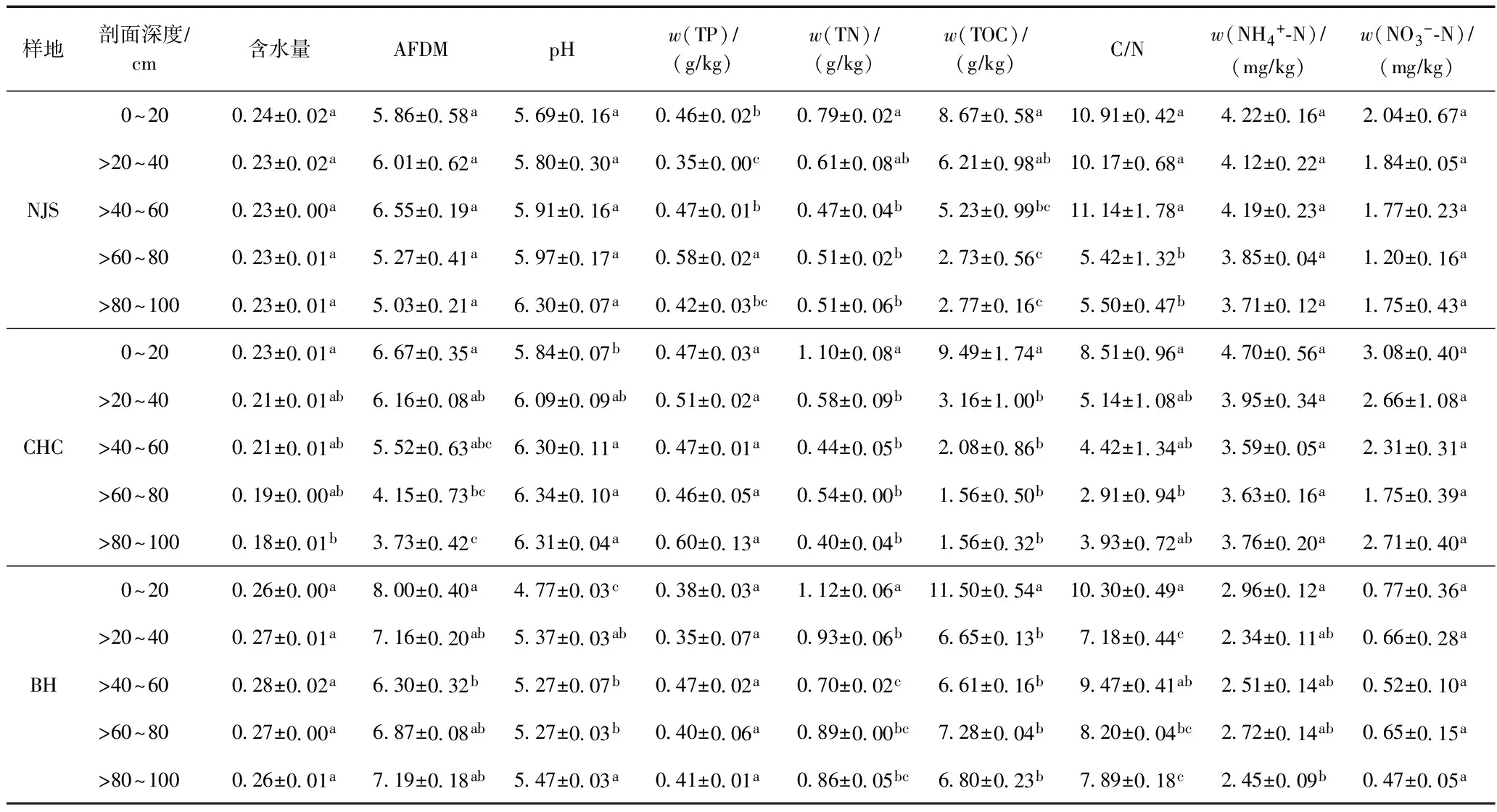
表1 鄱阳湖沿土壤剖面分布的理化性质
注:同一列不同小写字母表示不同样地内部差异显著(P<0.05);样品总数n=45.
2.2湿地土壤微生物生物量
随土壤剖面深度的增加,湿地土壤w(MBC)和w(MBN)显著降低(P<0.05),且表层土壤w(MBC)和w(MBN)分别占所研究整个剖面的57.1%~69.0%和51.1%~61.5%(见图1). 值得注意的是,当剖面土壤深度范围为>40~100 cm时,土壤中w(MBC)和w(MBN)最低且基本趋于稳定,占剖面土壤总量的13.8%~26.4%和14.7%~21.5%.
2.3湿地土壤酶活性
由表2可见,鄱阳湖湿地土壤中Phos活性最高,其次是NAG活性,Pero活性和Phox活性最低,所测定的6种土壤酶的活性在表层土壤显著高于其他深层土壤(P<0.05). Bglu活性在表层土壤中最高,占剖面土壤总Bglu活性的82.0%(NJS)、60.9%(CHC)和56.8%(BH),且随着土壤剖面深度的增加,土壤酶活性逐渐降低,土壤深度大于40 cm时Bglu活性开始出现最低值,并且逐渐趋于稳定〔见图2(A)〕. 表层土壤中Bxyl活性占剖面土壤总Bxyl活性的61.6%~79.5%,同样随着深度的增加其活性逐渐降低〔见图2(B)〕. NAG活性在表层土壤中的活性占剖面土壤总NAG活性的58.9%~66.4%,在NJS和BH样地其活性最低值出现在>60~80cm处;而在CHC样地,其他深度土壤中NAG活性无差异〔见图2(C)〕. Phos活性在NJS和CHC样地表层土壤中的活性占剖面土壤总活性的57.1%和44.0%,除表层外,>40~60 cm层土壤中Phos的活性显著高于其他深层土壤,而在BH样地,Phos活性有明显的分层现象,表层活性最高,占剖面土壤总Phos活性的53.3%,>20~40 cm次之,>40~100 cm活性最低〔见图2(D)〕. Phox活性在3个样地表层土壤中的活性占剖面土壤总Phox活性的33.0%~41.2%,但其活性并未随着土壤深度的增加而降低,>20~40cm和>60~80cm两层活性最低〔见图2(E)〕. Pero活性在NJS样地和CHC样地表现一致,表层土壤中其活性最高,占剖面土壤总Pero活性的37.2%和40.0%,>20~40 cm层Pero活性最低;BH样地的Pero活性同样有明显的分层现象(P<0.05),表层土壤中其活性最高,占剖面土壤总Pero活性的49.9%,其次是>40~80 cm,其他层次土壤Pero活性最低〔见图2(F)〕.
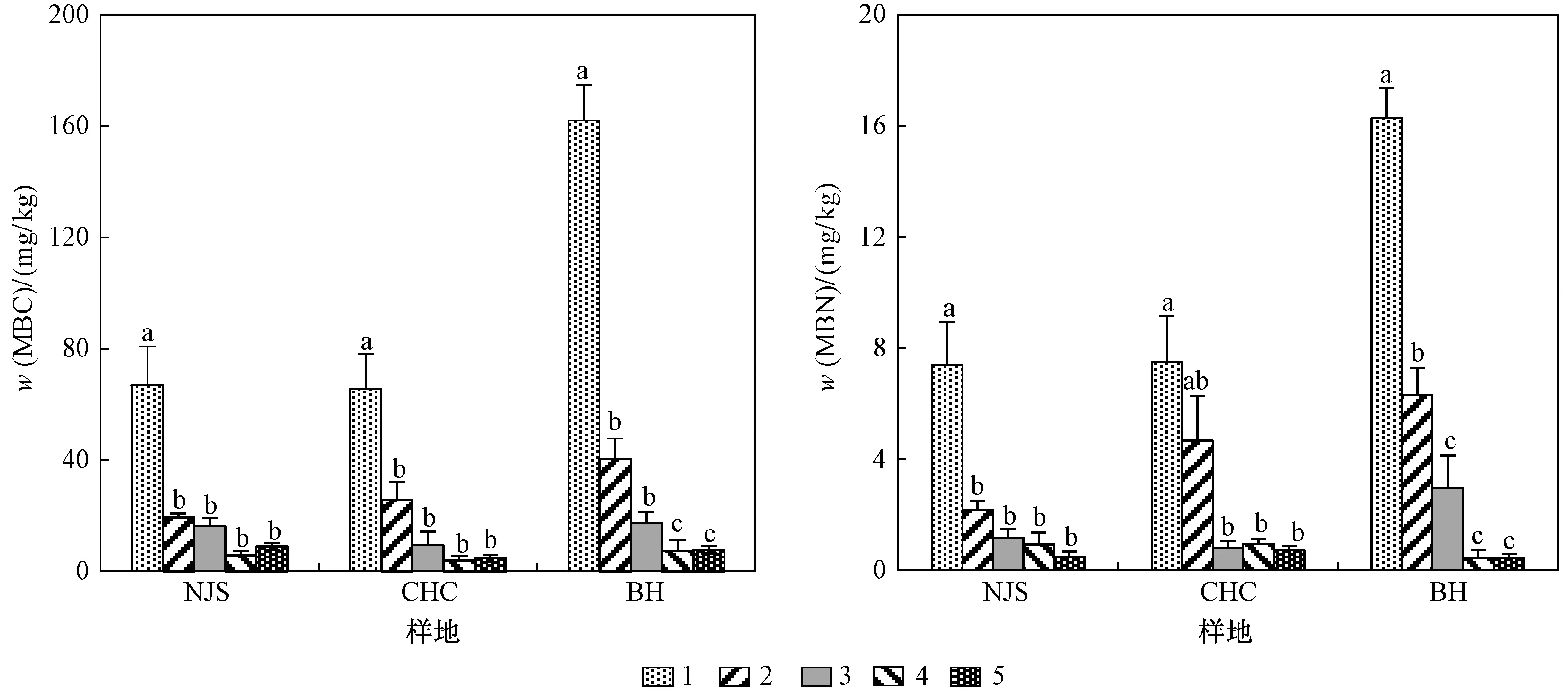
土壤剖面深度cm: 1—0~20; 2—>20~40; 3—>40~60; 4—>60~80; 5—>80~100.注:不同小写字母表示不同样地内部差异显著(P<0.05);样品总数n=45.图1 不同样地土壤剖面微生物生物量Fig.1 Microbial biomass in soil profile of sampling sites in the Poyang Lake wetland
表2 鄱阳湖湿地土壤剖面土壤酶活性
Table 2 Soil enzyme activities in soil profile in the Poyang Lake wetland 10-9 mol(h·g)
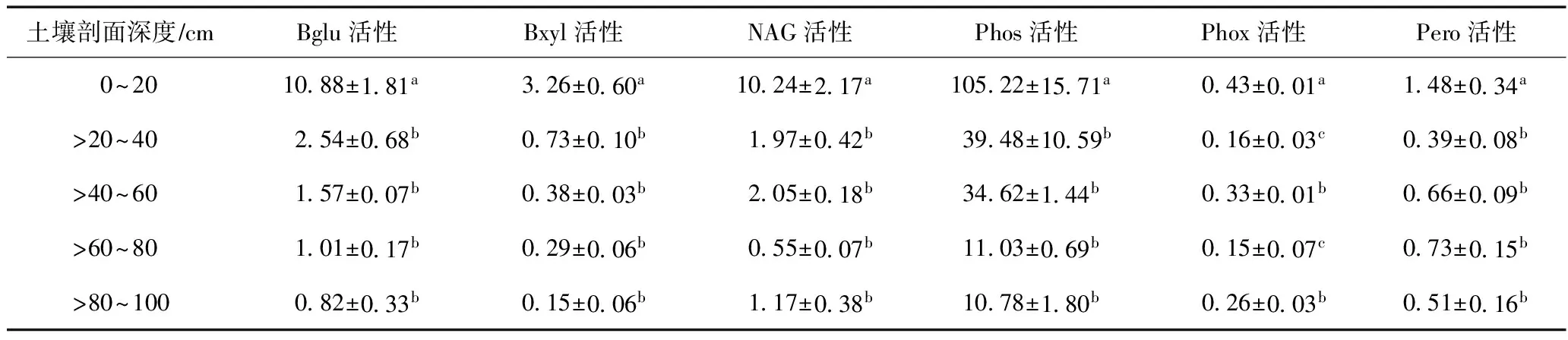
表2 鄱阳湖湿地土壤剖面土壤酶活性
土壤剖面深度∕cmBglu活性Bxyl活性NAG活性Phos活性Phox活性Pero活性0~201088±181a326±060a1024±217a10522±1571a043±001a148±034a>20~40254±068b073±010b197±042b3948±1059b016±003c039±008b>40~60157±007b038±003b205±018b3462±144b033±001b066±009b>60~80101±017b029±006b055±007b1103±069b015±007c073±015b>80~100082±033b015±006b117±038b1078±180b026±003b051±016b
注:表中同一列不同小写字母表示差异显著(P<0.05);样品总数n=45.
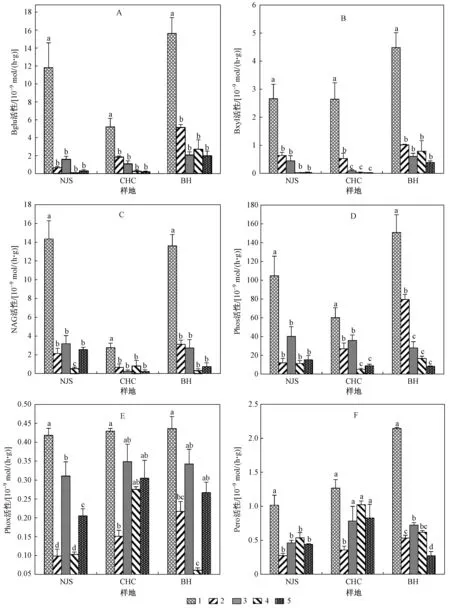
土壤剖面深度cm: 1—0~20; 2—>20~40; 3—>40~60; 4—>60~80; 5—>80~100.注:不同小写字母表示不同样地内部差异显著(P<0.05);样品总数n=45.图2 鄱阳湖湿地不同样地土壤剖面土壤酶活性Fig.2 Soil enzyme activities in soil profile of sampling sites in the Poyang Lake wetland
2.4土壤微生物功能特性与环境因子的相关性
为进一步了解鄱阳湖湿地土壤微生物功能特性与土壤理化性质之间的关系,将w(MBC)和w(MBN)、土壤酶活性与理化性质进行相关性分析(见表3),结果显示,所测定的w(MBC)、w(MBN)和4种水解酶(Bglu、Bxyl、NAG、Phos)的活性均与pH呈显著负相关(P<0.05),与土壤AFDM、w(TN)、w(TOC)和CN呈显著正相关(P<0.05),并与含水量呈显著正相关(除NAG酶活性外)(P<0.05). Phox活性和Pero活性仅与w(TOC)、w(TN)呈显著相关(P<0.05),Pero活性还与pH存在显著的负相关关系. 从相关性系数来看,微生物特性与w(TOC)、w(TN)的相关性系数较大,表明w(TOC)和w(TN)是影响土壤微生物数量和活性的最主要因素. 进一步分析发现(见表4),w(MBC)、w(MBN)均与土壤土壤酶活性之间呈极显著相关(P<0.01),且6种土壤酶之间的相关性也极为显著(P<0.01).
2.5讨论
该研究中,随着土壤深度的增加,w(MBC)和w(MBN)显著降低,表明土壤深度显著影响着土壤微生物的生长繁殖. 其中表层土壤微生物生物量占总研究剖面的51.1%~69.0%,提示鄱阳湖湿地的0~20 cm土壤中,大量的植物根系和动植物残体使其具有丰富的有机质储量和充足的营养元素可供微生物利用,并且表层土壤结构、孔隙度、通气性等物理性状也都有利于微生物的生长[18]. 在>20~100 cm的深层湿地土壤中,w(MBC)和w(MBN)也达到了31.0%~48.9%,揭示湿地深层土壤中也存在大量的微生物. 进一步分析发现鄱阳湖湿地土壤CN介于2.9~10.9之间,而Kaye等的研究结果指出,土壤CN 低于20~30时,微生物生物量可能受到有机碳含量的限制[19],由此可以推断鄱阳湖湿地土壤微生物生物量主要受到w(TOC)的限制.
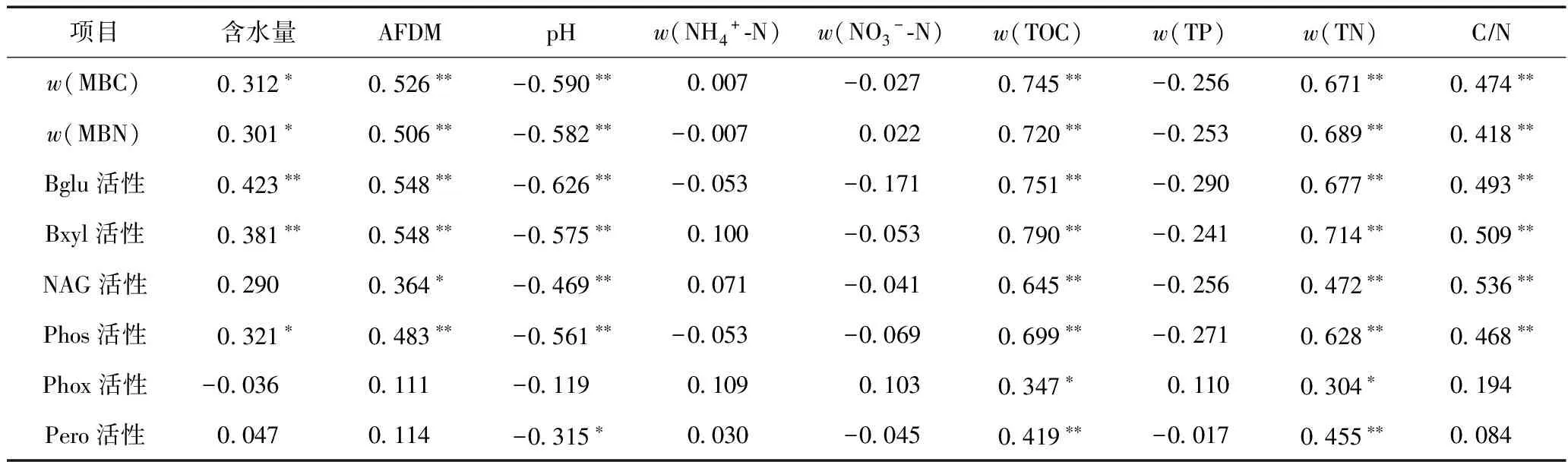
表3 微生物功能特性与土壤环境因子的相关性分析
注:*表示显著相关(P<0.05);** 表示极显著相关(P<0.01);样品总数n=45.
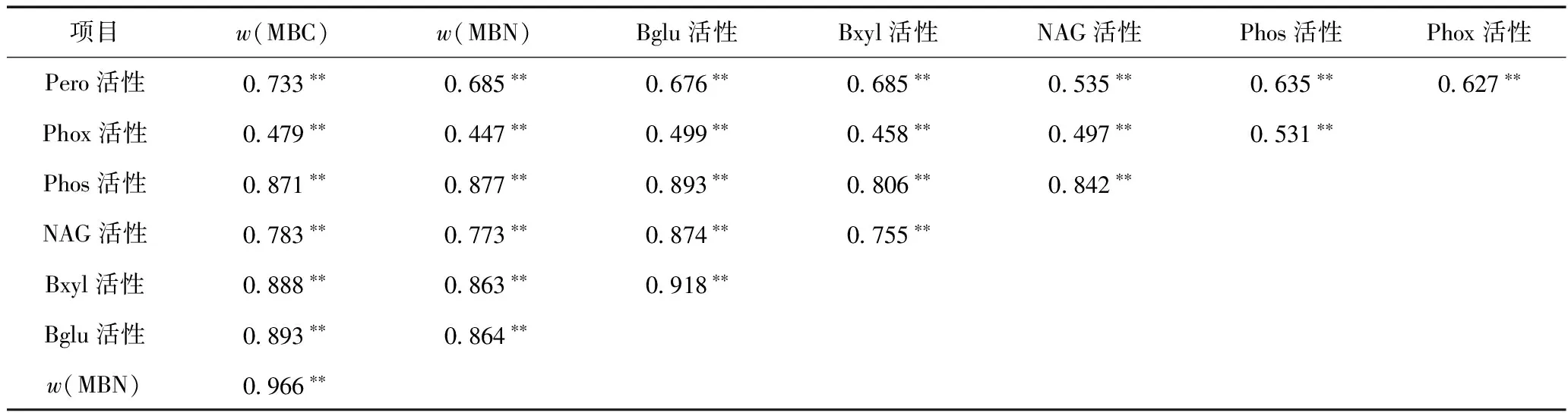
表4 微生物功能特性的相关性分析
注:*表示显著相关(P<0.05);** 表示极显著相关(P<0.01);样品总数n=45.
鄱阳湖湿地沿垂直剖面分布的土壤酶活性、w(MBC)和w(MBN)的变化规律相一致. 4种水解酶(Bglu、Bxyl、NAG、Phos)活性随土壤剖面深度的增加显著降低,表明土壤深度对微生物代谢功能活性有显著的影响. 尽管深层土壤中酶活性降低,但是在>80~100 cm土层中仍然可以检测到较高的土壤酶活性,这一结果提示在鄱阳湖湿地深层土壤中,微生物的代谢能力不容忽视,由微生物参与主导的糖类及纤维素类化合物的分解和碳、氮、磷等营养元素的循环过程仍然活跃. 值得注意的是,Senga等对日本北海道钏路湿地土壤微生物功能活性随深度剖面的变化研究发现,随着土壤深度的增加,参与营养元素水解的土壤酶活性会出现显著的回升[20],但是在笔者研究中4种水解酶的活性在土壤深度大于60 cm或80 cm时趋于稳定,微生物代谢功能变化不明显. 由此表明,不同的湿地生态系统,其水文、气候、土壤性质的不同以及深层土壤的发育与演替状况等因素的差异,都将影响到微生物分解代谢有机质的能力. 与此同时,笔者也发现了不同土壤酶活性在不同样地随土壤深度的变化趋势也不尽相同,土壤酶活性在样地间同样存在差异,这一现象在未来的研究中应予以关注并设计试验加以验证.
作为具有氧化还原能力的土壤酶,Phox主要通过降解和矿化作用来限制土壤有机质分解和腐殖质的形成[21];Pero能够将过氧化氢和酚类物质氧化还原成水和醌,减少其对活细胞的毒害[22],已有研究[23-25]表明Phox活性和Pero活性随深度变化的规律不一致. 该研究中表层土壤的Phox活性和Pero活性显著高于深层土壤,但是深层土壤(>20~100 cm)中Phox和Pero的活性在剖面土壤总量中所占比例均超过60%,表明在鄱阳湖湿地深层土壤中,有机质的积累速率受到抑制[17],这将会作为生态系统中反馈机制的信号,作用于土壤中的物质循环过程[21],从而影响到深层土壤中微生物的活性和其他代谢功能. 但是目前对于土壤中Phox活性和Pero活性的研究还相对较少,涵盖的土壤类型更是有限,其与环境因子及微生物功能的复杂作用机理还需要进一步的试验去验证.
值得注意的是,表层土壤中与碳氮代谢有关的土壤酶活性占到了剖面总体酶活性的23以上,而表层土壤中的AFDM、w(TOC)和w(TN)只占到了所研究剖面总有机物质含量的13左右. 同时,相关性研究进一步发现,湿地土壤微生物功能特性除受有机质及营养元素影响外,大部分还受到含水量和pH的显著影响[26-27],这也是造成表层土壤微生物功能活性远高于有机质储备量的原因. 具体而言,随着土壤深度的增加,土壤孔隙度会逐渐减少,限制了深层土壤微生物的正常活动,导致功能活性的急剧下降[28]. 此外,随土壤深度的增加pH逐渐升高,pH的升高影响有机物质的生物降解和矿化,从而直接影响土壤酶参与物质代谢循环的速度[29],而深层土壤的温度和水分的变化也是影响土壤酶活性随深度变化明显的因素之一[30].
土壤酶活性与微生物生物量之间的显著相关性以及6种土壤酶活性之间的显著相关性都表明,土壤微生物功能特性之间存在相互促进作用,并且在促进物质循环和能量转化的过程中,不同的微生物代谢活性物质不仅具有各自的专性,同时还具有协同作用.
4 结论
a) 鄱阳湖湿地土壤AFDM、w(TOC)和w(TN)随剖面深度的增加而显著降低,所测定的其他理化参数不随剖面深度的改变而变化.
b) 鄱阳湖湿地土壤微生物功能包括所测定的微生物生物量和6种土壤酶活性受到土壤深度的显著影响,表层(0~20 cm)土壤微生物活性和代谢功能最高,>40~60 cm层达到稳定. 但深层土壤中仍然进行着由微生物参与的复杂代谢活动.
c) 土壤微生物功能特性与AFDM、w(TOC)、w(TN) 和含水量及pH均呈显著相关,但土壤w(TOC)、w(TN)和pH是影响土壤微生物数量和活性的最主要因素.
[1] 张仲胜,吕宪国,薛振山,等.中国湿地土壤碳氮磷生态化学 计量学特征研究[J].土壤学报,2016,53(5):1160-1169.
ZHANG Zhongsheng,LV Xiangguo,XUE Zhenshan,etal.Is there a redfield-type C∶N∶P ratio in Chinese wetland soils?[J].Acta Pedologica Sinica,2016,53(5):1160-1169.
[2] 王晓龙,徐立刚,姚鑫,等.鄱阳湖典型湿地植物群落土壤微生物量特征[J].生态学报,2010,30(18):5033-5042.
WANG Xiaolong,XU Ligang,YAO Xin,etal.Analysis on the soil microbial biomass in typical hygrophilous vegetation of Poyang Lake[J].Acta Ecologica Sinica,2010,30(18):5033-5042.
[3] CALDWELL B A.Enzyme activities as a component of soil biodiversity:a review[J].Pedobiologia,2005,49(6):637-644.
[4] 陆坚,杜丽琴,庞浩,等.高糖土壤微生物宏基因组文库的构建及β-葡萄糖苷酶基因鉴定[J].基因组学与应用生物学,2013,32(1):30-35.
LU Jian,DU Liqin,PANG Hao,etal.Construction of metagenomic library of microbes from sugar enriching soil and identification ofβ-glucosidase genes[J].Genomics and Applied Biology,2013,32(1):30-35.
[5] PARHAM J A,DENG S P.Detection,quantification and characterization ofβ-glucosaminidase activity in soil[J].Soil Biology and Biochemistry,2000,32(8):1183-1190.
[6] 李莹飞,耿玉清,周红娟,等.基于不同方法测定土壤酸性磷酸酶活性的比较[J].中国生态农业学报,2016(1):98-104.
LI Yingfei,GENG Yuqing,ZHOU Hongjuan,etal.Comparison of soil acid phosphatase activity determined by different methods[J].Chinese Journal of Eco-Agriculture,2016(1):98-104.
[7] SINSABAUGH R L.Phenol oxidase,peroxidase and organic matter dynamics of soil[J].Soil Biology and Biochemistry,2010,42(3):391-404.
[8] FIERER N,SCHIMEL J P,HOLDEN P A.Variations in microbial community composition through two soil depth profiles[J].Soil Biology and Biochemistry,2003,35(1):167-176.
[9] JOBBAGY E G,JACKSON R B.The vertical distribution of soil organic carbon and its relation to climate and vegetation[J].Ecological Applications,2000,10(2):423-436.
[10] 胡维,葛刚,熊勇,等.鄱阳湖南矶山湿地土壤养分的时空分布规律研究[J].农业环境科学学报,2012,31(9):1785-1790.
HU Wei,GE Gang,XIONG Yong,etal.Temporal and spatial patterns of soil nutrients in the wetland of Nanjishan (Poyang Lake),China[J].Journal of Agro-Environment Science,2012,31(9):1785-1790.
[11] 聂兰琴,吴琴,尧波,等.鄱阳湖湿地优势植物叶片-凋落物-土壤碳氮磷化学计量特征[J].生态学报,2016,36(7):1898-1906.
NIE Lanqin,WU Qin,RAO Bo,etal.Leaf litter and soil carbon,nitrogen,and phosphorus stoichiometry of dominant plant species in the Poyang Lake wetland[J].Acta Ecologica Sinica,2016,36(7):1898-1906.
[12] 胡豆豆,欧阳克蕙,戴征煌,等.鄱阳湖湿地灰化苔草草甸群落特征及多样性[J].草业科学,2013,30(6):844-848.
HU Doudou,OUYANG Kehui,DAI Zhenghuang,etal.Investigation on community characteristics andα-diversity ofCarexcinerascensmeadow steppe in Poyang Lake wetland[J].Pratacultural Science,2013,30(6):844-848.
[13] 刘亚军,吴娟,邹锋,等.鄱阳湖湿地灰化薹草洲滩土壤微生物和酶特性对水分梯度的响应[J].湿地科学,2017,15(2):269-275.
LIU Yajun,WU Juan,ZOU Feng,etal.Response of properties of soil microbes and enzymes in beach covered byCarexcinerascensin Poyang Lake wetlands to moisture gradient[J].Wetland Science,2017,15(2):269-275.
[14] 杨桂生,宋长春,王丽,等.水位梯度对小叶章湿地土壤微生物活性的影响[J].环境科学,2010,31(2):444-449.
YANG Guisheng,SONG Changchun,WANG Li,etal.Influence of water level gradient on marsh soil microbial activity ofCalamagrostisangustifolia[J].Environmental Science,2010,31(2):444-449.
[15] MARX M C,WOOD M,JARVIS S C.A microplate fluorimetric assay for the study of enzyme diversity in soils[J].Soil Biology and Biochemistry,2001,33(12):1633-1640.
[16] CARREIRO M M,SINSABAUGH R L,REPERT D A,etal.Microbial enzyme shifts explain litter decay responses to simulated nitrogen deposition[J].Ecology,2000,81(9):2359-2365.
[17] 徐惠风,刘兴土,白军红.长白山沟谷湿地乌拉苔草沼泽湿地土壤微生物动态及环境效应研究[J].水土保持学报,2004,18(3):115-122.
XU Huifeng,LIU Xingtu,BAI Junhong.Study on the dynamics and environmental effects of soil microorganism inCarexmarsh wetland in Changbai Mountain Valley wetland[J].Journal of Soil Water Conservation,2004,18(3):115-122.
[18] 盛浩,周萍,袁红,等.亚热带不同稻田土壤微生物生物量碳的剖面分布特征[J].环境科学,2013,34(4):1576-1582.
SHENG Hao,ZHOU Ping,YUAN Hong,etal.Profile of soil microbial biomass carbon in different types of subtropical paddy soils[J].Environmental Science,2013,34(4):1576-1582.
[19] KAYE J P,HART S C.Competition for nitrogen between plants and soil microorganisms[J].Trends in Ecology & Evolution,1997,12(4):139-143.
[20] SENGA Y,HIROKI M,TERUI S,etal.Variation in microbial function through soil depth profiles in the Kushiro Wetland,northeastern Hokkaido,Japan[J].Ecological Research,2015,30(4):563-572.
[21] SINABAUGH R L.Phenol oxidase,peroxidase and organic matter dynamics of soil[J].Soil Biology and Biochemistry,2010,42(3):391-404.
[22] 关松荫.土壤酶及其研究法[M].北京:农业出版社,1986:274-323.
[23] 尤一泓.沿海沙地木麻黄,湿地松土壤酶活性及其与土壤养分关系的研究[D].福州:福建农林大学,2013.
[24] 陈立明,满秀玲.云冷杉林土壤酶活性与土壤养分的研究[J].中国水土保持科学,2009,7(4):94-99.
CHEN Liming,MAN Xiuling.Study on soil enzyme activities and soil nutrients in spruce fir forest[J].Science of Soil and Water Conservation,2009,7(4):94-99.
[25] 邱莉萍,刘军,王益权,等.长期施肥土壤中酶活性的剖面分布及其动力学特征研究[J].植物营养与肥料学报,2005,11(6):737-741.
QIU Liping,LIU Jun,WANG Yiquan,etal.Study on the profile distribution and kinetic characteristics of enzyme activity in long-term fertilization soil[J].Plant Nutrition and Fertilizing Science,2005,11(6):737-741.
[26] 万忠梅,吴景贵.土壤酶活性影响因子研究进展[J].西北农林科技大学学报(自然科学版),2005,33(6):87-92.
WANG Zhongmei,WU Jinggui.Research progress on soil enzyme activity[J].Journal of Northwest Sci-Tech University of Agriculture and Forestry (Natural Science Edition),2005,33(6):87-92.
[27] 和文祥,朱铭莪,张一平.土壤酶与重金属关系的研究现状[J].土壤与环境,2000,9(2):139-142.
HE Wenxiang,ZHU Mingmao,ZHANG Yiping.Recent advance in relationship between soil enzymes and heavy metals[J].Soil and Environmental Sciences,2000,9(2):139-142.
[28] VAN BRUGGEN A H C,SEMENOV A M.In search of biological indicators for soil health and disease suppression[J].Applied Soil Ecology,2000,15(1):13-24.
[29] 万忠梅,宋长春.土壤酶活性对生态环境的响应研究进展[J].土壤通报,2009,40(4):951-956.
WAN Zhongmei,SONG Changchun.Advance on response of soil enzyme activity to ecological environment[J].Chinese Journal of Soil Science,2009,40(4):951-956.
[30] 贺凤鹏,曾文静,王曌迪,等.温带草原退化对土壤剖面微生物学特征的影响[J].微生物学通报,2016,43(3):702-711.
HE Fengpeng,ZENG Wenjing,WANG Zhaodi,etal.Effect of temperate grassland deterioration on soil microbiological characteristics at different depths[J].Microbiology China,2016,43(3):702-711.
ProfileDistributionCharacteristicsofSoilEnzymesandMicrobialBiomassinthePoyangLakeWetland
YU Haotian1,2, HUANG Shihao1,2, LIU Yajun1,2, KOU Wenbo1,2, LIU Yizhen1,2, WU Lan1,2*
1.School of Life Sciences of Nanchang University, Nanchang 330031, China 2.Key Laboratory of Environment and Resource Utilization of Poyang Lake, Ministry of Education, Nanchang 330031, China
In order to study the soil microbial function in freshwater marsh wetlands, the Poyang Lake wetland with typicalCarexcinerascenscommunity was selected as the research object. The profile soil depth was 1 m, which was divided into five layers (0-20, >20-40, >40-60, >60-80 and >80-100 cm). The soil profile distribution of soil enzyme activities (Bglu, NAG, Bxyl, Phos, Phox and Pero), microbial biomass and soil physicochemical properties were determined. The results showed that the soil enzymesw(MBC) andw(MBN), which represented microbial functional activities, decreased gradually as the soil depth increased. The soil enzyme activities and microbial biomass in surface soil (0-20 cm) were significantly higher than those in deep soil. It should be noted that the profile distributions of different soil enzyme activities varied with increasing soil depth, but the overall enzyme activity was not only stable, but also relatively high at the soil depth of >40-60 cm. Besides,w(MBC) in the surface soil was 65.58-161.90 mgkg, andw(MBN) was 7.39-16.28 mgkg, accounting for 51%-69% of the total contents of MBC and MBN in the soil profile. In addition, correlation analysis showed that soil microbial functional characteristics were significantly related to AFDM,w(TOC),w(TN), soil moisture and pH. Among them,w(TOC) andw(TN) were the two most important factors affecting the soil microbial biomass and activity in the Poyang Lake wetland. These results indicated that soil depth had significant effects on both soil microbial functional characteristics and soil physicochemical properties. Our findings suggest that although the microbial activity in surface soil was highest, a large number of microorganisms still existed in the deep soil, and their metabolic activities were also active. Therefore, the microbial functional characteristics in deep soil should be explored in future work.
natural wetland; profile soil; microbial biomass; soil enzyme; microbial function
2017-04-29
2017-08-14
国家自然科学基金项目(31360127,31260110)
于昊天(1990-),男,山东烟台人,ncusk724@hotmail.com.
*责任作者,吴兰(1969-),女,江西萍乡人,教授,博士,博导,主要从事环境微生物研究,wl690902@hotmail.com
于昊天,黄时豪,刘亚军,等.鄱阳湖湿地土壤酶及微生物生物量的剖面分布特征[J].环境科学研究,2017,30(11):1715-1722.
YU Haotian,HUANG Shihao,LIU Yajun,etal.Profile distribution characteristics of soil enzymes and microbial biomass in the Poyang Lake Wetland[J].Research of Environmental Sciences,2017,30(11):1715-1722.
X172
1001-6929(2017)11-1715-08
A
10.13198j.issn.1001-6929.2017.03.13
