刚毛柽柳ThPP2C基因的克隆和表达分析
2017-11-10王培龙刘中原张腾倩唐绯绯曲冠证高彩球
王培龙 刘中原 张腾倩 唐绯绯 曲冠证 高彩球
(东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040)
刚毛柽柳ThPP2C基因的克隆和表达分析
王培龙 刘中原 张腾倩 唐绯绯 曲冠证 高彩球*
(东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040)
蛋白磷酸酶2C(PP2C)是一类丝氨酸/苏氨酸蛋白磷酸酶,在体内以单体形式存在,由它催化的可逆磷酸化反应是细胞信号转导的重要组成部分,这一过程几乎参与所有的生理和病理过程。本研究从柽柳中克隆获得一条PP2C基因,命名为ThPP2C。该基因开放读码框(ORF)长849 bp,编码282氨基酸,推测蛋白质分子量为30.54 kDa,理论等电点为7.13。qRT-PCR结果显示,0.4 mol·L-1NaCl、20%(w/v) PEG6000、150 μmol·L-1ABA和100 μmol·L-1JA胁迫处理后,ThPP2C基因在刚毛柽柳根和叶中的表达均发生了明显改变,但时空表达模式不完全相同。NaCl、ABA和JA处理后ThPP2C基因在叶中都表现为下调表达。而根中,NaCl和JA胁迫后主要表现为上调表达。ABA处理早期表达下调,随后表达量逐渐增加。与其他3种胁迫不同的是,PEG6000处理后ThPP2C基因在根中明显下调,而在叶中胁迫早期表现不明显,48 h后被高度诱导。表明ThPP2C基因可能参与了刚毛柽柳高盐、干旱以及激素处理的适应过程,但其功能还有待进一步验证。
蛋白磷酸酶2C(PP2C);刚毛柽柳;盐胁迫;ABA
由蛋白磷酸酶和蛋白激酶介导的蛋白质可逆磷酸化在植物逆境信号传递过程中发挥重要作用。蛋白磷酸酶2C(Protein Phosphatese 2C,PP2C)是一类丝氨酸/苏氨酸蛋白磷酸酶,在体内以单体形式存在,它的活性依赖于Mg2+或Mn2+等二价阳离子,并严格受二价阳离子尤其是Mg2+和Mn2+的调节。H2O2、不饱和脂肪酸、Ca2+/CaM、脂质信号分子等均可以调节PP2C的活性[1~2]。到目前为止,在人类基因组中大约发现15个PP2C类蛋白,线虫中大约有8个,果蝇中有10个,酵母菌中有7个[3]。植物中对于PP2C的报道主要集中于拟南芥、玉米、水稻等植物中。Schweighofer[4]等报道了拟南芥中有76个PP2C基因,Xue[5]等报道了水稻中有78个PP2C基因,表明植物的PP2C基因较其它的真核生物具有更大的多样性。
研究发现,植物中PP2C类蛋白在ABA信号传导途径中起关键作用[6~9]。ABA作为植物内源激素在响应干旱、寒冷、高盐等非生物胁迫中具有重要作用,植物体内存在大量ABA受体蛋白,通过与ABA结合和对ABA信号的转换实现ABA对逆境的响应[6]。一般认为PP2C为ABA信号传导途径下游的关键组分,是ABA信号途径的主要负调控因子。如,Xue等[5]从拟南芥基因组中鉴定出80个PP2C基因,并根据其进化关系将其分为13个亚家族,其中A亚家族中的9个成员含有6个负调控ABA信号的蛋白,即ABI1、ABI2、AHGI、AHG3/AtPP2CA、HAB1及HAB2。Jia等[10]研究表明,FaABI1在ABA信号途径中作为一个负调控因子对草莓的成熟起调控作用。但与此结果相反,在山毛榉中FsPP2C1、FsPP2C2对ABA信号途径起正调控作用[11~12]。
此外,PP2C基因也参与植物对钾通道蛋白调控、盐胁迫等信号的响应和细胞周期调控等生理过程。酵母试验就表明,拟南芥A组PP2C蛋白基因AtPPCA能够通过催化亚基与通道蛋白基因AKT2/AKT3结合,进而通过ABA信号通路调节AKT2蛋白的含量,并且在受到非生物胁迫时在K+离子通道调节和膜磷酸化过程中发挥重要作用[13]。Liu[14]等报道拟南芥AtPP2CGL基因编码PP2C家族G亚族蛋白,能够调控拟南芥对盐胁迫的响应,且其调控依赖于ABA。Menges[15]等通过微阵列技术对同一时期植物细胞中的基因表达分析,从中鉴定出几个细胞周期专一诱导PP2C基因。
刚毛柽柳(Tamarixhispida)柽柳科(Tamaricaceae)柽柳属(Tamarix)植物,灌木或小乔木。喜光、耐旱、耐寒,极耐盐碱,根系发达,萌生力强,极耐修剪刈割。广泛分布于砾石、戈壁、黏土、沙土、流沙及各种不同程度的盐渍化土壤中和各种典型的盐土中。因此,它是进行抗逆基因克隆和抗逆机制研究的理想材料。本研究从刚毛柽柳中克隆获得ThPP2C基因,对该基因的序列特征和逆境胁迫后的表达模式进行分析,以期初步鉴定柽柳ThPP2C基因的功能,该研究将有助于揭示林木逆境响应的分子机制。
1 材料与方法
1.1 植物材料及胁迫处理
将刚毛柽柳种子均匀播种于培养土(花土∶蛭石∶珍珠岩=5∶3∶2)表面,然后覆盖一层培养土,转移到温室中(湿度70%~75%,温度25℃,光周期14 h/10 h)进行培养。待幼苗长至5 cm左右时移至直径10 cm的花盆中,每盆种植4棵幼苗,温室中继续培养。生长2个月左右,选取苗高8 cm左右且长势一致的柽柳苗分别进行0.4 mol·L-1NaCl、20%(w/v) PEG6000、150 μmol·L-1ABA和100 μmol·L-1JA灌溉处理。以正常浇水处理作为对照。处理6、12、24、48和72 h后,分别取各处理和对照柽柳的根和叶组织立即放入液氮中冷冻,保存于-80℃冰箱中用于RNA提取。
1.2 RNA提取、反转录及cDNA的合成
柽柳根和叶组织总RNA的提取采用植物RNA提取试剂盒(BioTeKecoropration),具体操作步骤按照试剂盒说明进行。RNA提取质量和浓度用0.8%的琼脂糖凝胶电泳和Nanovue微型光度计检测。RNA反转录和cDNA合成采用TransScript One-step gDNA Remvoal and cDNA Synthesis SuperMix,具体操作方法按照说明书进行。将反转录获得的cDNA稀释10倍后用于实时荧光定量RT-PCR。
1.3 柽柳ThPP2C基因克隆
以“Protein phosphatase 2C”作为关键词,对柽柳转录组数据进行查找,获得ThPP2C基因序列。选择其中一个全长ThPP2C基因(登录号为KY488545),根据序列,设计引物,引物序列为:PP2C-F(5′CGCGGATCCATGGATAGTTTATGCTGCTTC3′)和PP2C-R(5′CGGGGTACCTGCTCTGAAACGAATTACAAC3′)。以柽柳cDNA样品为模板,RT-PCR扩增获得ThPP2C基因。RT-PCR反应体系为:Ex Buffer 2 μL,dNTP Mix 0.4 μL,ExTaq 0.3 μL,上下游引物各1 μL(10 μmol·L-1),稀释后的cDNA 2 μL,加水至20 μL。RT-PCR扩增条件为95℃ 3 min;95℃ 15 s,59℃ 30 s,72℃ 1 min,40个循环;72℃ 10 min。RT-PCR扩增产物经琼脂糖凝胶电泳后,使用胶回收试剂盒进行回收,与pMD18-T克隆载体连接,转化大肠杆菌感受态细胞DH5α,经菌落PCR验证后,进一步测序验证。
1.4 柽柳ThPP2C基因的生物信息学分析
对测序获得的ThPP2C基因序列进行BLASTx比对(https://blast.ncbi.nlm.nih.gov/Blast.cgi)和ORF查找(https://www.ncbi.nlm.nih.gov/orffinder/),确定其开放读码框,并推导其氨基酸序列;使用ProtParam软件计算推导蛋白质的相对分子质量及理论等电点;利用InterProscan在线工具预测柽柳PP2C蛋白的家族和结构域(http://www.ebi.ac.uk/interpro/sequencesearch/iprscan5-S20160808-074549-0025-74526427-oy)。利用NCBI中的BLAST程序对测序获得的序列进行比对,搜索同源性高的9种生物的PP2C蛋白氨基酸序列利用Clustalx1.83进行多序列比对。包括菠菜(Spinaciaoleracea),小球藻(Betavulgarissubsp.Vulgaris),枣(Ziziphusjujuba),芝麻(Sesamumindicum),落花生(Arachisipaensis),碧桃(Prunuspersica),莲(Nelumbonucifera),菜豆(Phaseolusvulgaris)和棉花(Gossypiumhirsutum)等。此外,选取拟南芥家族的PP2C蛋白,利用MEGA5.0等软件进行系统发育进化树构建。
1.5 实时荧光定量RT-PCR
以各处理和对照柽柳的根和叶cDNA为模板,用柽柳定量引物(表1)进行RT-PCR扩增,RT-PCR产物经0.8%琼脂糖凝胶电泳检测。结果显示各引物均能扩增出特异的目的条带(图1C),可用于实时荧光定量RT-PCR。实时定量RT-PCR内参基因选择柽柳Actin基因、α-tubulin基因和β-tubulin基因。qRT-PCR的反应体系为SYBR 10 μL,正反向引物(10 μmol·L-1)各1 μL,cDNA 2.0 μL,ddH2O补充到20 μL。反应程序为:95℃ 10 min;95℃ 15 s,58℃ 15 s,72℃ 30 s,80℃ 1 s,读板,45个循环。使用伯乐公司生产的OpticonMonitor2荧光定量PCR仪进行qRT-PCR实验。数据分析采用2-ΔΔ(Ct)方法分析。其中,非胁迫处理(对照)表达水平设定为1。
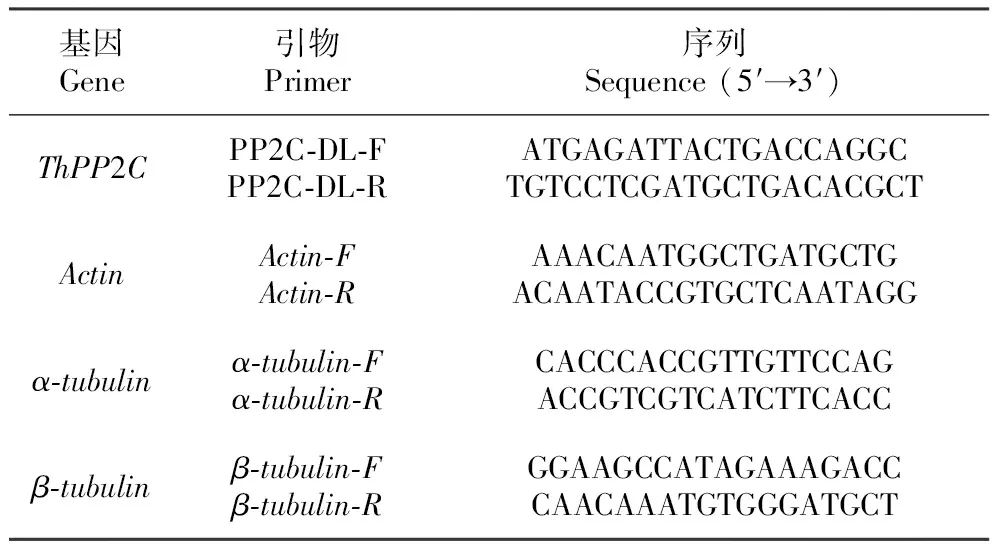
表1 实时定量RT-PCR引物序列
2 结果与分析
2.1 柽柳ThPP2C基因的克隆
以柽柳cDNA为模板,以PP2C-F和PP2C-R为上下游引物,PCR扩增得到一条特异条带(图1)。纯化回收后连接到pMD18-T克隆载体上,转化大肠杆菌感受态细胞DH5α,将菌液PCR检测得到的阳性克隆菌株进行测序。测序结果表明,柽柳ThPP2C基因cDNA编码区长度为849 bp,编码282个氨基酸,ProtParam预测ThPP2C蛋白的分子量为30.54 kD,理论等电点PI为7.13。同时利用InterProscan在线工具预测柽柳PP2C蛋白的家族和结构域,结果表明ThPP2C属于真核生物蛋白磷酸酶2C家族成员(IPR015655),含有一个PPM型磷酸酶(PPM-typephosphatase)结构域(IPR001932,21-281)。
2.2 PP2C蛋白多序列比对和系统进化树分析
利用NCBI的BLASTp程序搜索柽柳ThPP2C基因推导的氨基酸序列的同源序列。选择同源性较高的其他9种植物的PP2C蛋白氨基酸序列进行多序列比对和同源性分析,结果表明(图2)柽柳ThPP2C基因与其它植物的PP2C基因所编码的氨基酸序列相似度均在82%以上,其中与菠菜和小球藻的相似度最高为87%,与枣和芝麻的相似度为84%,与落花生、碧桃、莲和菜豆的相似度为83%。
为进一步分析柽柳ThPP2C蛋白的进化关系,选择拟南芥PP2C家族的80个PP2C蛋白[5],使用MEGA 5.0中的Neighbor-joining构建PP2C蛋白系统进化树。结果表明所有的蛋白可以分为13个亚家族,其中ThPP2C蛋白归为F1亚家族,与At1G34750和At1G43900的亲缘关系最近(图3)。
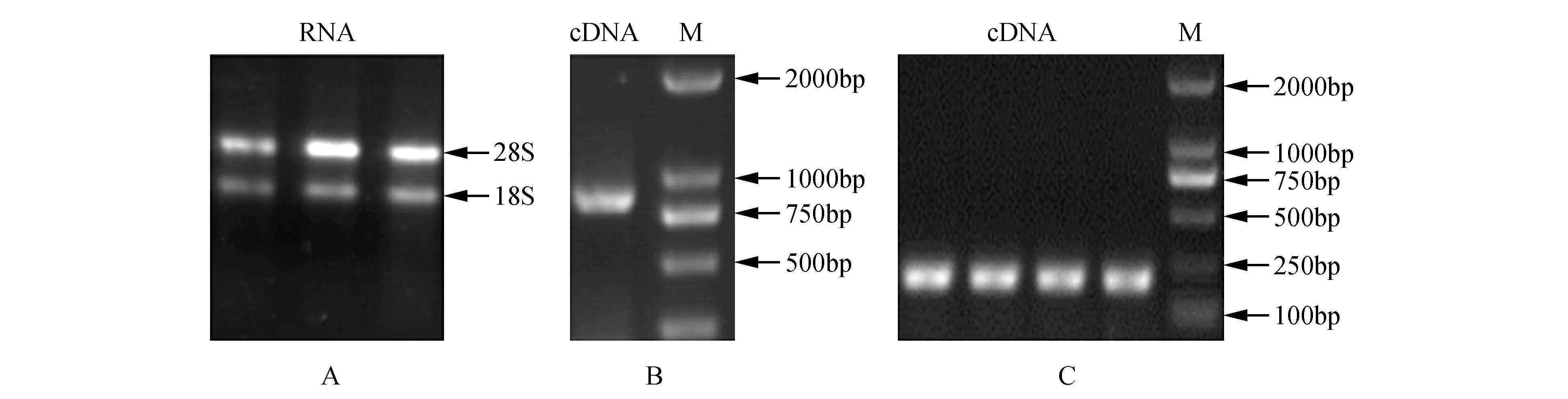
图1 柽柳ThPP2C基因的克隆 A. RNA凝胶电泳;B.柽柳ThPP2C基因RT-PCR扩增;C.柽柳内参和ThPP2C基因引物RT-PCR扩增Fig.1 Cloning of ThPP2C gene from T.hispida A. RNA gel electrophoresis; B. RT-PCR amplification of ThPP2C gene; C. RT-PCR amplification of T.hispida internal control and ThPP2C gene

图2 ThPP2C基因与其它物种PP2C基因的多序列比对注 M1/M2.二价金属离子结合位点;1~3.保守功能区Fig.2 The multiple sequence alignment of ThPP2C with other species PP2C gene M1/M2. Divalent metal ion binding sites; 1-3. Conservative functional areas
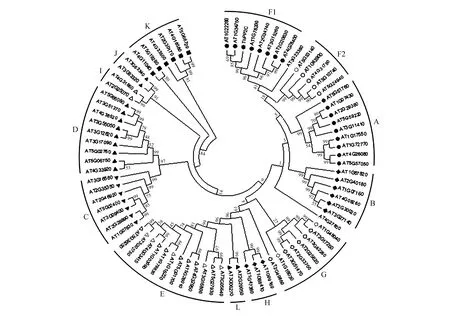
图3 ThPP2C与拟南芥PP2C蛋白质的进化树分析Fig.3 The evolutionary tree analysis of ThPP2C with Arabidopsis thaliana PP2C proteins
2.3 不同处理后ThPP2C基因的表达分析
为了初步分析ThPP2C基因的逆境胁迫应答功能,利用qRT-PCR技术分析了0.4 mol·L-1NaCl、20%PEG6000、150 μmol·L-1ABA和100 μmol·L-1JA胁迫处理后刚毛柽柳根和叶中ThPP2C基因相对表达情况(图4)。结果显示:在NaCl处理后,根中ThPP2C基因表达在胁迫早期(6 h)明显受抑制(仅为对照的3.8%),随后被上调表达,胁迫48 h时表达量最高,为对照的3.80倍。叶中所有时间点都表现为下调表达,其中24 h时表达量最低,仅为对照的2.3%。与NaCl胁迫不同,PEG处理后根中ThPP2C基因的表达均表现为下调,叶中ThPP2C基因的表达早期与非胁迫处理差异不显著,但48 h被高度诱导,为对照的24.9倍。ABA处理后,根中ThPP2C基因的表达在胁迫早期被明显抑制,处理6 h时表达量最低,为对照的5.5%。但随着胁迫时间的延长,ThPP2C基因的表达量逐渐增加。而叶中,ThPP2C基因在所有研究的时间点均被抑制。JA处理后ThPP2C基因的表达模式与NaCl胁迫较类似。其表达在根中表现为上调表达,胁迫72 h时达到其最高表达水平(9.89倍)。该基因在叶中则呈现为下调表达,胁迫24 h时表达量最低。
3 讨论
植物在非生物胁迫下会产生一系列的形态、生理生化和分子水平上的适应性变化,尤其是非生物胁迫会引起植物体内蛋白质磷酸酶2C基因表达的改变,从而诱导植物合成相关的蛋白以适应胁迫[16]。PP2C通过催化去磷酸化作用负调控蛋白激酶级联信号系统,参与细胞周期、胁迫信号转导、基因转录、蛋白翻译以及翻译后修饰等细胞活动过程[1]。
本研究从刚毛柽柳中克隆获得一条ThPP2C基因,序列分析结果表明该蛋白含有一个PPM型磷酸酶结构域,属于真核生物蛋白磷酸酶2C家族成员。通过多序列比对发现柽柳PP2C蛋白与其它植物PP2C蛋白的氨基酸长度均在279~283,并且在第50位和第72位都含有Mn2+/Mg2+结合位点,说明PP2C在不同的植物中都具有较高的保守性。与拟南芥家族PP2C蛋白的序列进化树分析结果显示,柽柳ThPP2C蛋白与At1G34750和At1G43900亲缘关系近,都属于F1亚家族。目前对拟南芥PP2C基因的F1亚家族研究较少,主要集中在A亚家族。研究发现A亚家族9个成员全部受ABA诱导表达,并且其中至少有5个成员已被证实对ABA信号转录途径起负调控功能。如ABI1和ABI2隐性突变损伤在种子萌发上对ABA敏感[17];AtPP2CA能够接触使ABA信号的正调控因子SnRK2发生去磷酸化作用而失活[18];另外还有HAB1、HAB2等均在ABA信号途径中起负调控作用[19~20]。
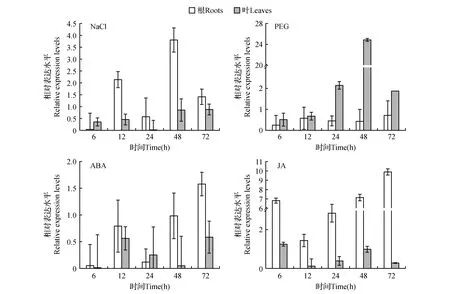
图4 不同胁迫处理下柽柳根和叶中ThPP2C基因表达模式 数据处理采用2-ΔΔ(Ct)法,非处理(对照)的表达水平设定为1,其他各时间点的表达均相对于对照进行计算。Fig.4 The expression patterns of ThPP2C gene under different treatments in roots and leaves of T.hispida The expression levels were calculated from the threshold cycle according to the delta-delta CT method.The expressions of non-treatment(the control) were assigned as one,and the expression level of the other treatments times was plotted relative to the normalized expression.
为了初步了解柽柳ThPP2C基因的功能,利用实时定量RT-PCR技术分析了ThPP2C基因在刚毛柽柳受高盐、JA、ABA、干旱等胁迫处理后的表达情况。结果显示,ThPP2C基因的表达量在这几种胁迫处理后都发生了明显改变。NaCl、ABA和JA处理后,ThPP2C基因在根和叶中分别表现出上调和下调的趋势,但在PEG6000处理后ThPP2C基因的表达趋势与以上处理相反,在根中主要表现为下调,而叶中表现为上调表达。表明柽柳ThPP2C基因可能参与了柽柳的抗旱耐盐胁迫和ABA、JA激素应答,但参与的调控途径不同。在后续研究中我们将继续对ThPP2C基因在柽柳抗逆过程中的具体功能和作用机制进行分析。
1.周旺,亓晓艳,张应玖.蛋白磷酸酶2C(PP2C)的表达、纯化与催化活性[J].吉林大学学报:理学版,2009,47(1):144-149.
Zhou W,Qi X Y,Zhang Y J.Expression,purification and catalytic activity of protein phosphatase 2C(PP2C)[J].Journal of Jilin University:Science Edition,2009,47(1):144-149.
2.Kharitonenkov A,Chen Z J,Sures I,et al.A family of proteins that inhibit signalling through tyrosine kinase receptors[J].Nature,1997,386(6621):181-186.
3.Ruan H H,Yan Z H,Sun H,et al.The YCR079w gene confers a rapamycin-resistant function and encodes the sixth type 2C protein phosphatase inSaccharomycescerevisiae[J].FEMS Yeast Research,2007,7(2):209-215.
4.Schweighofer A,Hirt H,Meskiene I.Plant PP2C phosphatases:emerging functions in stress signaling[J].Trends in Plant Science,2004,9(5):236-243.
5.Xue T T,Wang D,Zhang S Z,et al.Genome-wide and expression analysis of protein phosphatase 2C in rice andArabidopsis[J].BMC Genomics,2008,9:550.
6.Ma Y,Szostkiewicz I,Korte A,et al.Regulators of PP2C phosphatase activity function as abscisic acid sensors[J].Science,2009,324(5930):1064-1068.
7.Sheen J.Mutational analysis of protein phosphatase 2C involved in abscisic acid signal transduction in higher plants[J].Proceedings of the National Academy of Sciences of the United States of America,1998,95(3):975-980.
8.Nishimura N,Okamoto M,Narusaka M,et al.ABAHypersensitivegermination2-1 causes the activation of both abscisic acid and salicylic acid responses inArabidopsis[J].Plant and Cell Physiology,2009,50(12):2112-2122.
9.Hirayama T,Shinozaki K.Perception and transduction of abscisic acid signals:keys to the function of the versatile plant hormone ABA[J].Trends in Plant Science,2007,12(8):343-351.
10.Jia H F,Lu D,Sun J H,et al.Type 2C protein phosphatase ABI1 is a negative regulator of strawberry fruit ripening[J].Journal of Experimental Botany,2013,64(6):1677-1687.
11.Reyes D,Rodríguez D,González-garcía M P,et al.Overexpression of a protein phosphatase 2C from beech seeds inArabidopsisshows phenotypes related to abscisic acid responses and gibberellin biosynthesis[J].Plant Physiology,2006,141(4):1414-1424.
12.Saavedra X,Modrego A,Rodríguez D,et al.The nuclear interactor PYL8/RCAR3 ofFagussylvaticaFsPP2C1 is a positive regulator of abscisic acid signaling in seeds and stress[J].Plant Physiology,2010,152(1):133-150.
13.Chérel I,Michard E,Platet N,et al.Physical and functional interaction of theArabidopsisK+channel AKT2 and phosphatase AtPP2CA[J].The Plant Cell,2002,14(5):1133-1146.
14.Liu X,Zhu Y M,Zhai H,et al.AtPP2CG1,a protein phosphatase 2C,positively regulates salt tolerance ofArabidopsisin abscisic acid-dependent manner[J].Biochemical and Biophysical Research Communications,2012,422(4):710-715.
15.Menges M,Hennig L,Gruissem W,et al.Cell cycle-regulated gene expression inArabidopsis[J].The Journal of Biological and Chemistry,2002,277(44):41987-42002.
16.杜驰,张富春.植物蛋白磷酸酶2C在非生物胁迫信号通路中的调控作用[J].生物技术通报,2014(8):16-22.
Du C,Zhang F C.Protein phosphatases Ⅱ C in plants are involved in abiotic stress tolerance of several signaling pathways[J].Biotechnology Bulletin,2014(8):16-22.
17.Merlot S,Gosti F,Guerrier D,et al.The ABI1 and ABI2 protein phosphatases 2C act in a negative feedback regulatory loop of the abscisic acid signalling pathway[J].The Plant Journal,2001,25(3):295-303.
18.Yoshida T,Nishimura N,Kitahata N,et al.ABA-hypersensitivegermination3 encodes a protein phosphatase 2C(AtPP2CA) that strongly regulates abscisic acid signaling during germination amongArabidopsisprotein phosphatase 2Cs[J].Plant Physiology,2006,140(1):115-126.
19.Tähtiharju S,Palva T.Antisense inhibition of protein phosphatase 2C accelerates cold acclimation inArabidopsisthaliana[J].The Plant Journal,2001,26(4):461-470.
20.Saez A,Apostolova N,Gonzalez-guzman M,et al.Gain-of-function and loss-of-function phenotypes of the protein phosphatase 2CHAB1 reveal its role as a negative regulator of abscisic acid signalling[J].The Plant Journal,2004,37(3):354-369.
Science and technology research project of Heilongjiang Provincial Department of Education(12523017)
introduction:WANG Pei-Long(1990—),male,PhD student,mainly engaged in the study of forest tree genetic and breeding.
date:2017-01-03
CloningandExpressionAnalysisofThPP2CGenefromTamarixhispida
WANG Pei-Long LIU Zhong-Yuan ZHANG Teng-Qian TANG Fei-Fei QU Guan-Zheng GAO Cai-Qiu*
(State Key Laboratory of Tree Genetics and Breeding,Northeast Forestry University,Harbin 150040)
Protein phosphatase 2C(PP2C) is a kind of serine/threonine protein phosphatase, which is present in the body as monomer. The reversible phosphorylation by PP2C catalytic is an important component of the cell signal transduction, which is involved almost all the physiological and pathological processes. A novel PP2C gene(ThPP2C) was isolated fromTamarixhispidaby RT-PCR. The opening reading frame(ORF)length ofThPP2Cwas 869 bp, encoding 282 amino acid. The relative molecular weight ofThPP2Cprotein was 30.54 kD, with isoelectric point 7.13. By the real-time RT-PCR, the expressions ofThPP2Cwere obviously difference in roots and leaves ofT.hispidaunder the treatments(0.4 mol·L-1NaCl, 20%(w/v) PEG6000, 150 μmol·L-1ABA or 100 μmol·L-1JA) compared to the control. The expression patterns ofThPP2Cwere not exactly similarity among these treatments. Particularly, the expression ofThPP2Cin leaves ofT.hispidaafter the treatments of NaCl, ABA and JA all were down-regulated. However, it was mainly up-regulated in roots under the treatments of NaCl and JA. With the treatment of ABA, theThPP2Cexpression was down-regulated at the early stage and then gradually increased. Different with other three stress, under the treatment of PEG6000, the expressions ofThPP2Cwere obviously down-regulated in roots. It was not obviously different at the early stress stage in leaves until 48 h, when it was highly induced. Therefore,ThPP2Cmay play an important role inT.hispidato response the high salt, drought stress and hormones.
PP2C;Tamarixhispida;salt stress;ABA treatment
黑龙江省教育厅科学技术研究项目(12523017)
王培龙(1990—),男,博士研究生,主要从事林木遗传育种研究。
* 通信作者:E-mail:gaocaiqiu@nefu.edu.cn
2017-01-03
* Corresponding author:E-mail:gaocaiqiu@nefu.edu.cn
Q75
A
10.7525/j.issn.1673-5102.2017.03.010
