罗拉吡坦联合5-羟色胺3受体拮抗药和地塞米松防治化疗相关性恶心呕吐的系统评价
2017-11-09陈昆黄婷罗宏丽叶云西南医科大学附属医院药学部四川泸州646000西南医科大学附属口腔医院修复科四川泸州646000
陈昆,黄婷,罗宏丽,叶云#(.西南医科大学附属医院药学部,四川泸州646000;.西南医科大学附属口腔医院修复科,四川泸州646000)
罗拉吡坦联合5-羟色胺3受体拮抗药和地塞米松防治化疗相关性恶心呕吐的系统评价
陈昆1*,黄婷2,罗宏丽1,叶云1#(1.西南医科大学附属医院药学部,四川泸州646000;2.西南医科大学附属口腔医院修复科,四川泸州646000)
目的:系统评价罗拉吡坦联合5-羟色胺3受体拮抗药和地塞米松防治化疗相关性恶心呕吐的疗效和安全性,为临床提供循证参考。方法:计算机检索中国期刊全文数据库、中文科技期刊数据库、万方数据库、PubMed、EMBase、Cochrane图书馆,收集罗拉吡坦联合5-羟色胺3受体拮抗药和地塞米松(试验组)对比安慰剂联合5-羟色胺3受体拮抗药和地塞米松(对照组)防治化疗相关性恶心呕吐的随机对照试验(RCT),提取资料并按照Cochrane系统评价员手册5.1.0推荐的偏倚风险评价工具和标准评价质量后,采用Rev Man 5.3统计软件进行Meta分析。结果:共纳入3篇文献(4项RCT),合计2 583例患者。Meta分析结果显示,试验组患者完全缓解率[急性期:RR=1.10,95%CI(1.02,1.19),P=0.01;延迟期:RR=1.18,95%CI(1.11,1.25),P<0.001;总体期:RR=1.19,95%CI(1.12,1.26),P<0.001]、呕吐生活功能指数>108分患者占比[RR=1.10,95%CI(1.04,1.16),P<0.001]均显著高于对照组,差异均有统计学意义;两组患者不良反应发生率比较,差异无统计学意义[RR=1.10,95%CI(0.82,1.47),P=0.52]。结论:罗拉吡坦联合5-羟色胺3受体拮抗药和地塞米松能有效防治化疗相关性恶心呕吐,提高患者生存质量,且安全性较好。
罗拉吡坦;化疗相关性恶心呕吐;系统评价;疗效;安全性
化疗相关性恶心呕吐可增加患者对治疗的恐惧感,从而降低患者的依从性,最终影响化疗的成功率[1-4]。因此,积极、合理地预防和处理化疗相关性恶心呕吐,将为肿瘤患者顺利接受化疗提供保障[5-6]。患者在接受化疗后120 h(总体期)内均为出现恶心呕吐的高风险期,该时期通常分成两个阶段:急性期(0~24 h)主要由5-羟色胺(5-HT)介导,一般发生在给予化疗药物数分钟至数小时后,并且给药后5~6 h为恶心呕吐的易发期,但多在24 h内缓解;延迟期(24~120 h)主要是由神经激肽1(NK-1)和P物质起主导作用,多在给予化疗药物24 h之后发生,常见于使用顺铂、卡铂、环磷酰胺和阿霉素等药物化疗时发生,恶心呕吐可持续数天[4,7]。目前,国内外对于高度催吐性化疗方案致恶心呕吐的推荐预防措施为:在化疗前采用“三药方案”,包括5-HT3受体拮抗药、地塞米松和NK-1受体拮抗药[2,4,8-9]。罗拉吡坦是一个NK-1受体拮抗药,研究表明其与5-HT3受体拮抗药和地塞米松联用时,可有效预防和缓解化疗相关性恶心呕吐[10]。但目前国内外均无罗拉吡坦联合5-HT3受体拮抗药和地塞米松防治化疗相关性恶心呕吐的循证证据支持。因此,本研究采用Meta分析的方法系统评价了罗拉吡坦联合5-HT3受体拮抗药和地塞米松防治化疗相关性恶心呕吐的疗效和安全性,以期为临床提供循证参考。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型国内外公开发表的随机对照试验(RCT),文种限定为中文和英文。
1.1.2 研究对象①年龄>18周岁且卡氏功能状态(KPS)评分>60分的肿瘤患者,性别、人种、肿瘤类型不限;②化疗方案使用中度、高度催吐的抗肿瘤药物,具体包括卡铂、顺铂、阿霉素或表阿霉素+环磷酰胺(AC方案)、环磷酰胺≥1 500 mg/m2、卡莫司汀>250 mg/m2、阿霉素>60 mg/m2、表阿霉素>90 mg/m2、异环磷酰胺≥2 g/m2、氮芥、氮烯咪胺(达卡巴嗪)等;③预期寿命>4个月的患者;④具有足够的骨髓功能和肝、肾功能,能够承受化疗的患者。排除标准:①试验前曾接受过中度或高度催吐化疗药物的患者;②试验开始前5 d内曾接受过NK-1受体拮抗药或5-HT3受体拮抗药以及其他任何可能影响试验结果的药物患者。
1.1.3 干预措施试验组患者给予罗拉吡坦+5-HT3受体拮抗药+地塞米松治疗;对照组患者给予安慰剂+5-HT3受体拮抗药+地塞米松治疗。两组疗程均为5 d。
1.1.4 结局指标疗效指标:①完全缓解率(无恶心呕吐事件发生或者未使用针对恶心呕吐的解救性药物的患者比例)、②无呕吐率(无呕吐、干呕事件发生或者未使用针对呕吐、干呕的解救性药物的患者比例)、③无明显恶心率[视觉模拟(VAS)评分<25分的患者比例]、④无恶心率(VAS评分<5分的患者比例)、⑤完全预防率(无恶心呕吐事件发生或者未使用针对恶心呕吐的解救性药物且VAS评分<25分的患者比例)、⑥呕吐生活功能指数>108分患者占比;安全性指标:⑦不良反应发生率。其中,①⑥为主要指标,其余为次要指标。
1.1.5 排除标准①非RCT及动物实验、细胞学试验等基础研究;②综述、病例报告、会议论文等;③重复发表的文献;④数据不完整或无法获取所需数据的文献。
1.2 检索策略
计算机检索中国期刊全文数据库、中文科技期刊数据库、万方数据库、PubMed、EMBase、Cochrane图书馆,检索时限均从各数据库建库起至2015年12月。针对不同的数据库制定相应的检索策略,并辅以手工检索会议资料,追溯纳入文献的参考文献。
1.3 资料提取
两位研究者按照纳入与排除标准独立筛选文献、提取资料,并交叉核对,如遇分歧交由第三方裁定。资料提取内容包括:(1)基本情况——年龄、性别、干预措施、结局指标、失访、不良反应等;(2)偏倚风险评估指标——具体随机分配方法、盲法、分配方案隐藏、选择性报道研究结果、结果数据完整性等。
1.4 质量评价
根据Cochrane系统评价员手册5.1.0[11]推荐的偏倚风险评价工具和标准对纳入的RCT进行偏倚风险评估,评估指标包括以下6项:具体随机分配方法、盲法、分配方案隐藏、选择性报道研究结果、结果数据完整性及其他偏倚来源。
1.5 统计学方法
采用Rev Man 5.3统计软件进行Meta分析。
1.5.1 效应量选择若需要分析的指标是二分类变量则采用比值比(OR)、相对危险度(RR)或者危险差(RD)为合并统计量;若需要分析的指标是数值变量,可选用均数差(MD)或标准化均数差(SMD)为合并统计量,各效应量均以95%置信区间(CI)表示。
1.5.2 异质性检验如果异质性检验结果为P>0.10或者I2<50%,可认为多个同类研究不存在异质性,采用固定效应模型计算合并统计量;反之,可认为多个同类研究存在异质性,这时首先分析导致异质性的原因,如设计方案、测量方法、用法用量、年龄、性别、疗程长短等基线是否相同,针对上述引起异质性的原因,可以采用亚组分析来计算合并统计量,但如果采用亚组分析后仍然存在异质性,则采用随机效应模型进行合并统计量的计算。P<0.05为差异有统计学意义。
2 结果
2.1 文献检索结果
通过计算机初步检索到文献81篇,去重后得到68篇,然后根据纳入与排除标准进行初筛后得到10篇,仔细阅读全文后进一步剔除7篇文献,最终纳入3篇文献,包含4项RCT[12-14]。
2.2 纳入研究基本信息
4项研究合计2 583例患者,纳入研究基本信息见表1。
2.3 纳入研究偏倚风险评估结果
根据Cochrane协作网偏倚风险评价标准对纳入的4项RCT进行偏倚风险评估,其偏倚风险见图1、图2。
2.4 Meta分析结果
对于疗效指标①~⑤,将患者出现恶心呕吐的高风险期分为总体期、急性期(0~24 h)和延迟期(24~120 h)分别考察。
2.4.1 急性期急性期各疗效指标的异质性检验结果提示:完全缓解率(P=0.03,I2=67%)、无呕吐率(P<0.006,I2=76%)、无明显恶心率(P=0.009,I2=74%)、完全预防率(P=0.07,I2=63%)几个指标,各研究间均有统计学异质性,采用随机效应模型分析;而无恶心率(P=0.18,I2=42%)指标各研究间无统计学异质性,采用固定效应模型分析,详见图3。Meta分析结果显示,试验组患者完全缓解率[RR=1.10,95%CI(1.02,1.19),P=0.01]和无呕吐率[RR=1.11,95%CI(1.02,1.20),P=0.01]均显著高于对照组,差异均有统计学意义;两组患者无明显恶心率[RR=1.03,95%CI(0.95,1.11),P=0.49]、无恶心率[RR=1.03,95%CI(0.98,1.10),P=0.24]、完全预防率[RR=1.06,95%CI(0.99,1.15),P=0.11]比较,差异均无统计学意义。

表1 纳入研究基本信息Tab 1 Baseline data of included studies
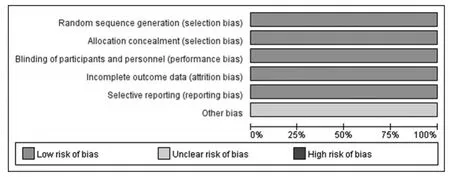
图1 偏倚风险条形图Fig 1 Bias risk bar chart
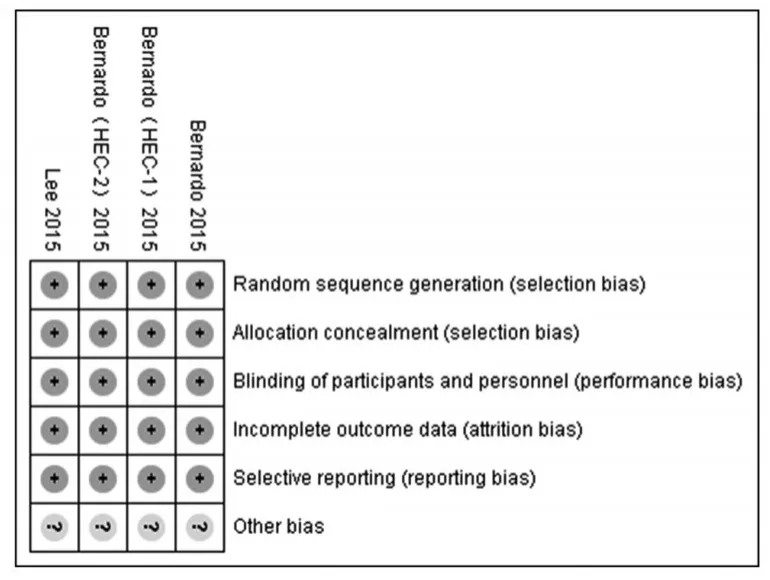
图2 偏倚风险总图Fig 2 Bias risk chart
2.4.2 延迟期延迟期各疗效指标的异质性检验结果提示:完全缓解率(P=0.60,I2=0)、无呕吐率(P=0.23,I2=30%)、无明显恶心率(P=0.25,I2=27%)、无恶心率(P=0.20,I2=38%)、完全预防率(P=0.45,I2=0)几个指标各研究间均无统计学异质性,采用固定效应模型分析,详见图4。Meta分析结果显示,试验组患者完全缓解率[RR=1.18,95%CI(1.11,1.25),P<0.001]、无呕吐率[RR=1.18,95%CI(1.12,1.24),P<0.001]、无明显恶心率[RR=1.09,95%CI(1.03,1.14),P=0.001]、无恶心率[RR=1.16,95%CI(1.07,1.26),P<0.001]、完全预防率[RR=1.15,95%CI(1.08,1.23),P<0.001]均显著高于对照组,差异均有统计学意义。
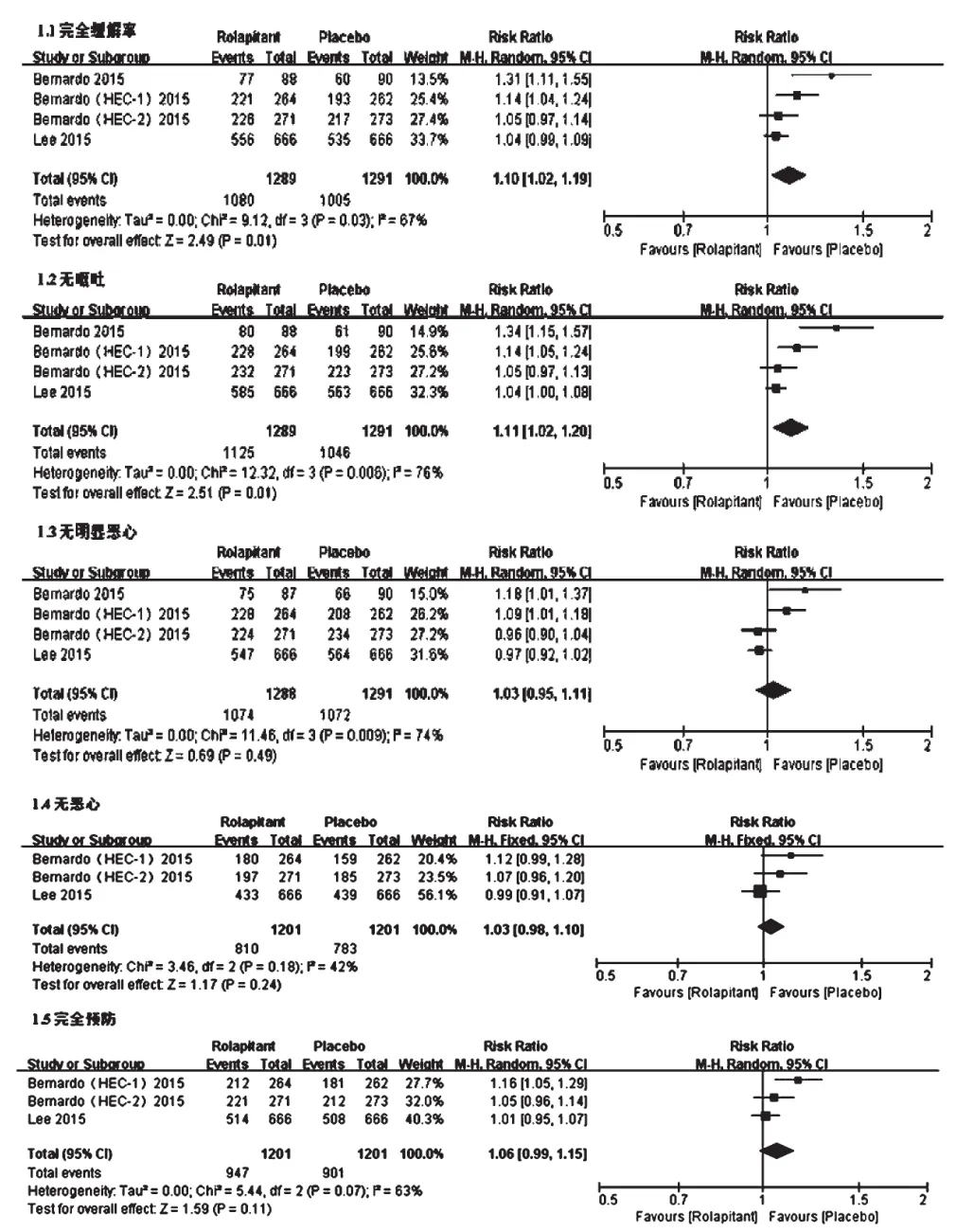
图3 急性期两组患者各疗效指标的Meta分析森林图Fig 3 Forest plots of Meta-analysis of efficacy indexes of 2 groups in acute stage
2.4.3 总体期总体期各疗效指标的异质性检验结果提示:完全缓解率(P=0.56,I2=0)、无呕吐率(P=0.20,I2=35%)、无明显恶心率(P=0.12,I2=48%)、无恶心率(P=0.26,I2=26%)、完全预防率(P=0.40,I2=0)几个指标各研究间均无统计学异质性,采用固定效应模型分析,详见图5。Meta分析结果显示,试验组患者完全缓解率[RR=1.19,95%CI(1.12,1.26),P<0.001]、无呕吐率[RR=1.21,95%CI(1.15,1.27),P<0.001]、无明显恶心率[RR=1.10,95%CI(1.04,1.16),P<0.001]、无恶心率[RR=1.16,95%CI(1.06,1.27),P=0.001]、完全预防率[RR=1.17,95%CI(1.10,1.26),P<0.001]均显著高于对照组,差异均有统计学意义。

图4 延迟期两组患者各疗效指标的Meta分析森林图Fig 4 Forest plots of Meta-analysis of efficacy indexes of 2 groups in delay stage
2.4.4 呕吐生活功能指数>108分患者占比4项研究报道了呕吐生活功能指数>108分患者占比[12-14],各研究间无统计学异质性(P=0.19,I2=36%),采用固定效应模型分析,详见图6。Meta分析结果显示,试验组患者呕吐生活功能指数>108分患者占比显著高于对照组,差异有统计学意义[RR=1.10,95%CI(1.04,1.16),P<0.001]。
2.4.5 不良反应发生率4项研究报道了不良反应发生率[12-14],各研究间无统计学异质性(P=0.14,I2=45%),采用固定效应模型分析,详见图7。Meta分析结果显示,两组患者不良反应发生率比较,差异无统计学意义[RR=1.10,95%CI(0.82,1.47),P=0.52]。
2.5 敏感性分析和发表偏倚分析
基于本研究Meta分析结果,改变各个结局指标的合并统计量或者效应模型得到的结果与改变之前比较,差异均无统计学意义(P>0.05)。说明本研究Meta分析结果稳定可信。
3 讨论
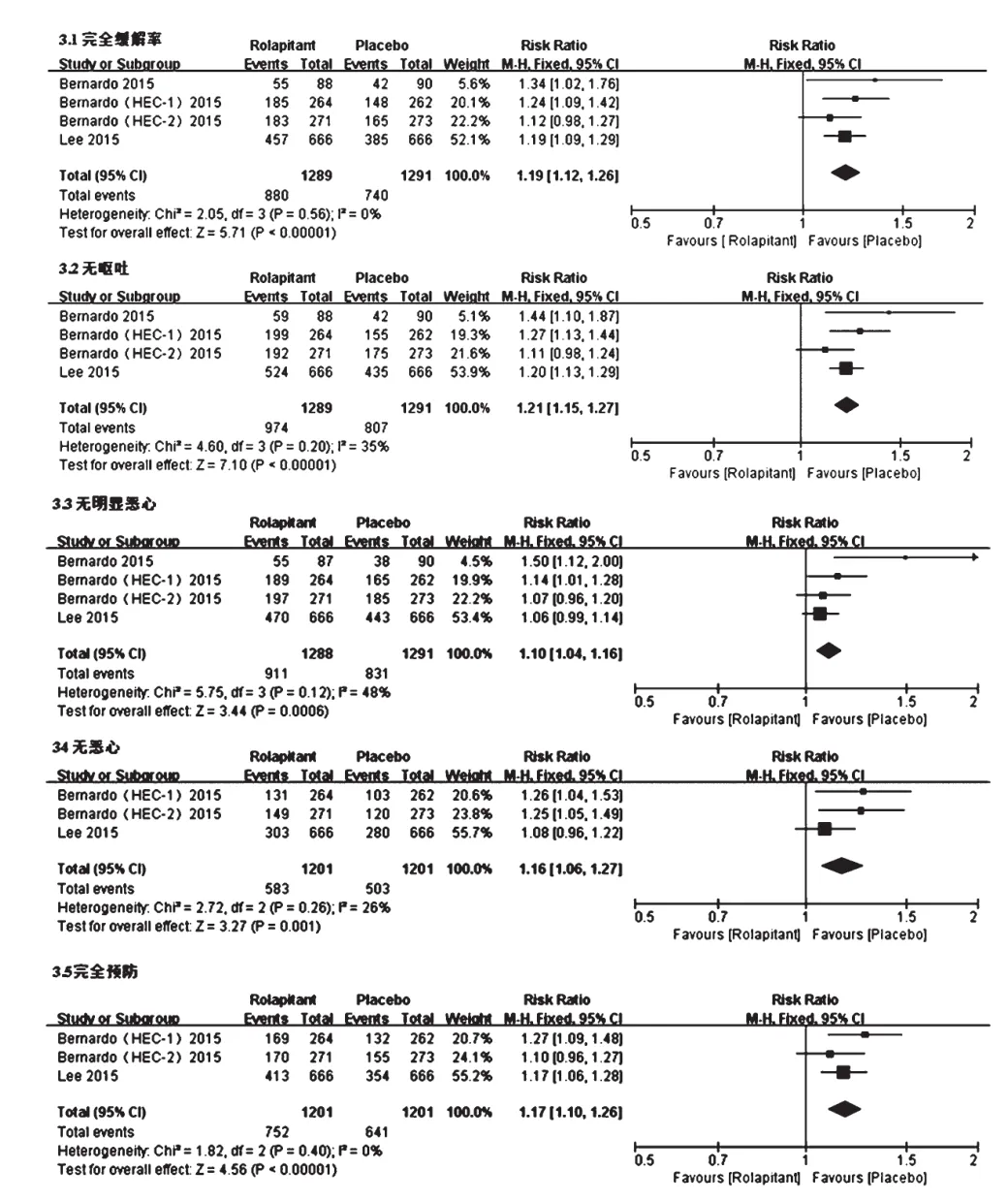
图5 总体期两组患者各疗效指标的Meta分析森林图Fig 5 Forest plots of Meta-analysis of efficacy indexes of 2 groups in overall stage
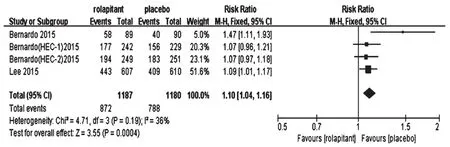
图6 两组患者呕吐生活功能指数>108分患者占比的Meta分析森林图Fig 6 Forest plots of Meta-analysis of the proportion of patients with living functional indexes of vomiting>108 in 2 groups
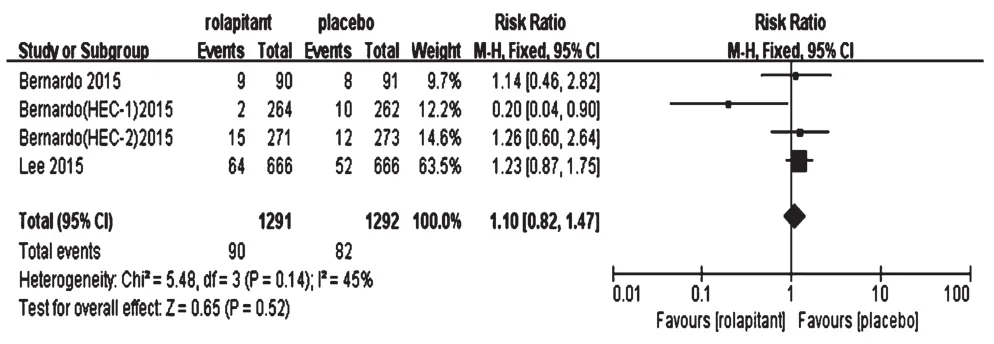
图7 两组患者不良反应发生率的Meta分析森林图Fig 7 Forest plots of Meta-analysis of the incidence of ADR in 2 groups
罗拉吡坦是一个高效、高选择性的竞争性NK-1受体拮抗药,半衰期长达180 h,与人体NK-1受体具有很高的亲和力[10,12]。有研究报道,给予化疗患者180 mg的罗拉吡坦,5 d内与受体的结合率超过90%,表明单次剂量的罗拉吡坦联合5-HT3受体拮抗药和地塞米松能在高风险期(120 h)内充分预防化疗相关性恶心呕吐[13-14]。此外,目前常用的NK-1受体拮抗药阿瑞匹坦[15](Aprepitant)和奈妥吡坦[16](Netupitant)可以诱导或抑制肝药酶CYP3A4,从而影响其他药物的代谢,因此在与其他药物联合使用时,往往需要调整相关药物的给药剂量(如地塞米松)[17-18]。而罗拉吡坦既不是肝药酶CYP3A4的诱导剂也不是抑制剂,因此不会与经肝药酶CYP3A4代谢的药物发生相互作用,联合用药时无需调整给药剂量,这就提高了肿瘤患者化疗药物的可选择性。
本次Meta分析结果显示,试验组患者急性期完全缓解率和无呕吐率均显著高于对照组,差异均有统计学意义;但是无明显恶心率、无恶心率和完全预防率与对照组比较,差异均无统计学意义。试验组患者延迟期和总体期的各疗效指标均显著高于对照组,差异均有统计学意义。说明罗拉吡坦联合5-HT3受体拮抗药和地塞米松防治延迟期和总体期化疗相关性恶心呕吐效果较好。急性期部分指标效果不明显的原因可能是罗拉吡坦为NK-1受体拮抗药,主要在延迟期起介导作用。此外,各研究均以呕吐生活功能指数来评估化疗相关性恶心呕吐对患者日常生存质量的影响。呕吐生活功能指数问卷表由18个关于恶心呕吐的评分项组成,每个评分项根据患者的恶心呕吐程度分为0~7分,总分为126分,当评分>108分可认为对患者生存质量无影响[19]。本研究中,试验组患者呕吐生活功能指数>108分患者占比显著高于对照组,差异有统计学意义。说明罗拉吡坦联合5-HT3受体拮抗药和地塞米松能够显著提高化疗患者生存质量。
安全性方面,各研究报道的最常见不良反应有贫血、白细胞减少、中性粒细胞减少、口腔炎、乏力等;严重不良反应发生率低,且无治疗药物相关不良反应导致的死亡;两组患者不良反应发生率比较,差异无统计学意义。说明罗拉吡坦联合5-HT3受体拮抗药和地塞米松防治化疗相关性恶心呕吐的安全性较好,患者可以耐受。
罗拉吡坦于2015年9月经美国FDA批准用于防治化疗相关性恶心呕吐。虽然本研究只纳入了4项RCT,相对较少,但各项RCT的质量均比较高,且总的样本量也较大。因此,效应量可能不会被夸大或缩小,从而不会影响结果可靠性。此外,本研究最终只纳入以英文形式发表的文献,可能存在一定的发表偏倚;而目前国内还没有关于罗拉吡坦防治化疗相关性恶心呕吐的RCT,因此还需要国内、外学者开展更多高质量的RCT,为临床合理用药提供更科学、可靠的循证证据。
综上所述,罗拉吡坦联合5-HT3受体拮抗药和地塞米松能有效防治化疗相关性恶心呕吐,提高患者生存质量,且安全性较好。
[1] Aapro M,Molassiotis A,Dicato M,et al.The effect of guideline-consistent antiemetic therapy on chemotherapyinduced nausea and vomiting(CINV):the Pan European Emesis Registry(PEER)[J].Ann Oncol,2012,23(8):1986-1992.
[2] Basch E,Prestrud AA,Hesketh PJ,et al.American society of clinical oncology(2011)antiemetics:American society of clinical oncology clinical practice guideline update[J].J Clin Oncol,2011,29(31):4189-4198.
[3] Jordan K,Gralla R,Jahn F,et al.International antiemetic guidelines on chemotherapy induced nausea and vomiting(CINV):content and implementation in daily routine practice[J].Eur J Pharmacol,2014,doi:10.1016j.ejphar.2013.09.073.
[4] 中国抗癌协会癌症康复与姑息治疗专业委员会,中国临床肿瘤学会抗肿瘤药物安全管理专家委员会.肿瘤治疗相关呕吐防治指南:2014版[J].临床肿瘤学杂志,2014,19(3):263-273.
[5] Neymark N,Crott R.Impact of emesis on clinical and economic outcomes of cancer therapy with highly emetogenic chemotherapy regimens:a retrospective analysis of three clinical trials[J].Support Care Cancer,2005,13(10):812-818.
[6] van Laar ES,Desai JM,Jatoi A.Professional educational needs for chemotherapy-induced nausea and vomiting(CINV):multinational survey results from 2 388 health care providers[J].Supp Care Cancer,2015,23(1):151-157.
[7] Hesketh PJ.Chemotherapy-induced nausea and vomiting[J].New Engl J Med,2008,358(23):2482-2494.
[8] National Comprehensive Cancer Network.Clinical practice guidelines in oncology:antiemesis[EB/OL].(2014-12)[2016-05].http://www.nccn.org/professionals/physician_gls/pdf/antiemesis.pdf.
[9] Roila F,Herrstedt J,Aapro M,et al.Guideline update for MASCC and ESMO in the prevention of chemotherapy and radiotherapy-induced nausea and vomiting:results of the Perugia consensus conference[J].Ann Oncol,2010,21(Suppl 5):232-243.
[10] Duffy RA,Morgan C,Naylor R,et al.Rolapitant(SCH619734):a potent,elective and orally active neurokinin NK1 receptor antagonist with centrally-mediated antiemetic effects in ferrets[J].Pharmacol Biochem Behav,2012,102(1):95-100.
[11] Higgins JPT,Green S.Cochrane handbook for systematic reviews of interventions[EB/OL].(2011-03)[2016-03].http://www.cochrane-handbook.org.2008.
[12] Rapoport B,Chua D,Poma A,et al.Study of rolapitant,a novel,long-acting,NK-1 receptor antagonist,for the prevention of chemotherapy-induced nausea and vomiting(CINV)due to highly emetogenic chemotherapy(HEC)[J].Support Care Cancer,2015,23(11):3281-3288.
[13] Schwartzberg LS,Modiano MR,Rapoport BL,et al.Safety and efficacy of rolapitant for prevention of chemotherapy-induced nausea and vomiting after administration of moderately emetogenic chemotherapy or anthracycline and cyclophosphamide regimens in patients with cancer:a randomised,active-controlled,double-blind,phase 3 trial[J].Lancet Oncol,2015,16(9):1071-1078.
[14] Rapoport BL,Chasen MR,Gridelli C,et al.Safety and efficacy of rolapitant for prevention of chemotherapy-in-duced nausea and vomiting after administration of cisplatin-based highly emetogenic chemotherapy in patients with cancer:two randomised,active-controlled,double-blind,phase 3 trials[J].Lancet Oncol,2015,16(9):1079-1089.
[15] Ruhlmann CH,Herrstedt J.Safety evaluation of aprepitant for the prevention of chemotherapy-induced nausea and vomiting[J].Expert Opin Drug Saf,2011,10(3):449-462.
[16] Aapro M,Rugo H,Rossi G,et al.A randomized phaseⅢstudy evaluating the efficacy and safety of NEPA,a fixeddosecombination of netupitant and palonosetron,for prevention of chemotherapy-induced nauseaand vomiting following moderately emetogenic chemotherapy[J].Ann Oncol,2014,25(7):1328-1333.
[17] McCrea JB,Majumdar AK,Goldberg MR,et al.Effects of the neurokinin-1 receptor antagonist aprepitant on the pharmacokinetics of dexamethasone and methylprednisolone[J].Clin Pharmacol Ther,2003,74(1):17-24.
[18] Lanzarotti C,Rossi G.Effect of netupitant,a highly selective NK-1 receptor antagonist,on the pharmacokinetics of midazolam,erythromycin,and dexamethasone[J].Support Care Cancer,2013,21(10):2783-2791.
[19] Lindley CM,HirschJ D,O’Neill CV,et al.Quality of life consequences of chemotherapy-induced emesis[J].Qual Life Res,1992,1(5):331-340.
Rolapitant Combined with 5-HT3Receptor Antagonist and Dexamethasone for the Prevention and Treatment of Chemotherapy-induced Nausea and Vomiting:A Systematic Review
CHEN Kun1,HUANG Ting2,LUO Hongli1,YE Yun(11.Dept.of Pharmacy,the Affiliated Hospital of Southwest Medical University,Sichuan Luzhou 646000,China;2.Dept.of Prosthodontics,Stomatology Hospital Affiliated to Southwest Medical University,Sichuan Luzhou 646000,China)
OBJECTIVE:To evaluate the effectiveness and safety of rolapitant combined with 5-HT3receptor antagonist and dexamethasone for the prevention of chemotherapy-induced nausea and vomiting systematically,and to provide evidence-based reference in clinic.METHODS:Retrieved from CJFD,VIP,Wanfang Database,PubMed,EMBase and Cochrane Library,randomized controlled trials(RCTs)about rolapitant+5-HT3receptor antagonist+dexamethasone(trial group)vs.placebo combined with 5-HT3receptor antagonist+dexamethasone(control group)for the prevention of chemotherapy-induced nausea and vomiting.Metaanalysis was performed by using Rev Man 5.3 statistical software after data extraction and quality evaluation with Cochrane system evaluator manual 5.1.0.RESULTS:A total of 3 literatures were included,involving 4 RCTs and 2 583 patients.The results of Metaanalysis were as follows:complete remission rate[acute stage:RR=1.10,95%CI(1.02,1.19),P=0.01;delay stage:RR=1.18,95%CI(1.11,1.25),P<0.001;overall stage:RR=1.19,95%CI(1.12,1.26),P<0.001]and the proportion of patients with functional indexes of vomiting living>108[RR=1.10,95%CI(1.04,1.16),P<0.001]in trial group were significantly higher than control group,with statistical significance.There was no statistical significance in the incidence of ADR between 2 groups[RR=1.10,95%CI(0.82,1.47),P=0.52].CONCLUSIONS:Rolapitant combined with 5-HT3receptor antagonist and dexamethasone can effectively prevent and relieve chemotherapy-induced nausea and vomiting,and improve the quality of life with good safety.
Rolapitant;Chemotherapy-induced nausea and vomiting;Systematic review;Therapeutic efficacy;Safety
R975+.4
A
1001-0408(2017)30-4242-06
DOI10.6039/j.issn.1001-0408.2017.30.18
*药师,硕士。研究方向:临床药学与循证药学。E-mail:2219251164@qq.com
#通信作者:主任药师。研究方向:临床药学。电话:0830-3165750。E-mail:yeyun8622@163.com
2016-12-12
2017-06-26)
(编辑:申琳琳)
