肥胖相关基因与叉头转录因子在非酒精性脂肪肝大鼠模型肝脏中的表达*
2017-11-08陈益耀何周桃蔡曼妮
陈益耀,陈 轶,何周桃,蔡曼妮
(海南省人民医院消化内科,海口 570311)
论著·基础研究doi:10.3969/j.issn.1671-8348.2017.30.003
肥胖相关基因与叉头转录因子在非酒精性脂肪肝大鼠模型肝脏中的表达*
陈益耀,陈 轶,何周桃,蔡曼妮
(海南省人民医院消化内科,海口 570311)
目的研究肥胖相关基因(FTO)与叉头转录因子O1(FoxO1)蛋白在非酒精性脂肪肝模型大鼠肝脏中的表达水平。方法通过饲喂高能量和高脂肪的大鼠饲料制备非酒精性脂肪肝动物模型,然后采集大鼠的血液和肝脏组织,测定其肝脏指数和血液生化指标,包括三酰甘油(TG)、总胆固醇(TC)、丙氨酸氨基转移酶(AST)、天冬氨酸氨基转移酶(ALT)、碱性磷酸酶(ALP)、高密度脂蛋白(HDL)和低密度脂蛋白(LDL);对大鼠进行肝脏病理检测;采用免疫组织化学法测定FTO蛋白和FoxO1蛋白在大鼠肝脏中的表达水平。结果8周后,模型组大鼠的肝脏质量、体质量和肝脏指数3项指标均高于对照组大鼠,差异有统计学意义(P<0.05);模型组大鼠的AST、ALT、LDL、ALP、TG和TC均高于对照组大鼠,差异有统计学意义(P<0.05);模型组大鼠的HDL低于对照组大鼠,差异有统计学意义(P<0.05);模型组大鼠肝小叶部分产生脂肪变性、炎症,对照组大鼠则没有;模型组大鼠的FTO蛋白和FoxO1蛋白在肝脏中的表达积分高于对照组大鼠,差异有统计学意义(P<0.05)。结论FTO与FoxO1一起相互作用,可能扰乱正常的能量和脂肪代谢。
叉头转录因子类;非酒精性脂肪肝;能量代谢;脂类代谢;肥胖相关基因
非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)作为一种与遗传、环境和代谢方式均相关的疾病,其与人体的肥胖程度具有很高的相关性。目前医学界对NAFLD的具体发病机制仍然没有完全研究透彻,但是“二次打击”学说获得了很大程度的认可。该学说认为胰岛素抵抗(IR)和氧化应激分别造成了初次打击和二次打击[1]。2007年,Frayling 等[2]发现了一种新型的基因,该基因在人体内分布较为广泛,并且能够在很大程度上对人的食欲进行调节,同时对能量的代谢也有很大影响。随后,Guo等[3]进一步的研究发现,肥胖相关基因(FTO)通过增多丙二醛(MDA)和超氧化物歧化酶(SOD)氧化应激标志物进而参与到NAFLD的发病机制中,且其自身亦在NAFLD中表达上调,但是这一过程的具体分子水平的机制尚不十分清楚。但已经有研究显示,FTO可以通过影响人体的肥胖程度参与到NAFLD的发病机制过程中。叉头转录因子(FoxO1)是一个被最早发现的转录因子,当人体肝脏细胞发生IR时,其活性得到提高,通过不同的途径最终可能会导致高血糖症和高三酰甘油血症[4]。腺苷酸活化蛋白激酶(AMPK)通过FoxO1来调节肝脏细胞糖异生过程中磷酸烯醇式丙酮酸羧基酶(PEPCK)和葡萄糖-6磷酸酶(G6Pase)这两种关键酶基因的表达,同时AMPK也是FTO调节人体肥胖程度和饮食的中介因子[5]。FTO和FoxO1二者之间的相互作用机制目前尚少见报道,本研究通过制备NAFLD大鼠模型,研究FTO和FoxO1在大鼠肝脏中的表达水平,并对其作用机制进行探究,以期为临床治疗NAFLD提供一定的参考依据。
1 材料与方法
1.1动物来源 雄性SD大鼠,购自湖南斯莱克景达实验动物有限公司,体质量(200±10)g。
1.2方法
1.2.1NAFLD大鼠模型建立 SD大鼠喂养1周适应环境后,分别抽取15只作为对照组和模型组,对照组大鼠饲喂普通动物饲料,模型组大鼠饲喂特制高能量和高脂肪动物饲料(普通饲料加100 g/kg猪油,加20 g/kg胆固醇,加100 g/kg蔗糖),饲养8周后进行指标测定。
1.2.2大鼠血液采集和肝脏分离 大鼠禁食24 h后,腹腔注射10%水合氯醛进行麻醉,断头采集血液,25 ℃静置3 h后,使用离心机以3 000 r/min离心15 min,留取上清液待用。大鼠断头处死后快速取出肝脏,计算肝脏指数=肝脏重量(g)/大鼠体质量(g)×100%,然后切下小片放入甲醛溶液进行组织固定,石蜡切块后进行苏木精-伊红(HE)染色,然后观察。
1.2.3大鼠血清生化检测 使用全自动生化仪(德国罗氏,Cobas6000)测定大鼠的血清标本,测定指标分别为:三酰甘油(TG)、总胆固醇(TC)、丙氨酸氨基转移酶(AST)、天冬氨酸氨基转移酶(ALT)、碱性磷酸酶(ALP)、高密度脂蛋白(HDL)和低密度脂蛋白(LDL)。
1.2.4大鼠肝脏病理切片 挑取大鼠肝脏组织,放入磷酸缓冲液中进行漂洗,漂洗干净后放入甲醛溶液中进行固定,然后交由医院病理科进行下一步的大鼠肝脏病理切片(HE染色)。
1.2.5FTO蛋白和FoxO1蛋白表达测定 参照张洁蕾[6]免疫组织化学S-P法对大鼠的FTO蛋白和FoxO1蛋白在肝脏中的表达进行测定。

2 结 果
2.1模型组大鼠与对照组大鼠的肝质量、体质量和肝脏指数比较 8周后,对照组大鼠皮毛光滑整齐,活动灵敏,精神状态良好,无不良特征,模型组大鼠皮毛特别有光泽,但较为肥胖,行动迟缓,习惯性待在原地打瞌睡。经过8周的喂养,模型组大鼠的肝脏质量、体质量和肝脏指数3项指标均高于对照组大鼠,差异有统计学意义(P<0.05)。见表1。

表1 两组大鼠的肝脏质量、体质量和肝脏指数比较
a:P<0.05,与对照组比较
2.2模型组大鼠与对照组大鼠的血清生化指标比较 经过8周喂养后,模型组大鼠的AST、ALT、LDL和ALP高于对照组,差异有统计学意义(P<0.01);模型组大鼠的TG和TC也高于对照组,差异有统计学意义(P<0.05);模型组大鼠的HDL低于对照组,差异有统计学意义(P<0.05)。见表2。

表2 两组大鼠的血清生化指标比较
a:P<0.01,b:P<0.05,与对照组比较
2.3模型组大鼠与对照组大鼠的肝脏组织病理比较 经HE染色法染色后显示,模型组大鼠肝小叶部分产生很多脂肪变性,有炎症产生(图1B);而对照组大鼠肝小叶部分则没有脂肪变性,也没有肝脏细胞产生炎症(图1A)。
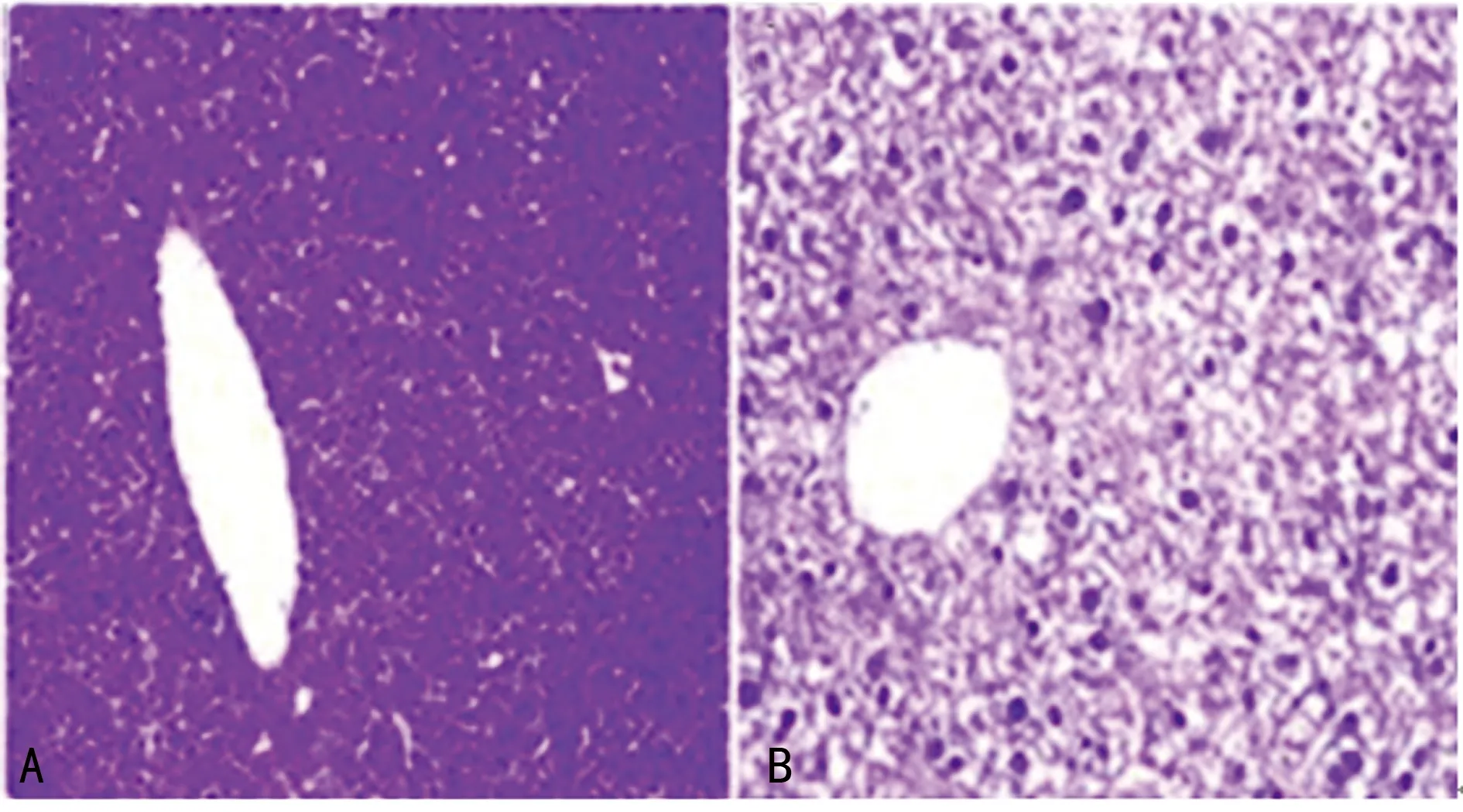
A:对照组;B:模型组
图1两组大鼠的肝脏组织病理切片比较
2.4模型组大鼠与对照组大鼠的FTO蛋白与FoxO1蛋白在肝脏组织的表达比较 选取合适的肝脏组织进行固定、切片,然后经免疫组织化学染色处理,结果显示模型组大鼠的FTO蛋白和FoxO1蛋白在肝脏中的表达积分(6.57±1.86vs.4.71±1.56)与对照组(1.28±0.49vs.2.67±0.99)相比,差异有统计学意义(P<0.05)。
3 讨 论
现代社会随着生活节奏和饮食结构的变化,脂肪肝的患者数量逐年上升,这其中NAFLD患者占有很高的比例。有研究显示,人体内的脂肪酸和脂肪酸的代谢物会沉积在肝脏细胞内,可能会导致NAFLD的发病[7-8]。但目前为止,NAFLD的发病机制并没有完全阐明,因此,也缺乏相应的有效治疗药物和手段,这使得NAFLD对患者的危害极其严重,发现NAFLD的发病机制并寻找有效的药物和治疗方法十分重要。
近年来的研究发现,肥胖与人体内血脂升高有紧密的联系,而肥胖和人体内的血脂升高都会导致NAFLD发病风险的明显升高[9]。环境和饮食结构对人体的肥胖程度及体内血脂水平影响巨大,但是随着科学研究的深入,发现人体本身的基因对此也有巨大影响,FTO可以通过调节人对食物的欲望和能量代谢来调节人体的肥胖及血脂水平。同时,该基因还可以在下丘脑、胰岛等器官中表达,与许多内科疾病的产生有很大关系[2]。变异后的FTO基因也可导致相关疾病的产生,如2型糖尿病[10]。FTO可以使MDA和SOD这两种物质在人体内的水平升高,这与NAFLD的发病关系密切,表明FTO在NAFLD的发病机制中具有某种重要作用[3]。FTO在NAFLD患者体内细胞表达升高时,患者体内细胞的脂肪形成和氧化应激水平均会显著增加[11]。FoxO1活性增高时,可以引起2型糖尿病的发病或人体血脂水平的升高[12]。有研究显示,当FoxO1在鼠肝脏内过表达时,会使鼠体内游离脂肪酸累积,进而导致肝脏细胞产生脂肪变性[13]。
本研究通过实验,证实了在模型组大鼠的肝脏中,FTO蛋白和FoxO1蛋白的表达与NAFLD的发病具有紧密联系,这说明FTO与FoxO1一起相互作用可能扰乱正常的能量和脂肪代谢。
[1]DayCP,JamesOF.Steatohepatitis:ataleoftwo"hits"?[J].Gastroenterology,1998,114(4):842-845.
[2]Frayling TM,Timpson NJ,Weedon MN,et al.A common variant in the FTO gene is associated with body mass index and predisposes to childhood and adult obesity[J].Science,2007,316(5826):889-894.
[3]Guo JJ,Ren W,Li AM,et al.Fat mass and Obesity-Associated gene enhances oxidative stress and lipogenesis in nonalcoholic fatty liver disease[J].Dig Dis Sci,2013,58(4):1004-1009.
[4]祝红梅.FoxO1在氧化应激诱导糖异生/胰岛素抵抗机制中的作用[D].泸州:西南医科大学,2011.
[5]Pitman RT,Fong JT,Billman P,et al.Knockdown of the fat mass and obesity gene disrupts cellular energy balance in a Cell-Type specific manner[J].PLoS One,2012,7(6):e38444.
[6]张洁蕾.FTO与FoxO1在非酒精性脂肪肝中的表达及其意义[D].郑州:郑州大学,2014.
[7]Forbes S,Taylor-Robinson SD,Patel N,et al.Increased prevalence of non-alcoholic fatty liver disease in European women with a history of gestational diabetes[J].Diabetologia,2011,54(3):641-647.
[8]刘慧.非酒精性脂肪性肝病患者肠道菌群变化与胰岛素抵抗及血清LPS、TNF-α、IL-6的相关性研究[D].合肥:安徽医科大学,2013.
[9]陈青云,吴耀生,冼苏,等.肥胖与血脂、血压、脂肪肝等因素关系的Logistic回归分析[J].广西医学,2002,24(1):1-4.
[10]Bravard A,Lefai E,Meugnier E,et al.FTO is increased in muscle during type 2 diabetes,and its overexpression in myotubes alters insulin signaling,enhances lipogenesis and ROS production,and induces mitochondrial dysfunction[J].Diabetes,2011,60(1):258-268.
[11]吴雪,郑丽丽.肥胖基因FTO对非酒精性脂肪性肝病的作用机制[J].河南医学研究,2015,24(7):64-66.
[12]Valenti L,Rametta R,Dongiovanni P,et al.Increased expression and activity of the transcription factor FOXO1 in nonalcoholic steatohepatitis[J].Diabetes,2008,57(5):1355-1362.
[13]Matsumoto M,Han S,Kitamura T,et al.Dual role of transcription factor FoxO1 in controlling hepatic insulin sensitivity and lipid metabolism[J].J Clin Invest,2006,116(9):2464-2472.
Expressionofobesity-relatedgeneandforkheadtranscriptionfactorsinliverofnonalcoholicfattyliverdiseaseratmodel*
ChenYiyao,ChenYi,HeZhoutao,CaiManni
(DepartmentofGastroenterology,HainanProvincialPeople′sHospital,Haikou,Hainan570311,China)
ObjectiveTo research the obesity-related gene (FTO) and forkhead transcription factors O1 (FoxO1) protein expression level in the livers of non-alcoholic fatty liver disease(NAFLD) rat model.MethodsThe animal model of NAFLD in rats was prepared by feeding high energy and high fat feed.Then the rat blood and liver tissue were collected for detecting the liver index and blood biochemical indexes,including triglycerides(TG),total cholesterol(TC),alanine aminotransferase(AST),aspartate aminotransferase(ALT),alkaline phosphatase(ALP),high-density lipoprotein (HDL) and low density lipoprotein(LDL);the liver pathological examination was performed;FTO protein and Fox O1 protein expression levels in rat liver were detected by using the immunohistochemical assay.ResultsThe rat liver weight,body weight and liver index after 8 weeks in the model group were higher than those in the control group,the difference was statistically significant (P<0.05);the levels of AST,ALT,LDL,ALP,TG and TC in the model group were higher than those in the control group,the difference was statistically significant (P<0.05),the HDL level in the model group was lower than that in the control group,the difference was statistically significant (P<0.05);the model group produced steatosis and inflammation in hepatic lobule part,while the control group had no these lesions;the FTO protein and FoxO1 protein expression levels in liver of the model group were higher than those in the control group,the difference was statistically significant (P<0.05).ConclusionFTO and FoxO1 interaction may disturb the normal energy and fat metabolism.
forkhead transcription factors;nonalcoholic fatty liver disease;energy metabolism;lipid metabolism;obesity related gene
海南省卫生与计划生育委员会基金资助项目(14A210192); 海南省自然科学基金资助项目(814310);海南省中药现代化专项基金资助项目(2015ZY02)。
陈益耀(1979-),副主任医师,硕士,主要从事非酒精性脂肪性肝病的基础与临床研究。
R322.4
A
1671-8348(2017)30-4185-02
2017-01-30
2017-04-18)
