南苜蓿总皂苷改善2型糖尿病大鼠糖代谢的作用机制*
2017-11-07宋红萍黄徐英徐雅敏
程 静,宋红萍,黄徐英,刘 萍,徐雅敏
(武汉市普爱医院药学部 430033)
·论著· doi:10.3969/j.issn.1671-8348.2017.29.001
南苜蓿总皂苷改善2型糖尿病大鼠糖代谢的作用机制*
程 静,宋红萍△,黄徐英,刘 萍,徐雅敏
(武汉市普爱医院药学部 430033)
南苜蓿总皂苷;糖尿病,2型;抗炎;糖代谢;胰岛素抗药性
随着社会经济的发展,人们的饮食结构发生改变,加之不健康的生活方式,我国糖尿病患病率迅速上升,糖尿病及其并发症已经成为严重的社会公共卫生问题。其中,2型糖尿病(T2DM)患者所占比例达90%~95%[1]。目前广泛应用的口服降糖药有磺酰脲类、双胍类、噻唑烷二酮类、α-糖苷酶抑制剂及胰升糖素样肽-1(GLP-1)类似物,但都有不同程度的不良反应[2]。从中草药中寻找安全、有效、不良反应小、多靶点作用的替代品,已成为目前研究的热点。传统医学将糖尿病及其并发症归于“消渴”“消癉”等范畴,认为其形成机制以阴虚为本,燥热为标,并有血瘀贯穿病程的始终[3]。南苜蓿系豆科植物苜蓿属植物南苜蓿(Medicago polymorpha L.)的全草,味苦、平、无毒,具有清热解毒、利湿退黄、通淋排石的功效,主要用于治疗黄疸、尿路结石、痔疮出血、肠炎等[4]。糖尿病患者常食用苜蓿食品具有降血糖的作用,研究表明其有效成分主要为皂苷类、黄酮类、多糖类等[5-6]。此外,本实验室前期预实验发现南苜蓿总皂苷(TSMP)对四氧嘧啶小鼠具有降糖作用,体外可促进HepG2细胞的葡萄糖消耗。本研究基于文献研究和本实验室前期研究结果,系统地探索TSMP防治T2DM的作用机制,为疾病防治提供新的科学依据。
1 材料与方法
1.1材料
1.1.1实验动物 健康无特殊病原体(SPF)级雄性SD大鼠70只,体质量180~220 g,由湖北省疾病预防控制中心提供[合格证号:SCXK(鄂)2008-0005]。高脂饲料由北京华阜康生物科技股份有限公司提供。
1.1.2实验药物 TSMP(中山市中健药物研究所有限公司,含量50%~60%,批号:100828);葡萄糖粉(重庆和平制药有限公司,批号:140109);胰岛素(江苏万邦生化医药有限公司,批号:1405202);盐酸二甲双胍片(中美上海施贵宝制药有限公司,批号:1403113)。链脲佐菌素(STZ)(美国Sigma公司,批号:S0130);胰岛素试剂盒(德国西门子医学诊断公司,批号:37037124);糖化血红蛋白(HbΑ1c)(美国Bio-Rad公司实验室,批号:64001873)。抗葡萄糖-6-磷酸酶(G-6-Pase)一抗(北京博奥森生物技术有限公司)、抗磷酸烯醇式丙酮酸羧激酶(PEPCK)一抗(美国Abcam公司)。白细胞介素(IL)-1、肿瘤坏死因子-α(TNF-α)酶联免疫吸附试验(ELISA)试剂盒(武汉伊莱瑞特生物科技股份有限公司,批号:AK0014SEP12001)。游离脂肪酸(FFA)、丙酮酸激酶(PK)、己糖激酶(HK)、葡萄糖激酶(GK)、瘦素(Leptin)、考马斯亮蓝试剂盒(南京建成生物工程研究所,批号:20131009、20130916、20131106、20131120、20131022、20131129);G-6-Pase、果糖-1,6-二磷酸酶试剂盒(上海宝曼生物科技有限公司,批号:20131210、20131128)。
1.1.3实验仪器 拜安康血糖仪及试纸(拜耳医药保健有限公司),Bio-Rad D-10型血液分析仪、电泳仪、转移电泳仪槽、蛋白电泳转膜装置、GelDoc2000型凝胶成像分析系统(美国Bio-Rad公司)。
1.2方法
1.2.1TSMP提取[7]取南苜蓿干燥全草,粉碎,50%乙醇提取2次,合并提取液,过滤,滤液回收溶剂,浓缩得浓缩液。将一次浓缩液加入大孔树脂(AB-8型大孔树脂),水-乙醇洗脱,收集乙醇洗脱液,回收乙醇,得二次浓缩液。减压干燥,过筛,得总皂苷,含量50%~60%。
1.2.2动物分组及处理[8]70只雄性SD大鼠中,挑选10只作为对照组,始终饲以基础饲料;其他大鼠给予高脂饲料喂养4周,大鼠禁食不禁水12 h后,按体质量腹腔注射STZ溶液30 mg/kg,72 h后经尾静脉采血测空腹血糖(FBG),FBG>11.1 mmol/L为糖尿病诊断标准。对照组腹腔注射同等体积的枸橼酸缓冲液。将成模的T2DM大鼠40只分为TSMP高剂量组(1.4 g/kg)、TSMP低剂量组(0.7 g/kg)、二甲双胍组(0.2 g/kg)、模型组(等量0.5%羧甲基纤维素钠),各10只。此时更换为正常饲料,同时开始灌胃,每天1次,连续给药4周。期间每周测1次血糖。
1.2.3指标检测
1.2.3.1血液指标及肝糖原 给药结束后,禁食12~16 h,乌拉坦(100 mg/kg)腹腔注射麻醉,下腔静脉取血测定胰岛素抵抗指数(IRI)、FBG、HbΑ1c、IL-1β、TNF-α、FFA及Leptin水平。测定肝糖原水平。
1.2.3.2糖代谢相关酶活性 处死大鼠后,立即解剖分离取得肝脏,在冰冷的生理盐水中漂洗,除去血液,剥掉结缔组织表面的脂肪。剪碎结缔组织,用生理盐水反复洗涤至无血色为止,再加生理盐水少许,用组织匀浆器做成匀浆,以3 000 r/min离心10 min后,取上清液测定PK、HK、GK、G-6-Pase及果糖-1,6-二磷酸酶的活性。
1.2.3.3肝脏组织中G-6-Pase、PEPCK蛋白的表达 采用试剂盒提供的方法,冰上操作,从肝脏组织中提取蛋白样品。然后以二喹啉甲酸(BCA)法测定各样品中蛋白质水平,-20 ℃保存。采用蛋白质印迹法(Western blot)分别检测蛋白样品中G-6-Pase、PEPCK蛋白的表达。
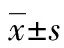
2 结 果
2.1各组大鼠IRI、FBG、HbΑ1c及肝糖原水平比较 与对照组比较,模型组大鼠的IRI及FBG、HbΑ1c水平明显升高(P<0.05)。治疗前,各给药组与模型组大鼠的FBG水平比较,差异均无统计学意义(P>0.05)。治疗后,与模型组比较,TSMP高剂量组和二甲双胍组大鼠的IRI及FBG、HbA1c水平均降低(P<0.05),TSMP高、低剂量组和二甲双胍组大鼠的肝糖原水平均升高(P<0.05),见表1。
2.2各组大鼠IL-1β、TNF-α、FFA及Leptin水平比较 与对照组比较,模型组大鼠的IL-1β、TNF-α、FFA、Leptin水平均明显升高(P<0.05)。治疗后,与模型组比较,TSMP高剂量组大鼠的IL-1β、TNF-α、FFA、Leptin水平均明显降低(P<0.05),见表2。
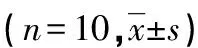
表1 各组大鼠IRI、FBG、HbA1c及肝糖原水平比较
*:P<0.05,与对照组比较;#:P<0.05,与模型组比较
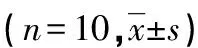
表2 各组大鼠IL-1β、TNF-α、FFA及Leptin水平比较
*:P<0.05,与对照组比较;#:P<0.05,与模型组比较
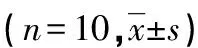
表3 各组大鼠PK、HK、G-6-Pase、果糖-1,6-二磷酸酶及GK活性比较
*:P<0.05,与对照组比较;#:P<0.05,与模型组比较
2.3各组大鼠PK、HK、G-6-Pase、果糖-1,6-二磷酸酶及GK活性比较 与对照组比较,模型组大鼠的PK、HK、GK活性均下降(P<0.05),G-6-Pase、果糖-1,6-二磷酸酶活性均上升(P<0.05)。治疗后,与模型组比较,TSMP高剂量组大鼠的PK、HK、GK活性均上升(P<0.05),G-6-Pase、果糖-1,6-二磷酸酶活性均下降(P<0.05),见表3。
2.4各组大鼠肝脏组织中G-6-Pase与PEPCK蛋白表达 给药4周后,与模型组比较,TSMP高剂量组大鼠G-6-Pase与PEPCK蛋白表达水平均降低(P<0.05),见图1。
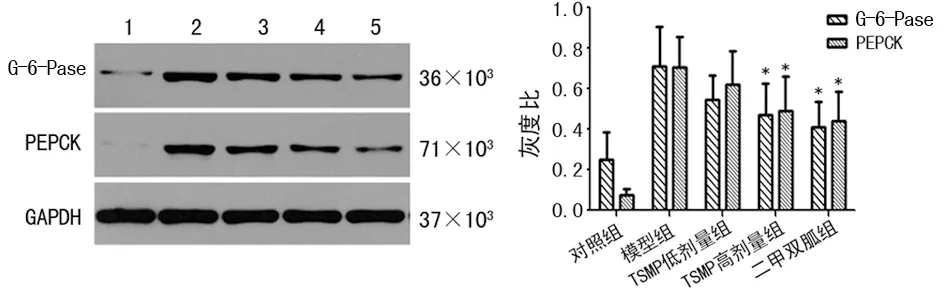
1:对照组;2:模型组;3:TSMP低剂量组;4:TSMP高剂量组;5:二甲双胍组;*:P<0.05,与模型组比较
图1 Western blot测定肝脏组织中G-6-Pase及PEPCK蛋白表达
3 讨 论
本研究以高脂饲料喂养加STZ诱导T2DM大鼠模型,观察TSMP的降血糖作用,并探讨其可能的作用机制。实验结果提示,TSMP干预后能有效地降低T2DM大鼠的FBG、HbA1c水平,升高肝糖原水平,增强葡萄糖在细胞内转化为糖原的储存形式而降低血糖。
T2DM中大多存在胰岛素抵抗、FFA升高及Leptin抵抗等,导致或参与炎性反应,进而影响肝脏、肌肉和脂肪细胞等胰岛素敏感细胞磷酸化,使胰岛素信号转导受阻,进而诱发胰岛素抵抗[9]。FFA是脂肪代谢的中间产物,是机体主要的能量来源,升高的FFA可以使胰岛素受体底物的丝氨酸残基磷酸化作用增强,影响胰岛素介导的葡萄糖转运,导致糖代谢障碍[10]。Leptin在脂肪细胞和胰岛素之间起负反馈的信号传递作用[11]。炎性因子通过炎症信号通路中介的激活参与肝脏和肌肉组织对胰岛素敏感性的影响,最终导致胰岛素的信号转导障碍,从而产生胰岛素抵抗[12]。实验发现模型组大鼠IL-1β、FFA、TNF-α及Leptin水平均明显升高,而TSMP能有效降低T2DM大鼠的IL-1β、FFA、TNF-α、Leptin水平及IRI。TSMP可能通过降低FFA水平,调节胰岛素介导的葡萄糖转运,改善糖代谢障碍;还可能减轻炎性反应和降低Leptin水平,从而缓解胰岛素抵抗作用。
肝脏通过血糖氧化分解、糖异生和肝糖原合成或分解对血液葡萄糖水平起到重要的调节作用。本实验对肝脏产生和消耗葡萄糖的关键酶进行研究。其中,HK参与葡萄糖分解过程,PK催化糖酵解,GK参与葡萄糖代谢过程,果糖-1,6-二磷酸酶参与糖异生途径,G-6-Pase是催化葡萄糖-6-磷酸水解为葡萄糖的关键酶。糖尿病状态中这些酶活性失衡,HK、PK、GK活性降低,G-6-Pase、果糖-1,6-二磷酸酶活性升高,导致血糖升高[13]。本实验结果显示,TSMP使T2DM大鼠肝脏组织中HK、PK、GK活性升高,G-6-Pase、果糖-1,6-二磷酸酶活性下降,降低血糖,提示TSMP可以改善T2DM大鼠肝脏内糖代谢紊乱,可能通过促进葡萄糖氧化代谢和抑制糖异生,减少葡萄糖生成,进而改善糖尿病。
胰岛素抵抗状态下,糖代谢紊乱,糖异生过度活跃,导致大量肝糖输出,血糖水平持续上升,从而产生T2DM。其中G-6-Pase和PEPCK是肝脏糖异生中两个关键的限速酶,抑制它们的表达水平能有效阻止肝脏糖异生,减少内源性葡萄糖生成,这是其治疗T2DM的重要机制[14]。本实验结果显示,TSMP可降低T2DM大鼠肝脏糖异生限速酶G-6-Pase和PEPCK的蛋白表达水平,抑制肝脏糖异生,减少葡萄糖生成,从而降低血糖。
综上所述,TSMP可以改善T2DM大鼠的糖代谢紊乱状态,其机制可能是促进肝细胞合成糖原,促进葡萄糖的利用并减少葡萄糖的生成,减轻炎性反应,改善胰岛素抵抗,从而达到对T2DM的治疗效应。
[1]Wang W,Xie Z,Lin Y,et al.Association of inorganic arsenic exposure with type 2 diabetes mellitus:a meta-analysis[J].J Epidemiol Community Health,2014,68(2):176-184.
[2]Li D,Peng C,Xie X,et al.Antidiabetic effect of flavonoids from Malus toringoides (Rehd.) Hughes leaves in diabetic mice and rats[J].J Ethnopharmacol,2014,153(3):561-567.
[3]刘传芃.玉液汤及其拆方对2型糖尿病大鼠影响的实验研究[D].武汉:湖北中医药大学,2016.
[4]夏素银,王成章.紫花苜蓿生物活性与应用的研究现状[J].中国食物与营养,2010,16(2):27-30.
[5]陈佩佩,闫景彩.苜蓿多糖的生物学功能及其在动物生产中的应用研究进展[J].广东饲料,2012,21(3):29-32.
[6]Assad T,Khan RA,Feroz Z.Evaluation of hypoglycemic and hypolipidemic activity of methanol extract of Brassica oleracea[J].Chin J Nat Med,2014,12(9):648-653.
[7]程静,程仁丽,刘忠,等.南苜蓿总皂苷对麻醉犬脑血流动力学的影响[J].中国医院药学杂志,2015,35(16):1478-1481.
[8]周才杰,黄鸣清,陈长青,等.丹酚酸B改善2型糖尿病大鼠糖脂代谢及胰岛素抵抗的实验研究[J].中国实验方剂学杂志,2012,18(13):233-237.[9]Tsai YC,Lin CL,Chen BH.Preparative chromatography of flavonoids and saponins in Gynostemma pentaphyllum and their antiproliferation effect on hepatoma cell[J].Phytomedicine,2010,18(1):2-10.
[10]崔鹏,田春雨,张艳萍,等.双益方对2型糖尿病大鼠SOD、MDA、FFA影响的实验研究[J].时珍国医国药,2013,24(8):1840-1842.
[11]刘永生,李晓坤,王金菊.苦瓜总皂苷对2型糖尿病模型大鼠胰岛素抵抗、脂联素和瘦素的影响[J].中国实验方剂学杂志,2010,16(9):177-179.
[12]陈璇,徐凛峰,汪悦,等.白虎二地汤改善2型糖尿病大鼠胰岛素抵抗分子机制的研究[J].南京中医药大学学报,2015,31(4):364-367.
[13]Gandhi GR,Jothi G,Antony PJ,et al.Gallic acid attenuates high-fat diet fed-streptozotocin-induced insulin resistance via partial agonism of PPARγ in experimental type 2 diabetic rats and enhances glucose uptake through translocation and activation of GLUT4 in PI3K/p-Akt signaling pathway[J].Eur J Pharmacol,2014,745:201-216.
[14]刘率男,刘泉,侯少聪,等.磷酸西格列汀改善2 型糖尿病KKAy小鼠糖脂代谢及作用机制探讨[J].中国临床药理学杂志,2015,31(3):206-211.
ThemechanismoftotalsaponinsfromMedicagopolymorphaonglycometabolismintype2diabeticrats*
ChengJing,SongHongping△,HuangXuying,LiuPing,XuYamin
(DepartmentofPharmacy,Pu′aiHospitalofWuhanCity,Wuhan,Hubei430033,China)
[Abstract]ObjectiveTo explore the effect of total saponins from Medicago polymorpha (TSMP) on glucose metabolism in type 2 diabetes mellitus (T2DM) rats and its possible mechanism.MethodsT2DM rats were established by feeding with fat diets and intraperitoneally injecting with STZ 30 mg/kg.The rats were divided into control group,model group,metformin group (0.2 g/kg),TSMP high dose group (1.4 g/kg) and TSMP low dose group (0.7 g/kg),which were administrated for four weeks.At the end of administration,blood samples were collected to determine insulin resistance index(IRI),levels of fasting blood glucose (FBG),glycosylated hemoglobin (HbA1c),hepatic glycogen,interleukin(IL)-1 β,tumor necrosis factor(TNF)-α,free fatty acids (FFA) and Leptin,and activities of pyruvate kinase (PK),hexokinase (HK),glucose-6-phosphatase (G-6-Pase),fructose-1,6-bisphosphatase and glucokinase (GK).Western blot was used to detect the expression levels of G-6-Pase and phosphoenolpyruvate carboxykinase (PEPCK) proteins.ResultsCompared with the model group,high dose (1.4 g/kg) TSMP decreased IRI,levels of FBG,HbA1c,IL-1β,TNF-α,FFA and Leptin,and activities of G-6-Pase and fructose-1,6-bisphosphatase in T2DM rats (P<0.05),while increased level of hepatic glycogen,and activities of PK,HK and GK (P<0.05).Moreover,high dose (1.4 g/kg) TSMP down-regulated expression levels of G-6-Pase and PEPCK protein in liver tissues.ConclusionChronic administration of TSMP can improved glucose homeostasis in T2DM rats,which might be related to promoting utilization of glucose,and alleviating inflammatory and insulin resistance.
total saponins from Medicago polymorpha;diabetes mellitus,type 2;anti-inflammatory;glycometabolism;insulin resistance
国家自然科学基金资助项目(81503146);武汉市卫生计生委中医药类重点课题资助项目(WZ15A01)。
程静(1983-),主管药师,硕士,主要从事中药药理学研究。△
,E-mail:Songhongping@126.com。
目的探讨南苜蓿总皂苷(TSMP)对2型糖尿病(T2DM)大鼠糖代谢的作用及其可能的机制。方法采用高脂加小剂量链脲佐菌素诱导T2DM大鼠模型,将大鼠分为对照组、模型组、二甲双胍组(0.2 g/kg)、TSMP高剂量组(1.4 g/kg)、TSMP低剂量组(0.7 g/kg),连续给药4周,末次给药后测定胰岛素抵抗指数(IRI)、空腹血糖(FBG)、糖化血红蛋白(HbA1c)、肝糖原、白细胞介素(IL)-1β、肿瘤坏死因子-α(TNF-α)、游离脂肪酸(FFA)、瘦素(Leptin)水平,以及丙酮酸激酶(PK)、己糖激酶(HK)、葡萄糖-6-磷酸酶(G-6-Pase)、果糖-1,6-二磷酸酶、葡萄糖激酶(GK)的活性;检测肝脏组织中G-6-Pase、磷酸烯醇式丙酮酸羧激酶(PEPCK)蛋白的表达。结果与模型组比较,给予高剂量(1.4 g/kg)TSMP能降低T2DM大鼠IRI、FBG、HbA1c、IL-1β、TNF-α、FFA、Leptin水平,升高肝糖原水平,提高PK、HK、GK的活性,降低G-6-Pase、果糖-1,6-二磷酸酶的活性,并下调肝脏组织中G-6-Pase、PEPCK蛋白表达水平,差异均有统计学意义(P<0.05)。结论TSMP可以改善T2DM大鼠的糖代谢紊乱,可能与其促进葡萄糖的利用,减轻炎性反应和改善胰岛素抵抗有关。
R285.5
A
1671-8348(2017)29-4033-03
2017-03-18
2017-06-16)
