南海红树林内生真菌Phomopsis sp.ZZF08酰胺类次级代谢产物
2017-11-07陶移文凌惠平张建业佘志刚林永成
陶移文,凌惠平,张建业,佘志刚,林永成
(1. 广州医科大学药学院,广东 广州 511436;2. 中山大学化学与化学工程学院,广东 广州 510275)
南海红树林内生真菌Phomopsis sp.ZZF08酰胺类次级代谢产物
陶移文1,凌惠平1,张建业1,佘志刚2,林永成2
(1. 广州医科大学药学院,广东 广州 511436;2. 中山大学化学与化学工程学院,广东 广州 510275)
采用色谱技术对红树林内生真菌Phomopsissp.ZZF08代谢产物进行分离纯化,MS、NMR、X-单晶衍射及与文献数据比对等方法确定其结构,MTT法考察其对体外人鼻咽癌细胞KB和KBv200的毒性作用。结果表明,由红树林内生真菌Phomopsissp.ZZF08培养液中分离得到12个酰胺类化合物,经鉴定,分别为viridicatol (1)、cytochalasin H (2)、cytochalasin IV (3)、葡萄糖神经酰胺 (4)、△4(5)(E)-鞘氨醇-正十六碳酰胺 (5)、尿囊素 (6)、胸腺嘧啶 (7)、尿嘧啶 (8)、环(亮-甘)二肽 (9)、环(亮-丙)二肽 (10)、环(苯丙-甘))二肽 (11)和环(苯丙-丙)二肽 (12),其中,化合物1,2,3,4,5为首次从湛江红树林内生真菌Phomopsissp.中发现。体外细胞毒性实验表明化合物2,3对KB细胞和KBv200细胞有较强细胞毒性。
红树林;内生真菌;拟茎点霉菌;酰胺类次级代谢产物
红树林内生真菌因其独特的生存环境而产生了独特的代谢方式,为其产生结构新颖,活性出众的次级代谢产物提供了可能[1-3]。拟茎点霉属Phomopsis(Sacc.) Bubak在分类学上属于半知菌亚门、腔孢纲、球壳孢目、球壳孢科,其种类多、分布广,活性代谢产物丰富[4-7]。
Phomopsissp. ZZF08为广东省湛江红树林植物树皮内生真菌,其代谢产物丰富。对该菌进行大规模发酵后,分离得到12个酰胺类化合物。运用现代波谱技术,单晶衍射技术以及文献比对等方法,确定这些化合物为viridicatol (1)、cytochalasin H (2)、cytochalasin Ⅳ (3)、葡萄糖神经酰胺 (4)、△4(5)(E)-鞘氨醇-正十六碳酰胺(5)、尿囊素(6)、胸腺嘧啶 (7)、尿嘧啶(8)、环(亮-甘)二肽(9)、环(亮-丙)二肽(10)、环(苯丙-甘)二肽(11)和环(苯丙-丙)二肽(12),结构式见图1。

图1 化合物的结构式Fig.1 The structures of compounds
1 仪器与材料
Varian INOVA 500NB/400NB/300NB核磁共振波谱仪 (美国Varian公司);VG ZAB-HS 双聚焦质谱仪 (英国VG公司);VG Autospec-500 质谱 (英国VG公司);EQUINOX55 红外仪 (德国Bruker公司);UV-2501PC 紫外-可见分光光度计 (日本岛津公司);Vario EL CHNS-O元素分析仪 (德国 Elementar公司); Bruker XSCANS 衍射仪 (德国Bruker公司); Polaptronic HNQW5 型旋光仪 (德国Schmidt-Haensch 公司);北京 X-4 型显微熔点仪;Agilent 1100 型高效液相色谱仪(美国Agilent公司)。薄层色谱硅胶GF254和柱色谱用硅胶 (青岛海洋化工厂有限公司);常规试剂均为AR。
2 提取与分离
发酵培养基为GYP为:φ(葡萄糖)=1%,φ(蛋白胨)=0.2%,φ(酵母膏)=0.1%,φ(粗海盐)=0.2%,pH 7.0,室温静置培养30 d。
用纱布过滤发酵液,分离菌体和发酵液。发酵液浓缩至5 L,用乙酸乙酯萃取3次;菌体晾干,甲醇浸泡至无色。将萃取物和浸提物合并,经硅胶柱层析、高效液相色谱、重结晶等操作,获得12个纯化合物。
3 结构鉴定
化合物1:白色块状固体,θmp250~252 ℃,HR EI MSm/z253.072 9,结合1H和13C NMR数据可确定该化合物分子式为C15H11NO3,不饱和度U=11提示分子中可能存在芳香环。红外光谱数据(35 44,3 423,3 239,1 654和1 245 cm-1)暗示分子中有羟基、酰胺和芳环存在。1H NMR (DMSO-d6, 500 MHz)δ: 9.06 (1H, s), 7.34 (1H, dd,J=1.0, 8.0 Hz), 7.07 (1H, ddd,J= 1.0, 8.0, 8.0 Hz), 7.32 (1H, dt,J= 1.0, 8.0 Hz), 7.09 (1H, dd,J= 1.0, 8.0 Hz), 6.71 (1H, dd,J= 1.5, 2.5 Hz), 6.82 (1H, ddd), 7.29 (1H, dd,J= 8.0, 8.0 Hz), 6.72 (1H, ddd,J= 1.0, 1.5, 8.5 Hz), 12.16 (1H, s), 9.55 (1H, s);13C NMR (DMSO-d6, 125 MHz)δ: 158.3, 157.3, 142.2, 134.9, 133.1, 129.5, 126.5, 124.5, 124.2, 122.2, 120.9, 120.4, 116.8, 115.3, 114.7。1H NMR显示该化合物含8个芳香区质子峰和三个可交换的质子信号(δH= 9.06, 9.55,12.16),其中δH= 12.16应为螯合羟基质子峰。13C NMR和DEPT 135°谱图表明化合物存在8个芳香CH(129.5、126.5、124.5、122.2、120.4、116.8、115.3和114.7),6个芳香季碳(120.9、124.2、133.1、134.9、142.2和157.3)以及1个酰胺基团(δC: 158.3)。这些基团对应8个不饱和度,相对于11个不饱和度来说分子中还剩3个不饱和度,暗示化合物结构中应该含3个环。一维氢谱和1H-1H COSY谱图表明一组4个芳香次甲基质子依次连接在一起的,另一组3个芳香质子也是依次连接在一起的。综合上述信息,推导出该化合物的初步结构是苯酚取代的异喹啉结构,经文献查阅后确定化合物1为viridicatol[8]。X-单晶衍射进一步证实其结构,其单晶结构见图2。
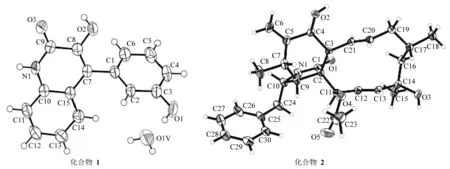
图2 化合物1和2的分子结构图Fig.2 Molecular structures of compounds 1 and 2
化合物2:无色块状晶体,θmp272~273 ℃,HR EI MSm/z493.285 1,结合1H和13C NMR数据可确定该化合物分子式为C30H39NO5。1H NMR (DMSO-d6, 500 MHz)δ: 5.68 (1H, s), 3.24 (1H, m), 2.11 (1H, t), 2.76 (1H, m), 3.81 (1H, d,J= 11.0 Hz), 2.92 (1H, t), 2.64 (1H, dd,J= 8.5, 13.5 Hz), 2.84 (1H, dd,J= 4.5, 13.5 Hz), 0.97 (3H, d,J= 6.5 Hz), 5.09 (1H, s), 5.33 (1H, s), 5.72 (1H, ddd,J= 1.0, 10.5, 15.5 Hz), 5.38 (1H, m,), 1.8 (1H, m), 2.03 (1H, m), 1.77 (1H, m), 1.55 (1H, dd,J=3.0, 14.0 Hz), 1.86 (1H, dd,J= 3.0, 14.0 Hz), 5.84 (1H, dd,J= 3.0, 13.5 Hz), 5.52 (1H, dd,J= 2.5, 13.5 Hz), 5.54 (1H, s), 1.03 (3H, d), 1.32 (3H, s), 2.26 (3H, s), 7.13 (2H, d), 7.31 (2H, dd), 7.23 (1H, t), 2.08 (1H, s);13C NMR (DMSO-d6, 125 MHz)δ: 174.2, 170.1, 147.9, 138.6, 138.1, 137.3, 129, 128.9, 127.1, 127.0, 125.9, 114.0, 77.4, 74.2, 69.7, 53.7, 53.7, 51.7, 50.3, 47.1, 45.5, 42.7, 32.8, 31.1, 28.4, 26.4, 20.8, 14.0。通过1H NMR、13C NMR 及2D NMR确定了2的结构为cytochalasin H[7]。该结构经X-单晶衍射证实,其单晶结构见图2。
化合物3:白色晶体,θmp124~126 ℃,EI MSm/z481。1H NMR (DMSO-d6, 500 MHz)δ: 7.99 (1H, d,J= 8.5 Hz),6.55 (1H, d,J= 8.5 Hz),3.82 (1H, dd,J= 5, 10 Hz), 2.43 (1H, m), 2.70 (2H, m), 1.15 (3H, s), 3.63 (3H, s), 7.56 (1H, d,J= 8.5 Hz),6.55 (1H, d,J= 8.5 Hz),3.93 (1H, d,J= 10 Hz), 2.43 (1H, m), 2.46 (2H, m), 3.63 (3H, s),1.08 (3H, s),11.34 (1H, br s),11.62 (1H, br s), 2.05 (2H, br s), 13.76 (2H, br s);13C NMR (DMSO-d6, 125 MHz)δ: 188.43, 188.43, 179.92, 179.12, 170.99, 170.92, 162.22, 159.98, 159.87, 157.22, 141.94, 141.87, 118.31, 116.70, 110.13, 108.33, 107.69, 107.51, 103.00, 102.73, 86.08, 86.08, 77.06, 76.8, 53.07, 52.98, 36.77, 36.66, 30.87, 30.87, 18.24, 18.10。将核磁数据与文献[9]相对照, 证实3为cytochalasin Ⅳ。
化合物4:白色粉末状固体,θmp178~180 ℃。LC MSm/z754.4 [M+1]+。结合1H、13C NMR推断分子式为C43H79NO9,不饱和度U=5。1H NMR (DMSO-d6, 500 MHz )δ: 3.55 (1H, dd,J= 10.5, 4.5 Hz), 3.91 (1H, dd,J= 10.5, 6.0 Hz), 3.81 (1H, m), 4.01 (1H, ddd,J= 7.0, 6.0, 6.0 Hz), 5.40 (1H, dd,J= 15.0, 6.0 Hz), 5.59 (1H, dt,J= 15.0, 6.0 Hz), 1.97 (2H, m), 1.85 (2H, m), 1.98 (2H, m), 5.09 (1H, t,J= 7.0 Hz), 1.93 (m, 2H), 1.28 (m, 12H), 1.28 (2H, m), 0.84 (3H, t,J= 7.5 Hz), 1.51 (3H, s), 7.29 (1H, d,J= 9.0 Hz), 5.60 (1H, d,J= 5.0 Hz), 4.80 (1H, d,J= 7.0 Hz), 4.30 (1H, ddd,J= 5.5, 5.0, 1.5 Hz), 5.46 (1H, dd,J= 16.0, 5.5 Hz), 5.69 (1H, ddt,J= 16.0, 7.5, 1.5 Hz), 1.96 (2H, m), 1.35 (2H, m), 1.28 (20H, m), 1.28 (2H, m), 0.84 (3H, t,J= 7.5 Hz), 4.12 (1H, d,J= 8.0 Hz), 2.98 (1H, ddd,J= 8.0, 8.0, 4.5 Hz), 3.20 (1H, m), 3.08 (1H, m), 3.09 (1H, m), 3.45 (1H, ddd,J= 11.0, 5.5, 6.0 Hz), 3.67 (1H, ddd,J= 11.0, 6.0, 2.0 Hz), 4.79 (1H, d,J= 4.5 Hz), 4.74 (1H, d,J= 4.5 Hz), 4.73 (1H, d,J= 5.0 Hz), 4.34 (1H, t,J= 6.0 Hz);13C NMR (DMSO-d6, 125 MHz)δ: 171.9, 134.7, 130.8, 130.7, 130.7, 128.9, 123.3, 103.3, 76.7, 76.5, 73.2, 71.8, 70.5, 70, 68.3, 61.0, 52.9, 38.8, 31.9, 31.0, 28.5-31.4, 28.5-31.4, 28.4, 27.2, 27.1, 21.8, 21.8, 15.5, 13.6, 13.6。通过与文献[10]数据比对,确定化合物4为(3′E,4E)-1-(β-D-吡喃葡萄糖基)-3-羟基-2-[(2′-羟基十八碳酰基)氨基]-10-甲基-3′,4,9-十八碳三烯,即葡萄糖神经酰胺。
化合物5:白色固体,θmp95~97 ℃,FAB MSm/z583 [M+1]+。1H NMR (CDCl3, 300 MHz)δ: 6.36 (1H, d,J=5.5 Hz ), 5.78 (1H, dt,J= 16.0, 6.0 Hz), 5.30 (1H, dd,J= 16.0, 6.5 Hz), 4.32 (1H, t,J=5.0 Hz), 3.95 (1H, dd,J=11.0, 4.0 Hz), 3.91 (1H, d,J=3.5 Hz), 3.71 (1H, dd,J=11.0, 3.5 Hz), 2.25 (2H, m,J= 7.5 Hz), 2.05 (2H, q,J=6.0 Hz), 1.64 (2H, m), 1.35 (2H, t,J= 7.5 Hz), 1.26 (44H, br s), 0.88 (6H, t, J = 6.5 Hz);13C NMR (CDCl3, 75 MHz)δ: 173.1, 134.3, 128.8, 74.6, 62.5, 54.5, 36.9, 32.6, 31.9, 29.4~29.9, 25.8, 22.7, 14.0。化合物的波谱数据与文献[11]比较,确定化合物5为△4(5)(E)-鞘氨醇-正十六碳酰胺。
化合物6:白色细簇状晶体,θmp236~237 ℃;FAB MSm/z:159 [M+1]。1H NMR (DMSO-d6, 300 MHz)δ: 10.48 (1H, s), 7.98 (1H, s), 6.85 (1H, d,J= 8.0 Hz), 5.71 (2H, s), 5.24 (1H, dd,J= 8.0, 1.0 Hz);13C NMR (DMSO,75 MHz)δ: 173.5, 157.3, 156.7, 62.4;这与尿囊素的波谱数据相符合,单晶数据进一步确证了其结构。
化合物7:黄色固体;θmp233~235 ℃;1H NMR (DMSO-d6, 300 MHz)δ: 1.70 (3H, s), 7.20 (1H, d,J= 2.0 Hz), 10.48 (1H, s), 10.91 (1H, s)。其外观、TLC和氢谱与实验室常见化合物库中的胸腺嘧啶相符,所以可确定7为胸腺嘧啶。
化合物8:泥黄色固体,θmp>265 ℃ (升华);1H NMR (DMSO-d6, 300 MHz)δ: 5.43 (1H, dd,J= 1.0, 7.5 Hz), 7.23 (1H, d,J= 7.5 Hz), 10.72 (1H, s), 10.92 (1H, s)。外观、TLC和氢谱与实验室常见化合物库中的尿嘧啶一致,确定化合物8为尿嘧啶。
化合物9:白色粉末,θmp224~226 ℃;1H NMR (DMSO-d6, 300 MHz)δ: 8.20 (1H, br s), 7.91 (1H, br s), 3.79 (1H, m), 3.63 (2H, m), 1.77 (1H, m), 1.52 (2H, t,J= 6.9 Hz), 0.89 (3H, d,J= 6.9 Hz), 0.87 (3H, d,J= 6.9 Hz);13C NMR (DMSO-d6, 75 MHz)δ: 165.95, 168.31, 52.82, 44.23, 42.14, 23.78, 23.05, 21.96。参照标准谱图[12],化合物9可确定为环(甘-亮)二肽。
化合物10:白色粉末,在210~220 ℃升华。FAB MSm/z185 [M+1]。1H NMR (DMSO-d6, 300 MHz)δ: 8.11 (1H, s), 8.09 (1H, s), 3.86 (1H, m), 3.76 (1H, m), 1.82~1.86 (1H, m), 1.61~1.66 (1H, m), 1.71~1.76 (1H, m), 1.44 (3H, d,J= 7.0 Hz), 0.97 (3H, d,J= 6.5 Hz), 0.96 (3H, d,J= 6.5 Hz);13CNMR (DMSO-d6, 75 MHz)δ: 171.5, 170.9, 60.9, 54.8, 45.1, 25.3, 23.5, 22.1, 20.9。根据1H NMR,13C NMR和MS及与文献[13]对照可确定化合物10为环(丙-亮)二肽。
化合物11:白色粉末,加热到165~170 ℃升华;FAB MSm/z205 [M+1]+;1H NMR (DMSO-d6,300 MHz)δ: 8.09 (1H, br s), 7.81 (1H,br s), 7.17~7.27 (5H,m), 4.06 (1H,m), 3.38 (1H, d,J= 16.8 Hz), 3.15 (1H,dd,J= 12.9, 5.4Hz), 3.02 (1H, dd,J= 12.9, 5.4Hz), 2.81 (1H, d,J= 16.8 Hz);13C NMR (DMSO, 75 MHz)δ: 166.9, 165.5, 135.1, 129.7, 127.6, 126.1, 55.6, 43.7, 39.0。根据1H NMR,13C NMR和MS, 可确定化合物11为环(甘-苯丙)二肽,其数据与文献[14]基本一致。
化合物12:白色粉末,θmp>270 ℃,FAB MSm/z218。1H NMR (DMSO-d6, 300 MHz)δ: 8.09 (1H, br s), 8.00 (1H, br s), 7.15~7.29 (5H, m), 4.16~4.17 (1H, m), 3.60~3.62 (1H, m), 3.06~3.10 (1H, dd,J= 13.5, 4.5 Hz), 3.18~3.21 (1H, dd,J= 13.5, 4.5 Hz), 0.77 (3H, d,J= 7.0 Hz);根据1H NMR, MS及与文献[15]比对,确定12为环(苯丙-丙)二肽。
4 结果与讨论
在Phomopsissp.ZZF08中共分得12个酰胺类化合物,并对其结构进行了解析,证明其有产生大量酰胺类化合物的潜力。化合物1,2,3,4,5为首次从湛江红树林树皮内生真菌Phomopsissp.中分离得到。
此外,我们采用了MTT 法做了所有化合物对人鼻咽癌细胞株KB和人鼻咽癌细胞耐药株KBv200的体外肿瘤细胞毒性实验。用酶标仪以试验波长为570 nm,参比波长为450 nm测定A值。

绘制剂量反应回归曲线,计算半数杀伤浓度IC50,结果见表1。
化合物2,3对KB细胞株和KBv200细胞株表现出了良好的抑制活性,其IC50不高于1.41 μg/mL,其抗肿瘤作用机制有待进一步研究。
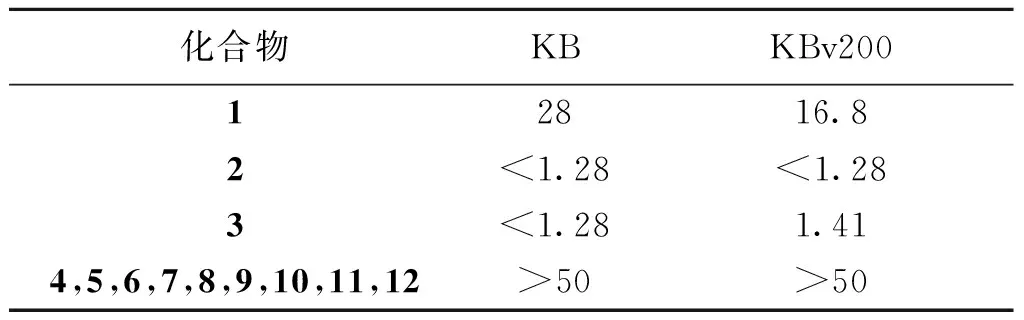
表1 12个化合物对KB、KBv200细胞的IC50Table 1 In vitro IC50 value (μg/mL) of 12 compounds against KB and KBv200 cells μg/mL
致谢: 本文的核磁共振谱、质谱等测试均在中山大学化学与化学工程学院或测试中心完成。
[1] DESHMUKH S K, VEREKAR S A, BHAVE S V. Endophytic fungi: a reservoir of antibacterials[J]. Frontiers in Microbiology, 2015, 5: 715.
[2] CHOWDHARY K, KAUSHIK N. Fungal endophyte diversity and bioactivity in the indian medicinal plantOcimumsanctumLinn[J]. Plos One, 2015, 10(11): e141444.
[3] MARTINEZ-LUIS S, CHERIGO L, HIGGINBOTHAM S, et al. Screening and evaluation of antiparasitic andinvitroanticancer activities ofPanamanianendophyticfungi[J]. Int Microbiol, 2011, 14(2): 95-102.
[4] CHITHRA S, JASIM B, JYOTHIS M, et al. EndophyticPhomopsissp. colonization in Oryza sativa was found to result in plant growth promotion and piperine production[J]. Physiol Plant, 2017, 22. doi: 10.1111/ppl.12556. [Epub ahead of print]
[5] ZHONG L Y, ZOU L, TANG X H, et al. Community of endophytic fungi from the medicinal and edible plantFagopyrumtataricumand their antimicrobial activity[J]. Tropical J Pharmaceutical Res, 2017, 16(2):387-396.
[6] TAO Y W, ZENG X J, MOU C B, et al.1H and13C NMR assignments of three nitrogen containing compounds from the mangrove endophytic fungus (ZZF08)[J]. Magn Reson Chem, 2008, 46(5): 501-505.
[7] TAO Y W, MOU C B, ZENG X J, et al.1H and13C NMR assignments of two new diaryl ethers phomopsin B and C from the mangrove endophytic fungus (ZZF08)[J]. Magn Reson Chem, 2008, 46: 761-764.
[8] TAO Y W, WANG Y. 3-Hydroxy-4-(3-hydroxyphenyl)-2-quinolone monohydrate[J]. Acta Cryst, 2011, E67: o2195-o2196.
[9] BUCHANAN M, HASHIMOTO T, ASAKAWA Y. Five 10-phenyl- [11]-cytochalasans from aDaldiniafungalspecies[J]. Phytochemistry, 1995, 40(1): 135-140.
[10] LIN Y C, WU X Y, FENG S, et al. A novel N-cinnamoylcyclopeptide containing an allenic ether from the fungusXylariasp. (strain # 2508) from the South China Sea[J]. Tetrahedron Lett, 2001, 42(3): 449-451.
[11] 匡云艳,苏镜娱,曾陇梅. 新的田野甾醇阿拉伯糖苷[J].中山大学学报(自然科学版),2002, 41(2): 64-67.
KUANG Y Y, SU J Y, ZENG L M. A new campesterol arabinside [J]. Acta Scientiarm Naturalium Universitis Sunyatseni, 2002, 41(2):64-67.
[12] 李德海,顾谦群,朱伟明. 海洋放线菌11014中抗肿瘤活性成分的研究 I.环二肽.[J]. 中国抗生素杂志, 2005, 30(8): 449-452.
LI D H, GU Q Q, ZHU W M, et al. Antitumor components from marine actinomycete 11014 I. Cyclic dipeptides [J]. Chinese J Antibiotics, 2005, 30(8): 449-452.
[13] 杨建香,黄日明,邱声祥,等. 南海红树林内生真菌GX-3代谢产物研究 [J]. 湖北农业科学, 2013, 52(11): 2558-2561.
YANG J X, HUANG R M, QIU S X, et al. Study on the metabolites of mangrove endohytic fungus GX-3 from the South China Sea [J]. Hubei Agricultural Sciences, 2013, 52(11): 2558-2561.
[14] 郭琼,王剑,姚俊华,等.一株南海珊瑚细菌L-4抗肿瘤活性次生代谢产物研究[J].中山大学学报(自然科学版),2013, 52(3): 77-82.
GUO Q, WANG J, YAO J H, et al. Anti-tumour secondary metabolites from the coral-derived bacteria L-4 of South China Sea[J]. Acta Scientiarm Naturalium Universitis Sunyatseni, 2013, 52(3):77-82.
[15] 邓芸,胡谷平,陈小洁,等. 南海珊瑚内生细菌Pelomonaspuraquaesp.nov(B-2)中环二肽类次生代谢产物研究[J].中山大学学报(自然科学版),2015, 54(3): 80-85.
DENG Y, HU G P, CHEN X J, et al. Research on cyclo-dipeptides from the coral-derived endophytic bacteriaPelomonaspuraquaesp. nov of South China Sea[J]. Acta Scientiarm Naturalium Universitis Sunyatseni, 2015, 54(3):80-85.
AmidemetabolitesofthemangroveendophyticfungusPhomopsissp.ZZF08fromtheSouthChinaSea
TAOYiwen1,LINGHuiping1,ZHANGJianye1,SHEZhigang2,LINYongcheng2
(1. School of Pharmaceutical Sciences,Guangzhou Medical University, Guangzhou 511436, China;2. School of Chemistry and Chemical Engineering,Sun Yat-sen University,Guangzhou 510275,China)
The amide metabolites ofPhomopsissp. ZZF08 from the South China Sea were isolated and purified by chromatography. Their structures were determined by MS, NMR, X-ray diffraction data and comparison with the literature data. Cytotoxicityinvitrowas performed by tetrazolium (MTT) assay. Twelve amide compounds were isolated, which were viridicatol (1), cytochalasin H (2), cytochalasin IV (3), glucosylceramide (4), ceramide (5), allantoin (6), thymine (7), pyridine (8), cyclo- (Leu-Gly) (9), cyclo-(Leu- Ala) (10), cyclo-(Phe- Gly) (11), and cyclo-(Phe- Ala) (12). Compounds1,2,3,4and5were isolated firstly fromPhomopsissp. collected from the mangrove bark of the Zhanjiang. In our cytotoxicity assays, compounds2and3exhibited strong cytotoxicity toward KB cells and KBv200 cells.
mangrove; endophytic fungus;Phomopsissp.; amide metabolites
O621.2
A
0529-6579(2017)05-0073-07
10.13471/j.cnki.acta.snus.2017.05.010
2017-05-08
广东省自然科学基金 (2016A030313588); 广东省科技计划项目 (2013B021100021);广州市教育局项目(1201610155)
陶移文(1975年生),男;研究方向天然药物化学;E-mail:yywentao@aliyun.com
