食管黏膜病变内镜黏膜下剥离术前和术后的临床病理分析
2017-11-04庄洁吴洪磊王洪波王红娟陈兆生郭建强许伟华
庄洁,吴洪磊,王洪波,王红娟,陈兆生,郭建强,许伟华
(山东大学第二医院 消化内科,济南 山东 250033)
食管黏膜病变内镜黏膜下剥离术前和术后的临床病理分析
庄洁,吴洪磊,王洪波,王红娟,陈兆生,郭建强,许伟华
(山东大学第二医院 消化内科,济南 山东 250033)
目的 回顾性分析早期食管癌和癌前病变的内镜下特征及临床病理特征,探讨内镜黏膜下剥离术(ESD)治疗的必要性、安全性和有效性。方法 纳入2013年5月-2016年4月经白光内镜及病理活检诊断为早期食管癌及上皮内瘤变的患者51例,分析毛细血管袢(IPCL)、碘染色、术前术后病理结果及相关并发症的发生情况。结果 51例患者共58处病变,IPCL分类58处病变中A型8处(13.79%),B1型44处(75.86%),B2型6处(10.34%);术前活检结果11处(18.97%)为低级别上皮内瘤变(LGIN),42处(72.41%)为高级别上皮内瘤变(HGIN),5处(8.62%)为鳞状细胞癌,术后病理结果10处(17.54%)病变为LGIN,27处(46.55%)为HGIN,21处(36.21%)病变为鳞状细胞癌,术前术后病理结果符合率为60.34%。微穿孔、狭窄和术后迟发性出血的概率分别为0.00%(0/58)、8.62%(5/58)和3.45%(2/58)。结论 ESD术后食管早癌的检出率显著增加,术前活检对诊断和治疗有指导意义,ESD治疗能减少食管早癌的漏诊。
早期食管癌;上皮内瘤变;内镜黏膜下剥离术
浸润性食管癌患者手术治疗后5年生存率低于40.00%,且术后复发常见;相比之下,早期病变患者内镜或手术治疗后的5年生存率超过90.00%[1]。随着内镜技术的发展,内镜下切除成为早期食管癌和癌前病变重要的诊断和治疗方法。对于没有远处淋巴结转移的早期食管癌患者,内镜下切除术是有效的微创治疗选择。本研究通过分析山东大学第二医院2013年5月-2016年4月51例病理诊断为早期食管癌及上皮内瘤变患者的毛细血管袢(intraepithelial papillary capillary loop,IPCL)、碘染色、术前术后病理结果及相关并发症的发生情况,探讨术前活检对早期食管癌诊断的重要性和内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)早期诊断的治疗价值。
1 资料与方法
1.1 一般资料
回顾性分析山东大学第二医院2013年5月-2016年4月收治的51例早期食管癌及上皮内瘤变患者。其中,男29例,平均(62.59±7.47)岁,女22例,平均(61.18±9.16)岁,全部患者平均(61.98±8.18)岁,手术时间(110.2±29.0)min,切除标本周长<1/2食管周径45处,<3/4食管周径11处,≥3/4食管周径2处。术后经病理诊断确认病变58处,病灶大小以长轴(最大长径)和面积(长轴×短轴)表示,病变部位胸上段3处,胸中段35处,胸下段20处。所有患者均术前病理活检诊断为上皮内瘤变或鳞状细胞癌,无食管静脉曲张,无淋巴结转移,无严重的心肺疾病史。向患者及家属说明手术的优点和风险,患者及家属同意行ESD,并签署手术同意书。研究经山东大学第二医院伦理委员会批准。
1.2 器材
窄带成像放大内镜(narrow band imaging magnifying endoscopy,ME-NBI)(GIF-H260Z;奥林巴斯,东京,日本),带送水功能的内镜(GIF-Q260J;奥林巴斯),Dual刀(KD-650L,奥林巴斯),IT刀(KD-612L,奥林巴斯),氩离子凝固器(APC300)等。
1.3 ESD治疗过程
ESD治疗过程包括4个步骤[2]:①ME-NBI和碘染色内镜确定病变范围;②氩离子或Dual刀标记病变边缘;③亚甲蓝、肾上腺素、甘油果糖、玻璃酸钠混合液黏膜下注射抬高病变;④用Dual刀、IT刀切开病变边缘黏膜,完整切除病变。标本处理:切除的黏膜使用大头针固定在泡沫板或木板上,标记口侧和肛侧,浸泡于4%的福尔马林中。患者均采用全身麻醉。ESD操作步骤见图1。
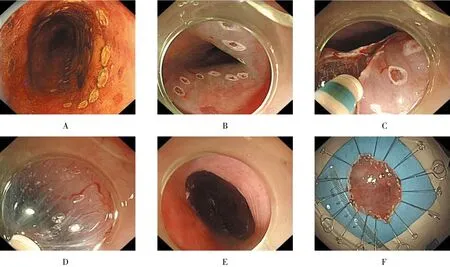
图1 ESD操作步骤Fig.1 Endoscopic submucosal dissection procedure
1.4 早期食管癌的评价
1.4.1 早期食管癌的内镜下特征 使用2011年日本食管协会新分类方法将通过窄带内镜成像(narrow band imaging,NBI)观察到的IPCL分为A型和B型[3]。IPCL分类的主要标准是血管的形态和宽度,无血管区域的面积。IPCLs的A型与正常没有区别。B型按照异型性的程度被分为3个亚型:B1、B2、B3型,其中B1的浸润深度为局限于黏膜上皮层,未突破基底膜(T1aEP)或局限于固有层(LPM),B2的浸润深度为局限于黏膜肌层,未突破黏膜肌层(T1aMM)或局限于黏膜下层上1/3(T1bSM1),B3的浸润深度为局限于黏膜下层的中1/3(T1bSM2)。碘染色结果评估使用MASAKI分级,此种分级[4]依据颜色深浅将碘染色分为4级:Ⅰ级浓染区,比正常食管黏膜染色深;Ⅱ级为正常表现,呈棕褐色;Ⅲ级为淡染区,多见于轻度和中度不典型增生,萎缩等;Ⅳ级为不染区,多见于重度不典型增生、原位癌、浸润癌。
1.4.2 相关并发症 微穿孔定义为在操作期间食管壁没有严重穿孔缺陷,影像学上有自由空气或皮下气肿证据。在操作过程中的轻微出血,依靠热凝术或钛夹立即止血。ESD术后大出血被定义为出血可能需要终止操作。术后迟发性出血被定义为术后5天血液中的血红蛋白含量下降>2 g/dl,伴有呕血和黑便。此外,术后ESD食管狭窄定义为吞咽困难需要内镜治疗。
1.5 随访
早期食管癌患者ESD术后3和6个月以及每年进行内镜检查,必要时进行活检,同时行肿瘤标记物及相关影像学检查,如随访活检发现局部复发或同时性或异时性多源食管癌,可选择行内镜治疗或手术治疗。同时性多源癌定义为手术后12个月内原癌变部位外的其他位置发现的新病变。异时性多源癌则为12个月后发现的新病变。
1.6 统计学方法
数据分析使用SPSS 21.0统计学软件,计量资料以均数±标准差(±s)表示,根据是否为正态分布使用t检验或秩和检验比较。计数资料表示为每个类别或频率的数目,使用χ2检验、连续校正χ2检验或Fisher确切概率法比较。P <0.05为差异有统计学意义。
2 结果
2.1 内镜下特征
根据2011年日本食管协会IPCL分型[3]显示58处病变中A型8处(13.79%),B1型44处(75.86%),B2型6处(10.34%),术后病理结果显示浸润深度局限于黏膜上皮层及固有层、黏膜肌层及黏膜下层分别为54和4处,在术前IPCL分型对病理结果预测的诊断正确率分别为100.00%和66.67%,碘染色中低级别上皮内瘤变(low-grade gastric intraepithelial neoplasia,LGIN)淡染和不染处分别为6和4处,高级别上皮内瘤变(high-grade intraepithelial neoplasia,HGIN)和早期食管癌的淡染和不染处分别为2和46处,两者之间的差异有统计学意义(χ2=17.26,P =0.000)。见表1。

表1 病理类型和碘染色结果的相关性 例Table 1 Correlations between pathological type and iodine staining results n
2.2 术前活检和术后病理结果诊断情况
术前病理活检显示LGIN、HGIN和鳞状细胞癌分别为11(18.97%)、42(72.41%)和5处(8.62%),术后病理诊断为LGIN、HGIN和鳞状细胞癌分别为10、27和21处,诊断符合率分别为9处(81.82%)、23处(54.76%)和3处(60.00%),总符合率为60.34%(35/58),术后病理较术前病理严重占34.48%(20/58),术后病理较术前病理轻占5.17%(3/58),见表2。HGIN和鳞状细胞癌的病理图片见图2。
2.3 术后病理类型和病灶直径、面积比较
LGIN的最大长径小于20 mm,面积(长轴×短轴)小于250 mm2,HGIN和鳞状细胞癌的最大长径均大于20 mm,面积大于250 mm2。表3显示,LGIN和HGIN、鳞状细胞癌比较,病灶最大长径的差异有统计学意义(t =-2.07,P =0.046;t =-2.14,P =0.041),病灶面积差异无统计学意义(t =-1.73,P =0.093;t =-1.66,P =0.107)。HGIN和鳞状细胞癌之间病灶最大长径(t =-0.39,P =0.702)和面积(t =-1.00,P =0.339)差异均无统计学意义。
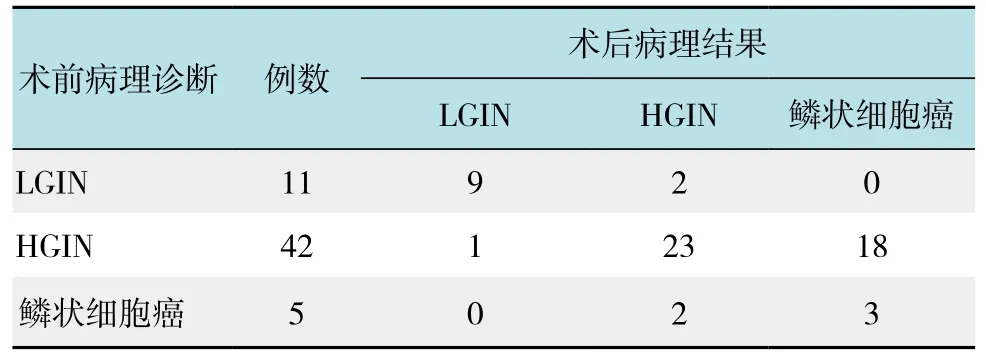
表2 术前和术后病理结果比较 例Table 2 Comparison of preoperative and postoperative pathologic results n
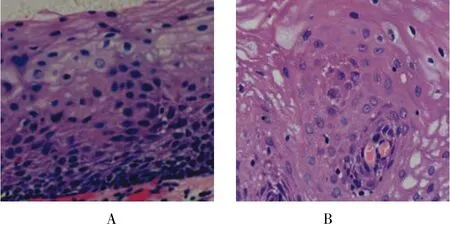
图2 HGIN和鳞状细胞癌术后病理Fig.2 Postoperative pathology of HGIN and squamous cell carcinoma
2.4 并发症及随访
整块切除率为94.83%(55/58),上皮内瘤变整块切除率36/37(97.30%)比鳞状细胞癌19/21(90.48%)高,但两组之间差异无统计学意义(P =0.547)。完全切除率为93.10%(54/58);上皮内瘤变完全切除率 35/37(94.59%)比鳞状细胞癌组19/21(90.48%)高,但两者差异无统计学意义(P =0.615)。6处病变在ESD术中肌层受损,使用钛夹、禁食及支持治疗后未出现皮下气肿等微穿孔表现。微穿孔和术后迟发性出血的概率分别为0.00%(0/0)和3.45(2/58)。5名患者出现ESD术后狭窄,经狭窄扩张术恢复。肿瘤环食管管腔<3/4周径56处,ESD术后狭窄3处,肿瘤环食管管腔≥3/4周径2处,ESD术后狭窄2处,肿瘤环食管管腔的范围与术后狭窄的发生率明显相关(P =0.006)。患者平均随访期(11.47±7.86)个月,随访期内2名患者出现同时多原性食管早癌,再次行ESD治疗,在随访期间未再出现局部复发。见表4。

表3 术后病理类型和病灶直径及面积Table 3 Postoperative pathologic types and diameter and area of lesions
3 讨论
根据2011年中国恶性肿瘤发病和死亡分析,食管癌相关死亡占肿瘤相关总死亡人数的第4位[5]。肿瘤侵犯增加、区域淋巴结转移和远处转移存在时生存时间大幅减少。食管早癌患者内镜或手术治疗后5年生存率超过90.00%[1]。因此,食管癌的早发现和早治疗十分重要。目前ESD已经成为早期食管癌的主要治疗手段。
随着内镜技术的发展,染色内镜和放大内镜用于早期食管癌的筛查,明显提高了食管癌筛查的阳性率。染色内镜主要是碘液和鳞状细胞中的糖原结合,正常细胞被染为棕色,食管癌及癌变病变由于缺乏糖原,常表现为淡染或不染。王国清等[6]对867个高危个体进行碘染,结果显示食管黏膜病灶碘染色图像与病理诊断结果呈正相关关系。张惠晶等[7]对323例患者进行碘染色,共有176处淡染或不染灶,重度不典型增生、早癌及轻、中度不典型增生的检出率分别为25.56%(45/176)和24.43%(43/176)。本组病变中LGIN淡染和不染处分别为6和4处,HGIN和早期食管癌的淡染和不染处分别为2和46处,两者之间差异有统计学意义(P =0.000)。
ME-NBI是图像增强技术,采用415(390~445)和540(530~550)nm的峰值波长渗透,因为这些光容易被血红蛋白吸收,在背景中正常黏膜表面的血管为棕色,癌和癌前病变的IPCL有形态和结构变化[8]。日本食管协会IPCL分型主要用于判断病变的浸润深度,大阪、仙台等医院对210个病变进行前瞻性研究显示病变局限于黏膜上皮层和固有层(T1aEPLPM)诊断正确率为92.44%(159/172),病变局限于黏膜肌层和黏膜下层上1/3(T1aMM-T1bSM1)诊断正确率为75.00%(21/28),病变局限于黏膜下层中1/3诊断正确率为100.00%(4/4)[3]。本组病变中T1aEPLPM、T1aMM-T1bSM1的诊断正确率分别为100.00%和80.00%,基本和先前的研究相似。
ESD用于胃肠道肿瘤的早期治疗,主要目标是达到肿瘤病灶的治愈性切除。关于ESD治疗疗效评估主要分为3个方面[9]:①整块切除:内镜下病变以整块的形式一次性切除;②完整切除:切除标本病理学诊断上垂直切缘和水平切缘均为阴性;③治愈性切除:在完整切除的基础上,无淋巴结转移或低淋巴结转移风险。由于早期食管癌可能伴随淋巴结转移风险,在ESD治疗前应该仔细评估患者的情况。
本组病例中整块切除率为94.83%,2处病变由于黏膜下层严重粘连,1处病变由于术中患者出现心律失常,改用圈套器分块切除,完整切除率为93.10%,本组资料的病理诊断符合率、术后病理诊断较术前严重、术后病理诊断较术前轻分别为60.34%(35/58)、34.48%(20/58)、5.17%(3/58)。术后病理诊断较术前严重和术后病理诊断较术前轻,可能原因有:①内镜下活检时取样较小,难以获得黏膜下层组织,无法精确进行病理判断;②食管癌的多中心起源及组织异型性多态性以及病理组织的嵌套,增加了准确评估的困难;③恶性肿瘤细胞虽然是从一个恶性转化的细胞单克隆增殖而来,但在生长过程中,出现不同的基因改变或其他分子的改变,其生长速度、侵袭能力、对生长信号的反应和对抗癌药物的敏感性等方面都可以有差异,成为异质性的肿瘤细胞群体,使病变中肿瘤细胞的群体分化程度不同[10],术后病理较术前活检轻,可能是由于活检时钳取了病变较重的部分;④医师的主观性对结果有一定的影响。两名患者出现同时多源性食管早癌,考虑与食管癌细胞的异质性相关。
EGUCHI等[11]对464个浅表食管鳞癌进行分析显示,浸润黏膜上皮层未突破基底膜的病变基本没有淋巴结转移,病变浸润固有层、黏膜肌层、黏膜下层的上1/3、中下1/3的淋巴结转移率为5.60%、18.00%、53.10%和53.90%。KIM等[12]分 析197例T1期食管癌患者显示M1、M2病变无淋巴结转移风险,黏膜癌和黏膜下癌的淋巴结转移率分别为6.25%(4/64)和 29.32%(39/133)(P <0.01),并推断肿瘤大小>20 mm、非平坦型和淋巴侵犯是淋巴结转移的显著独立危险因素。YAMASHINA等[13]对402个食管早癌患者进行随访发现EP/LPM、MM、SM1和SM2患者5年累计淋巴结转移率分别为0.40%、8.70%、7.70%和36.20%,多因素分析显示浸润深度和年龄是生存率的独立预测因子,多处碘不染区域、年龄、淋巴血管侵犯是异时性癌的独立预测因子。本组病例中LGIN病灶长轴小于20 mm,HGIN和食管鳞癌大于20 mm,建议LGIN患者病灶长轴大于20 mm,应尽快行内镜治疗。虽然研究中浸润深度为黏膜肌层和黏膜下层患者的淋巴结转移的数据略有不同,但是基本可明确的是,M1、M2病变几乎没有淋巴结转移出现,M3、SM1病变行ESD治疗前需要行CT或超声内镜等明确淋巴结转移和浸润深度等,若有淋巴结转移,则至外科行手术治疗。
出血、穿孔和狭窄是ESD术后的常见并发症,其中狭窄严重影响患者的生活质量。根据最近的研究,ESD 术后狭窄发生率为 5.00% ~ 17.20%[14-16]。ONOS等[17]研究65例浅表食管鳞癌患者显示,病变大于食管全周3/4和组织学深度达到黏膜肌层是ESD术后狭窄的可靠危险因素。术后狭窄的主要治疗方式有内镜球囊扩张术、病灶内注射类固醇激素和口服类固醇激素,HANAOKA等[18]进行前瞻性研究发现和不进行处理的ESD术后患者相比,ESD术后食管黏膜缺损超过3/4患者进行病灶内类固醇激素注射后,患者的狭窄率更低(P <0.01),进行内镜下球囊扩张术(endoscopic balloon dilation,EBD)次数更少(P <0.01)。EZOE 等[19]观察41名ESD术后患者显示接受预防性EBD的患者狭窄的发生率低,狭窄的严重程度低,狭窄持续的时间短(均P <0.05)。这些方法分别有以下缺点,花费高、有穿孔风险和激素的副作用。KATAOKA等[20]研究低剂量短周期服用激素的疗效,结果显示低剂量口服泼尼松组(17.60%)食管ESD术后狭窄率明显低于ESD单独组(68.70%)(P <0.01),且无激素相关不良事件发生。本组资料中5名患者出现ESD术后狭窄,2名患者经狭窄扩张术恢复,3名患者轻度狭窄,不影响生活,未予以治疗。
在黏膜下剥离期间肌层受损,由于食管没有浆膜层,可能会出现穿孔。在本研究中,未发生严重穿孔,但共有6处(10.34%)病变在ESD过程中出现肌层损伤,通过内镜下钛夹夹闭和积极支持治疗恢复。部分患者出现术中出血,使用电凝止血,没有影响手术的术中大出血。迟发性出血发生在2个患者(3.45%),通过内镜治疗和积极止血、补液等治疗后痊愈。没有ESD治疗相关的死亡。
综上所述,食管早癌的ESD治疗具有完全切除率高、创伤小,术后并发症少、生活质量高和花费少等特点,其中应注意活检为LGIN、病灶直径大于20 mm的患者应建议尽早行内镜治疗。本研究的局限性在于:①本组病例为单中心回顾性分析,结果存在偏倚;②病例数少,随访时间较短,应继续进行长期随访观察。因此,ESD治疗可作为早期食管癌的首选治疗,同时术前活检和先进内镜技术的应用能减少食管早癌的漏诊。
[1]RICE T W, RUSCH V W, APPERSON‐HANSEN C, et al.Worldwide esophageal cancer collaboration[J]. Dig Endosc, 2009,22(1): 1-8.
[2]FUJISHIRO M, KODASHIMA S, GOTO O, et al. Endosopic submuscosal dissection for esophageal squamous cell neoplasms[J].Dig Endosc, 2009, 21(5):109-115.
[3]OYAMA T, ISHIHARA R, TAKEUCHI M, et al. Tu1588 usefulness of Japan Esophageal Society classification of magnified endoscopy for the diagnosis of superficial esophageal squamous cell carcinoma[J]. Gastrointestinal Endoscopy, 2012, 75(4):AB456.
[4]MORI M, ADACHI Y, MATSUSHIMA T, et al. Lugol staining pattern and histology of esophageal lesions[J]. American Journal of Gastroenterology, 1993, 88(5): 701-705.
[5]陈万青, 郑荣寿, 曾红梅, 等. 2011年中国恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2015, 24(1): 1-10.
[5]CHEN W Q, ZHANG R S, ZENG H M, et al. Report of cancer incidence and mortality in China, 2011[J]. China Cancer, 2015,24(1): 1-10. Chinese
[6]王国清, 刘韵源, 郝长青, 等. 食管黏膜碘染色图像和浅表食管癌及癌前病变组织学的关系[J]. 中华肿瘤杂志, 2004, 26(6):342-344.
[6]WANG G Q, LIU Y Y, HAO C Q, et al. A comparative study of endoscopic image stained by iodine and histopathology in early esophageal cancer and precancerous lesions (dysplasia)[J]. Chinese Journal of Oncology, 2004, 26(6): 342-344. Chinese
[7]张惠晶, 罗纪, 王轶淳, 等. 碘染色在早期食管癌及癌前病变诊治中的价值[J]. 中国内镜杂志, 2010, 16(5): 459-461.
[7]ZHANG H J, LUO J, WANG Y C, et al. The evaluation of mucosal iodine staining in the diagnosis of dysplasia and early esophageal carcinoma[J]. China Journal of Endoscopy, 2010, 16(5): 459-461.Chinese
[8]YOSHIDA T, INOUE H, USUI S, et al. Narrow-band imaging system with magnifying endoscopy for superficial esophageal lesions[J]. Gastrointestinal Endoscopy, 2004, 59(2): 288-295.
[9]Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2014 (ver. 4)[J]. Gastric Cancer, 2017, 20(1):1-19.
[10]李玉林, 文继舫, 唐建武, 等. 病理学[M]. 第8版. 北京: 人民卫生出版社, 2013: 83-89.
[10]LI Y L, WEN J F, TANG J W, et al. Pathology[M]. 8th Edition.Beijing: People’s Medical Publishing House, 2013: 83-89.Chinese
[11]EGUCHI T, NAKANISHI Y, SHIMODA T, et al. Histopathological criteria for additional treatment after endoscopic mucosal resection for esophageal cancer: analysis of 464 surgically resected cases[J]. Mod Pathol, 2006, 19: 475-480.
[12]KIM D U, LEE J H, MIN B H, et al. Risk factors of lymph node metastasis in T1esophageal squamous cell carcinoma[J]. Journal of Gastroenterology & Hepatology, 2008, 23(4): 619-625.
[13]YAMASHINA T, ISHIHARA R, NAGAI K, et al. Long-term outcome and metastatic risk after endoscopic resection of superficial esophageal squamous cell carcinoma[J]. American Journal of Gastroenterology, 2013, 108(4): 544-551.
[14]TAKAHASHI H, ARIMURA Y, MASAO H, et al. Endoscopic submucosal dis section is superior to conventional endoscopic resection as a curative treatment for early squamous cell carcinoma of the esophagus (with video)[J]. Gastrointest Endosc,2010, 72(2): 255-264.
[15]REPICI A, HASSAN C, CARLINO A, et al. Endoscopic submucosal dissection in patients with early esophageal squamous cell carcinoma: results from a prospective western series[J].Gastrointest Endosc, 2010, 71(4): 715-721.
[16]HIGUCHI K, TANABE S, AZUMA M, et al. A phaseⅡ study of endoscopic submucosal dissection for super fi cial esophageal neoplasms (KDOG 0901)[J]. Gastrointest Endosc, 2013, 78(5):704-710.
[17]ONO S, FUJISHIRO M, NIIMI K, et al. Predictors of postoperative stricture after esophageal endoscopic submucosal dissection for super fi cial squamous cell neoplasms[J]. Endoscopy, 2009, 41(8):661-665.
[18]HANAOKA N, ISHIHARA R, TAKEUCHI Y, et al. Intralesional steroid injection to prevent stricture after endoscopic submucosal dissection for esophageal cancer: a controlled prospective study[J]. Endoscopy, 2012, 44(11): 1007-1011.
[19]EZOE Y, MUTO M, HORIMATSU T, et al. Ef fi cacy of preventive endoscopic balloon dilation for esophageal stricture after endoscopic resection[J]. Journal of Clinical Gastroenterology,2011, 45(3): 222-227.
[20]KATAOKA M, ANZAI S, SHIRASAKI T, et al. Ef fi cacy of short period, low dose oral prednisolone for the prevention of stricture after circumferential endoscopic submucosal dissection (ESD) for esophageal cancer[J]. Endoscopy International Open, 2014, 3(2):E113-E117.
Clinicopathological analysis of endoscopic submucosal dissection for esophageal mucosa lesion
Jie Zhuang, Hong-lei Wu, Hong-bo Wang, Hong-juan Wang, Zhao-sheng Chen,Jian-qiang Guo, Wei-hua Xu
(Department of Digestive Diseases, the Second Hospital of Shandong University,Jinan, Shandong 250033, China)
Objective To analyze the endoscopic and clinicopathologic features of early esopheal carcinoma and precancerous lesions and evaluate the necessity, ef fi cacy and safety of ESD in the treatment. Methods From May 2013 to April 2016, 51 consecutive patients underwent high-resolution video endoscopy and biopsy,con fi rmed diagnosis of early esophageal squamous cell carcinoma or intraepithelial neoplasia were included. There were capillary loops (IPCL), iodine-staining, preoperative and postoperative pathology, and complications to analyze. Results 51 patients had total 58 lesions, Type A, Type B1, Type B2 of IPCL classi fi cation were diagnosed in 8 (13.79%), 44 (75.86%), 6 (10.34%). Low-grade intraepithelial neoplasia (LGIN), high-grade intraepithelial neoplasia, early esophageal carcinoma of preoperative biopsy were diagnosed in 11 (18.97%), 42 (72.41%), 5(8.62%), low-grade intraepithelial neoplasia (LGIN), high-grade intraepithelial neoplasia, early esophageal carcinoma of postoperative pathology results were diagnosed in 10 (17.54%), 27 (46.55%), 21 (36.21%), concordance rate of pathological results were 60.34%. Complications included micro-perforations (0.00%), strictures (8.62%) and delayed hemorrhage (3.51%), respectively. Conclusion After endoscopic submucosal dissection, detection rate of early esophageal cancer increased signi fi cantly, preoperative biopsy had guidance signi fi cance in diagnosis and treatment,ESD treatment can reduce the missed diagnosis of early esophageal carcinoma.
early esophageal carcinoma; intraepithelial neoplasia; endoscopic submucosal dissection (ESD)
R735.1
A
10.3969/j.issn.1007-1989.2017.10.007
1007-1989(2017)10-0031-06
2017-01-17
许伟华,E-mail:xu30002001@163.com ;Tel:15153169860
(吴静 编辑)
