DDR1在卵巢癌细胞中对转移侵袭和化疗抗性的调控作用
2017-11-02张丹瑜邓宇傲刘新琼王玲
张丹瑜,邓宇傲,刘新琼,王玲
(深圳市人民医院 计划生育科,广东 深圳518020)
DDR1在卵巢癌细胞中对转移侵袭和化疗抗性的调控作用
张丹瑜,邓宇傲,刘新琼,王玲
(深圳市人民医院 计划生育科,广东 深圳518020)
目的探讨盘状结构域受体1(discoidin domain receptor 1,DDR 1)在卵巢癌细胞中对转移侵袭和化疗抗性的调控作用。方法选取我院2015年8月至2016年8月正在接受化疗治疗的40例原发性卵巢癌患者作为研究对象,在征得患者知情同意下切取病理组织并获得卵巢癌细胞后分别通过Talen基因敲除和过表达构建功能丧失和功能获得模型各40株,随后在此基础上进行转移侵袭功能实验以及顺铂联合紫杉醇的化疗抗性检测实验,以阐明其在卵巢癌细胞中对转移侵袭和化疗抗性的调控作用。结果功能获得模型的信号通路关键因子 IKKbeta、 P50、 P62 的表达水平分别为 833.47 ± 5.33、 796.89 ± 5.77、 685.55 ± 1.35, 功能丧失模型分别为 678.85 ± 5.25、 633.49 ± 5.61、 547.88 ± 1.32, 组间差异有统计学意义 (P <0.05)。 功能丧失模型和功能获得模型给药前的卵巢癌细胞凋亡率、 增殖抑制率分别为 (2.50 ± 0.50) %、 (7.85 ± 0.25) %以及 (2.91 ± 0.48) %、 (8.94 ± 0.26) %,差异无统计学意义 (P>0.05);给药后功能获得模型 24 h、48 h、72 h、96 h的细胞凋亡率和增殖抑制率分别为 (20.47±1.13) %、 (47.46 ± 1.34) %、 (95.96 ± 1.38) %、 (20.18 ± 1.32) %和 (19.77 ± 1.23) %、 (27.44 ± 1.56) %、 (36.46 ±1.14) %、 (50.67 ± 1.33) %, 功能丧失模型 24 h、 48 h、 72 h、 96 h 的细胞凋亡率和增殖抑制率分别为 (5.97 ± 1.03) %、(16.88 ± 1.32) %、 (70.10 ± 1.50) %、 (10.85 ± 1.15) %和 (12.44 ± 1.31) %、 (15.89 ± 1.11) %、 (19.98 ± 1.12) %、(21.28±1.22)%,差异有统计学意义 (P<0.05)。结论DDR 1在卵巢癌细胞中的生物功能主要涉及转移侵袭和化疗抗性调控两方面,同时IKKbeta、P50、P62为DDR 1靶向信号通路的关键因子,揭示卵巢癌全新靶向作用途径,具有重要的临床应用价值。
盘状结构域受体1;卵巢癌;转移;侵袭;化疗抗性
卵巢癌是目前女性最为常见的生殖器官恶性肿瘤之一,其发病率仅次于宫颈癌以及子宫体癌而位居第三位且给患者的生命安全带来严重威胁[1]。由于卵巢的胚胎发育、组织解剖结构、内分泌功能复杂,使得卵巢癌早期缺乏特异性临床表现,在被明确诊断时往往已经处于中晚期且绝大多数发生扩散转移,丧失了最佳手术时机[2]。化疗是目前治疗该疾病最有效的手段之一,尤其是随着基因研究的深入开展,通过调控靶向信号通路来提高化疗效果成为临床研究的热门议题。但是,DDR1在卵巢癌化疗治疗过程中是否具有调控肿瘤细胞转移的能力以及失调表达下的DDR1是否会对卵巢癌的化疗抗性带来影响目前尚不得而知。本研究分析DDR1在卵巢癌细胞中对转移侵袭和化疗抗性的调控作用,具体报道如下。
1 临床资料
1.1 一般资料 选取我院2015年8月至2016年8月正在接受化疗治疗的40例原发性卵巢癌患者作为研究对象,患者年龄38 ~ 59 岁, 平均年龄 (48.45 ± 1.15) 岁; 病程 6 个月 ~ 2.5年,平均病程 (20.24±0.36)个月;症状表现:疼痛、压迫症状、胃肠道不适。
1.2 诊断标准 卵巢癌诊断符合中华医学会妇科肿瘤学分会颁布的 《常见的妇科恶性肿瘤诊治指南》以下内容:①影像学检查提示生殖器官 (包括子宫、卵巢、宫颈及阴道)包块≥2 cm;②肿瘤标志物检查:CA125阳性;③妇科检查:内诊发现附件肿物质硬、表面不平、活动度差;④其他检查:阴道后穹窿穿刺液检查或腹水细胞学检查阳性[3]。
1.3 纳入标准 ①经病理证实均为卵巢癌者;②无全身其他严重器质性疾病者;③无化疗治疗禁忌者。
1.4 排除标准 ①预期生存周期≤1个月者;②妊娠期、哺乳期患者;③不同意本研究方案者。
2 方法
2.1 卵巢癌细胞原代培养 将新鲜的上皮性卵巢癌细胞于超净工作台上采用无菌磷酸盐缓冲液反复清洗8次后利用眼科剪将周围坏死组织、血凝块、脂肪等彻底清除,操作过程中严格按无菌操作规范执行。将收集到的细胞转移至另一无菌培养皿中,利用眼科剪将其彻底剪碎,大小以1 mm×1 mm×1 mm为宜。加入0.2 mg/mL胶原酶A溶液10 mL后吹打均匀,于37℃恒温摇床消化4 h,常温下3 000 r/min离心15min,去除上清液后收集沉淀部分并使用无菌磷酸盐缓冲液重悬处理,以相同离心速度离心3次后加入100 mL胎牛血清,转移至3.5 cm培养皿中依次加入霍乱毒素 (100 ng/mL)、白血病抑制因子 LIF (25 ng/mL)、 氢化可的松 (15 μg/mL)、 胰岛素 (40 μg/mL)及肝素 (4μg/mL)等细胞生长因子,于5%二氧化碳、37℃下静置3 d后换液,依据卵巢癌细胞生长情况每隔2~3 d换液一次,待其80%汇合时传代。首先倒掉培养液,加入双抗生理盐水或磷酸盐缓冲液5~10 mL轻轻摇晃均匀后倒掉,加入0.25% ~0.35%胰酶2 mL,促使其均匀分布,待卵巢癌细胞间隙变大后停止消化。加入含有10%血清的培养液5 mL轻柔吹打,按照1∶3比例传代培养。
2.2 功能模型构建 核酸识别单元为间隔32个恒定氨基酸序列的双连氨基酸且与A、G、C、T有恒定的对应关系,即NI识别A,NG识别T,HD识别C,NN识别G。要想获得卵巢癌细胞功能丧失及功能获得模型,只需按照靶点序列将相应单元串联克隆,其中功能丧失模型利用内切酶活性打断目标基因,将(两个相邻)靶点识别模块 (分别)克隆入真核表达载体,得到Talen质粒对,靶点识别模块串接成功后需克隆入真核表达载体中,将T alen质粒对共转入细胞中实现靶基因敲除[4]。而功能获得模型则是在靶点附近序列由基因组中扩增,克隆至验证质粒中基因上游并与基因相融合,筛选出稳定功能细胞株。
2.3 卵巢癌细胞转移侵袭能力实验 采用Trizol总RNA提取试剂对卵巢癌细胞总RNA进行提取,随后取1μL滴入到15μL反转录反应体系之中,充分混匀后65℃1 min、30℃5 min、65℃ 30 min、98℃ 5 min、4℃ 5 min后形成反转录 cDNA。取1μL实施荧光定量PCR扩增,条件为95℃5 s、60℃30 s、72℃15 s,共计40个循环,最后进行mRNA相对定量计算[5]。
2.4 化疗抗性检测试验 将功能丧失模型与功能获得模型卵巢癌细胞置于10%牛血清培养基中,温度37℃,待细胞融合≥80%后制备成为单细胞混悬液[6]。对细胞浓度进行计算后接入细胞培养孔板常温下孵育24 h,加入顺铂联合紫杉醇,具体给药方案如下:顺铂75 mg/m2+紫杉醇 85 mg/m2,孵育箱中孵育48 h后加入MTT溶液,培养5 h后测定卵巢癌细胞活性[7-8]。去除培养液后加入PBS缓冲液,甲醛固定后加入染色液,染色5min后采用流式细胞仪测定细胞凋亡率。
2.5 观察指标 ①DDR1信号通路关键因子,包括 IKKbeta、P50、P62,采用Western Blot检测;②卵巢癌细胞化疗抗性,包括给药前,以及给药后24 h、48 h、72 h、96 h五个时段,分别采用四唑盐比色法、流式细胞术进行测定。
2.6 统计学方法 本研究所有数据均采用SPSS 17.0统计软件进行处理,计量资料以均数 ±标准差 (±s)表示,采用t检验,重复测量数据采用方差分析,P<0.05表示差异具有统计学意义。
3 结果
3.1 不同模型下DDR1表达水平比较 功能获得模型信号通路关键因子IKKbeta、P50、P62的表达水平均显著高于功能丧失模型,差异有统计学意义 (P<0.05),见表1。提示临床DDR1在卵巢癌细胞中具有调控转移侵袭的能力。
表1 不同模型下DDR1表达水平比较 (±s)
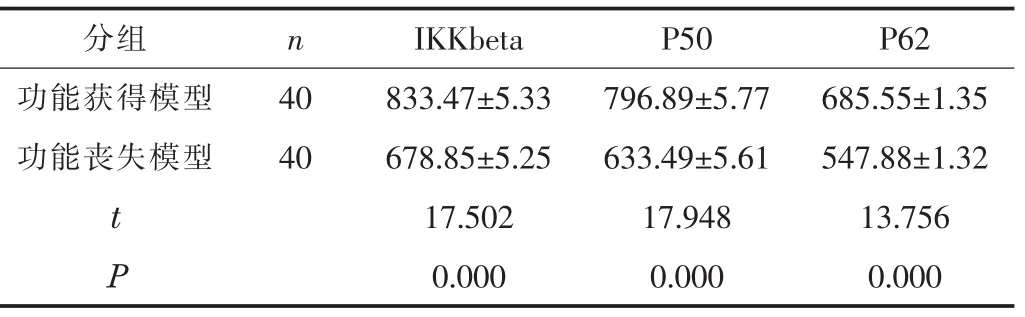
表1 不同模型下DDR1表达水平比较 (±s)
分组 n IKKbeta P50 P62功能获得模型 40 833.47±5.33 796.89±5.77 685.55±1.35功能丧失模型 40 678.85±5.25 633.49±5.61 547.88±1.32 t 17.502 17.948 13.756 P 0.000 0.000 0.000
表2 不同模型下细胞凋亡率及细胞增殖抑制率比较 (±s,%)
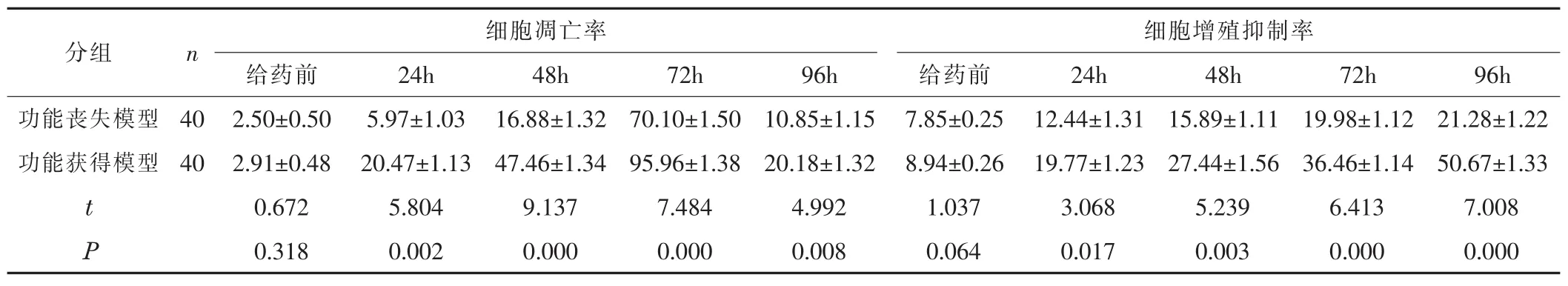
表2 不同模型下细胞凋亡率及细胞增殖抑制率比较 (±s,%)
分组 n细胞增殖抑制率功能丧失模型 40功能获得模型 40 t P细胞凋亡率给药前 24h 48h 72h 96h 给药前 24h 48h 72h 96h 2.50±0.50 5.97±1.03 16.88±1.32 70.10±1.50 10.85±1.15 7.85±0.25 12.44±1.31 15.89±1.11 19.98±1.12 21.28±1.22 2.91±0.48 20.47±1.13 47.46±1.34 95.96±1.38 20.18±1.32 8.94±0.26 19.77±1.23 27.44±1.56 36.46±1.14 50.67±1.33 0.672 5.804 9.137 7.484 4.992 1.037 3.068 5.239 6.413 7.008 0.318 0.002 0.000 0.000 0.008 0.064 0.017 0.003 0.000 0.000
3.2 不同模型下细胞凋亡率及细胞增殖抑制率比较 给药前功能获得模型的细胞凋亡率以及细胞增殖抑制率稍高于功能丧失模型,但组间差异无统计学意义 (P>0.05);给药后24 h、48 h、72 h、96 h四个时段,功能获得模型的细胞凋亡率、增殖抑制率均显著高于功能丧失模型,差异有统计学意义 (P<0.05);见表2。提示DDR1具有调控卵巢癌细胞化疗抗性的作用。
4 讨论
卵巢癌作为目前我国女性最为常见的恶性肿瘤之一,其治疗一直是困扰临床的棘手问题。虽然化疗治疗能够取得较为理想的疗效,提高了卵巢癌患者的生存率,但是随着用药时间的延长,化疗抗性问题不可避免地发生,给临床治疗工作的开展带来严重阻碍[9],如何降低化疗抗性,提高临床疗效成为当务之急。
本研究结果显示,功能获得模型信号通路关键因子IKKbeta、P50、P62的表达水平显著高于功能丧失模型,组间差异有统计学意义 (P<0.05)。化疗抗性实验证实给药前功能获得模型的细胞凋亡率以及细胞增殖抑制率稍高于功能丧失模型,但组间差异无统计学意义 (P>0.05);给药后功能获得模型的卵巢癌细胞凋亡率、增殖抑制率均显著高于功能丧失模型,差异有统计学意义 (P<0.05)。提示DDR1在卵巢癌细胞转移侵袭和化疗抗性调控中扮演着至关重要的角色,尤其是DDR1功能获得下化疗抗性明显下降,无论是卵巢癌细胞凋亡率还是增殖抑制率均明显上升,提示临床IKKbeta、P50、P62为DDR1重要的靶向信号通路关键因子,能够调节卵巢癌细胞的转移侵袭以及化疗抗性,给临床治疗工作提供了全新的靶向调控思路。原因在于DDR1为受体酪氨酸激酶,胞外区均含有一个由155个氨基酸构成的圆盘状结构,在其基因组中包含有17个外显子,可被蛋白酶裂解并与IKKbeta、P50、P62受体相结合,活化诱导卵巢癌细胞表达,继而增强其活性[10]。在本研究中,DDR1功能获得模型的IKKbeta、P50、P62表达水平均明显提高,促使正常卵巢细胞的活性得到增强,抑制癌细胞的转移和侵袭。而在给药后由于卵巢癌细胞IKKbeta、P50、P62表达水平降低,其活性受到抑制,化疗药物产生的杀伤效果更佳,因此在细胞凋亡率、增殖抑制率上均优于功能丧失模型,提示DDR1在包括卵巢癌在内的恶性肿瘤生长、浸润、转移过程中均发挥了重要的作用。此外,本研究着眼点在于探寻能同时作用于卵巢癌转移复发和化疗抗性的关键分子并阐明其上下游分子机制和具体的信号通路,首次研究DDR1在卵巢癌中的生物功能主要涉及转移侵袭和化疗抗性调控两个方面,阐述DDR1在卵巢癌中转移和化疗敏感功能发生的可能共同信号通路,验证DDR1在卵巢癌细胞株中的靶向关系,并由此阐明除了胶原激活外DDR1在卵巢癌中失调表达的新分子机制,弥补了此领域研究的空白,具有一定的创新性。
综上所述,DDR1在卵巢癌细胞中的生物功能主要涉及转移侵袭和化疗抗性调控两方面,并且IKKbeta、P50、P62为DDR1靶向信号通路关键因子,揭示卵巢癌全新靶向作用途径,具有重要的临床应用价值。
[1]杨宗元,魏晓,周晓水,等.microRNA-103下调Dicer1对卵巢癌侵袭转移影响及其机制探讨 [J].中华肿瘤防治杂志,2014,21(22):1757-1763.
[2]许琮,夏超,李德民,等.姜黄素联合吉西他滨对胰腺癌细胞体外增殖、凋亡及肿瘤干细胞表型特征的影响 [J].华中科技大学学报:医学版,2015,44(5):499-504.
[3]杨宗元,孙朝阳,周波,等.miR-107靶向调控Dicer1促进卵巢癌细胞系侵袭转移 [J].肿瘤防治研究,2013,40(7):660-666.
[4]韦士勤,李常颖,李保国,等.siRNA干扰MACC1表达对前列腺癌细胞株PC-3生长与侵袭影响研究 [J].中华肿瘤防治杂志,2015,22(23):1803-1808.
[5]靳平,杨宗元,徐森,等.Dicer1在卵巢癌间质成纤维细胞中调控DNA损伤修复相关基因 [J].现代妇产科进展,2016,25(3):161-165.
[6]周莹莹,王敏,吴建磊,等.耐药及敏感卵巢癌组织与细胞系中microRNA的表达及意义 [J].肿瘤学杂志,2014,14(3):197-202.
[7]牟玲,陈婕,罗祎,等.高尔基体基质蛋白 130、14-3-3ξ和整合素β3在卵巢上皮恶性肿瘤组织中的表达及其临床意义 [J].肿瘤,2014,34(1):47-54.
[8]张萍,王敏,接智慧,等.miR-210在化疗耐药与化疗敏感卵巢浆液性癌组织中的检测及意义 [J].中国医科大学学报,2014,43(6):487-492.
[9]张彭南,孙红.半乳糖凝集素-3(Gal-3)在上皮性卵巢癌中的表达及其对增殖、迁移和侵袭的影响 [J].复旦学报:医学版,2014,41(3):321-327.
[10]Chen C,Deng J,Yu X,et al.Identification of novel inhibitors of DDR1 against idiopathic pulmonary fibrosis by integrative transcriptome meta-analysis,computational and experimental screening[J].Mol Biosyst,2016,12(5):1540-1551.
Regulation Function of DDR1 on Metastasis,Invasion and Chemotherapy Resistance in Ovarian Cancer Cells
ZHANG Danyu,DENG Yuao,LIU Xinqiong,WANG Ling
(Departmentof Family Planning,Shenzhen People's Hospital,Shenzhen 518020,China)
ObjectiveTo explore the regulation function of discoidin domain receptor 1(DDR1)on metastasis,invasion and chemotherapy resistance in ovarian cancer cells.MethodsFrom August2015 to August2016,40 cases of primary ovarian cancer patients undergoing chemotherapy were selected as the research objects.With patients' informed consent,pathological tissue was cut off to obtain the ovarian cancer cells.Gain-of-function model(40 strains)and loss-of-function model(40 strains)were respectively constructed by over expression and knockout of Talen gene.The metastasis-invasion function test and the resistance test of cisplatin combined with paclitaxel were conducted to clarify the regulation of metastasis,invasion and chemotherapy resistance in ovarian cancer cells.ResultsThe expression levels of signal pathway key factors IK Kbeta,P50 and P62were833.47±5.33,796.89±5.77 and 685.55±1.35 in gain-of-function model,and 678.85±5.25,633.49±5.61 and 547.88±1.32 in loss-of-function model,with statistical differences between two different models(P<0.05).Before drug administration,no statistical difference was found between loss-of-function model and gain-of-function model in the apoptosis rate of ovarian cancer cell[(2.50±0.50)%vs.(2.91±0.48)%]or the proliferation inhibition rate[(7.85±0.25)%vs.(8.94±0.26)%],P>0.05;24 h,48 h,72 h and 96 h after drug administration,the cell apoptosis rates of gain-of-function model were(20.47±1.13)%,(47.46±1.34)%,(95.96±1.38)%and(20.18±1.32)%respectively,while the cell apoptosis rates of loss-of-function model were(5.97±1.03)%,(16.88±1.32)%,(70.10±1.50)%and(10.85±1.15)%respectively,with statistical differences between two different models(P<0.05);24 h,48 h,72 h and 96 h after drug administration,the proliferation inhibition rates of gain-of-function model were(19.77±1.23)%,(27.44±1.56)%,(36.46±1.14)%and(50.67±1.33)%respectively,while the proliferation inhibition rates of loss-of-function model were(12.44±1.31)%,(15.89±1.11)%,(19.98±1.12)%and(21.28±1.22)%respectively,with statistical differences between two different models(P<0.05).Conclusions The biological function of DDR1mainly involves in metastasis,invasion and chemotherapy resistance in ovarian cancer cells.IKKbeta,P50 and P62 are the key factors of targeting signaling pathway,which suggests a novel targeting pathway for ovarian cancer,and has important clinical application value.
Discoidin domain receptor1;Ovarian cancer;Metastasis;Invasion;Chemotherapy resistance
R737.32
A
10.3969/j.issn.1674-4659.2017.10.1361
2017-07-27
广东省省级科技计划项目 “miR-199a启动子超甲基化诱导DDRI过表达调节卵巢癌转移侵袭及化疗抗性的研究” (项目编号:2014A020212428)
张丹瑜 (1981-),女,广东梅州人,本科学历,主治医师,擅长不孕不育、宫腔镜及宫腹腔镜手术。
(责任编辑:常海庆)
