四氯化碳皮下注射诱导兔肝纤维化模型
2017-11-02唐靓罗涛杨亚冬张文元浙江省医学科学院保健食品研究所浙江杭州3003浙江省医学科学院生物工程研究所浙江杭州3003
唐靓,罗涛,杨亚冬,张文元*(浙江省医学科学院 保健食品研究所,浙江 杭州3003;浙江省医学科学院 生物工程研究所,浙江 杭州3003)
四氯化碳皮下注射诱导兔肝纤维化模型
唐靓1,罗涛2,杨亚冬2,张文元2*(1浙江省医学科学院 保健食品研究所,浙江 杭州310013;2浙江省医学科学院 生物工程研究所,浙江 杭州310013)
目的采用四氯化碳 (CCl4)皮下注射诱导兔肝纤维化模型。方法36只新西兰白兔随机分组:实验组30只、对照组6只。实验组开始2周颈背部皮下注射50%CC l4橄榄油0.3m L/kg,随后10周注射0.2m L/kg,每周各2次;对照组注射等量橄榄油。实验组及对照组分别于第4、8、12周末,检测兔肝脏功能生化指标的变化,以及肝脏大体和组织病理学变化,观察肝纤维化的发展程度。结果造模期间实验组家兔死亡6只,动物死亡率20%,对照组家兔无死亡。实验组兔肝脏纤维化程度随造模时间延长而逐渐加重,血清谷丙转氨酶、谷草转氨酶和γ-谷氨酰转移酶均明显升高,肝组织出现假小叶结构,造模成功率为80%。对照组肝脏功能以及组织学结构正常。结论长期持续给予四氯化碳可导致家兔的肝纤维化形成,成模率较高,并有较明显的阶段性变化,可进一步用于相关实验研究。
新西兰白兔;肝纤维化;动物模型;四氯化碳
0 前言
肝纤维化 (hepatic fibrosis)是肝脏受到各种外界损伤时的一种慢性修复反应,是各种慢性肝病发展过程中肝内纤维生成与降解失衡,造成肝脏内纤维结缔组织异常增生和胶原过度沉积[1]。肝纤维化是慢性肝病的重要病理特征,也是各种慢性肝病向肝硬化发展的必经阶段。肝纤维化可以经过治疗后逆转,发展为肝硬化时则难以逆转。阻断甚至逆转肝纤维化已成为慢性肝病治疗中的一个关键问题[2]。因此,建立肝纤维化动物模型是开展肝纤维化诊断与防治研究的重要手段,也是进行人体研究的前提[3],以实现早期诊断,筛选有效的治疗药物防治肝纤维化。应用四氯化碳 (carbon tetrachloride,CCl4)建立肝纤维化动物模型,是最经典、最常用的方法,但缺点是CCl4连续多次给药后动物死亡率较高。既往研究较多采用CCl4诱导大小鼠[4-5]等动物,但大小鼠肝脏体积小、血容量少,不利于生化指标检测及介入性治疗[6]。兔肝脏大小适中,血容量大,本实验选用家兔造模。造模的难点是掌握合适的CCl4浓度和剂量,本实验拟寻找合适的CCl4浓度和剂量,建立兔肝纤维化模型,并对实验过程中肝功能和组织病理学的动态改变进行观察,分阶段观察造模过程中动物的肝脏功能和组织病理学变化。
1 材料与方法
1.1 材料和仪器
CCl4(分析纯,上海凌峰化学试剂有限公司),自动生化分析仪 (日本日立公司)。新西兰白兔,4月龄,体重2.1 kg左右,雄性,由浙江省实验动物中心提供及饲养,实验动物质量合格证号:SCXK (浙)2013-0055号。
1.2 方法
1.2.1 肝纤维化模型的建立
健康新西兰白兔36只,实验前血常规、肝功检查均正常,适应性饲养1周后,随机分为实验组30只、对照组6只,每笼单只饲养。取CCl4和橄榄油,按体积比1∶1配制,充分摇匀,制成浓度50%的CCl4。实验组开始2周于背中部以上颈部以下皮下注射50%CCl40.3mL/kg,一次性注射器注射,每周注射2次;随后10周注射0.2mL/kg,每周注射 2次,并根据实验动物实际状态,适当减少注射次数或剂量。对照组均注射等量橄榄油。基础颗粒状饲料与自来水喂食、饮用。饲养兔房符合建立兔肝纤维化模型的实验条件。
1.2.2 血生化指标检测
分别于第4、8和12周末,各组动物禁食12 h后取兔耳中央动脉血样,离心后取上层血清,送肝功能检测:谷丙转氨酶(alanine aminotransferase, ALT)、 谷 草 转 氨 酶 (aspartate aminotransferase, AST)、 γ-谷氨酰转移酶 (γ-glutam ltransferase, γGT)、 总蛋白 (total protein, TP)、 白蛋白 (albumin,ALB)、 球蛋白 (g lobulin,GLO)、 白球蛋白比值 (albumin/globulin,A/G)。检测兔肝脏功能变化。
1.2.3 肝脏标本大体观察和病理学检查
于造模第4、8周末,每个时间点各随机处死实验组4只、对照组1只,并于第12周末将剩余的动物全部处死。大体观察肝脏的颜色、质地、体积和表面变化后,行组织病理切片检查。适量新鲜肝脏用10%甲醛固定,石蜡包埋、切片,苏木精-伊红 (HE)染色和Masson染色。光镜观察肝脏组织病理学变化,以及肝纤维化的发展程度情况。2名病理学人员按Scheuer制定的肝纤维化分期评估方案,对肝纤维化程度进行评价 (分5期:S0~S4, 相应计分0~4分)[7]。
1.3 统计学处理
2 结果
2.1 兔常规大体观察
正常对照组家兔状态如常,造模期间无死亡,体重增加明显 (表 1)。
实验组随造模时间的延长,家兔的活动逐渐减少,状态呆滞,毛发逐渐失去光泽,脱毛逐渐增多,饮食、饮水减少,体重无明显增加,有些甚至降低 (表1)。实验组造模期间共24只家兔完成实验,6只死亡,病死率为20%。死亡大多发生在给药后4周之前,6周之后基本上趋于稳定。
表1 两组实验兔的体重变化比较 (±s,kg)

表1 两组实验兔的体重变化比较 (±s,kg)
注:与同期对照组相比,*P<0.05,#P<0.01。
组别 0 week 4 weeks 8 weeks 12 weeks实验组 2.18±0.25 2.29±0.35 2.34±0.39* 2.45±0.45#对照组 2.12±0.22 2.46±0.34 2.75±0.42 3.17±0.48
2.2 肝脏表面观察
对照组肝脏表面呈现鲜红色,表面无颗粒和结节,光滑柔软,肝缘锐利,形态与大小均正常。实验组随造模时间的延长,肝纤维化逐渐加重,肝缘逐渐变钝,表面颗粒状逐渐加重,被膜肿胀;4周时肝脏质地稍韧,稍有变暗,表面有很轻微的颗粒状改变;8周时肝脏呈暗紫色,表面有较轻微的颗粒状改变;12周时肝脏呈灰褐色,表面有明显的颗粒状改变。
2.3 组织病理学观察
HE、Masson染色显示,对照组肝小叶结构完整清楚,肝细胞排列整齐完整,肝细胞呈放射状排列。
实验组随造模时间延长,组织结构破坏逐渐加重,肝内胶原纤维和网状纤维组织增生逐渐增多,肝细胞脂质变性、坏死逐渐加重;诱导8周时汇管区炎性细胞浸润,肝小叶正常结构减少,胶原纤维增生,呈早期纤维化症状 (图1、图2);诱导12周后,肝小叶正常结构消失,肝组织呈现网状结构,肝细胞脂肪变性严重,肝细胞排列紊乱,间质胶原纤维增生严重,假小叶结构形成,汇管区及其窦周淤血现象严重,肝细胞呈现弥漫性坏死,呈重度肝纤维化症状 (图3、图4)。实验组的造模成功率为80%。

图1 实验组造模8周肝组织HE染色 (×100)

图2 实验组造模8周肝组织Masson 染色 (×100)

图3 实验组造模12周肝组织HE染色 (×100)

图4 实验组造模12周肝组织Masson染色 (×100)
不同时间点病理学检查结果分期情况见表2。
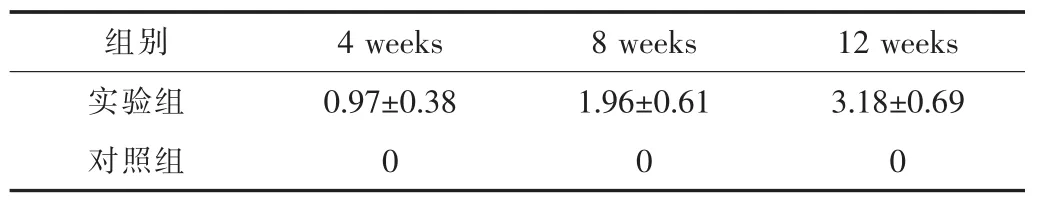
表2 不同时间点的病理学检查结果分期情况
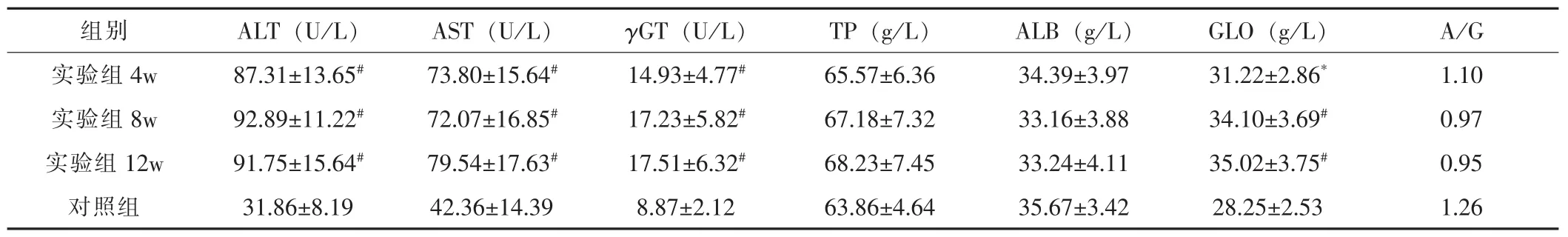
表3 实验动物不同时间点动脉血清生化指标变化
2.4 肝功能检查脉血生化指标的变化
实验动物不同时间点的血清生化指标变化见表3。家兔血生化指标随着注药时间的延长,谷丙转氨酶、谷草转氨酶、γ-谷氨酰转移酶均明显升高,白球蛋白比值逐渐下降,球蛋白逐渐升高。
3 讨论
肝脏是营养代谢和解除机体外来有毒化学药物、毒物的主要器官。肝脏的其他功能是帮助消化、生产无价的内源激素、酶,以及禁食时生产葡萄糖等。近年来慢性肝脏疾病越来越多,医学上治疗这些疾病通常是困难的,效果有限。肝纤维化是慢性肝病的一个共性,如果损伤因素长期不能去除,就会发展成肝硬化,严重损伤肝脏功能,由于其较高的发病率和死亡率,被认为是一个重要的医学问题[8]。阻断、逆转肝纤维化已成为慢性肝病治疗中的一个重要环节[9-10]。 因此,建立能全面、准确地反映肝纤维化本质的动物模型尤为重要。
CCl4是亲肝毒物,是经典的动物肝纤维化造模药物。其特点为成模率高、费用低廉、病理特征稳定可靠、复制时间短、重复性好、方法简便,目前作为肝纤维化造模的主要方法[11-12]。其缺点是CCl4连续多次给药后动物死亡率高。本实验选用适量CCl4诱导家兔肝纤维化造模,皮下注射诱导12周,实验组的造模成功率为80%,动物死亡率为20%。死亡动物肝脏病理学检查发现其原因主要为急性肝坏死。
随着造模时间的延长,实验组的白球蛋白比值逐渐下降,球蛋白逐渐升高,说明肝细胞发生病变,肝脏的代谢功能发生障碍,兔肝脏功能受损;ALT、AST、γGT显著增高,表明CCl4可造成肝脏损害。诱导12周后,肝小叶正常结构消失,肝组织呈现网状结构,肝细胞脂肪变性严重,肝细胞排列紊乱,间质胶原纤维增生严重,假小叶结构形成,汇管区及其窦周淤血现象严重,肝细胞呈现弥漫性坏死,呈重度肝纤维化症状。本实验利用适量CCl4皮下注射成功诱导出兔肝纤维化模型,为以家兔为实验动物进行肝纤维化的研究打下了基础。
[1]刘晔,齐荔红,王硕丰,等.肝星状细胞HSC-T6体外肝纤维化模型的建立 [J].药学实践杂志,2005,23(6):339-342.
[2]Mohammadalipour A,Karimi J,Khodadadi I,et al.Dasatinib prevent hepatic fibrosis induced by carbon tetrachloride(CCl4)via anti-inflammatory and antioxidant mechanism[J].Immunopharmacol Immunotoxicol,2017,39(1):19-27.
[3]Ionica FE,Mogoanta L,Nicola GC,et al.Antifibrotic action of telmisartan in experimental carbon tetrachloride-induced liver fibrosis in Wistar rats[J].Rom J Morphol Embryol,2016,57(4):1261-1272.
[4]Deng G,Wang J,Zhang Q,et al.Hepatoprotective effects of phloridzin on hepatic fibrosis induced by carbon tetrachloride against oxidative stress-triggered damage and fibrosis in rats[J].Biol Pharm Bull,2012,35(7):1118-1125.
[5]Harris T R,Bettaieb A,Kodani S,et al.Inhibition of soluble epoxide hydrolase attenuates hepatic fibrosis and endoplasmic reticulum stress induced by carbon tetrachloride in mice[J].Toxicol Appl Pharmacol,2015,286(2):102-111.
[6]Habuchi H,Ushida T,Habuchi O.Mice deficient in N-acetylgalactosamine 4-sulfate 6-O-sulfotransferase exhibit enhanced liver fibrosis and delayed recovery from fibrosis in carbon tetrachloride-treated mice[J].Heliyon,2016,2(8):e00138.
[7]中华医学会肝病学分会肝纤维化学组.肝纤维化诊断及疗效评估共识 [J].中华肝脏病杂志,2002,10(5):327-328.
[8]Huang X,Wang X,Lv Y,et al.Protection effect of kallistatin on carbon tetrachloride-induced liver fibrosis in rats via antioxidative stress[J].PLoSOne,2014,9(2):e88498.
[9]Sayyed HG,Osama A,Idriss NK,et al.Comparison of the therapeutic effectiveness of human CD34+and rat bonemarrow mesenchymal stem cells on improvement of experimental liver fibrosis in Wistar rats[J].Int J Physiol Pathophysiol Pharmacol,2016,8(3):128-139.
[10]Oyeyemi IT,Akanni OO,Adaramoye OA,et al.Methanol extract of Nymphaea lotus ameliorates carbon tetrachloride-induced chronic liver injury in rats via inhibition of oxidative stress[J].JBasic Clin Physiol Pharmacol,2017,28(1):43-50.
[11]Dong S,Chen QL,Song YN,et al.Mechanisms of CCl4-induced liver fibrosis with combined transcriptomic and proteomic analysis[J].J Toxicol Sci,2016,41(4):561-572.
[12]Abdelghany AH,BaSalamah MA,Idris S,et al.The fibrolytic potentials of vitamin D and thymoquinone remedial therapies:insights from liver fibrosis established by CCl4in rats[J].JTransl Med,2016,14(1):281-295.
Liver Fibrosis Model in Rabbit Induced by Subcutaneous Injection of Carbon Tetrachloride
TANG Liang1,LUO Tao2,YANG Yadong2,ZHANG Wenyuan2*
(1Institute of Health Food,Zhejiang Academy of Medical Sciences,Hangzhou 310013,China;2Institute of Bioengineering,Zhejiang Academy of Medical Sciences,Hangzhou 310013,China;*Corresponding author:ZHANG Wenyuan,E-mail:zhangwy61@163.com)
ObjectiveTo use subcutaneous injection of carbon tetrachloride(CCl4)to induce hepatic fibrosis model in rabbit.Methods36 New Zealand white rabbits were divided into the experimental group(n=30)and the control group(n=6)random ly.The rabbits of experimental group were treated by subcutaneous injection of 50%CCl40.3m L/kg in olive oil tw ice a week for the initial two weeks,then were treated by subcutaneous injection of 50%CCl40.2m L/kg in olive oil twice a week for the next10 weeks.The rabbits of control group were treated by same amount of olive oil.Rabbits' liver function,biochemical indicators,liver gross,his to pathological changes and hepatic fibrosis degree were detected in experimental group and control group at4th,8th,and 12thweek respectively.Results6 rabbits were dead in experimental group during the period of molding,and animal mortality rate was 20%.No dead case was found in control group.In experimental group,rabbits' liver fibrosis degree increased gradually with molding time extension.Serum alanine aminotransferase,aspertate aminotransferase,and gamma glutamyl transpeptidase increased significantly,while their liver tissue appeared false flocculus structure,and molding success rate was 80%.The liver function and histological structure of control group were normal.Conclusions Injecting CCl4for a long time may lead to the formation of liver fibrosis in rabbits,with significant difference in different time and high success rate.The model can be used further in related experiments.
New Zealand white rabbit;Liver fibrosis;Animal models;Carbon tetrachloride
R-332
A
10.3969/j.issn.1674-4659.2017.10.1358
2017-04-06
2017-06-26
浙江省科技计划公益技术研究社会发展项目 (项目编号:2015C33109);浙江省科研院所专项 (项目编号:2016F10002);浙江省医药卫生科技计划项目 (项目编号:2016KYB071,2017KY299)
唐靓 (1979-),男,浙江杭州人,硕士学位,助理研究员,主要从事生物技术工作。
*通讯作者:张文元 (1961-),男,硕士学位,研究员,研究方向:组织工程; E-mail: zhangwy61@163.com。
(责任编辑:常海庆)
