pH对δ-MnO2和水铁矿吸附As(Ⅴ)的影响*
2017-11-02李晓月王华伟孙英杰郑志远汉红燕
李晓月 王华伟 孙英杰# 郑志远 汉红燕
(1.青岛理工大学环境与市政工程学院,山东 青岛 266033;2.青岛理工大学土木工程学院,山东 青岛 266033; 3.青岛市环境保护局,山东 青岛 266033)
pH对δ-MnO2和水铁矿吸附As(Ⅴ)的影响*
李晓月1王华伟1孙英杰1#郑志远2汉红燕3
(1.青岛理工大学环境与市政工程学院,山东 青岛 266033;2.青岛理工大学土木工程学院,山东 青岛 266033; 3.青岛市环境保护局,山东 青岛 266033)
研究了初始pH对δ-MnO2和水铁矿吸附As(Ⅴ)的动力学和热力学过程的影响。结果表明,不同初始pH对水铁矿去除As(Ⅴ)的效果影响不明显,而对δ-MnO2去除As(Ⅴ)的效果影响较大。在相同的吸附时间下,初始pH=5.0时,As(Ⅴ)去除率最高,且随初始pH增大而降低。当初始pH=5.0时,δ-MnO2和水铁矿对As(Ⅴ)的平衡吸附量总体上都大于初始pH=7.0或初始pH=9.0时。准二级动力学方程可以很好地描述δ-MnO2和水铁矿吸附As(Ⅴ)的动力学过程。Freundlich方程拟合水铁矿和δ-MnO2吸附As(Ⅴ)的过程优于Langmuir方程。
δ-MnO2水铁矿pHAs(Ⅴ)
据统计,2014年我国有109.7 t As随废水排放进入环境[1]。由于As毒性强、危害大,可引发许多疾病以及慢性中毒,对农业环境和人体健康存在巨大威胁[2]。
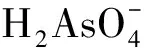
铁和锰的氧化物通常具有比表面积大、表面活性强等特点[5-7],可以高效吸附多种过渡元素和重金属[8]1990,[9-12]。豆小敏等[8]1989对比研究了水铁矿、赤铁矿、针铁矿3种铁的氧化物对As(Ⅴ)的吸附特性,结果表明,水铁矿对As(Ⅴ)的吸附效果远好于赤铁矿和针铁矿。WANG等[13]研究表明,δ-MnO2也能高效、快速吸附As(Ⅴ)。
本研究对比了水铁矿和δ-MnO2对As(Ⅴ)的吸附效果,重点研究了初始pH对水铁矿和δ-MnO2吸附As(Ⅴ)的动力学和热力学过程的影响。
1 材料与方法
1.1 吸附剂的制备
1.1.1 δ-MnO2的制备
将0.1 mol/L的高锰酸钾溶液80 mL和0.1 mol/L的氢氧化钠溶液160 mL加入到1 640 mL蒸馏水中,置于磁力搅拌器上,通氮气30 min,同时逐滴加入120 mL 0.1 mol/L的氯化锰溶液。弃去上清液后在3 000 r/min条件下离心10 min,所得沉淀即为δ-MnO2[14],用蒸馏水进行洗涤。
1.1.2 水铁矿的制备
称取40 g九水硝酸铁溶于500 mL蒸馏水中,以100 mL/min的速率加入310 mL 1 mol/L的氢氧化钾,置于磁力搅拌器上,调pH至7.5,充分搅拌后,弃去上清液,在3 000 r/min条件下离心10 min,所得沉淀即为水铁矿[15],用0.1 mol/L的氯化钠进行洗涤。
1.2 实验设计
1.2.1 吸附动力学实验
分别称取0.5 g δ-MnO2或水铁矿,加入1 L 0.01 mol/L的氯化钾溶液中,置于磁力搅拌器上,即δ-MnO2或水铁矿投加量为0.5 g/L,分别调节初始pH至5.0、7.0、9.0,在搅拌的同时用一次性针筒取样器抽取悬浊液19 mL于100 mL的塑料离心管中,分别加入1 mL 7.5 mg/L的As(Ⅴ)使用液,即As(Ⅴ)质量浓度为0.375 mg/L,置于25 ℃、20 r/min的振荡器中进行动力学实验,间隔一定时间取样,用0.22 μm滤膜过滤后测定As(Ⅴ)浓度。
1.2.2 吸附等温线实验
δ-MnO2或水铁矿投加量为0.5 g/L,分别调节初始pH至5.0、7.0、9.0,在搅拌的同时用一次性针筒取样器抽取适量悬浊液于100 mL的塑料离心管中,分别加入一定体积的7.5 mg/L的As(Ⅴ)使用液使As(Ⅴ)质量浓度为0.075~15.000 mg/L,在25 ℃、220 r/min的振荡器中振荡12 h后,用0.22 μm滤膜过滤,测定As(Ⅴ)浓度。
1.3 数据处理方法
1.3.1 吸附动力学拟合
采用准一级动力学方程(见式(1))和准二级动力学方程(见式(2))对δ-MnO2或水铁矿吸附As(Ⅴ)
的动力学过程进行拟合[16]。
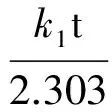
(1)
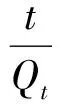
(2)
式中:Qe、Qt分别为吸附剂对As(Ⅴ)的平衡吸附量和t时刻吸附量,mg/g;k1为准一级动力学速率常数,min-1;t为吸附时间,min;k2为准二级动力学速率常数,g/(mg·min)。
1.3.2 吸附等温线拟合
吸附等温线反映的是不同As(Ⅴ)平衡浓度时δ-MnO2或水铁矿对As(Ⅴ)的吸附量,Langmuir方程(见式(3))和Freundlich方程(见式(4))是常用的描述吸附等温线的模型。

(3)
lnQe=nlnce+lnKF
(4)
式中:ce为As(Ⅴ)的平衡质量浓度,mg/L;Qm为吸附剂对As(Ⅴ)的饱和吸附量,mg/g;KL为Langmuir吸附常数,L/mg;KF为Freundlich吸附常数,mg1-n/(g·Ln);n为吸附强度常数。
2 结果与讨论
2.1 初始pH对吸附动力学的影响
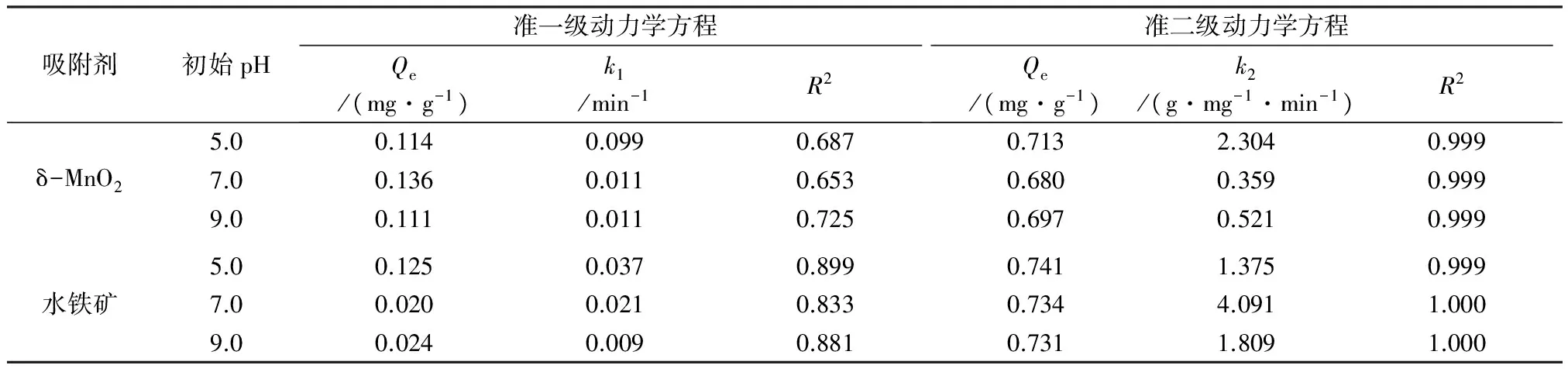
不同初始pH下δ-MnO2和水铁矿对As(Ⅴ)的去除效果如图1所示。由图1可知,3种不同初始pH条件下,δ-MnO2和水铁矿对As(Ⅴ)均有很好的去除效果。其中,δ-MnO2对As(Ⅴ)的去除效果受初始pH影响较明显。在相同的吸附时间下,初始pH=5.0时,As(Ⅴ)去除率最高,随初始pH增大,去除率降低。反应180 min后,As(Ⅴ)的去除率趋于稳定。相对而言,水铁矿对As(Ⅴ)的去除效果较为稳定,不同初始pH对水铁矿去除As(Ⅴ)的效果影响不明显。反应30 min即达到稳定。因此,水铁矿对As(Ⅴ)的去除效果略好于δ-MnO2。
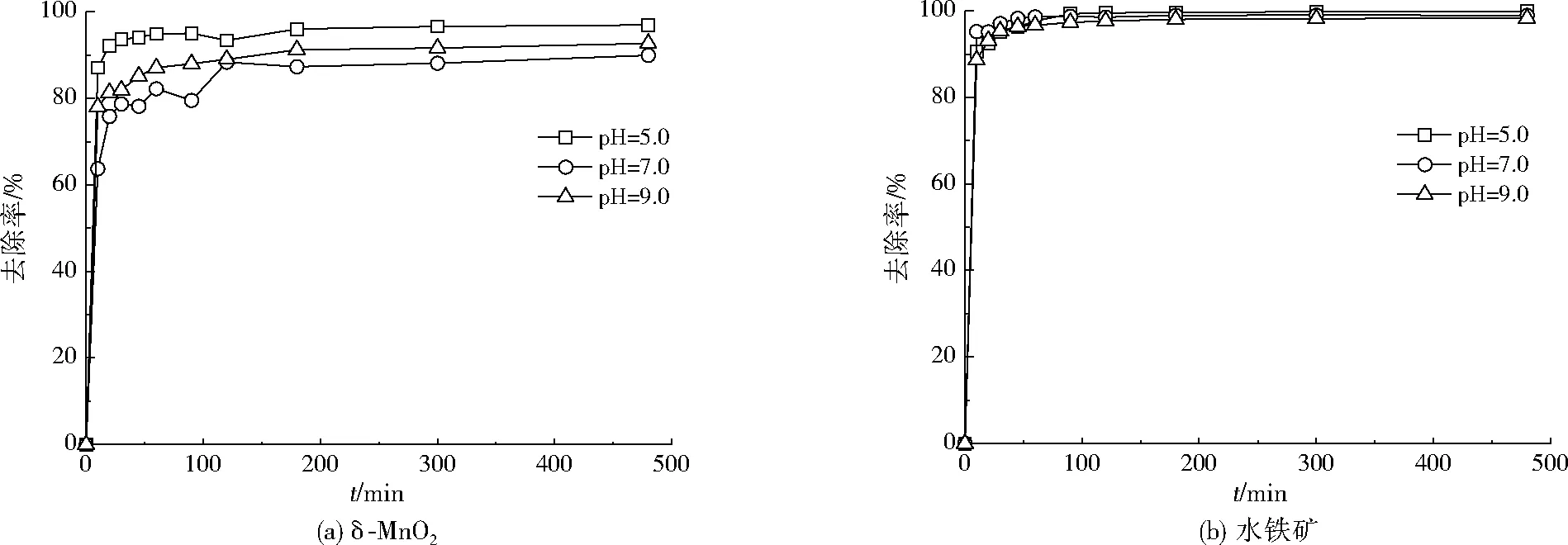
图1 不同初始pH对吸附动力学的影响Fig.1 Effect of initial pH on adsorption kinetics
吸附剂初始pH准一级动力学方程Qe/(mg·g-1)k1/min-1R2准二级动力学方程Qe/(mg·g-1)k2/(g·mg-1·min-1)R25.00.1140.0990.6870.7132.3040.999δ-MnO27.00.1360.0110.6530.6800.3590.9999.00.1110.0110.7250.6970.5210.9995.00.1250.0370.8990.7411.3750.999水铁矿7.00.0200.0210.8330.7344.0911.0009.00.0240.0090.8810.7311.8091.000
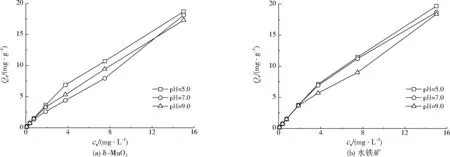
图2 不同初始pH对吸附等温线的影响Fig.2 Effect of initial pH on adsorption isotherm curve
由表1可见,初始pH=5.0~9.0时,δ-MnO2和水铁矿对As(Ⅴ)的准一级动力学方程R2为0.653~0.899,而准二级动力学方程R2均大于等于0.999。由此可见,准二级动力学方程可以更好地描述δ-MnO2和水铁矿对As(Ⅴ)的吸附过程,表明δ-MnO2和水铁矿对As(Ⅴ)的吸附过程主要受化学吸附的影响[17]。
pH是影响污染物表面带电性及形态的重要因素。δ-MnO2和水铁矿对As(Ⅴ)的吸附机制主要为静电吸附。当溶液pH较低时,δ-MnO2和水铁矿表面的正电荷增多,负电性明显降低,质子化作用增强,As(Ⅴ)阴离子与吸附剂的静电引力增强,去除率提高[18]。当溶液pH升高时,As(Ⅴ)与吸附剂的静电斥力增加,δ-MnO2和水铁矿对As(Ⅴ)的去除率降低。
2.2 初始pH对吸附等温线的影响
不同初始pH下,δ-MnO2和水铁矿对As(Ⅴ)的吸附等温线如图2所示。由图2可以看出,δ-MnO2和水铁矿对As(Ⅴ)的平衡吸附量均随As(Ⅴ)平衡浓度的增加而增加,初始pH对As(Ⅴ)的吸附效果有一定影响。当初始pH=5.0时,δ-MnO2和水铁矿对As(Ⅴ)的平衡吸附量总体上都大于初始pH=7.0或初始pH=9.0。
由表2可见,初始pH=5.0~9.0时,δ-MnO2和水铁矿对As(Ⅴ)的吸附等温线通过Langmuir方程拟合的R2为0.879~0.978,而通过Freundlich方程拟合的R2为0.991~0.999。由此可见,Freundlich方程可以更好地描述δ-MnO2和水铁矿对As(Ⅴ)的吸附等温线,表明δ-MnO2和水铁矿对As(Ⅴ)的吸附过程为多分子层吸附。通常,当n为0.1~0.5时,吸附过程易于进行;当n为>0.5~2.0时,吸附过程可以进行;当n>2.0时,吸附过程难以进行[3]25。从表2来看,δ-MnO2和水铁矿的n均在>0.5~2.0之间,表明这两种吸附剂对As(Ⅴ)的吸附热力学过程都是可以进行。
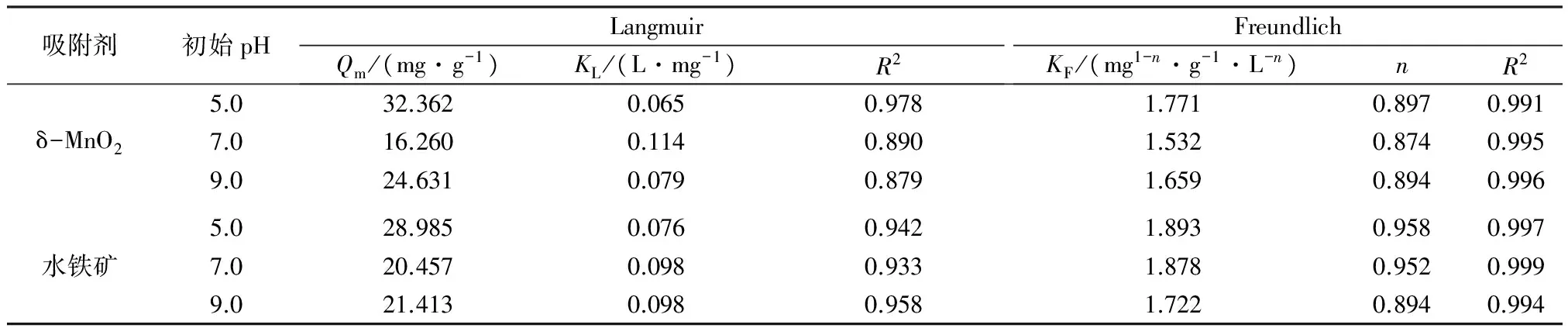
表2 吸附等温线拟合参数
3 结 论
(1) 不同初始pH对水铁矿去除As(Ⅴ)的效果影响不明显,而对δ-MnO2去除As(Ⅴ)的效果影响较大。在相同的吸附时间下,初始pH=5.0时,As(Ⅴ)去除率最高,且随pH增大而降低。当初始pH=5.0时,δ-MnO2和水铁矿对As(Ⅴ)的平衡吸附量总体上都大于初始pH=7.0或初始pH=9.0时。
(2) 准二级动力学方程可以更好地描述δ-MnO2和水铁矿对As(Ⅴ)的吸附过程,主要受化学吸附的影响
(3) Freundlich方程可以更好地描述δ-MnO2和水铁矿对As(Ⅴ)的吸附等温线,吸附过程为多分子层吸附。
[1] 国家统计局.2015中国统计年鉴[M].北京:中国统计出版社,2015.
[2] 王楠.铁锰氧化物对砷的吸附和氧化特性研究[D].沈阳:沈阳农业大学,2012.
[3] 庞禄.铁锰复合氧化物对重金属铬(Ⅲ)、砷(Ⅲ)吸附/氧化特征研究[D].重庆:西南大学,2014.
[4] 彭昌军.铁氧化物及铁锰复合氧化物对砷的吸附及其应用研究[D].厦门:厦门大学,2014.
[5] 常方方,曲久辉,刘锐平,等.铁锰复合氧化物的制备及其吸附除砷性能[J].环境科学学报,2006,26(11):1769-1774.
[6] KOHN T,KENNETH J T,ROBERTS A L,et al.Longevity of granular iron in groundwater treatment processes:corrosion product development[J].Environmental Science & Technology,2005,39(8):2867-2879.
[7] LEE Y,UM I,YOOD J.Arsenic(Ⅲ) oxidation by iron(Ⅵ) (ferrate) and subsequent removal of arsenic(Ⅴ) by iron(Ⅲ) coagulation[J].Environmental Science & Technology,2003,37(24):5750-5756.
[8] 豆小敏,于新,赵蓓,等.5种铁氧化物去除As(Ⅴ)性能的比较研究[J].环境工程学报,2010,4(9).
[9] 彭昌军,姜秀丽,计红芳,等.铁锰复合氧化物对As(Ⅲ)、As(Ⅴ)的吸附研究及其在沼液中的应用[J].化工学报,2014,65(5):1848-1855.
[10] BOWELL R J,刁凤琴.土壤中铁的氧化物和氢氧化物对砷的吸附[J].地质科学译丛,1995,12(2):52-58.
[11] 周超.两种铁氧化物矿物对As(Ⅲ)的吸附—解吸及氧化特性研究[D].合肥:安徽农业大学,2013.
[12] AND S D,HERING J G.Comparison of arsenic(Ⅴ) and arsenic(Ⅲ) sorption onto iron oxide minerals:implications for arsenic mobility[J].Environmental Science & Technology,2003,37(18):4182-4189.
[13] WANG Huawei,ZHANG Daoyong,MOU Shuyong,et al.Simultaneous removal of tetracycline hydrochloride and As(Ⅲ) using poorly-crystalline manganese dioxide[J].Chemosphere,2015,136:102-110.
[14] WANG Lingling,CHENG Hefa.Birnessite (δ-MnO2) mediated degradation of organoarsenic feed additivep-arsanilic acid[J].Environmental Science & Technology,2015,49(6):3473-3481.
[15] RAVEN K P,JAIN A,LOEPPERT R H.Arsenite and arsenate adsorption on ferrihydrite:kinetics,equilibrium,and adsorption envelopes[J].Environmental Science & Technology,1998,32(3):344-349.
[16] 谢超然,王兆炜,朱俊民,等.核桃青皮生物炭对重金属铅、铜的吸附特性研究[J].环境科学学报,2016,36(4):1190-1198.
[17] 董婧.铁锰复合氧化物的制备及除砷性能研究[D].武汉:武汉理工大学,2013.
[18] 徐伟,刘锐平,曲久辉,等.铁锰复合氧化物吸附去除五价锑性能研究[J].环境科学学报,2012,32(2):270-275.
EffectofpHonAs(Ⅴ)adsorptionbyδ-MnO2andferrihydrite
LIXiaoyue1,WANGHuawei1,SUNYingjie1,ZHENGZhiyuan2,HANHongyan3.
(1.SchoolofEnvironmentalandMunicipalEngineering,QingdaoUniversityofTechnology,QingdaoShandong266033;2.SchoolofCivilEngineering,QingdaoUniversityofTechnology,QingdaoShandong266033;3.QingdaoEnvironmentalProtectionBureau,QingdaoShandong266033)
Effects of initial pH on As(Ⅴ) adsorption kinetics and isotherm curve by δ-MnO2and ferrihydrite were conducted. Results indicated that initial pH had little effect on As(Ⅴ) removal by ferrihydrite,but relatively great effect by δ-MnO2. As(Ⅴ) removal efficiency was highest when initial pH=5.0 at the same adsorption time. Besides,As(Ⅴ) removal efficiency dropped down as initial pH increased. Equilibrium adsorption quantity was higher when initial pH=5.0 than when initial pH=7.0 or 9.0. The adsorption kinetic process on As(Ⅴ) by δ-MnO2or ferrihydrite could well be described by the pseudo-second-order equation. The adsorption isotherm curve was better fitted for Freundlich equation than Langmuir equation.
δ-MnO2; ferrihydrite; pH; As(Ⅴ)
10.15985/j.cnki.1001-3865.2017.02.013
2016-07-12)
李晓月,女,1992年生,硕士研究生,研究方向为固体废弃物处理、处置与资源化。#
。
*山东省自然科学基金青年基金资助项目(No.ZR2016DQ08)。
