冀中典型农业区农作物中有机氯农药的生物富集特征与健康风险评价*
2017-11-02马玉霞虞敏达唐含英黄彩红高如泰
马玉霞 虞敏达 唐含英 黄彩红 高如泰# 张 慧 张 媛 李 丹
(1.满洲里市环境保护监测站,内蒙古 满洲里 021400;2.内蒙古环境监测中心站,内蒙古 呼和浩特 010011; 3.中国环境科学研究院地下水与环境系统工程创新基地,北京 100012)
冀中典型农业区农作物中有机氯农药的生物富集特征与健康风险评价*
马玉霞1,2虞敏达3唐含英1,2黄彩红3高如泰3#张 慧3张 媛3李 丹3
(1.满洲里市环境保护监测站,内蒙古 满洲里 021400;2.内蒙古环境监测中心站,内蒙古 呼和浩特 010011; 3.中国环境科学研究院地下水与环境系统工程创新基地,北京 100012)
分析了冀中典型农业区土壤-农作物体系中有机氯农药(OCPs)残留与生物富集特征,探讨了该地区所产农作物的可食部分对人体健康产生的潜在风险。结果表明:11种OCPs以滴滴涕(DDTs)和六六六(HCHs)为主要残留物。土壤中DDTs和HCHs残留量总计达36.52~73.45ng/g,在各自的异构体中p,p’-DDT和γ-HCH所占比例最高,表明OCPs污染主要为近期输入所致。玉米和小麦各器官中,OCPs均在籽粒中最高,分别残留20.66~33.33、19.14~34.57ng/g。小麦和玉米对HCHs的富集能力均强于DDTs。研究显示,该地区玉米与小麦籽粒中OCPs含量虽未超过《农产品安全质量 无公害蔬菜安全要求》(GB18406.1—2001)和《食品安全国家标准 食品中农药最大残留限量》(GB2763—2012),但OCPs致癌总风险相对较高,玉米和小麦中均超过了1×10-6,小麦中OCPs的非致癌总风险和致癌总风险均大于玉米,因此该地区应该优先关注OCPs对小麦所造成的粮食安全问题。
土壤-农作物体系 有机氯农药 生物富集 健康风险
有机氯农药(OCPs)是一类氯代芳香烃衍生物,主要包括六六六(HCHs)、滴滴涕(DDTs)、硫丹、艾氏剂等[1]209-210。OCPs的使用为人类生存和发展带来了不可磨灭的贡献,但同时也造成了很多环境问题[2]。研究表明,OCPs在自然环境中很难通过生物代谢、光降解、化学分解等途径进行降解,可以在环境中长期残留,且具有亲脂疏水特性,容易发生生物蓄积。OCPs大多数组分具有致癌、致畸与致突变作用,对人类和动物的生殖、遗传、神经、内分泌等系统具有强烈的危害作用,已成为环境研究领域关注的重点。在《关于持久性有机污染物的斯德哥尔摩公约》中,首批禁止的12种物质中有9种为OCPs。同时,在美国环境保护署(USEPA)所公布的优先控制污染物名单中,OCPs占很大比例[3]。
我国是OCPs生产和使用量最大的国家之一,近30年累计施用DDTs约4.0×105t,HCHs约4.9×105t[4]。虽然我国已于1983年禁止生产和使用OCPs,但是由于绝大多数OCPs具有半挥发性和持久性,可以通过干湿沉降、扩散等过程由大气、水体转移至土壤中[5]83-84,[6-7],使土壤成为OCPs汇。土壤作为地球表层系统循环的主要要素,既是植物的营养来源,也是植物中有害污染物的重要来源。土壤中的OCPs被农作物吸收富集至可食用部分,给粮食安全带来隐患,严重威胁人体健康。因此,土壤中OCPs污染已成为国内外关注的热点问题。近几年来,前人已经在不同尺度上对土壤OCPs污染及其对农作物的影响展开了相关研究[8-10]。然而,华北平原耕地广泛轮作种植的玉米和小麦中OCPs的污染分布及其对人体的健康风险研究却鲜有报道。
本研究以冀中平原典型农业区土壤-农作物体系为研究对象,检测土壤中主要OCPs的含量与分布,分析不同OCPs在玉米与小麦各器官中的分配与富集特征,并评价可食部分OCPs的人体健康风险,以期为我国土壤OCPs污染控制与修复提供参考依据。
1 材料与方法
1.1 研究区概况
研究区为冀中典型农业区,位于冀中平原西南部,太行山东麓山前平原的滹沱河冲积扇(37°27′~38°47′N,114°30′~115°20′E),隶属石家庄市。研究区地处半干旱大陆季风气候区,年降雨量556 mm,7—9月为雨季,年均温13.1 ℃,年无霜期约200 d。土壤类型为褐土类,包括潮褐土和碳酸盐褐土两个亚类。区域土壤的有机质和氮素含量处于中等偏缺,磷素含量相对缺乏。70%以上可耕农田采用冬小麦、夏玉米的轮作模式,所生产的小麦和玉米占粮食总产量的90%以上。研究区基本采用相同的耕作、施肥、秸秆还田等田间管理措施。主要引水灌溉河流为子牙河南系支流洨河和汪洋沟,均由西北流向东南最终汇入滏阳河。
1.2 样品采集与制备
分别于2012年5月和10月采集土壤样品,共计36个。其中,作为对照的非根际土壤样品12个,农作物对应的根际土壤样品24个(12个为小麦土壤,12个为玉米土壤)。采集样品时,在20 m范围内用清洁不锈钢铲在中心及周边4个方向采集0~20 cm的表层土壤样品,将这5个土壤样品混合均匀后作为研究区的代表性土壤样品。所采集样品用经450 ℃处理4 h的铝箔包裹,置于聚乙烯密实袋中,运回实验室冷冻(-4 ℃)保存。采集的土壤样品运回实验室后,分别按编号对其进行压碎,并去除石砾及植物残留物,置于阴凉通风处自然晾干。充分混匀样品,研磨后过2 mm筛,供分析测试用。
采集土壤样品同时,在对应采样点采集成熟期的整株玉米或小麦样品。采集的玉米与小麦样品数均为12个。所采集的农作物样品运回实验室后,先用自来水洗去附着的泥砂,再用蒸馏水彻底清洗其他杂质后,称取各器官代表部位(根部、茎部、叶片及去皮后可食用的籽粒)质量。然后放入-20 ℃冰箱中冷冻,冷冻后于-40 ℃冷冻干燥机中进行脱水处理。将干燥后的样品进行破碎,过40目筛,混匀,供分析测试用。
1.3 测试方法
称取5.0 g处理后的土壤样品于离心管中,加入1.0 g无水硫酸钠,用10 mL正己烷、丙酮混合萃取液(正己烷、丙酮体积比为1∶1)超声萃取20 min,以4 000 r/min离心5 min,收集萃取液。重复2次加入萃取液进行超声萃取,将收集的全部萃取液放置于棕色玻璃瓶中,并用超纯水定容至500 mL。使用C18固相萃取柱对定容后的萃取液中OCPs进行富集和洗脱[11]。依次用5 mL乙酸乙酯、5 mL甲醇和10 mL超纯水活化C18固相萃取柱,流速为5 mL/min。然后以6 mL/min抽滤,在即将抽滤完之前,加入10 mL超纯水洗涤玻璃瓶,继续真空抽滤30 min。分两次使用5 mL正己烷、乙酸乙酯混合液(正己烷、乙酸乙酯体积比10∶1)洗脱C18固相萃取柱。使用氮吹仪将收集的萃取液吹干,并用正己烷定容至1 mL,进行气相色谱(GC)/电子检测器(ECD)分析。
准确称取已磨碎的农作物各器官1.0 g于离心管中,加入1.0 g无水硫酸钠,用15 mL正己烷丙酮混合萃取液(正己烷、丙酮体积比2∶1)超声萃取20 min,以6 000 r/min离心5 min,收集萃取液。重复2次加入萃取液进行超声萃取,将收集的全部萃取液放置于棕色玻璃瓶中并用超纯水定容至500 mL,使用C18固相萃取柱参照土壤样品处理步骤进行富集、洗脱、浓缩和定容。
样品分析使用Agilent HP7890A型GC/ECD,并参考贾丽娟等[12]提出的分析方法。使用DB-5MS色谱柱(30 m×0.25 mm×0.25 μm),程序升温条件为:50 ℃保持1 min,以30 ℃/min升温至180 ℃,再以5 ℃/min升温至230 ℃,最后以10 ℃/min升温至300 ℃,保持5 min。不分流进样,进样量1 μL,进样口温度250 ℃,载气为高纯氦气(纯度为99.999%),恒流模式(流速为1 mL/min)。
农作物根部生物量采用恒温干燥法进行测定,根长与根表面积根据MOSADDEGHI等[13]174-176提出的方法进行分析。
1.4 质量控制
所用试剂经测定无干扰峰,每分析6个样品就包括1个全程空白样品,1个平行样品。土壤OCPs测试过程中,准确称取5 g非根际土壤样品,加入OCPs混标(购自美国AccuStandard公司,含17种OCPs),同时每份样品均加入回收率指示物2,4,5,6-四氯间二甲苯(TCMX)和十氯联苯(PCB209),平行样品标准偏差控制在20%以内。结果表明,17种OCPs的回收率为81.2%~112.6%,相对标准偏差为1.3%~9.5%,检测限为0.01~700.00 ng/g,回收率指示物回收率为75.3%~94.1%。选取无污染的小麦籽粒作为实验样品,在其上喷洒10 mL质量浓度为10 μg/L的混标溶液,密封在室温下保存24 h,以此模拟老化过程。同样加入回收率指示物。测得小麦籽粒中17种OCPs回收率为71.9%~85.2%,相对标准偏差为4.5%~10.3%,回收率指示物回收率为65.3%~84.1%。根据研究区OCPs使用状况,选用所有样品(包括土壤样品和农作物样品)中平均检出率大于5%的11种OCPs作为分析对象进行具体分析。
1.5 健康风险分析
采用USEPA推荐的健康风险评价模型,对研究区环境介质中的OCPs污染进行健康风险评价[14]5-8。根据文献[15]对研究区农作物中所检出的11种OCPs进行分类,除δ-HCH暂无分类数据外,其余均为可能致癌的化合物。以摄食为OCPs通过玉米和小麦的摄入途径,分析致癌风险(HI)和非致癌风险(R),计算方法分别见式(1)和式(2)[16]131-133。
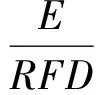
(1)
R=E×SF
(2)
式中:E为日均暴露剂量,mg/(kg·d);RFD为参考剂量,mg/(kg·d);SF为斜率因子,(kg·d)/mg。RFD和SF的取值见表1。
摄食途径下的日均暴露剂量计算方法如下:
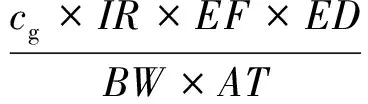
(3)
式中:cg为OCPs质量浓度,mg/kg;IR为日摄入剂量,mg/d,本研究中玉米取31 000 mg/d,小麦取330 000 mg/d;EF为暴露频率,d/a,本研究取365 d/a;ED为暴露时间,a,本研究取30 a;BW为平均体重,kg,本研究取65 kg;AT为平均生命时间,d,针对致癌风险取25 550 d,针对非致癌风险取10 950 d[14]10-12,[16]131-133,[17-18]。
2 结果与分析
2.1 土壤中OCPs的分布
对研究区土壤中OCPs进行检测,选取检出率超过5%的11种OCPs进行分析,结果见表2。在采集的所有根际土壤样品中,DDTs和HCHs为OCPs的主要组分。其中,HCHs异构体(α-HCH、β-HCH、γ-HCH、δ-HCH)中δ-HCH检出率最低,为50.0%,DDTs的3种异构体(p,p’-DDD、p,p’-DDT、p,p’-DDE)中p,p’-DDE检出率最低,为58.3%。土壤中HCHs与DDTs总计达到36.52~73.45 ng/g,平均值为54.40 ng/g,占OCPs的94.8%(质量分数,下同)以上。DDTs含量最高,占OCPs的84.5%以上,其质量浓度为32.18~64.27 ng/g,平均值为48.50 ng/g。其次为HCHs,质量浓度为2.83~9.18 ng/g,平均值为5.89 ng/g。土壤中OCPs含量分布呈现研究区流域下游(55.43~72.89 ng/g)高于上游(38.78~50.31 ng/g),DDTs和HCHs也均呈现下游(分别为5.27~8.46、51.41~55.62 ng/g)高于上游(分别为2.84~5.76、32.18~49.08 ng/g)。可见,OCPs广泛存在研究区土壤中,DDTs和HCHs为主要残留物质,且流域下游含量高于上游。
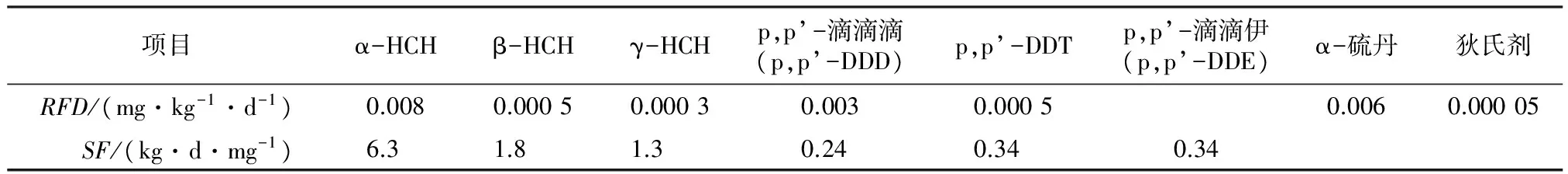
表1 摄食途径摄入OCPs的日均暴露剂量和斜率因子1)
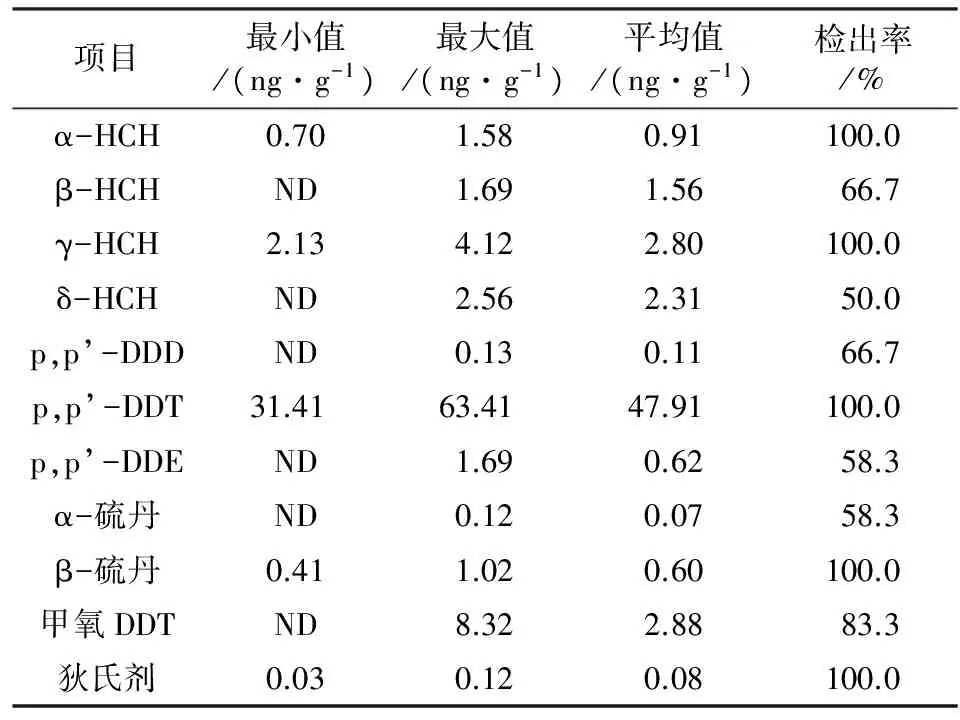
表2 研究区土壤OCPs残留特征1)
注:1)ND为未检出。
通过比较DDTs与HCHs残留量可知,DDTs显著高于HCHs,与迭庆杞等[5]86-88的研究结果类似。由表3可见,研究区土壤中HCHs残留量与海河上游地区土壤及黄淮海地区农业土壤类似,但显著低于天津市市郊污灌土壤及海河河口地区土壤。研究区土壤中DDTs残留量低于北京市市郊农业土壤和天津市农业土壤[24]外,但高于黄淮海地区农业土壤,存在这些差异可能与不同地区农药的使用种类、使用量及农业管理方式有关[25]。与《土壤环境质量标准》(GB 15618—1995)相比,研究区土壤样品中HCHs残留量均低于一级标准限值(50 ng/g),而41%的土壤样品中DDTs残留量略高于一级标准限值(50 ng/g)。
由于OCPs在不同来源中各异构体组成比例及异构体间物理化学性质存在差异,且各异构体存在相互转化的可能,因此不同异构体的组成特征可作为一种环境指示指标。对HCHs异构体而言,γ-HCH的降解速率比α-HCH快,而在一定条件下γ-HCH可以向α-HCH转化[26]。α-HCH的亨利系数最大,易挥发;γ-HCH也具有较大的亨利系数和水溶性;β-HCH亨利系数、蒸气压和水溶性低,化学性质稳定,抗生物降解能力强。在环境中,α-HCH和γ-HCH可以转化为β-HCH,导致β-HCH含量逐渐积累[27]。检测结果显示,研究区土壤中HCHs最主要残留物为γ-HCH,其残留量占HCHs总量的36.44%~75.24%,α-HCH、β-HCH、δ-HCH分别占HCHs总量的0.09%~27.44%、0~31.14%、0~43.73%。研究区土壤中HCHs与近期输入密切相关。不同DDTs在土壤环境中残留量不同,p,p’-DDT通过微生物降解转化为p,p’-DDD和p,p’-DDE,而p,p’-DDE在自然环境下很难降解。研究区土壤中p,p’-DDT占DDTs总量的91.23%~99.51%。根据本课题组前期对研究区土壤研究的发现,土壤中有机质及矿物粒径分布特征对OCPs的迁移分布也存在较大影响,在高有机碳含量土壤中HCHs的分布主要受小粒径的黏土影响,而在有机碳含量相对较低的土壤中,影响OCPs分布的主要为粗粉土和细粉土。此外,研究区污水灌溉耕作方式导致土壤中有机质含量增高,有机质对OCPs的吸附作用导致OCPs在该研究区土壤中富集[28]459-461,[29]31987。
2.2 农作物中OCPs的分布
研究区主要农作物全株OCPs表现为玉米(平均值97.14 ng/g)高于小麦(平均值90.69 ng/g)。其中,DDTs为玉米(平均值81.32 ng/g)高于小麦(平均值67.81 ng/g),而HCHs为玉米(平均值13.06 ng/g)与小麦(平均值13.59 ng/g)接近。结合小麦与玉米生物量的显著差异,发现玉米对土壤中OCPs的生物富集程度更高。
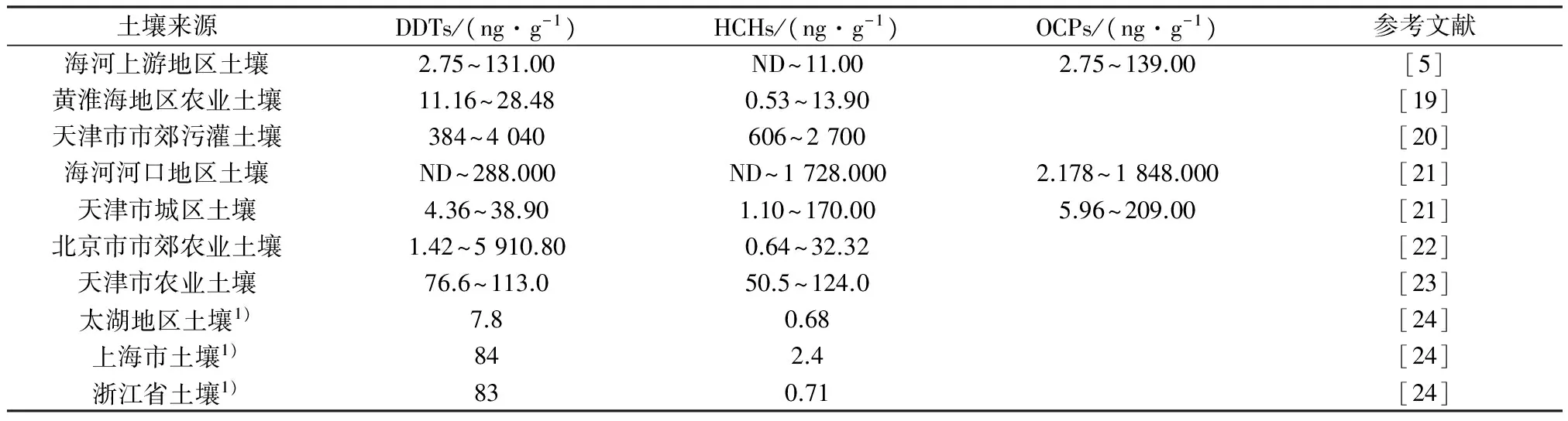
表3 国内其他地区土壤OCPs残留量
注:1)DDTs和HCHs均以平均值计。

图1 玉米和小麦不同器官中的OCPs质量浓度Fig.1 The concentration of OCPs in different organs of maize and wheat
如图1所示,OCPs、DDTs和HCHs在不同农作物器官间的分布均存在一定差异。OCPs均在籽粒中最高:玉米籽粒中OCPs为20.66~33.33 ng/g,平均值为26.51 ng/g;小麦籽粒中OCPs为19.14~34.57 ng/g,平均值为26.32 ng/g。其次为根部,玉米根部OCPs为19.60~30.41 ng/g,平均值为24.33 ng/g;小麦根部OCPs为18.62~27.99 ng/g,平均值为23.22 ng/g。不同农作物根部OCPs含量均呈现为流域下游高于上游,其分布与采样点土壤中有机碳含量呈现显著相关(P<0.031)[28]460-461,[29]31990-31991。茎部与叶片的OCPs含量最低,且两者相差不大,玉米茎部与叶片的OCPs平均值分别为23.31、23.01 ng/g,小麦茎部与叶片的OCPs的平均值分别为20.52、20.62 ng/g。而农作物中DDTs、HCHs在各器官的分布与OCPs存在显著差异(P<0.042)。DDTs在玉米器官中的平均值分布特征为籽粒>根部>茎部>叶片,在小麦器官中为籽粒>叶片>根部>茎部。HCHs在玉米器官中的平均值分布特征为籽粒>根部>茎部>叶片,在小麦器官中为根部>籽粒>茎部>叶片。因此,农作物对环境中OCPs的富集因化合物类型不同而存在差异,且主要通过根部吸收的方式富集OCPs,而根部对OCPs的吸收能力受土壤中有机质含量影响较大。
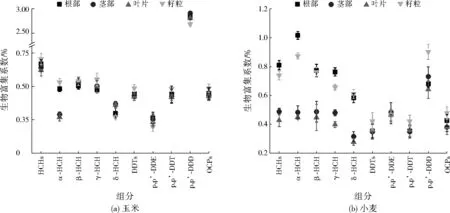
图2 OCPs在玉米与小麦不同器官中的生物富集系数Fig.2 The bioaccumulation coefficient of OCPs in different organs of maize and wheat
OCPs等已被禁止使用的化合物在农作物器官中被检出,一般是农作物通过对环境中残留的OCPs的再吸收而获得,而较少是由于直接或间接的OCPs使用而导致。针对此种OCPs残留现象,国际食品法典委员会制定了一系列最大可接受浓度。以OCPs≤100 ng/g为最大可接受质量浓度[30],研究区农作物器官中OCPs均未超标。参照《农产品安全质量 无公害蔬菜安全要求》(GB 18406.1—2001)中DDTs<100 ng/g、HCHs<100 ng/g的规定,研究区农作物器官中的DDTs和HCHs也符合标准。与《食品安全国家标准 食品中农药最大残留限量》(GB 2763—2012)中DDTs<50 ng/g、HCHs<50 ng/g的规定相比,研究区农作物各器官中的DDTs和HCHs仍符合标准。
2.3 农作物不同器官中OCPs的富集特征
评价不同农作物从土壤中富集污染物的能力通常采用农作物与土壤中的污染物浓度比值,即生物富集系数来表征。因此,本研究对土壤与农作物中检出率较高的DDTs和HCHs的生物富集系数进行了分析,结果如图2所示。由图2可知,玉米与小麦对OCPs各种组分的富集能力相差不大,其生物富集系数大体为0.20~0.80,但不同农作物的不同器官对OCPs的富集能力具有较大差异。相对小麦而言,玉米各器官对OCPs的富集能力较接近。玉米各器官大体表现为籽粒对OCPs的富集能力最大,其次为根部;而小麦各器官大体表现为根部对OCPs富集能力最强,且根部与籽粒对OCPs的富集能力显著强于叶片和茎部。小麦和玉米对HCHs的富集能力大体上均强于DDTs。在4种HCHs异构体中玉米和小麦对δ-HCH的富集能力均弱于其他异构体,而在DDTs异构体中p,p’-DDD在农作物中的富集能力均显著强于p,p’-DDT和p,p’-DDE。
为进一步认识不同农作物对OCPs富集能力的差异,分别计算了玉米和小麦的OCPs转运系数(籽粒与根部OCPs含量的比值),见图3。由图3可以看出,OCPs组分的转运系数存在差异。除δ-HCH外,HCHs的转运系数均体现为玉米大于小麦。DDTs异构体中玉米对p,p’-DDD和p,p’-DDT转运系数远高于p,p’-DDE。前人的研究显示,植物对污染物的富集受辛醇-水分配系数(Kow)影响。Kow越小(HCHs的Kow较小,为2.79~3.81),越有利于根部从土壤中吸收污染物;而Kow越大(DDTs的Kow较大,为6.33~6.91),污染物越容易在植物体内蓄积[1]210,[13]177-178,[16]131。OCPs为典型的疏水亲脂物质,容易被土壤颗粒吸附截留,在土壤环境中迁移性较差,且大量研究表明其主要分布在0~20 cm的表层土壤,难以向深层土壤迁移[31-33]。而玉米与小麦均为须根系植物,通过对其根部生物量、根长及根表面积分布的检测结果可发现,玉米的根部生物量、根长与根表面积在0~20 cm土壤深度的分布比例基本都高于小麦(见图4)。农作物对OCPs的吸收和迁移受土壤有机碳及土壤酶的影响。本课题组前期研究表明,土壤有机碳组分中微生物量碳对植物的
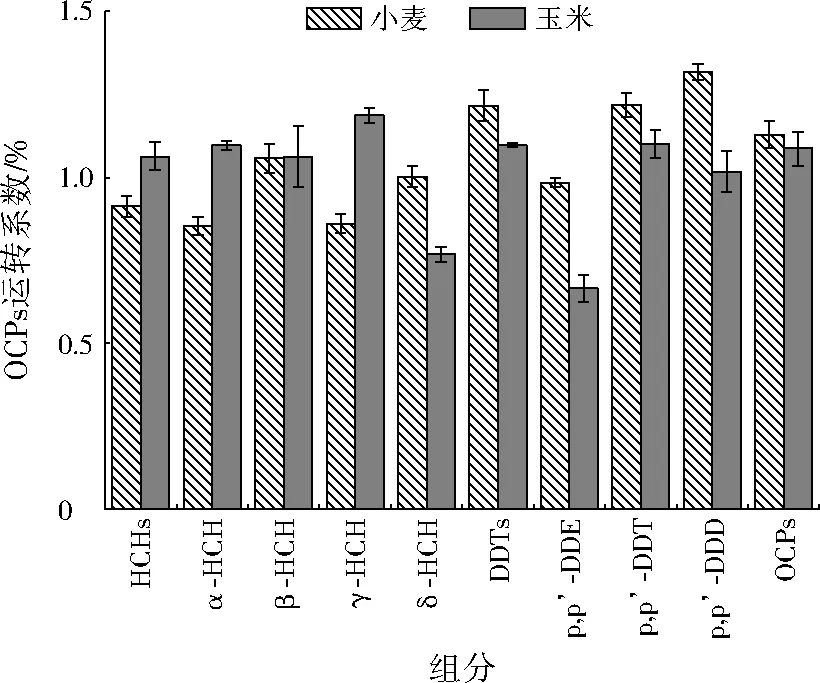
图3 玉米与小麦的OCPs转运系数Fig.3 OCPs transfer coefficient of maize and wheat
吸收能力影响最大[34],土壤酶中脲酶和β-葡萄糖苷酶分别对DDTs和HCHs的迁移转化具有决定性作用[29]31987。
2.4 农作物的健康风险分析
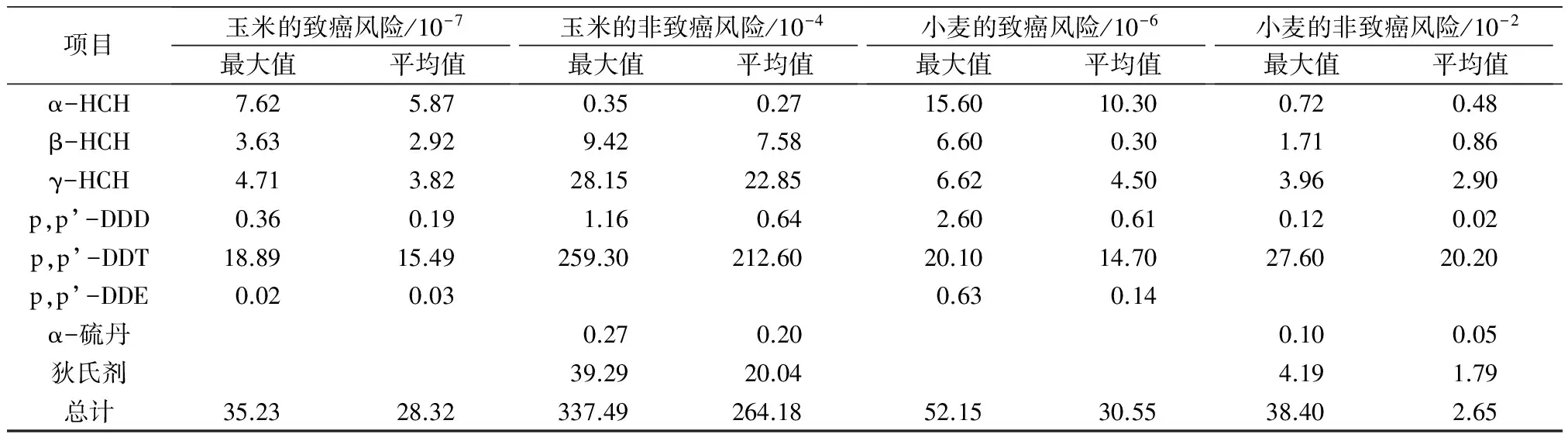
为考察研究区生产的农作物质量安全,以摄食为人体暴露途径,评价研究区农作物对人体产生的非致癌风险和致癌风险,评价结果见表4。
由表4可以看出,研究区所检出的OCPs各种组分的非致癌风险均符合USEPA标准(非致癌风险<1),表明该地区居民通过研究区玉米和小麦的摄入,基本不存在OCPs带来的非致癌风险。在OCPs的各种组分中,p,p’-DDT的非致癌风险最大,其次为γ-HCH。玉米和小麦中OCPs的致癌总风险均超过了1×10-6,表明研究区所生产的农作物中OCPs可能对人体产生潜在的致癌风险,因此需要关注该地区的农产品安全。小麦中OCPs的非致癌总风险和致癌总风险均大于玉米,表明该地区应该优先关注OCPs对小麦所造成的安全问题。
本研究中估算的健康风险只关注致癌风险与非致癌风险,将所有污染物健康风险相加作为健康总风险。目前,对混合污染物的毒性效应研究逐渐成为热点问题,但尚未得到较明确的结论,实际情况下的健康总风险需要进一步探讨。此外,本研究的健康风险评价还存在一定程度的不确定性,主要源于:受多种不同耕作方式以及季节变化等因素影响导致研究区污染物浓度分布不确定;人群的膳食结构多样、复杂和烹饪方式不同带来的不确定性;人群的体质、工作性质和住址的不同导致暴露参数存在不确定性。
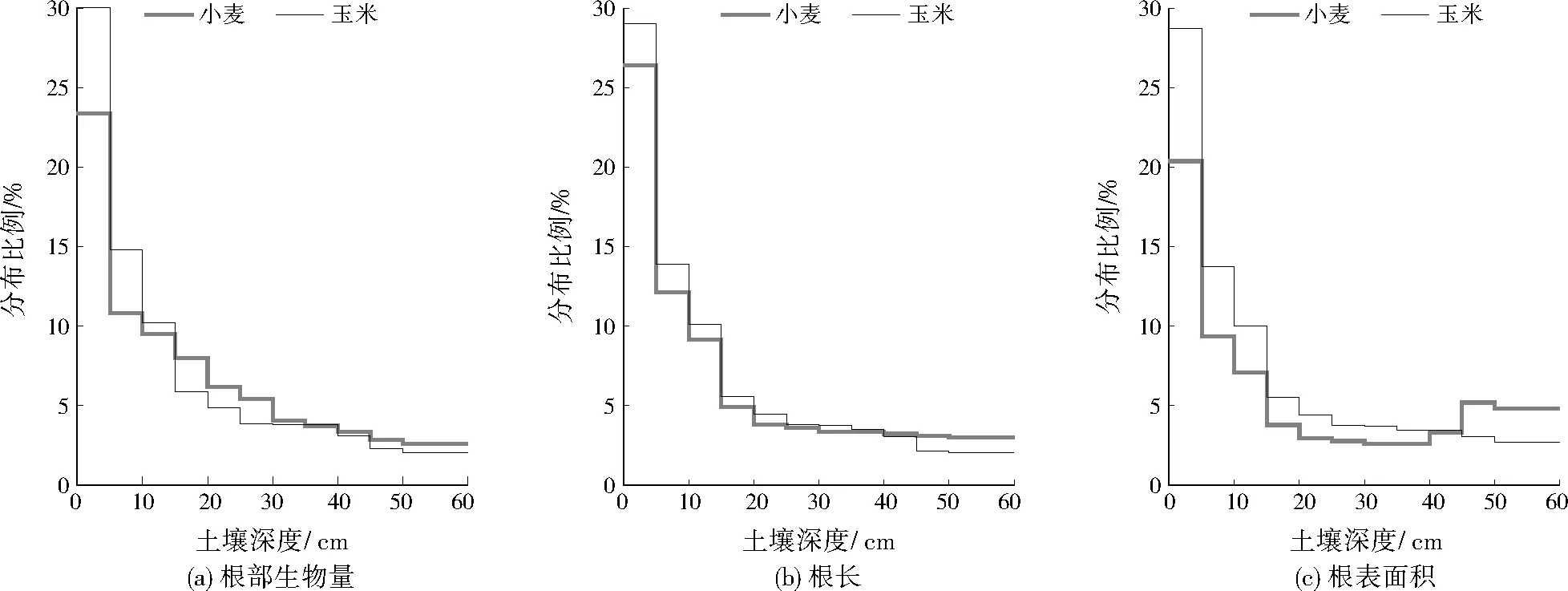
图4 玉米和小麦在不同土壤深度中根部生物量、根长和根表面积分布比例Fig.4 Distribution proportion of root biomass,length and surface area at different soil depth
项目玉米的致癌风险/10-7最大值平均值玉米的非致癌风险/10-4最大值平均值小麦的致癌风险/10-6最大值平均值小麦的非致癌风险/10-2最大值平均值α-HCH7.625.870.350.2715.6010.300.720.48β-HCH3.632.929.427.586.600.301.710.86γ-HCH4.713.8228.1522.856.624.503.962.90р,р’-DDD0.360.191.160.642.600.610.120.02р,р’-DDT18.8915.49259.30212.6020.1014.7027.6020.20р,р’-DDE0.020.030.630.14α-硫丹0.270.200.100.05狄氏剂39.2920.044.191.79总计35.2328.32337.49264.1852.1530.5538.402.65
3 结 论
(1) 研究区土壤中OCPs以DDTs和HCHs为主要残留组分,其中HCHs异构体中δ-HCH检出率最低,为50.0%;DDTs异构体中p,p’-DDE检出率最低,为58.3%。HCHs与DDTs总计达到36.52~73.45 ng/g,占OCPs的94.8%以上。
(2) 玉米与小麦的不同器官中,均表现为籽粒中OCPs最高,其质量浓度分别为20.66~33.33、19.14~34.57 ng/g,其次为根部,茎部与叶片中OCPs含量较低且两者相差不大。玉米与小麦对DDTs和HCHs的生物富集系数大体为0.2~0.8,且对HCHs的生物富集系数大体上均大于DDTs。小麦根部与籽粒对OCPs的富集能力显著强于叶片和茎部,而玉米各器官相比小麦对OCPs的富集能力较为接近。
(3) 研究区土壤中OCPs污染与近期输入密切相关,相比国内其他地区,其污染程度处于中等水平。玉米与小麦OCPs浓度均小于国际食品法典委员会制定的最大可接受浓度、GB 18406.1—2001及GB 2763—2012的规定。但由于OCPs的高富集性,小麦和玉米通过摄食途径对人体产生的致癌总风险均超过1×10-6,且小麦中OCPs致癌总风险大于玉米。因此,应对小麦和玉米,尤其是小麦的安全问题加以关注。
[1] JONES K C,DE VOOGT P.Persistent organic pollutants (POPs):state of the science[J].Environmental Pollution,1999,100(1/2/3).
[2] GIOIA R,OFFENBERG J H,GIGLIOTTI C L,et al.Atmospheric concentrations and deposition of organochlorine pesticides in the US Mid-Atlantic region[J].Atmospheric Environment,2005,39(12):2309-2322.
[3] 李军.珠江三角洲有机氯农药污染的区域地球化学研究[D].北京:中国科学院研究生院,2005.
[4] 王彬,米娟,潘学军,等.我国部分水体及沉积物中有机氯农药的污染状况[J].昆明理工大学学报(理工版),2010,35(3):93-99.
[5] 迭庆杞,聂志强,刘峰,等.海河上游地区土壤有机氯农药的分布特征研究[J].环境科学与技术,2015,38(2).
[6] 肖春艳,邰超,赵同谦,等.黄河湿地孟津段水体及沉积物有机氯农药的分布特征[J].环境科学,2009,30(6):1614-1620.
[7] 张明,花日茂,李学德,等.巢湖表层水体中有机氯农药的分布及组成[J].应用生态学报,2010,21(1):209-214.
[8] 张慧,刘红玉,张利,等.湖南省东北部蔬菜土壤中有机氯农药残留及其组成特征[J].农业环境科学学报,2008,27(2):555-559.
[9] 郜红建,蒋新.有机氯农药在南京市郊蔬菜中的生物富集与质量安全[J].环境科学学报,2005,25(1):90-93.
[10] 张家春,林绍霞,张清海,等.贵州草海耕地土壤与农作物中DDTs和HCHs残留及污染特征[J].农业环境科学学报,2014,33(7):1351-1357.
[11] 董玮玮,郝玉江,王丁,等.固相萃取—气相色谱—质谱法测定水中23种多氯联苯和10种有机氯农药残留[J].湖北农业科学,2011,50(8):1693-1696.
[12] 贾丽娟,邓芸芸.气相色谱—串联质谱法测定土壤中的有机氯农药[J].色谱,2008,26(6):697-703.
[13] MOSADDEGHI M R,MAHBOUBI A A,SAFADOUST A.Short-term effects of tillage and manure on some soil physical properties and maize root growth in a sandy loam soil in western Iran[J].Soil & Tillage Research,2009,104(1).
[14] USEPA.Risk assessment guidance for superfund.Volume 1.Human health evaluation manual.Part A.Interim report (final)[R].Washington,D.C.:Office of Emergency and Remedial Response,1989.
[15] METCALF R L.Century of DDT[J].Journal of Agricultural and Food Chemistry,1973,21(4):511-520.
[16] WANG Jun,CHEN Gangcai,CHRISTIE P,et al.Occurrence and risk assessment of phthalate esters (PAEs) in vegetables and soils of suburban plastic film greenhouses[J].Science of the Total Environment,2015,523.
[17] BABU G S,FAROO M.DDT and HCH residues in Basmati rice cultivated in Dehradun (India)[J].Water,Air,and Soil Pollution,2003,144(1):149-157.
[18] WATANABE K H,DESIMONE F W,THIYAGARAJAH A,et al.Fish tissue quality in the lower Mississippi River and health risks from fish consumption[J].Science of the Total Environment,2003,302(1/2/3):109-264.
[19] 赵炳梓,张佳宝,周凌云,等.黄淮海地区典型农业土壤中六六六(HCH)和滴滴涕(DDT)的残留量研究Ⅰ.表层残留量及其异构体组成[J].土壤学报,2005,42(5):761-767.
[20] 龚钟明,曹军,李本钢,等.天津市郊污灌农田土壤中有机氯农药的残留[J].农业环境保护,2002,21(5):459-461.
[21] 赵龙,侯红,郭平毅,等.海河干流及河口地区土壤中有机氯农药分布特征[J].环境科学,2009,30(2):543-550.
[22] 张红艳,高如泰,江树人,等.北京市农田土壤中有机氯农药残留的空间分析[J].中国农业科学,2006,39(7):1403-1410.
[23] WANG Xuejun,PIAO Xiuying,CHEN Jing,et al.Organochlorine pesticides in soil profiles from Tianjin,China[J].Chemosphere,2006,64(9):1514-1520.
[24] HARUHIKO N,YUKO H,MASAHIRO K,et al.Concentrations and compositions of organochlorine contaminants in sediments,soils,crustaceans,fishes and bird collected from Lake Tai,Hangzhou Bay and Shanghai city region,China[J].Environmental Pollution,2005,133(3):415-429.
[25] 杨国义,万开,张天彬,等.广东省典型区域农业土壤中有机氯农药含量及其分布特征[J].农业环境科学学报,2007,26(5):1619-1623.
[26] WANG Tieyu,LU Yonglong,SHI Yajuan,et al.Spatial distribution of organochlorine pesticide residues in soils surrounding Guanting Reservoir,People’s Republic of China[J].Bulletin of Environmental Contamination and Toxicology,2005,74(4):623-630.
[27] KIM S K,OH J R,SHIM W J,et al.Geographical distribution and accumulation features of organochlorine residues in bivalves from coastal areas of South Korea[J].Marine Pollution Bulletin,2002,45(1):268-279.
[28] 席北斗,虞敏达,张媛,等.华北典型污灌区有机氯农药残留特征及健康风险评价[J].生态毒理学报,2016,11(2).
[29] TAN Wenbing,ZHANG Yuan,HE Xiaosong,et al.Distribution patterns of phthalic acid esters in soil particle-size fractions determine biouptake in soil-cereal crop systems[J].Scientific Reports,2016,6.
[30] 宋稳成,何艺兵,叶纪明.国际食品法典农药残留限量标准最新进展[J].农药科学与管理,2008,29(2):41-51.
[31] 王存龙,张殿成,刘华峰,等.烟台市土壤有机氯农药分布及迁移规律[J].地球与环境,2012,40(2):171-178.
[32] 王春辉,吴绍华,周生路.典型土壤持久性有机物污染空间分布特征及环境行为研究进展[J].环境化学,2014,33(11):1828-1834.
[33] 李尧,左谦,刘文新,等.河北表层土壤中七氯的残留污染现状及其空间分异特征[J].农业环境科学学报,2007,26(1):230-234.
[34] ZHANG Yuan,LIANG Qiong,GAO Rutai,et al.Contamination of phthalate esters (PAEs) in typical wastewater-irrigated agricultural soils in Hebei,North China[J].PLOS One,2015,10(9):e0137998.
BioaccumulationandhealthriskassessmentoforganochloinepesticidesincropsoftypicalagriculturalregioninCentralHebei
MAYuxia1,2,YUMinda3,TANGHanying1,2,HUANGCaihong3,GAORutai3,ZHANGHui3,ZHANGYuan3,LIDan3.
(1.ManzhouliEnvironmentMonitoringStation,ManzhouliInnerMongolia021400;2.InnerMongoliaEnvironmentMonitoringStation,HuhehotInnerMongolia010011;3.InnovationBaseofGroundWaterandEnvironmentalSystemSectionEngineering,ChineseResearchAcademyofEnvironmentalSciences,Beijing100012)
The residue and bioaccumulation of organochlorine pesticides (OCPs) in soil-crop system was investigated and their potential human health risks were assessed. The results showed that DDTs and HCHs were the main OCPs in both soil and crop samples. The total concentrations of HCHs and DDTs ranged from 36.52 to 73.45 ng/g in soil. Among the HCHs and DDTs,γ-HCH and p,p’-DDT were the most abundant congeners,respectively,indicating that DDTs and HCHs might be recently released to the environment. The grains showed the highest concentrations of total OCPs,with 20.66-33.33 and 19.14-34.57 ng/g for maize and wheat,respectively. Bioconcentration factors of HCHs in maize and wheat were higher than those of DDTs. Although the concentration of OCPs in grains of maize and wheat were within “Safety qualification for agricultural product - safety requirements for non-environmental pollution vegetable” (GB 18406.1-2001) and “National food safety standard - maximum residue limits for pesticides in food” (GB 2763-2012),the total potential carcinogenic risk of OCPs was relatively high,which was higher than 1×10-6. The non-carcinogenic and carcinogenic risks in wheat grains were higher than those in maize grains,indicating that the effect of OCPs on wheat should be prioritized.
soil-crop system; organochlorine pesticides; bioaccumulation; health risk
10.15985/j.cnki.1001-3865.2017.02.008
2016-06-23)
马玉霞,女,1966年生,本科,高级工程师,主要从事环境监测与污染物控制工作。#
。
*国家水体污染控制与治理科技重大专项(No.2012ZX07203-003)。
