高效液相色谱法同时测定复方倍他米松注射液两主成分含量
2017-11-02沈丹丹肖波姜学美张涛
沈丹丹,肖波,姜学美,张涛
(1.重庆市食品药品检验检测研究院,重庆401121;2.重庆市药物过程与质量控制工程技术研究中心,重庆401121;3.重庆医药工业研究院有限责任公司,重庆400061;4.福安药业集团重庆礼邦药物开发有限公司,重庆401121)
高效液相色谱法同时测定复方倍他米松注射液两主成分含量
沈丹丹1,2,肖波3,姜学美1,2,张涛4
(1.重庆市食品药品检验检测研究院,重庆401121;2.重庆市药物过程与质量控制工程技术研究中心,重庆401121;3.重庆医药工业研究院有限责任公司,重庆400061;4.福安药业集团重庆礼邦药物开发有限公司,重庆401121)
目的建立同时测定复方倍他米松注射液中倍他米松磷酸钠及二丙酸倍他米松含量的高效液相色谱(HPLC)法。方法流动相为甲醇-乙腈-0.01 mol/L磷酸二氢铵(取磷酸二氢铵1.15 g,用水1 000 mL溶解后,加20%四丁基氢氧化铵28 mL,用磷酸调pH至7.0)溶液(34∶30∶36),检测波长为242 nm,柱温为35℃,流速为1.0 mL/min,进样量为10 L。结果倍他米松磷酸钠及二丙酸倍他米松相邻色谱峰之间的分离度大于1.5,质量浓度分别在0.052 6~1.316 0 g/L(r=0.999 9)和0.115 2~2.879 7 g/L(r=1.000 0)范围内与峰面积线性关系良好,平均回收率分别为99.54%和99.78%,RSD分别为0.94%和0.70%(n=9);倍他米松磷酸钠在光照条件下含量急剧下降。结论该方法可同时测定复方倍他米松注射液中倍他米松磷酸钠、二丙酸倍他米松的含量,可用于其质量控制。
复方倍他米松注射液;倍他米松磷酸钠;二丙酸倍他米松;含量;高效液相色谱法
复方倍他米松注射液(商品名得宝松)是由先灵葆雅公司开发的一种倍他米松磷酸钠(BSP)和二丙酸倍他米松(BD)的复方药物剂型,具有抗炎、抗过敏和抗风湿的功效[1]。原进口药品注册标准(JX20070074)中收载的含量测定方法[2],分别采用不同色谱条件测定2种成分,以内标法计算,操作烦琐,分析时间较长。也有采用同一色谱条件测定该2个主成分的含量,但以梯度洗脱,采用内标法计算含量[3],操作程序仍比较复杂,且2个主成分色谱峰理论板数不高(BSP与BD分别为2 955和3 031)。本研究中建立了一种同时测定BSP及BD含量的色谱条件,以等度洗脱,按外标法计算含量,更加快速、准确、有效地控制产品质量,以完善现行质量标准中的不足,提升药品检验的准确性,同时为本品在生产、贮藏及运输过程中把好技术关,更好地为药品监督服务。现报道如下。
1 仪器与试药
1.1 仪器
Agilent 1260型高效液相色谱仪(美国Agilent公司);K51502653型电子天平(德国赛多利斯公司)。
1.2 试药
磷酸二氢氨、四丁基氢氧化铵为分析纯,甲醇及乙腈为色谱纯。BSP对照品(中国食品药品检定研究院,批号为100180-201103,含量为98.7%);BD对照品(中国食品药品检定研究院,批号为100596-200601,含量为99.3%);复方倍他米松注射液(上海先灵葆雅制药有限公司,批号分别为3BBKAO8C03,4BBKAO6A01,5BBKAC3E01,含BD 6.43 g/L,含BSP 2.63 g/L)。
2 方法与结果
2.1 色谱条件
色谱柱:Phenomenex Luna C18柱(250 mm×4.6 mm,5 μm);流动相:甲醇-乙腈-0.01 mol/L磷酸二氢铵(取磷酸二氢铵1.15 g,用水1 000 mL溶解后,加20%四丁基氢氧化铵28 mL,用磷酸调pH至7.0)溶液(34∶30∶36);检测波长:242 nm;柱温:35℃;流速:1.0 mL/min;进样量:10 μL。
2.2 溶液制备
精密量取本品5.0 mL,置50 mL容量瓶中,加流动相溶解并稀释至刻度,摇匀,作为供试品溶液。另取BD对照品和BSP对照品适量,精密称定,用流动相溶解并定量稀释成每1 mL中约含BD 0.64 mg和BSP 0.26 mg的溶液,作为对照品混合溶液。
2.3 方法学考察
2.3.1 专属性试验
空白辅料干扰试验:按照处方配制混合辅料,精密量取辅料适量,按供试品溶液配制方法制成辅料溶液,精密量取续滤液10 μL,注入液相色谱仪,记录色谱图,见图1。在此条件下,溶剂空白、辅料空白不干扰BSP和BD的测定,理论板数均大于3 000,2个主峰与相邻峰的分离度均大于1.5,专属性良好。
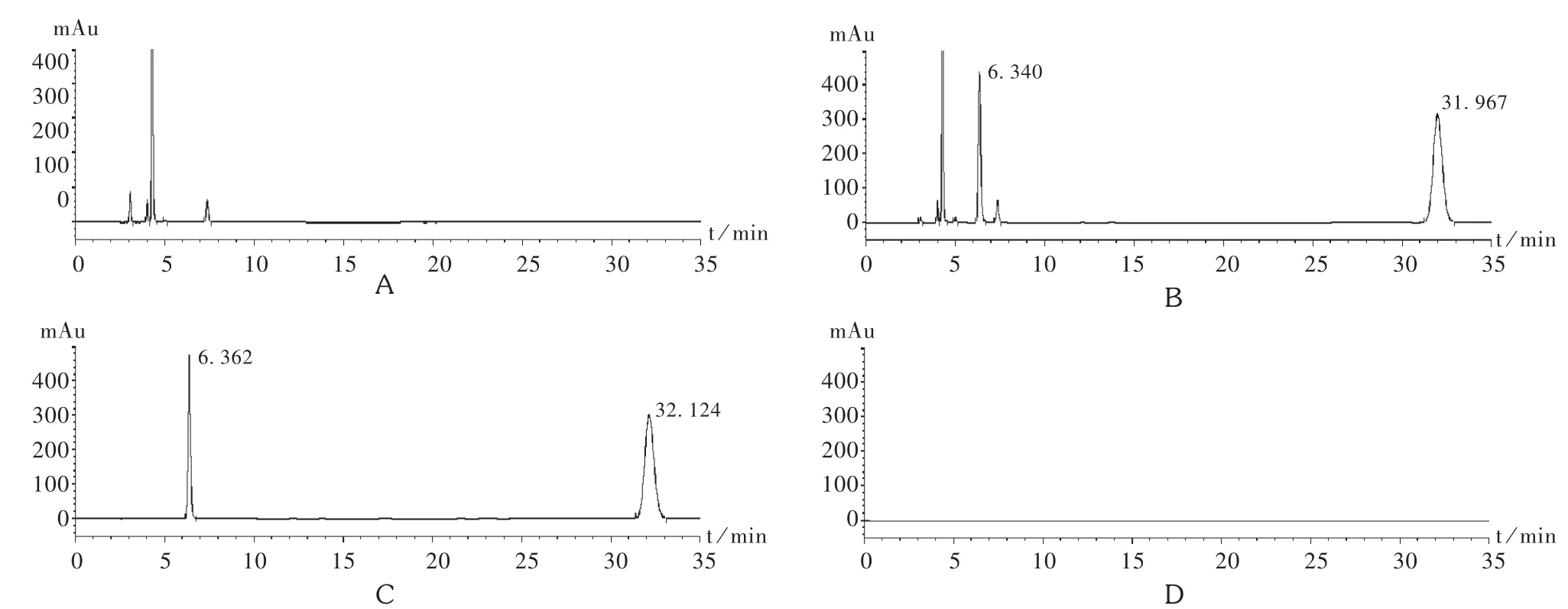
图1 专属性试验高效液相色谱图
降解试验:精密量取本品1.0 mL,置10 mL容量瓶中,用流动相溶解并稀释至刻度,置水浴中80℃条件下放置3 h,取出放至室温,加流动相至刻度,摇匀,即得80℃高温降解供试品溶液。精密量取本品1.0 mL,置10 mL容量瓶中,加0.1 mol/L盐酸1.0 mL,摇匀,室温避光放置30 min后,加0.1 mol/L氢氧化钠1.0 mL,加流动相4.0 mL,再加乙腈稀释至刻度,摇匀,即得强酸降解供试品溶液。精密量取本品1.0 mL,置10 mL容量瓶中,加0.1 mol/L氢氧化钠1.0 mL,摇匀,室温避光放置30 min后,加0.1 mol/L盐酸1.0 mL,加流动相4.0 mL,再加乙腈稀释至刻度,摇匀,即得强碱降解供试品溶液。精密量取本品1.0 mL,置10 mL容量瓶中,加30%过氧化氢(H2O2)1.0 mL,室温避光放置3 h后,加流动相4.0 mL,再加乙腈稀释至刻度,摇匀,即得强氧化降解供试品溶液。精密量取本品1.0 mL,置10 mL容量瓶中,用流动相溶解并稀释至刻度。置光照箱中[照度为(3 500±500)lx],放置16 h后取出,即得强光照射降解供试品溶液。分别精密吸取上述溶液各10 μL注入液相色谱仪,记录色谱图,见图2。另以未降解供试品溶液作为对照品溶液评价质量平衡,对上述供试品溶液分别采用二极管阵列检测器(DAD检测器)测试主峰的峰纯度,结果见表1。结果表明,主峰色谱峰纯度因子均大于999,表明2个主峰为纯物质峰;质量平衡在95%~105%范围内,产生的杂质均能被有效检出,方法专属性强,可有效测定含量。

图2 降解试验高效液相色谱图
2.3.2 精密度试验
精密吸取对照品混合溶液10 μL,平行6份,注入液相色谱仪,记录色谱图。结果BSP与BD的RSD分别为0.5%及0.3%(n=6),表明仪器精密度良好。
2.3.3 定量限与检测限确定
取BSP与BD对照品适量,精密称定,用流动相溶解并定量稀释成每1 mL约含BD 0.64 mg和BSP 0.26 mg的溶液,作为对照品贮备液。精密量取1.0 mL,用流动相逐级稀释成系列浓度,吸取10 μL注入液相色谱仪,记录色谱图。以信噪比(S/N)=3∶1计算检测限,以S/N=10∶1计算定量限。结果BSP与BD检测限分别为0.32 ng和0.93 ng,定量限分别为0.56 ng和1.84 ng。
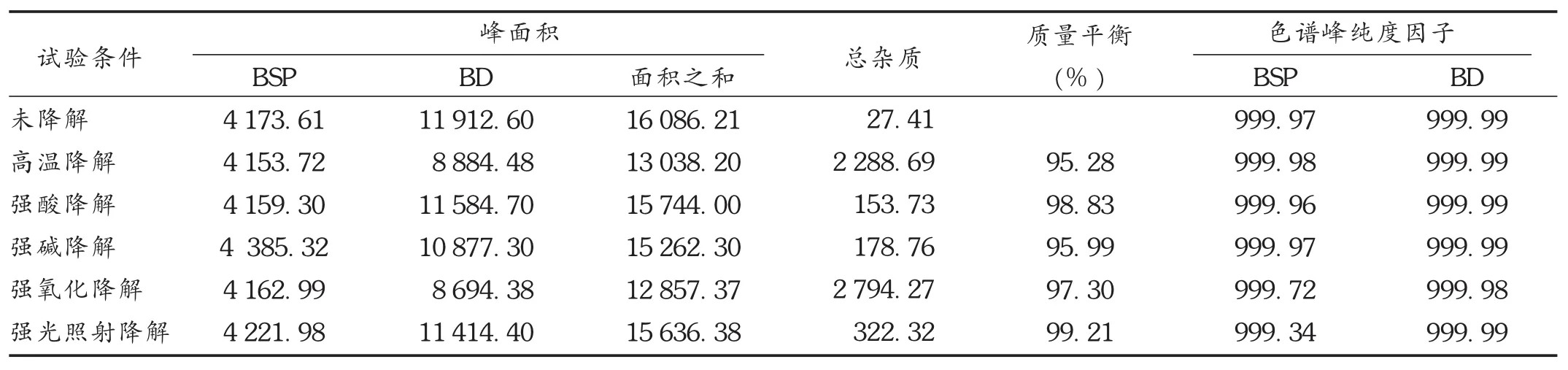
表1 强制降解试验结果
2.3.4 稳定性试验
取2.2项下同一供试品溶液,分别于0,1,2,8,16 h时吸取10 μL,注入液相色谱仪,记录色谱图。结果BSP与BD峰面积的RSD分别为0.9%和0.6%(n=6),表明供试品溶液在16 h内稳定。
2.3.5 线性关系考察
称取BD对照品约32 mg和BSP对照品约13 mg,精密称定,置同一10 mL容量瓶中,用流动相溶解并稀释至刻度,作为对照品贮备液。精密量取对照品贮备液2.0 mL,置50 mL容量瓶中,用流动相稀释至刻度,作为对照品溶液1;精密量取对照品贮备液1.0,2.0,4.0 mL,分别置10 mL量瓶中,用流动相稀释至刻度,作为对照品溶液2,3,4。取对照品贮备液作为对照品溶液5。精密吸取对照品系列溶液各10 μL,分别注入液相色谱仪,记录色谱图。以质量浓度(C)为横坐标、峰面积(A)为纵坐标绘制标准曲线,得回归方程,BSP为A=-23.035 37+14 651.780 43 C(r=0.999 9),表明BSP质量浓度在0.115 2~2.879 7 g/L范围内与峰面积线性关系良好;BD为A=183.147 04+17 378.365 26 C(r=1.000 0),表明BD质量浓度在0.052 6~1.316 0 g/L范围内与峰面积线性关系良好。
2.3.6 回收试验
取BSP对照品和BD对照品适量,精密称定,置同一50 mL容量瓶中,用流动相溶解并定量稀释制成每1 mL中约含BD 0.64 mg和BSP 0.26 mg的溶液,作为对照品混合溶液。分别精密量取本品辅料空白溶液(批号为20150105)5 mL,平行9份,分别置50 mL容量瓶中,加入处方量80%,100%,120%的BSP和BD,分别用流动相稀释至刻度,摇匀,用微孔滤膜滤过,取续滤液,作为供试品溶液。精密吸取10 μL,注入液相色谱仪,记录色谱图,计算回收率。结果BSP与BD的平均回收率分别为99.54%和99.78%,RSD分别为0.94%和0.70%(n=9)。见表2。
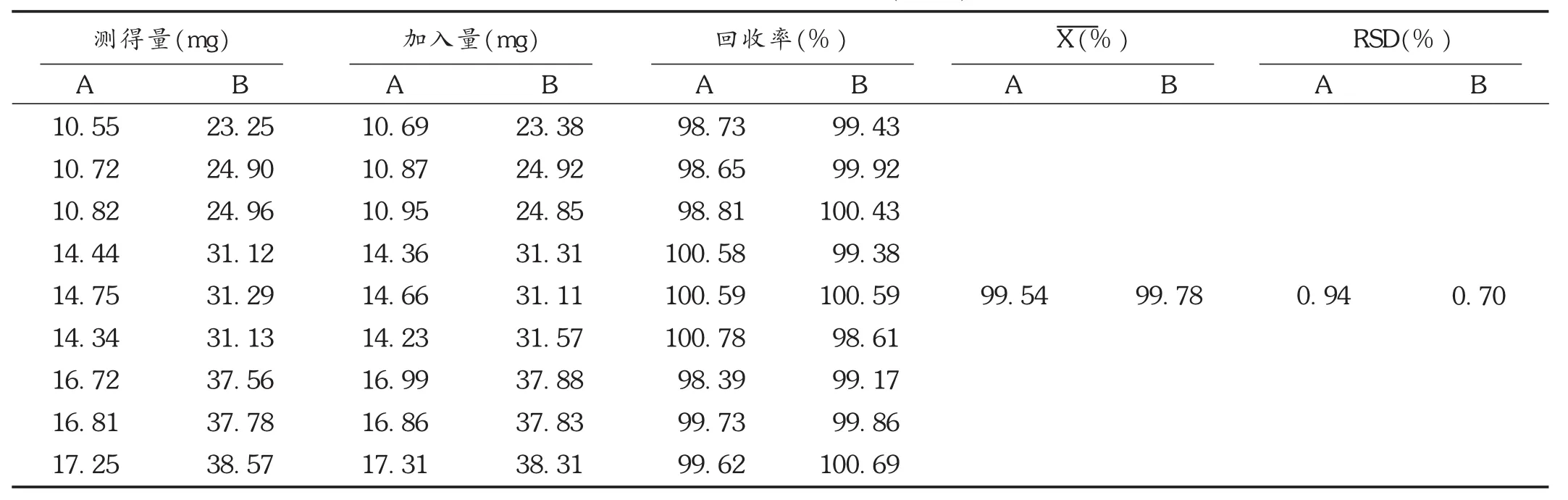
表2 回收试验测定结果(n=9)
2.3.7 重复性试验
取本品6份,依法制配供试品溶液,进样测定。结果BSP与BD平均含量分别为99.10%和102.09%,RSD分别为0.62%和0.44%(n=6)。
2.3.8 耐用性试验
色谱柱:选用Agilent Zorbax SB-C18柱及Phenomenex Luna C18柱对供试品溶液进行测定,其他条件保持不变、结果不同种类的色谱柱对分离度无明显影响,表明本方法对色谱柱种类耐用性强。

表3 3批样品影响因素试验测定结果(%)
缓冲液pH:将缓冲液pH分别调至6.9,7.0,7.1,其他条件保持不变,取2.2项下供试品溶液10 μL注入液相色谱仪。结果缓冲液pH在6.9~7.1变化范围内,分离度均大于2.0,表明方法对缓冲液pH耐用性较强。
柱温:将柱温分别设定为30,35,40℃,其他条件保持不变,取2.2项下供试品溶液10 μL注入液相色谱仪。结果柱温在30~40℃变化范围内,分离度均大于2.0,表明方法对柱温耐用性强。
流速:将流速分别设定为0.8,1.0,1.2 mL/min,其他条件保持不变,取2.2项下供试品溶液10 μL注入液相色谱仪。结果流速在0.8~1.2 mL/min变化范围内,分离度均大于2.0,表明方法对流速耐用性强。
流动相比例:选用色谱柱Phenomenex Luna C18柱,改变流动相比例,其他条件保持不变,取2.2项下供试品溶液10 μL注入液相色谱仪。结果甲醇在±2%变化范围内,乙腈在±5%变化范围内,分离度均大于2.0,表明方法对流动相比例耐用性强。
2.3.9 影响因素试验
取本品3批,分别于60℃恒温干燥箱中放置5,10,30 d,作为高温60℃破坏样品;于40℃恒温干燥箱中放置5,10,30 d,作为高温40℃破坏样品;于(4 500±500)lx光照箱中放置5,10,30 d,作为光照破坏样品。将破坏后的样品按2.2项下方法处理,按拟订色谱条件进样分析,记录色谱图。与未经破坏的含量测定结果比较,结果见表3。结果表明,与0 d比较,光照条件下,随着时间增加,BSP含量呈急剧下降趋势。在高温40℃,60℃条件下,随着时间增加,各成分含量无明显变化,说明BSP对光照不稳定。
3 讨论
3.1 流动相选择
在200~400 nm波长范围内对BSP对照品、BD对照品分别进行紫外扫描,结果均在242 nm波长处有最大吸收,因此确定检测波长为242 nm。由于BSP与BD极性相差较大,如乙腈比例低,则BD不能被有效洗脱;如增加乙腈比例,则BSP出峰时间又较快,不能达到与相邻峰良好分离。参照国家食品药品监督管理总局标准含量测定色谱条件[4],供试品中2个主峰与相邻峰的分离度均符合要求,但流动相中加入的20%四丁基氢氧化铵用量比较大,流动相很容易有晶体析出,堵塞色谱柱,方法耐用性较差。因此,本研究确定的流动相中降低了20%四丁基氢氧化铵用量,将2个主峰均有效洗脱并能与相邻峰达到良好分离,BSP与BD理论板数均达到10 000以上,能同时测定2个主成分的含量,方法耐用性好。
3.2 强降解试验
本品对强酸强碱较为稳定,在光照、强氧化及高温条件下,杂质增加较多;各降解杂质与2个主峰达到有效分离。主峰色谱峰纯度因子均大于999,表明2个主峰为纯物质峰;质量平衡在95%~105%范围内,产生的杂质均能被有效检出,方法专属性强,能有效测定含量。
3.3 影响因素分析
与0 d比较,在光照条件下,随着时间增加,BSP含量呈急剧下降趋势;在高温40℃,60℃条件下,随着时间增加,各成分含量无明显变化,说明BSP对光照不稳定。建议企业在研发、生产、运输及贮藏过程中应注意避光,保证产品质量的有效性。
[1] 单敏,郑方晔,李锋武.RP-HPLC法测定复方倍他米松注射液有关物质[J].药物分析杂志,2008,28(4):624-626.
[2] JX20070074,复方倍他米松注射液进口药品注册标准[S].
[3] 金薇,汪洁.HPLC同时测定复方倍他米松注射液中倍他米松磷酸钠和二丙酸倍他米松的含量[J].中国药学杂志,2002,37(1):48-50.
[4] YBH01252015,国家食品药品监督管理总局标准·复方倍他米松注射液[S].
Simultaneous Determination of Two Main Components in Compound Betamethasone Injection by HPLC
Shen Dandan1,2,Xiao Bo3,Jang Xuemei1,2,Zhang Tao4
(1.Chongqing Institute for Food and Drug Control,Chongqing,China401121;2.Chongqing Research Center for Drug Process and Quality Control Engineering,Chongqing,China401121;3.Chongqing Research Academy of Pharmaceutical Industry,Chongqing,China400061;4.Fuan Pharmaceutical Lybon Pharm-Tech Co.,Ltd.,Chongqing,China401121)
Objective To establish an HPLC method for simultaneous determination of betamethasone sodium phosphate and betamethasone dipropionate in Compound Betamethasone Injection.MethodsThe mobile phase was methanol-acetonitrile-0.01 mol/L ammonium dihydrogen phosphate(ammonium dihydrogen phosphate 1.15 g was dissolved in 1 000 mL water,28 mL 20%tetrabutylammonium hydroxide(TBAH)was added,and the pH was adjusted to 7 with phosphoric acid)(34∶30∶36),the detection wavelength was 242 nm,the column temperature was 35℃,the flow rate was 1.0 mL/min and the sample size was 10 μL.ResultsThe resolution among the adjacent chromatographic peaks of betamethasone sodium phosphate and betamethasone dipropionate was greater than 1.5.Betamethasonesodium phosphate and betamethasone dipropionate in the ranges of 0.052 6-1.316 0 g/L(r=0.999 9),0.115 2-2.879 7 g/L(r=1.000 0)showed a good linearity.The average recovery rates were 99.54%,99.78%,RSDs were 0.94%,0.70%(n=9).The content of betamethasone sodium phosphate decreased sharply in the light conditions.ConclusionThe method can simultaneously determine the content of betamethasone sodium phosphate and betamethasone dipropionate in Compound Betamethasone Injection,which can be used for the quality control of the products.
Compound Betamethasone Injection;betamethasone sodium phosphate;betamethasone dipropionate;content;HPLC
R927.2
A
1006-4931(2017)21-0025-05
10.3969/j.issn.1006-4931.2017.21.010
沈丹丹,女,硕士研究生,工程师,研究方向为药物分析及药剂学,(电子信箱)499258077@qq.com。
张涛,男,硕士研究生,教授级高级工程师,研究方向为新药开发,(电子信箱)zzhtao@qq.com。
2017-06-06)
·临床研究·
