黄河三角洲盐碱地固氮细菌的分离鉴定和生长特性研究
2017-11-01薛婷婷陆洪省程建光
薛婷婷,陆洪省,程建光
(山东科技大学, 山东 青岛 266590)
黄河三角洲盐碱地固氮细菌的分离鉴定和生长特性研究
薛婷婷,陆洪省,程建光
(山东科技大学, 山东 青岛 266590)
本研究采用传统培养法,在黄河三角洲自然保护区盐碱地地区采集了未经人为干预地区的土样,从盐碱土中分离筛选出耐盐碱固氮菌,通过菌株个体形态特征、菌落特征、生理生化特征等方面进行初步鉴定。分析菌株的16S rDNA序列,从基因水平鉴定为固氮菌,并命名为SKDN-1。对耐盐碱固氮菌的环境适应性研究表明,该菌株在28℃,摇床(150r/min)培养条件下,最适pH范围为7~9,最佳利用的碳源为葡萄糖。筛选出的耐盐碱固氮菌具有较高的碱度适应能力。因此,接种耐盐碱固氮菌种能够发挥固氮菌的固氮性能,提高盐碱土中生物氮的含量。
盐碱地;黄河三角洲;固氮细菌;分离鉴定
黄河三角洲的生态特征明显,物种丰富,人为干预少,是珍贵物种多样性的天然基因库。而细菌作为土壤生态系统中物质循环和能量流动的主要参与者,起着非常重要、无法取代的作用。土壤的质量能够影响植物的生长情况,而土壤中的微生物是其生态系统的一项重要组成成分,它是评价土壤质量变化最有潜力,且最敏感的指标[1],在整个土壤生态系统中的作用是重大的[2]。同时,土壤与植物也反作用于细菌群落的构成。因此,研究土壤中细菌的群落特征,分析细菌多样性,不仅在微生物学的细菌进化方面具有重要意义,而且对盐碱地土壤的改良提供参考意见。再者,由于盐渍化土壤中的细菌能够生存,我们猜想,这些细菌可能具有耐盐基因,才能够适应盐碱环境的压力。如果能够找到调控耐盐方面的基因,并转入植物体中成功进行表达,那么这无疑为盐碱地土壤的改良提供了另一条途径。
本文采用传统培养法,利用改良的无氮Burk's选择培养基[3],从黄河三角洲盐碱地中筛选出耐盐碱固氮菌,以期分离得到适应盐碱环境的高效固氮菌,并探究不同培养条件对其生长特性的影响。在最优条件下培养固氮菌,得到的纯种菌株进行基因鉴定。
1 材料与方法
1.1 样品及培养基
从黄河三角洲盐碱地采集的盐碱化程度比较深的盐斑土、星星草及碱蓬根际土(根系和土壤),采样深度15~20cm,为便于研究,将根际区分为:据根系较远(1cm)土壤(NRS)、根表土壤(RS)、根系表面(RP)和根内(HP)。各样品按常规方法分别混合后装入灭菌信封袋,分别编号1号、2号、3号、4号,带回实验室放在4℃的冰箱内保存,供分离固氮菌之需。改良的无氮Burk's选择培养基:葡萄糖20g,NaCl 10g,K2HPO40. 64g,KH2PO40.16g,MgSO4·7H2O 0.20g,CaSO4·2H2O 0.05g,,钼酸钠 2.5mg,FeSO415mg, 水1000mL,(琼脂15~20g,做固体培养基用;琼脂5~10g,做半固体培养基用)
1.2 固氮细菌的分离筛选
取5g上述2号混合土样放50mL烧杯内,用50mL水搅拌、振荡,约20min后,使样品与水充分混合,将细胞分散,形成均匀菌悬液。静置1h等溶液澄清后,吸取5mL悬浮液装入盛有200mL选择基培养液的250mL三角瓶中,100r/min,30℃下培养3~5d后,换新鲜培养基继续培养,重复5~6次。在改良的Bark's 培养基基础上加入20g NaCl,分离出耐盐碱的极端固氮菌,取富集培养后的培养液,稀释涂布于平板分离培养基上。30℃培养7天后,取单菌落重复划线4次,直至菌落形态一致,将单菌落保存于鞋面培养基中,4℃冰箱保藏备用。
1.3 细菌的初步鉴定
根据现有的实验条件,本实验主要依据《常见细菌系统鉴定手册》和《伯杰细菌鉴定手册》(第八版) ,从菌落的形态特征、生理生化特征等方面,用传统的鉴定方法进行鉴定。
1.3.1 菌株的形态观察
将待鉴定菌株活化后, 将改良的无氮Burk's 选择培养基制成平板,取少量菌苔进行平板划线,将培养皿倒置,于30℃培养7~15天,观察菌落形态特征,如菌落颜色,形状,大小,透明度及粘度,边缘和隆起形状,表面光滑程度以及是否产生非水溶性色素等。
1.3.2 生理生化性质鉴定
生理生化指标包括革兰氏染色,乙酰甲基甲醇(V.P.)试验,甲基红(M.R.)试验,吲哚试验,糖醇发酵试验,细菌运动性测定,柠檬酸盐试验,产氨试验等,方法参照参考文献[4-5]。
1.3.3 菌株生长曲线测定
将保存在半固体培养基中的耐盐碱固氮菌按 1%的接种量(100mL 培养基接种 1mL 活化菌液)转接至新鲜的种子培养基营养液中,30℃下于摇床(180r/min)中培养,从零时开始,不同时间取出培养液,用722分光光度计在720nm波长下进行光密度测定。
1.4 不同条件下固氮菌生长特性研究
本试验主要利用控制变量法研究各种因子对固氮菌生长特性的影响。以改良的无氮Burk's选择培养基为基础,根据要求相应改变其中一些组分,所有环境适应性试验采用液体培养基。
1.4.1 酸碱性对固氮细菌生长的影响
把Burk's 无氮培养基的起始 pH 值设定在 5, 7, 9, 11 共 4 个水平,将保存在半固体培养基中的耐盐碱固氮菌按 1%的接种量(100mL 培养基接种 1mL 活化菌液)转接至新鲜的种子培养基营养液中,30℃下于摇床(180r/min)中培养,从零时开始,不同时间取出培养液,用722分光光度计在720nm波长下进行光密度测定。
1.4.2 碳源对耐盐碱固氮菌生长特性的影响
Burk's 无氮培养基中的蔗糖分别用葡萄糖、蔗糖、淀粉、乳糖代替, 碳含量一致, pH 值都为 9.0。将保存在半固体培养基中的耐盐碱固氮菌按 1%的接种量(100mL 培养基接种 1mL 活化菌液)转接至新鲜的种子培养基营养液中,30℃下于摇床(180r/min)中培养,从零时开始,不同时间取出培养液,用722分光光度计在720nm波长下进行光密度测定。
1.5 耐盐碱固氮菌基因水平的鉴定
1.5.1 细菌基因组DNA的提取
采用UNIQ-10柱式细菌基因组抽提试剂盒对菌株进行DNA提取,提取步骤按照试剂盒说明书。
1.5.2 16S rDNA基因序列通用引物进行PCR扩增
以细菌DNA为模板,以通用引物7F:5′-CAGAGTTTGATCCTGGCT-3′;1540R:5′-AGGAGGTGATCCAGCCGCA-3′进行PCR扩增。反应体系(25μL):2.5μL 5×Buffer(with Mg2+),0.5μL模板DNA,各0.5μL 7F(10uM)和1540R(10uM),1μL dNTP(各2.5mM),超纯水定容至25μL。PCR反应条件:98℃预变性3min;98℃变性25 S,55℃退火25S,72℃延伸1min, 30个循环,再72℃延伸10min。PCR扩增产物测序由上海生工生物工程公司完成。
1.5.3 系统发育树创建
将分离菌株测得的16S rDNA序列在DDBJ (DNA Data Bank of Japan, http://www.ddbj.nig.ac.jp/)数据库中进行序列比较,选取相似度高。利用CustalX2.1和Mega5 (Molecular Evolutionary Genetics Analysis)软件构建系统发育树,系统进化距离矩阵根据Kimura模型估算[6],创建方法为邻接法(Neighbor-Joining)[7-9]
2 实验结果与分析
2.1 菌株的形态结构特征
从肉眼观察,单菌落表面光滑,边缘齐整,隆起,半透明,淡黄色,湿润,油状,粘稠,周边光滑,但在部分菌落密集处边缘变得不规则,菌株的形态结构特征见表1。

图1 改良的无氮Burk's选择固体平板上纯化后的菌株
2.2 菌株生理生化性质
耐盐碱固氮菌生理生化指标鉴定结果见表1。

表1 耐盐碱固氮菌生理生化指标鉴定结果
注:“+”为阳性;“-”为阴性
2.3 菌株SKDN-1的生长曲线
从图2可以看出,实验中培养的固氮菌在0~24h内生长较为缓慢,在24~120h内进入对数生长期,120~192h内生长速度逐渐减慢,200h左右开始进入稳定期。

图2 菌株SKDN-1的生长曲线图
2.4 酸碱性对固氮细菌生长的影响
固氮菌在不同pH值(如pH值=5,7,9)的生长环境中的生长曲线如图3所示,都是先处于生长极其缓慢的停滞期,而后进入高速增殖的对数期,再进入菌数变动不大的稳定期,最后进入衰亡期。而在pH=11处生长曲线的趋势与前者有些相反,菌株直接由稳定期进入衰亡期,最后菌数不再变化。
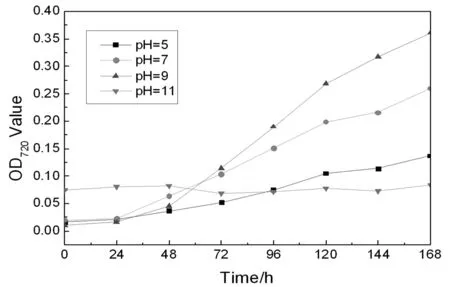
图3 不同pH值条件下,菌株SKDN-1的生长曲线图
由于菌株的生长特性主要同菌株本身的固氮酶的活性有关,可以由曲线断定该固氮菌的固氮酶的活性在pH值处于5~9范围内时变化不是特别明显,说明该菌对酸碱度具有较好的适应性,并且在pH值=9时固氮酶活性最高。由于该菌株在pH值=11的生长环境中对环境的耐受性较差,可断定该菌株不能耐受太极端的碱性环境。
2.5 不同碳源条件下菌株SKDN-1的生长
如图4,培养液中的耐盐碱固氮菌对不同碳源的供给表现出了不同的固氮酶的活性,但都能以这四种碳源作为唯一碳源进行生长。其中,固氮菌在以葡萄糖(glucose)作为唯一碳源的生长环境中生长时,表现出较高的生长特性,其固氮酶活性要高于固氮菌在其他碳源如蔗糖(sugar)、淀粉(starch)和乳糖(lactose)等作为唯一碳源的生长环境中的固氮酶酶活性。对碳源的高适应性能够帮助菌种更能适应一般的生长环境,因此,筛选获得的耐盐碱固氮菌能使其在极端环境中更好地生长,发挥其固氮特性,从而改善土壤性质。
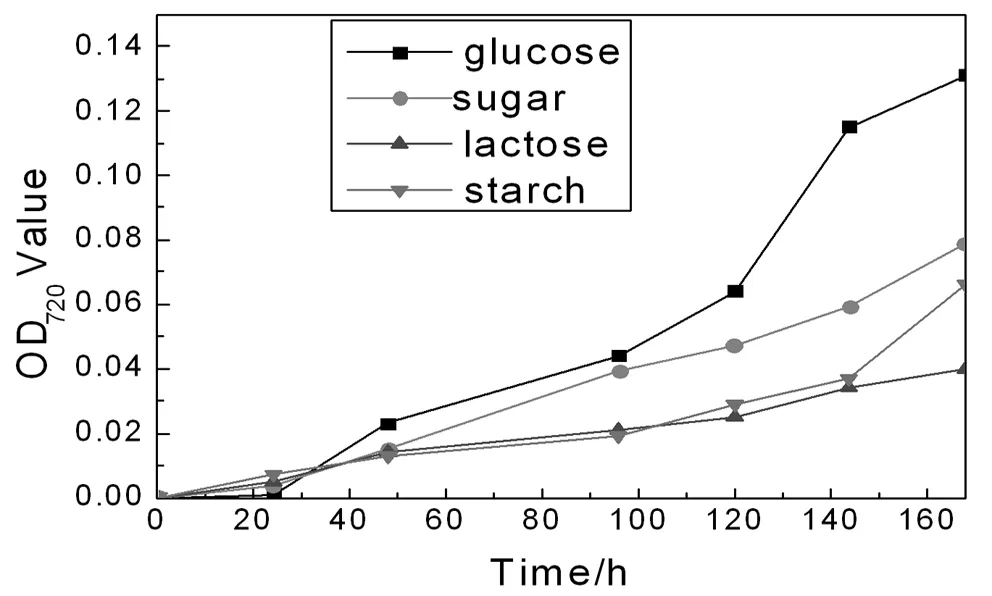
图4 不同碳源条件下菌株SKDN-1的生长曲线
2.5 固氮菌系统数的构建
对菌株SKDN-1的16S rDNA序列进行PCR扩增,将扩增序列提交到GenBank获得收录号AB826004。用CustalX2.1和Mega5软件对菌株SKDN-1及其同源性较高菌株的16S rDNA序列进行系统发育树创建(图5)。从图5可以看出,菌株SKDN-1与分直杆菌聚成一群。因此,菌株SKDN-1应属于分直杆菌属,并命名Mycobacterium sp. SKDN-1(AB826001)。

图5 菌株SKDN-1基于16S rDNA序列N-J法系统发育树
Fig.5 The neighbor-joining phylogenetic tree based on 16S rDNA sequence of strain SKDN-1
3 实验结果讨论
为了对菌株的形态特征和生理生化特性进行进一步的了解,从而初步鉴定该菌株,通过革兰氏染色和镜检、糖醇酵解实验、M.R.实验、V.P.试验、柠檬酸盐试验、产氨试验、吲哚试验、运动性试验等对菌株进行一些常规的鉴定试验,初步确定该菌株为固氮菌属。通过对16S rDNA序列相似度分析,把该固氮菌株命名为SKDN-1。同时通过探究在不同pH,不同碳源等条件下菌株的生长状况,得到该菌的固氮酶在pH值处于7~9范围内活性较高;该菌株对不同碳源环境也有较好的适应性,但对葡萄糖的利用程度最高。因此,筛选得到的固氮菌株能够对盐碱地土壤的改良提供研究依据。
[1] 孙 波, 赵其国, 张桃林, 等. 土壤质量与持续环境 III. 土壤质量评价的生物学指标[J].土壤,1997, 29(5): 225-234.
[2] 周 桔,雷 霆.土壤微生物多样性影响因素及研究方法的现状与展望[J].生物多样性, 2007, 15(3):306-311.
[3] 张 巍,冯玉杰,陈桥.耐盐碱固氮细菌的分离筛选及固氮特性研究[J].环境科学与技术.2008,31(5):22-25.
[4] 东秀珠, 蔡妙英. 常见细菌鉴定手册[M]. 北京: 科学出版社, 2001.
[5] 布坎南 R E, 吉本斯 N E. 中国科学院微生物研究所《伯杰氏细菌鉴定手册》[M]. 8版. 北京: 科学出版社, 1984: 622-651.
[6] Kimura M. A Simple Method for Estimating Evolutionary Rates of Base Substitutions Through ComparativeStudies of Nucleotide Sequences [J]. Journal of Molecular Evolution, 1980, 16: 111-120.
[7] Person W R , Lipman D J. Improved Tools for Biological Sequence Comparison [J]. Proceedings of the National Academy of Sciences, 1988, 85: 2444-2448.
[8] Saitou N , Nei M. The Neighbor-joining Method: a New Method of Reconstructing Phylogenetic Tress [J]. Molecular Biology and Evolution, 1987, 4: 406-425.
[9] Felsenstein J. Confidence Limits on Phylogenies: An Approach Using the Bootstrap[J]. Evolution, 1985, 39: 783-791.
TheSeparationandIdentificationofNitrogen-fixingBacteriafromYellowRiverDeltaSaline-alkaliSoilandtheResearchofItsGrowthCharacteristic
XueTingting,Luhongsheng,ChengJianguang
(Shandong University of Science and Technology,Qingdao 266590,China)
By culture-dependent approach, we have collected soil from YRDNRA, in which there is without human intervening and the soil was not transformed artificially. A strain of salt-tolerant Azotobacter were screened from the saline soil., which was identified preliminarily through the conventional methods to study heir morphology of colonies and individual, physiological and chemical characteristics. Through analyszing the 16S rDNA alignment of the strain, make sure it is salt-tolerant Azotobacter in the genetic level ,and named it SKDN-1. The study upon the adaptability of the salt-tolerant nitrogen-fixing bacteria to the environment factors showed that with the growth temperature of 28℃ and 150r/min shaking, strain SKDN-1 showed its optimum pH, carbon source were 7~9, glucose respectively. The strain can tolerate relatively high basicity adaptability. Therefore, the inoculation of salt tolerance azotobacter can play nitrogen-fixing performance of azotobacter and improve the content of biological nitrogen in saline soil.
saline-alkali soil; the Yellow River delta; nitrogen-fixing bacteria; separation and identification
2017-07-11
薛婷婷(1991—),女,山东胶州人,研究生,环境工程专业。
S156.4
A
1008-021X(2017)18-0045-03
(本文文献格式薛婷婷,陆洪省,程建光.黄河三角洲盐碱地固氮细菌的分离鉴定和生长特性研究[J].山东化工,2017,46(18):45-47,51.)
