TiO2纳米管阵列的多重改性及其在超级电容器中应用的最新进展
2017-11-01余翠平崔接武刘家琴吴玉程
余翠平 王 岩 ,* 崔接武 刘家琴 吴玉程 ,2,*
(1合肥工业大学材料科学与工程学院,合肥 230009;2先进功能材料与器件安徽省重点实验室,合肥 230009;3合肥工业大学工业与装备技术研究院,合肥 230009)
TiO2纳米管阵列的多重改性及其在超级电容器中应用的最新进展
余翠平1王 岩1,*崔接武1刘家琴2,3吴玉程1,2,*
(1合肥工业大学材料科学与工程学院,合肥 230009;2先进功能材料与器件安徽省重点实验室,合肥 230009;3合肥工业大学工业与装备技术研究院,合肥 230009)
阳极氧化法制备的TiO2纳米管阵列因其简单的制备方法、可控的形貌以及环境友好等优点而成为超级电容器领域重点研究的电极材料之一。本文介绍了TiO2纳米管的多重改性方法,包括引入氧空位、金属或非金属修饰或掺杂、金属化合物(氧化物、氢氧化物、硫化物、氮化物)以及导电聚合物修饰等,以进一步提高TiO2纳米管的电化学性能。介绍了近年来阳极氧化法制备的TiO2纳米管阵列在超级电容器中应用的研究进展,为进一步拓展TiO2纳米管阵列的实际应用提供参考。
阳极氧化;TiO2纳米管阵列;多重改性;超级电容器;电化学性能
1 引 言
随着社会的发展,目前使用的低能量密度和功率密度的电池已无法满足人类社会的逐渐需求,基于科学技术的进步,具备高能量密度和功率密度的超级电容器应运而生并受到人们越来越多的重视1–4。作为超级电容器的核心部分,高性能电极材料的研究也逐渐成为热点之一。近年来,阳极氧化法制备的TiO2纳米管阵列引起越来越多学者的关注。以电解液体系划分,阳极氧化法制备TiO2纳米管阵列经历了四代的发展,即HF基电解液、氟化物水溶液基电解液、有机电解液以及无氟电解液5,6。此外,其管状结构的形成目前认为主要是由 Ti/TiO2界面处氧化物的生成和TiO2/电解质界面处氧化物溶解这两个阶段共同控制的。前期在Ti/TiO2界面形成致密氧化膜后,由于 F−和电场力的不均匀分布,溶解反应只会在氧化膜的局部表层进行,从而形成了点蚀小孔,随后小孔逐渐长大,进而加剧电场在其底部的不均匀分布,溶液中的O2–穿过氧化层继续与Ti反应,造成了氧化层的增加,与此同时,运动到TiO2/电解质界面处的 F−会加速氧化层的溶解,以上两个相反的过程导致了TiO2小孔的不断延伸,最终形成TiO2纳米管阵列7,8,其具体形成过程如图1所示。阳极氧化法制备的TiO2纳米管阵列具备优异的化学稳定性、简单可控的形貌等优点,并且其高度有序的结构为电子和离子的传输提供了直接的通道,进一步可直接作为基底来负载其他超级电容器活性材料,避免了导电剂和粘结剂的使用,降低了材料的电阻、简化了电极的制备并提高了活性材料的利用率。因此阳极氧化法制备的 TiO2纳米管阵列在超级电容器领域受到了广泛的关注。本文从不同的修饰改性方法入手,综述了近年来TiO2纳米管阵列在超级电容器领域中的研究现状与进展,并对TiO2纳米管阵列的发展方向与应用前景做了展望。

余翠平,1991年生,本科毕业于合肥工业大学,现为合肥工业大学材料学院硕博连读研究生,主要研究方向:有序纳米阵列的可控制备、改性及其超级电容性能。
王岩,1985年生,2012年获合肥工业大学材料学工学博士学位,2015–2016年获国家公派赴美国Rice University访学,现为合肥工业大学材料学院副教授,主要研究方向:纳米功能材料与器件。

刘家琴,1981年生,合肥工业大学理学博士,现为合肥工业大学工业与装备技术研究院副研究员,主要研究方向:无机纳米半导体材料与器件。

图1 TiO2纳米管阵列形成的原理示意图8Fig.1 Schematic diagram of the formation of TiO2 nanotube array8.
2 TiO2纳米管阵列的多重修饰
2.1 引入氧空位
近年来,TiO2纳米管阵列被广泛地应用于超级电容器中,但其较差的导电性与电化学活性限制了其进一步的应用。据报道,可通过引入缺陷,如间隙离子、空位以及点缺陷等缺陷,来改善与提高金属氧化物半导体的性能9,10。其中,通过引崔接武,1985年生,2011–2013年赴澳大利亚Monash University进行国家公派联合培养,2013年获合肥工业大学材料学工学博士学位,现为合肥工业大学材料学院副教授,主要研究方向:低维纳米材料。


吴玉程,1962年生,中国科学院理学博士,现为合肥工业大学材料学院教授/博导,先进功能材料与器件安徽省重点实验室主任,主要研究方向:纳米功能材料及其能源应用。入氧空位,可提高TiO2纳米管阵列的导电性,进而改善材料的电化学性能。因此,探索氧空位对TiO2纳米管阵列电化学性能的影响具有十分重要的研究价值。目前,氧空位的引入主要依靠以下方法,即还原性氢气气氛退火氢化、电化学氢化、惰性气氛(如氮气、氩气等)退火处理、氢等离子体处理以及还原性溶液处理。
2.1.1 氢气气氛退火氢化
2012年,Lu及其合作者11报道了还原性氢气退火氢化处理的TiO2纳米管阵列(图2),探究了一系列退火温度(300–600 °C)对 TiO2纳米管阵列电化学性能的影响。通过X射线光电子能谱可以证明氢气气氛处理可以引入一定的氧空位。测试表明,在400 °C处理的TiO2纳米管阵列具有最高的比电容,在 100 mV∙s−1的扫速下达到了 3.24 mF∙cm−2,是同样条件下空气中退火 TiO2纳米管阵列比电容的40倍,并表现出优异的倍率性能(扫速由 10 mV∙s−1增大到 1000 mV∙s−1时,其比电容仍能保持68%)与较高循环稳定性(10000圈后比电容仅损失3.1%)。该突出的电化学性能得益于氢气气氛处理后载流子浓度的提高以及二氧化钛表面吸附羟基官能团浓度的增大。同样,2016年,Zhu等12将阳极氧化后的TiO2纳米管阵列置于氢气气氛中450 °C处理5 h得到了氢化的TiO2纳米管阵列,亦表现出良好的电化学性能。
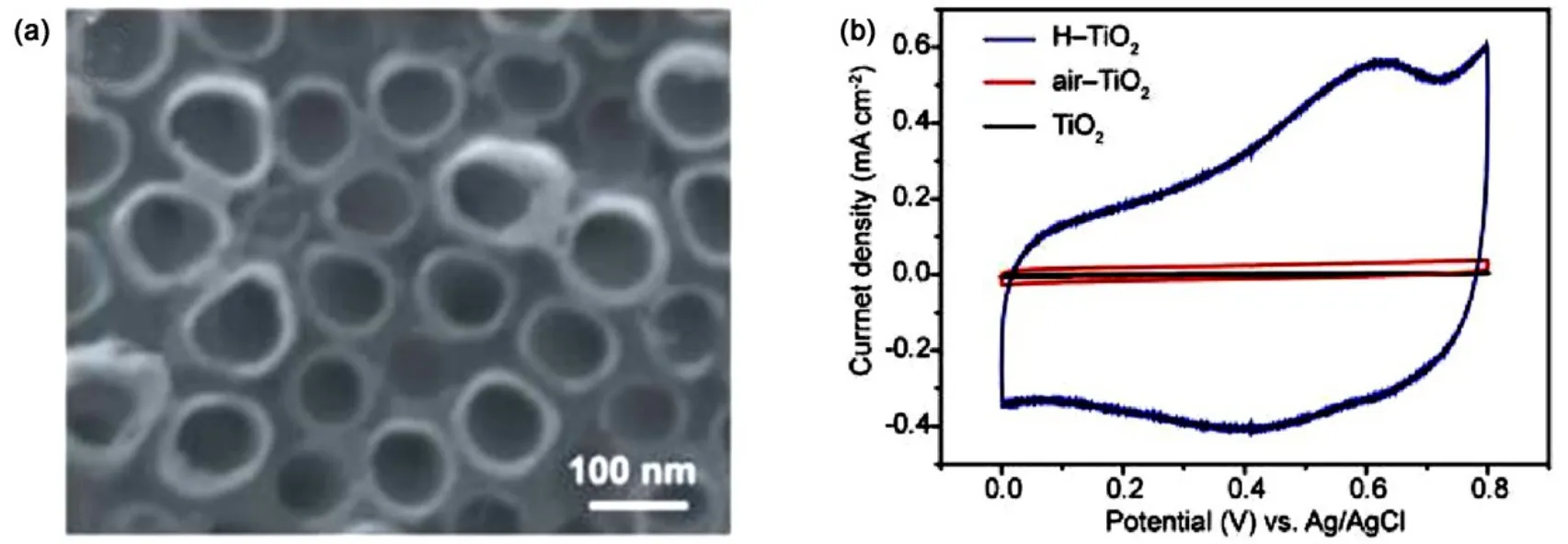
图2 氢化TiO2纳米管阵列的(a)形貌以及(b)电化学性能11Fig.2 (a) Morphology and (b) electrochemical properties of hydrogenated TiO2 nanotube arrays11.

图3 电化学氢化TiO2纳米管阵列的(a)形貌及其(b)电化学性能14Fig.3 (a) Morphologies and (b) electrochemical properties of electrochemical hydrogenated TiO2 nanotube arrays14.
2.1.2 电化学氢化
不同于还原性气氛中退火处理的氢化过程,电化学氢化过程不仅涉及电子的引入,而且还包括水溶液中氢离子(质子)的引入。其中,电子的引入导致锐钛矿 TiO2中部分 TiO62−八面体被还原成(O5)Ti3+(Vo),即生成了一定数量的氧空位,质子的引入致使毗连的 TiO62−八面体转变为(HO)Ti4+(O5)。其反应式如下13:
2xe−+ 2xH++ TiO2→ TiO2−x+ xH2O
2014年,Wu等14将碳棒(阳极)和空气中退火后的 TiO2纳米管阵列(阴极)置于 0.5 mol∙L−1Na2SO4水溶液中,施加5 V的电压,保持30 s,即完成了电化学氢化过程。实际上,该电化学氢化是一个电解水的过程。由于该电化学氢化过程引入的间隙氢离子和氧空位,TiO2纳米管阵列的导电性大大提高,0.05 mA∙cm−2的电流密度下,氢化后 TiO2纳米管阵列的比电容可达到 20.08 mF∙cm−2,是未处理 TiO2纳米管阵列的近 20 倍(如图3)。2014年,Zhou等15研究了不同的电压对氢化TiO2纳米管阵列电化学性能的影响,结果表明,在 0.5 M Na2SO4溶液中施加不同电压(−1.2、−1.4、−1.6、−1.8 V) 10 min中,−1.4 V得到的氢化TiO2纳米管阵列的电化学性能最佳,在 5 mV∙s−1的扫速下,其比电容达到了1.84 mF∙cm−2,比原始TiO2纳米管阵列高了39倍左右。鉴于该电化学氢化原理,2016年,Kim等16进一步研究了掺杂的程度(或氢化处理顺序)对 TiO2纳米管阵列电化学性能的影响。该实验对比了两种不同颜色的TiO2纳米管阵列(蓝色和黑色)的电化学性能,即不同掺杂程度对TiO2纳米管阵列性能的影响,其中,蓝色TiO2纳米管阵列是将阳极氧化的非晶TiO2纳米管阵列在空气中退火后再阴极极化处理(0.017 A∙cm−2的电流密度下保持90 s),类似于以上提到的传统的电化学氢化过程,而黑色TiO2纳米管阵列是将阳极氧化后的非晶TiO2纳米管阵列先电化学处理,再在氮气气氛的保护下退火,如图 4所示。通过对比可以得到,尽管两者的表面性能没有太大的差别,但因于电化学掺杂和退火处理顺序的不同,黑色 TiO2纳米管阵列的掺杂程度稍微高于蓝色TiO2纳米管阵列,因此黑色TiO2纳米管阵列拥有更高的比电容。
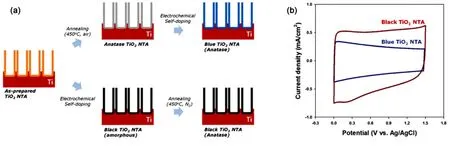
图4 蓝色和黑色TiO2纳米管阵列的(a)制备示意图及其(b)电化学性能16Fig.4 (a) Schematic diagram for the fabrication process and (b) electrochemical properties of blue and black TiO2 nanotube arrays16.

图5 等离子体氢化TiO2纳米管阵列的(a)形貌及其(b)电化学性能21Fig.5 (a) Morphology and (b) electrochemical property of hydrogenated TiO2 nanotube arrays with hydrogen plasma treatment21.
2.1.3 惰性气氛退火
原始 TiO2纳米管阵列可以通过在惰性气氛(如氮气、氩气等)中退火来引入氧空位,惰性气氛中,外界的氧分压低于TiO2内的氧分压,为了达到平衡,TiO2的晶格氧逸出,从而产生氧空位17。Salari等分别在2011年18和2014年19先后报道了氩气气氛中退火以引入氧空位的工艺,这些氧空位可以克服 Ti―O键破坏和重排的活化能,加速锐钛矿相向金红石相的转变。该非化学计量比的结构可以将TiO2纳米管阵列的电化学性能提高1到2倍。2016年,香港城市大学的Pei及其合作者20将阳极氧化后的非晶TiO2纳米管阵列在氩气气氛中700 °C退火处理3 h,通过拉曼光谱和X射线光电子能谱分析证明了缺陷即氧空位的引入,且700 °C退火TiO2纳米管阵列的性能明显优于原始态TiO2纳米管阵列。
2.1.4 氢等离子体处理
2013年,Wu等21利用等离子体技术制备了氢化的TiO2纳米管阵列,如图5所示。他们针对钛的氢脆敏感性这一特点,将退火晶化后的 TiO2纳米管阵列置于氢等离子体中,在纳米管表面形成了一层1–2 nm左右的粗糙非晶层,并同时引入了氧空位(Ti3+)和羟基官能团(―OH)。通过电化学测试,该等离子体氢化的TiO2纳米管阵列在0.05 mA∙cm−2的电流密度下,比电容达到了 7.22 mF∙cm−2。该氢等离子体处理技术为提高超级电容器的电化学性能提供了一个新颖并且高效的思路。
2.1.5 还原性溶液处理
2016年,本课题组采用简单的化学还原法22,成功地将氧空位引入TiO2纳米管阵列,如图6所示。主要利用 NaBH4的还原性,将 TiO2中部分Ti4+还原成 Ti3+,从而在 TiO2的晶格中产生氧空位,且可以通过调控NaBH4水溶液的浓度来优化TiO2纳米管阵列的电化学性能。由莫特-肖特基曲线可以计算出不同样品的载流子浓度,计算结果表明,NaBH4水溶液还原处理的TiO2纳米管阵列的载流子浓度是原始态TiO2纳米管阵列的3到4倍,且其中5 mol∙L−1NaBH4水溶液中得到的TiO2纳米管阵列的载流子浓度最高,该样品在2 mV∙s−1的扫速下,比电容高达23.24 mF∙cm−2,且拥有优异的循环稳定性。
2.2 金属元素修饰
金属修饰或掺杂是指利用物理或化学的方法将高导电性的金属单质引入到TiO2纳米管阵列表面,或将金属离子引入到TiO2晶格内,从而在晶格结构中引入新电荷、形成缺陷或改变晶格类型,从而改变 TiO2的性能23。目前研究较多的修饰TiO2纳米管阵列的金属单质有 Ag、Au、Pt等贵金属24,研究人员还通过将目标掺杂金属的盐加入到阳极氧化电解液中,阳极氧化得到了金属离子掺杂的TiO2纳米管阵列25。此外,2015年,Zhong等26在AlCl3溶液中利用阴极极化原理制备了Al3+掺杂的 TiO2纳米管阵列,一方面,Al3+的插入造成了锐钛矿相 TiO2里原子的重新排列,提高了TiO2纳米管阵列的导电性,另一方面,阴极极化将Ti4+还原为Ti3+,引入了氧空位,提高了载流子浓度,从而提高了基底的导电性,其电阻由之前未处理的接近10 kΩ降低到处理后的20 Ω,比电容可达到 3.51 mF∙cm−2。
2.3 非金属元素修饰
2.3.1 N元素修饰
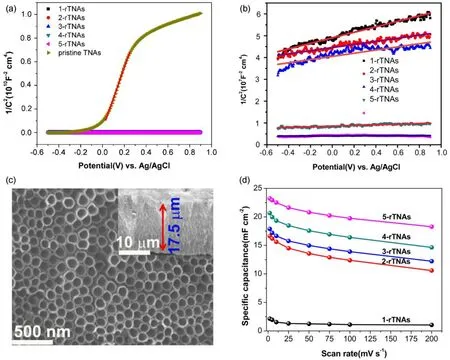
图6 (a–b)原始态和还原态TiO2纳米管阵列的莫特肖特基曲线,(c)还原态TiO2纳米管阵列的形貌以及(d)电化学性能22Fig.6 (a–b) Mott-Schottky plots of pristine TNAs and rTNAs electrodes collected at a frequency of 10 kHz,(c) morphologies and (d) electrochemical properties of reduced TiO2 nanotube arrays22.
TiN中的N占据了金属晶格的间隙,金属的晶格扩张,从而d电子态密度增加,使得TiN表现出类似金属的高导电性27;此外,相比于TiO2,TiN表现出更优异的倍率性能和快速充放电性能。因此,TiN比TiO2的性能更加优越。大部分氮化工艺是将 TiO2纳米管阵列或负载有活性物质的TiO2纳米管阵列置于氨气气氛中,高温热处理,得到部分或全部氮化的纳米管,或者氮化活性物质和氮化钛纳米管的复合材料。2011年,Dong等28制备了TiN纳米管阵列,首先利用传统的阳极氧化工艺制备了TiO2纳米管阵列,随之将非晶的TiO2纳米管阵列置于氨气气氛中退火处理,自然冷却到室温后得到TiN纳米管阵列。因为氮化所需的温度相对来说比较高(800 °C左右),所以为了尽可能地保护TiO2纳米管阵列的管状结构不受破坏,该氮化过程一般使用三段不同的升温速率来达到最终温度,例如300 °C以下采用较大的升温速率(5 °C∙min−1),300 °C 到 700 °C 温度区间内采用 2 °C∙min−1,而在高温段(700 °C 到 800 °C)则升温较慢(1 °C∙min−1)。TiN 纳米管具有较好的导电性,可以直接用作超级电容器电极材料的集流体。同理,2014年,Xie等29采用上述的氨气气氛三段升温法制备了TiN纳米管,并应用于超级电容器中,展现出良好的电化学性能。
2017年,Schmuki课题组30,31先后报道了两篇大间隙TiO2纳米管阵列的制备及其氮化在超级电容器中的应用。与传统方法制备的TiO2纳米管阵列不同的是,他们通过调整实验参数(电解液、实验温度等)制备了大间隙的TiO2纳米管阵列,该大间隙有利于比表面积的提高以及后期活性物质的负载,以便得到最优化的超电容电极材料。他们指出该TiO2纳米管阵列的间隙可控且最大可调至200 nm,远远大于传统的TiO2纳米管阵列,然后将Nb2O5纳米晶负载在大间隙的TiO2纳米管阵列上,随后在氨气气氛中使之氮化,该氮化处理实现了两种不同物质的同时氮化,即TiO2转变为TiN,Nb2O5氮化为Nb4N5和NbN,所制备的氮化复合物展现出优异的电化学性能。此外,他们利用 TiCl4水解的方法,在大间隙 TiO2纳米管阵列上负载TiO2纳米颗粒层,且负载TiO2的量可以通过TiO2纳米颗粒层的沉积次数来调整,如图7所示。600 °C氮化处理后,样品具有最高的比电容,得益于纳米管较高的比表面积和优异的导电性。该大间隙TiO2纳米管阵列为新颖形貌的TiO2纳米管阵列的制备及其进一步修饰改性提供了崭新的设计思路。

图7 (a)负载不同TiO2纳米颗粒层(2,4,6,8次)的大间隙TiO2纳米管阵列的形貌及(b)不同氮化温度下的电化学性能31Fig.7 (a) Morphologies of spaced TiO2 nanotubes arrays decorated with different layers of TiO2 nanoparticles(2, 4, 6 and 8 times) and their (b) electrochemical properties at different nitriding temperature31.
2.3.2 C元素修饰
碳材料具有良好的导电性和稳定性,经常用于超级电容器的碳材料有石墨烯、还原氧化石墨烯、单壁或多壁碳纳米管以及无定型碳等1,32–34。2015年,Gao等35利用正负电荷相互吸引的原理将多壁碳纳米管(MWNTs)负载在 TiO2纳米管阵列上。他们首先将TiO2纳米管阵列浸泡在3-氨基丙基三乙氧基硅烷(APS)中使得纳米管表面吸附上APS分子,由于APS含有氨基官能团,所以此时的 TiO2纳米管阵列显电正性,然后将吸附有APS分子的 TiO2纳米管阵列置于带有负电的MWNTs的分散液中,由正负电荷相互吸引的原理制得了MWNTs负载TiO2纳米管阵列电极材料。研究表明,APS的浓度可以影响MWNTs-TiO2纳米管阵列的电化学性能,0.1 mA∙cm−2的电流密度下,使用 10 mg∙mL−1APS 时 MWNTs-TiO2纳米管阵列的比电容最高,达到了4.4 mF∙cm−2。同一年,Faraji等36在GO水溶液中利用恒电压电沉积的方法制备了 RGO和 TiO2纳米管阵列的复合材料,其在高电流密度50 A∙g−1下,比电容仍能达到410 F∙g−1,体现了优异的电化学性能(如图 8 所示)。
此外,有机物,如葡萄糖、乙醇、甲烷、乙二醇等,在高温时可直接热解产生不同形式的C,如石墨烯、石墨化碳、无定型碳等。鉴于这一点,2015年,Gao等37和 Di等38先把阳极氧化后的TiO2纳米管阵列空气中退火得到锐钛矿相的TiO2纳米管阵列,然后将其置于葡萄糖溶液中水热,再利用葡萄糖的高温热解制备出C包覆的TiO2纳米管阵列。相比于锐钛矿相的TiO2纳米管阵列,该C包覆的TiO2纳米管阵列的比电容提高了至少60倍(22.7 mF∙cm−2)。2016年,Zheng等39以甲烷为碳源,600 °C碳化处理制得了无定型C修饰的TiO2纳米管阵列,其比电容比原始TiO2纳米管阵列提高了大约 33倍。事实上,传统的 TiO2纳米管阵列是在乙二醇的溶液中阳极氧化制备的,作为有机物,乙二醇可直接高温热解生成 C,避免了有机物的额外加入,大大简化了实验过程。2015年,东北大学的Song等40,41先后报道了两篇关于碳包覆TiO2纳米管阵列在超级电容器中的应用。他们利用上述原理将C引入TiO2纳米管阵列上,大大提高了原始TiO2纳米管阵列的导电性和稳定性,制得的C包覆TiO2纳米管阵列可作为基底来负载活性物质RuO2,进一步发挥其在超级电容器中的应用。2016年本课题组42指出并详细证明了该碳化过程伴随有氧空位的生成,在氩气气氛中环境中,一方面TiO2纳米管阵列表面吸附的乙二醇直接裂解生成C,另一方面,由于TiO2外界的氧分压低于 TiO2内,晶格氧会逸出,所以 TiO2内会有氧空位的生成,该修饰过程未改变TiO2纳米管阵列的形貌,碳的分布十分均匀,并在一步退火过程中实现C和氧空位的双重修饰改性,大大提高了基底的性能并简化了实验过程。电化学测试表明,C包覆及氧空位修饰的TiO2纳米管阵列的电化学性能是原始TiO2纳米管阵列的大约83倍,这得益于TiO2纳米管阵列导电性的大大提高(如图9所示)。
2.4 金属化合物修饰
2.4.1 金属氧化物
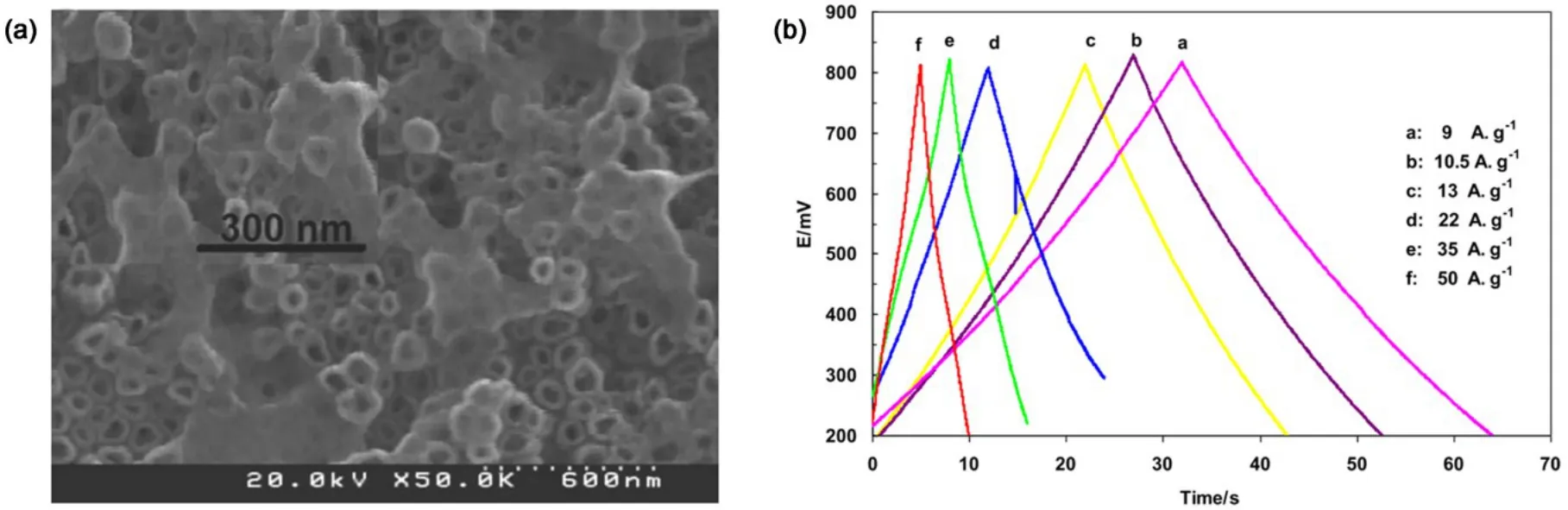
图8 (a)RGO修饰TiO2纳米管形貌及其(b)电化学性能36Fig.8 (a) Morphology and (b) electrochemical properties of RGO decorated TiO2 nanotube arrays36.
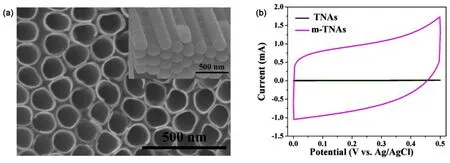
图9 (a)改性TiO2纳米管的形貌及(b)电化学性能42Fig.9 (a) Morphologies and (b) electrochemical properties of modified TiO2 nanotube arrays42.
相比于碳材料的双电层电容,金属氧化物主要是依靠活性物质在电极表面以及近表面发生氧化还原反应来储存能量,其比容量远远大于碳材料的双电层电容,且其使用寿命长、维护简单,引起了越来越多学者的关注与研究。近年来,用于超级电容器的金属氧化物主要有一元金属氧化物(RuO2、MnO2、Mn3O4、Mn2O3、Co3O4、NiO、Cu2O、V2O5等)40,33–49、二元金属氧化物(NiCo2O4、MnCo2O4等)50,51以及他们的混合物52。一元金属氧化物中,RuO2具有优良的导电性、稳定性以及超高的比电容,因此许多学者将其作为修饰物来提高 TiO2纳米管阵列的电化学性能。2015年,Song等40将RuO2负载在碳化的TiO2纳米管阵列上,碳化的TiO2纳米管阵列作为高导电性的基底,提高了RuO2的利用率,最终,该复合材料的比电容达到了 1089 F∙g−1。然而,考虑到实际应用,RuO2的高成本、环境有害等缺点限制了其进一步应用与发展,所以研究中心转向了一些价格低廉、环境友好且资源丰富的氧化物上。其中,基于 TiO2纳米管阵列的修饰,锰氧化物是最具代表性的负载物,许多学者采用不同的方法合成不同形貌的锰氧化物,以探索复合材料的电化学性能。锰氧化物具备不同的形式,如 MnO2、Mn2O3、Mn3O4等,其性能也有所差别。鉴于锰氧化物不同的制备方法,2016年,Zhou等53采用脉冲电沉积法将MnO2负载在阴极极化后的 TiO2纳米管阵列上,Pei等20先将阳极氧化后的 TiO2纳米管阵列置于真空条件下退火以引入缺陷(氧空位),然后将其放入Mn(CH3COO)2与Na2SO4的混合溶液中,利用恒电压电沉积法制备了 MnO2/TiO2纳米管阵列复合材料(如图10)。缺陷的引入增强了TiO2纳米管阵列的电荷转移,且后续 MnO2的负载增加了氧化还原反应的活性位点,有利于提高复合材料的电化学性能。基于 MnO2的质量,在 5 mV∙s−1的扫速下,该 MnO2/TiO2纳米管阵列复合材料的比电容高达1117 F∙g−1。Zhu等12利用光降解的方法将Mn3O4纳米棒负载在氢气气氛氢化处理的TiO2纳米管阵列上,制备了高性能的Mn3O4/氢化TiO2纳米管阵列复合材料。2016年,本课题组巧妙地利用 C与 KMnO4反应生成 MnO2的原理制备了MnO2/TiO2纳米管阵列复合材料54,如图11所示,该实验的关键在于 Ar气氛退火时 TiO2纳米管阵列表面引入的碳层,该碳层不仅提高了基底的导电性,还可以在水热条件下与KMnO4反应,从而得到均匀负载MnO2的TiO2纳米管阵列。另外,本课题组成员还利用化学浴沉积、循环浸渍沉积等方法,分别制备了Mn3O4/TiO2纳米管阵列55以及MnO2/氢化TiO2纳米管阵列56复合材料,均表现出优良的电化学性能。
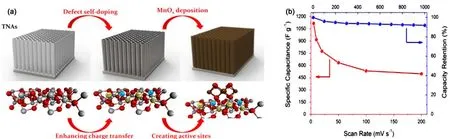
图10 (a)MnOx负载还原TiO2纳米管的其分子模型及其(b)电化学性能20Fig.10 (a) Molecular model of MnOx deposited reduced TiO2 nanotube arrays electrode and(b) electrochemical properties20.
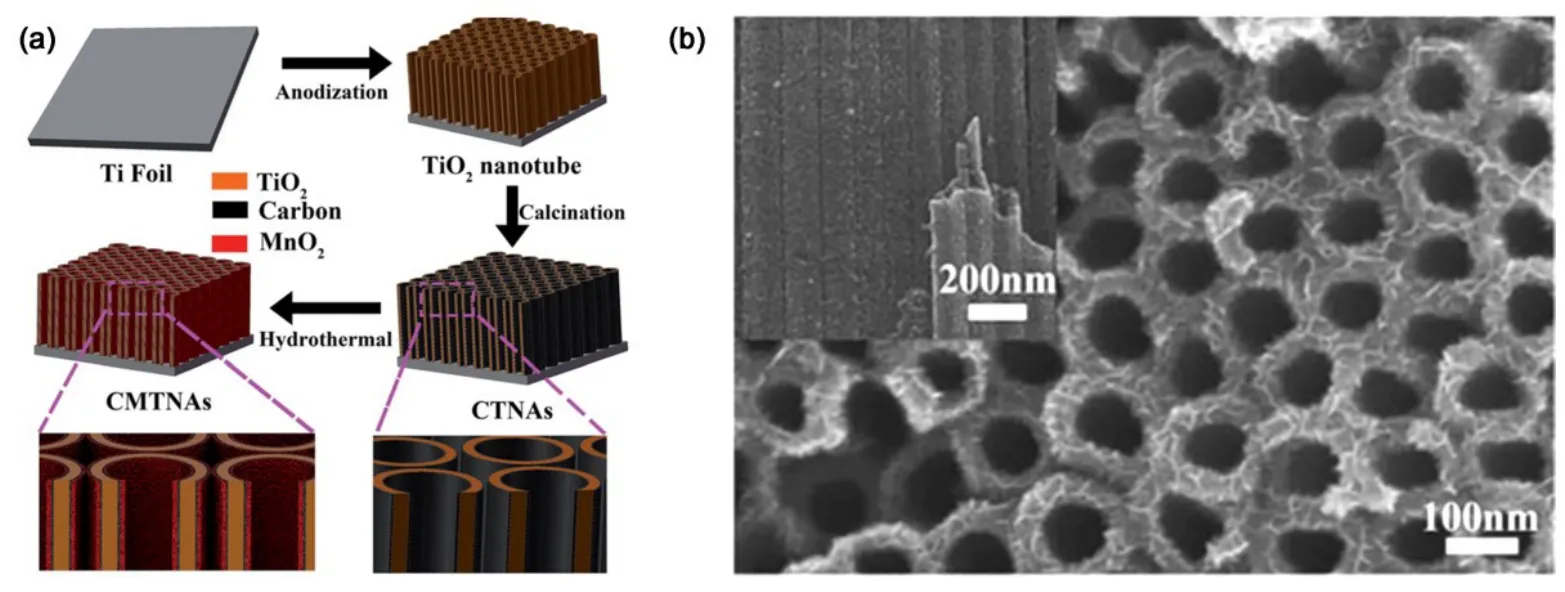
图11 MnO2负载TiO2纳米管阵列的(a)实验过程示意图,(b)形貌54Fig.11 (a) Schematic illustration of synthesis process and (b) morphologies of MnO2 deposited TiO2 nanotube arrays54.
此外,2014年 Guan等57利用电沉积的方法制备了 α-MoO3/TiO2纳米管阵列复合材料,α-MoO3具备比电容高、氧化态多、成本低以及环境友好等优点,TiO2纳米管阵列作为基底来负载α-MoO3,可以避免 α-MoO3的团聚以及体积膨等缺点,得到了性能较好的 α-MoO3/TiO2纳米管阵列复合材料。2016年本课题组42制备了Co3O4纳米颗粒与改性TiO2纳米管阵列的复合材料,如图12所示,首先将阳极氧化后的TiO2纳米管阵列置于氩气气氛中退火以引入碳层和氧空位,大大提高了TiO2纳米管阵列基底的导电性和稳定性,随后利用化学浴沉积将 Co3O4纳米颗粒均匀地沉积到改性后的TiO2纳米管阵列上,由于Co3O4纳米颗粒与改性TiO2纳米管阵列的协同效应,该复合材料在 2 A∙g−1电流密度下的比电容达到 662.7 F∙g−1。本课题组同时利用电沉积方法将NiO纳米颗粒均匀地沉积到氢气氢化处理的TiO2纳米管阵列上58,在1.5 A∙g−1的电流密度下,其比电容达到689.3 F∙g−1;利用方波伏安法制备了Cu2O纳米颗粒与电化学氢化TiO2纳米管阵列的复合材料,均表现出良好的电化学性能48。

图12 Co3O4负载TiO2纳米管阵列的(a)形貌,(b)电化学性能42Fig.12 (a) Morphologies and (b) electrochemical properties of Co3O4 decorated TiO2 nanotube arrays42.

图13 镍钴氧化物负载TiO2纳米管阵列(a)形貌,(b)电化学性能59Fig.13 (a) Morphologies and (b) electrochemical properties of Ni-Co oxides nanowires decorated on TiO2 nanotube arrays59.
相比于一元金属氧化物,混合金属氧化物、二元金属氧化物甚至多元金属氧化物拥有更高的导电性、更丰富的氧化还原反应,从而具备更优异的电化学性能。2013年,Yang等59利用一步水热及后续退火法在 TiO2纳米管阵列同时合成了CoO和NiO纳米线,如图13所示。该Ni-Co氧化物导电性良好,且其多孔结构提高了反应比表面积、促进了离子向材料内部的传输,再加之TiO2纳米管阵列提供的高度有序的基底,避免了粘结剂和导电剂的使用,鉴于以上各种因素的协同效应,该复合材料展现出优异的电化学性能,在2.5 A∙g−1的电流密度下,其比电容高达 2353 F∙g−1,远远优于大部分TiO2纳米管阵列基超级电容器电极材料。二元金属氧化物通常以 AxB3−xO4的分子形式出现,其中A和B是指两种不同金属60,例如NiCo2O4、CoNi2O4、MnCo2O4等。本课题组61制备了NiCo2O4纳米结构与改性TiO2纳米管阵列的复合材料,如图14所示,并研究了其电化学性能。首先利用化学浴沉积法将镍钴氢氧化物前驱体沉积到碳改性后的纳米管管内壁与外壁,随之将负载有前躯体的改性TiO2纳米管阵列退火得到目标复合材料,通过研究发现,该复合材料的电化学性能可以通过调整前驱体溶液中Ni(NO3)2和Co(NO3)2的比例来实现,优化后的复合材料展现出较高的电化学性能。此研究内容与结果可进一步扩展,为以TiO2纳米管阵列为基底制备高性能超级电容器电极材料提供参考。本课题组22同时利用化学浴沉积法将MnCo2O4纳米颗粒均匀地沉积到NaBH4还原的TiO2纳米管阵列上,该复合材料具备优良的电化学性能。此外,2015年,Sarkar等62利用湿化学法将BiFeO3纳米颗粒负载在TiO2纳米管阵列上(如图 15所示),该复合材料在 1.1 A∙g−1电流密度下的比电容达到了 440 F∙g−1。

图14 NiCo2O4修饰改性TiO2纳米管阵列的TEM图以及EDX面扫元素分布图61Fig.14 TEM image and EDX elemental mapping of NiCo2O4/modified TiO2 nanotube arrays61.The insets present the corresponding EDX elemental distribution.
此外,通过阳极氧化处理含有目标氧化物金属的Ti合金也可以制备出氧化物与TiO2纳米管阵列复合材料。早在2006年,Ghicov等63就以Ti-Nb合金为基底,采用阳极氧化和高温退火技术制备出了TiO2-Nb2O5纳米管阵列。后续学者进一步完善并补充了这一方法的适用范围。2010年,Kim等64报道了由Ni含量56% (w)的Ni-Ti合金阳极氧化和后续空气退火处理制备的NiO-TiO2纳米管阵列,并研究不同阳极氧化电压(20 V到80 V)对纳米管阵列形貌的影响,以及不同退火温度(400 °C 到 700 °C)对 NiO-TiO2纳米管阵列电化学性能的影响。研究表明,太小的电压无法形成纳米管结构,而过大的电压会加速化学溶解反应,从而破坏纳米管结构,最终确定的最佳的电压为60 V。通过退火,阳极氧化后的纳米管阵列由非晶态转变为NiO与金红石相TiO2的混合态。通过电化学性能测试,证明了600 °C退火的NiO-TiO2纳米管阵列具备最优的电化学性能。2011年,Yang等65指出可由 Ti-V合金的阳极氧化制备V2O5-TiO2纳米管阵列。他们研究了 Ti-V合金中不同V含量对所制备的V2O5-TiO2纳米管阵列的形貌以及电化学性能的影响(如图16)。不同V含量的合金基底,即 Ti,Ti-0.2% (x) V (Ti0.2V),Ti-3% (x) V (Ti3V)和 Ti-18% (x) V (Ti18V)上均能制备出平均长度4–5 μm,管径150–160 nm的纳米管,电化学性能测试表明,Ti18V基底上阳极氧化制备的纳米管具备220 F∙g−1的比电容。2016年,Ning等66,67先后报道了两篇关于Ti-Mn合金阳极氧化法制备Mn掺杂TiO2纳米管阵列的研究。他们提出由Mn-Ti合金(Mn:10.0% (w))阳极氧化制备 Mn掺杂 TiO2纳米结构的形成原理,在生成Mn掺杂 TiO2纳米管阵列的基础上,研究不同退火温度(100到500 °C)对其电化学性能的影响,随之进一步探索了Ti-Mn合金中不同Mn含量对Mn掺杂TiO2纳米阵列的形貌(如图17)和电化学性能的影响。通过优化实验参数,最终得到性能优异的超级电容器电极材料。合金阳极氧化法为制备氧化物-TiO2纳米管阵列提供了崭新的思路。
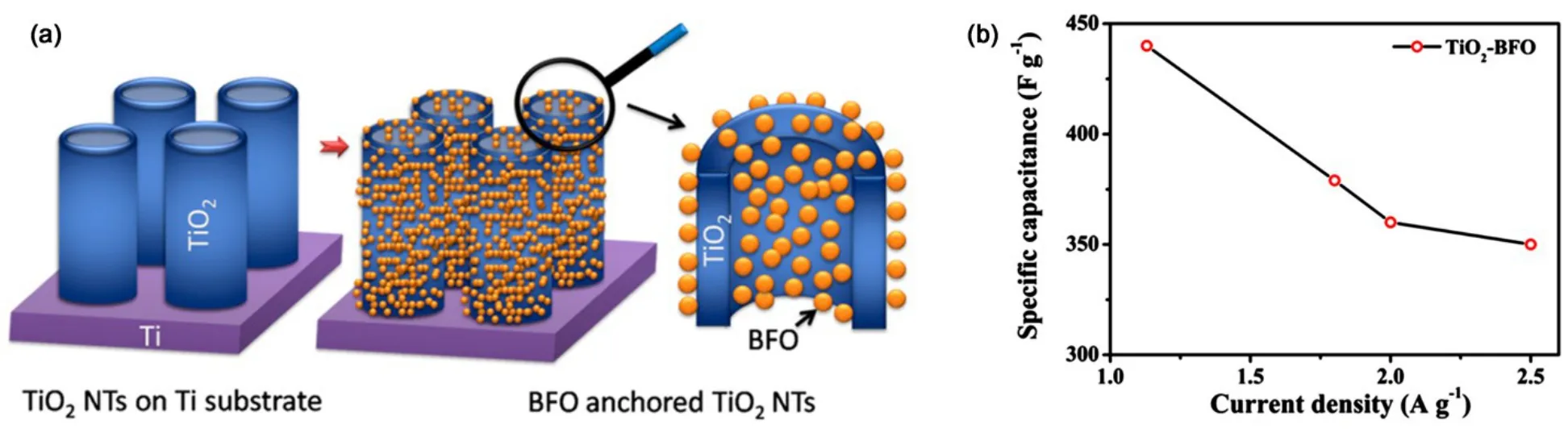
图15 (a)TiO2纳米管阵列负载BiFeO3纳米颗粒示意图,(b)电化学性能62Fig.15 (a) Schematic representation and (b) electrochemical properties of BiFeO3 nanoparticles decorated TiO2 nanotube arrays62.
2.4.2 金属氢氧化物
近年来,金属氢氧化物由于其绿色环保、取材丰富、比电容高等优点而成为超级电容器电极材料的研究热点68,69。其中,层状双氢氧化物,如Ni-Co双氢氧化物32,70,由于其独特的层状结构与性质,使其在超级电容器领域展现了广阔的应用前景。2013年,Shang等71先将TiO2纳米管阵列置于氨气气氛中氮化得到TiN纳米管阵列以提高基底材料的导电性,然后采用电沉积法将Ni-Co双氢氧化物均匀地沉积到 TiN 纳米管阵列上,得到NixCo2x(OH)6x/TiN纳米管阵列复合材料,如图 18所示。得益于TiN纳米管阵列基底的高导电以及活性物质的高利用率,该NixCo2x(OH)6x/TiN纳米管阵列呈现出优异的电化学性能,其比电容高达 2543 F∙g−1(5 mV∙s−1)。
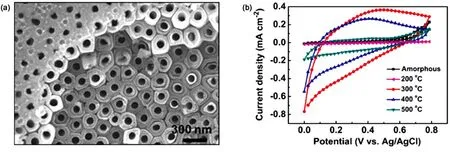
图16 (a)Ti18V基底上制备的纳米管形貌,(b)电化学性能65Fig.16 (a) Morphology of nanotube arrays obtained from Ti18V, (b) electrochemical properties65.

图17 不同Mn含量的Ti-Mn合金(a)TiO2, (b)TiO2-Mn (3%), (c)TiO2-Mn (7%), (d)TiO2-Mn (10%)制备的纳米管形貌67Fig.17 Morphologies of nanotube arrays prepared from Ti-Mn alloys (a) TiO2, (b) TiO2-Mn (3%), (c) TiO2-Mn (7%),(d) TiO2-Mn (10%)67.

图18 (a)NixCo2x(OH)6x/TiN纳米管阵列制备过程示意图,(b)电化学性能71Fig.18 (a) Schematic illustration of NixCo2x(OH)6x/TiN nanotube arrays preparation, (b) electrochemical properties71.
2.4.3 金属硫化物
由于S (2.58)的电负性小于O (3.44),而其共价半径(104 pm)却大于O (60 pm),因此相比于金属氧化物中的 M―O键,金属与硫离子形成的M―S键结合力更弱,所以金属硫化物更容易发生氧化还原反应。过渡族金属硫化物,特别是硫化钴(镍),由于其高的导电性与比电容而广泛地应用在超级电容器中72–76。2015年,Misra等77利用电沉积的方法制备了CoS与TiO2纳米管阵列的复合材料,对比了两种不同的电沉积方法,恒电压电沉积与 CV电沉积对硫化物形貌影响,并研究了该复合材料在四种不同电解液中(KOH、KCl、Na2SO4和 Na2SO3)的电化学性能(如图 19)。研究结果表明,该复合材料具备良好的电化学性能。近期,本课题组利用简单的电沉积法将Co0.12Ni1.88S2@Co8S9纳米颗粒均匀地沉积到碳和氧空位改性后的 TiO2纳米管阵列上,如图 20所示。得益于 Co0.12Ni1.88S2@Co8S9纳米颗粒和改性TiO2纳米管阵列的协同效应,该复合材料在 2 A∙g−1的电流密度下,比电容达到 1511.2 F∙g−1,明显高于大部分TiO2纳米管阵列为基底电极的电化学性能。此外,该复合材料作为正极与活性炭负极组装为非对称电极,该器件在400.5 W∙kg−1的功率密度下的能量密度高达45.5 Wh∙kg−1,并成功点亮LED,实现了TiO2纳米管阵列在超级电容器上的器件化。

图19 (a)CoS与TiO2纳米管阵列复合材料的形貌图,(b)不同电解液中的电化学性能77Fig.19 (a) Morphology of the CoS depositd on TiO2 nanotube arrays, (b) electrochemical properties at different electrolytes77.
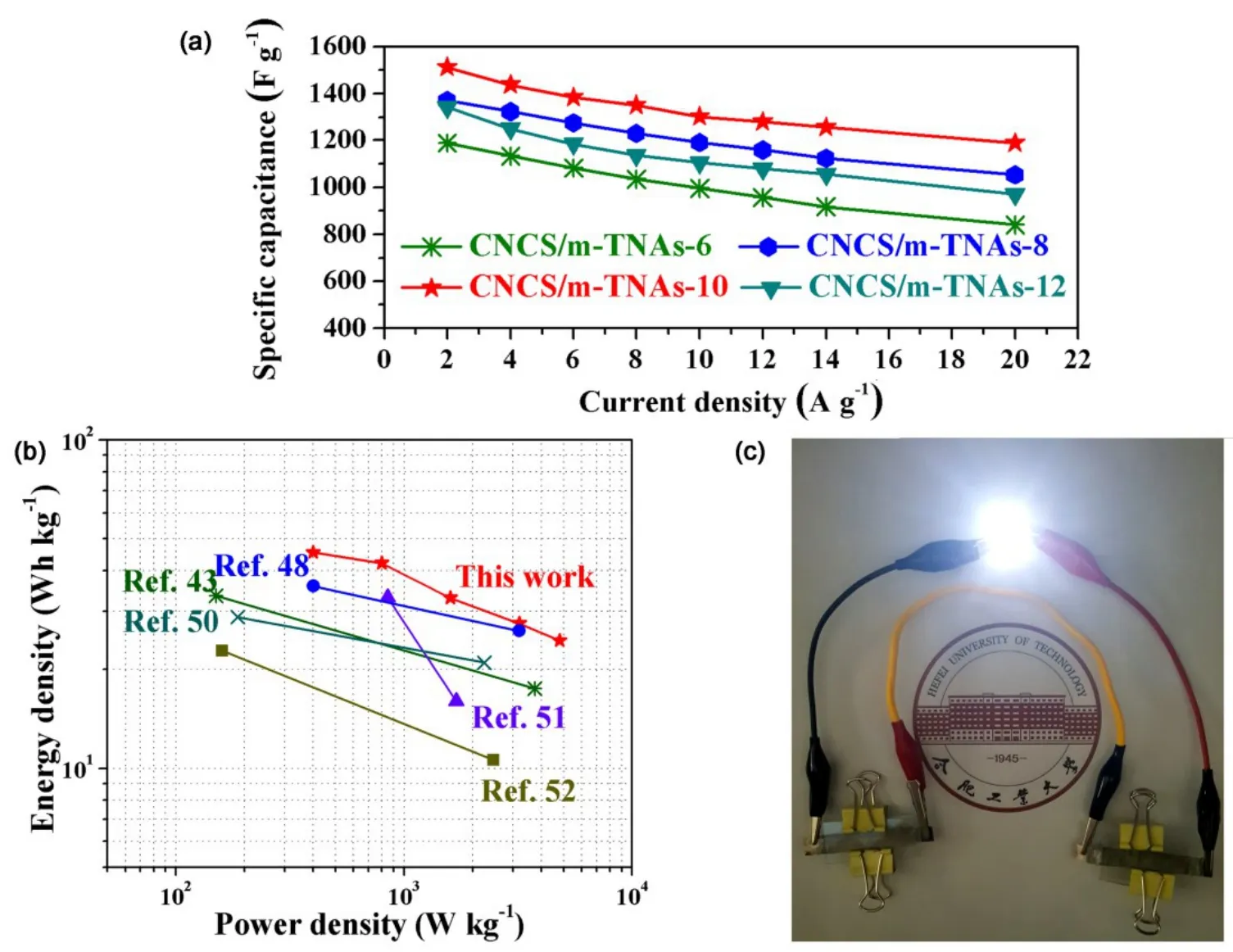
图20 Co0.12Ni1.88S2@Co8S9纳米颗粒修饰TiO2纳米管阵列的(a)(b)性能及其(c)应用Fig.20 (a) (b) Electrochemical property and (c) application of Co0.12Ni1.88S2@Co8S9 nanoparticles decorated TiO2 nanotube arrays.
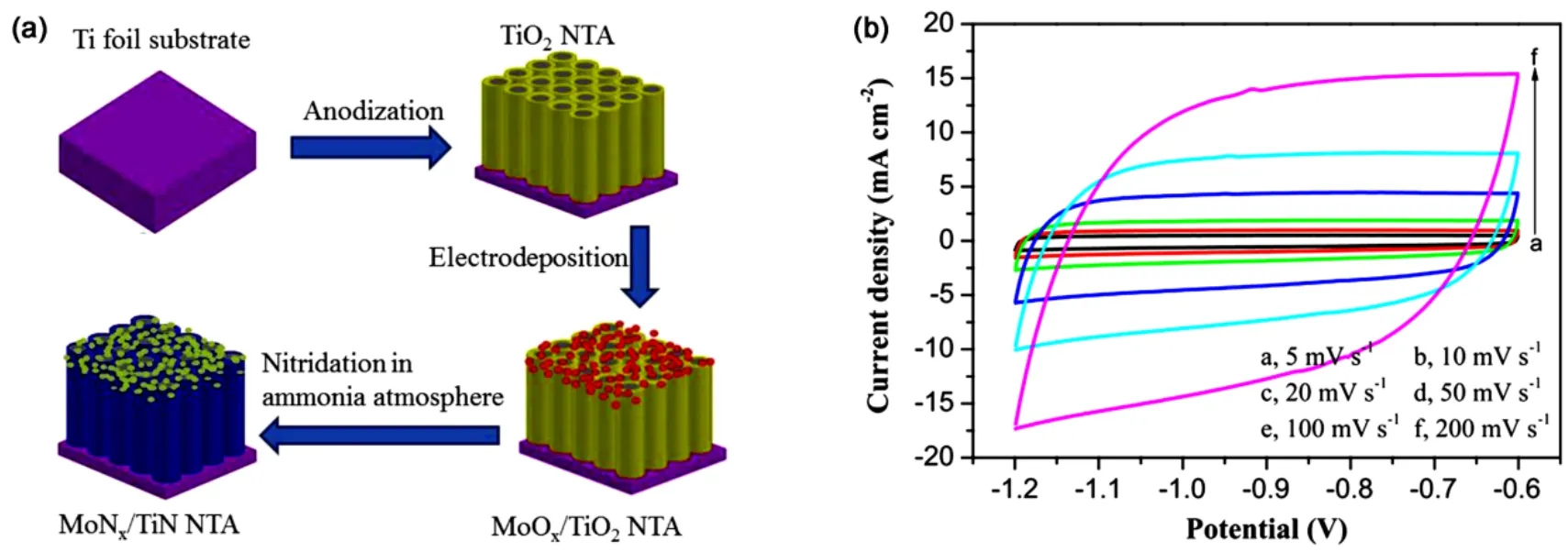
图21 (a)TiN纳米管阵列负载MoNx实验过程示意图,(b)电化学性能81Fig.21 (a) Fabrication process of MoNx/TiN nanotube arrays, (b) electrochemical properties81.
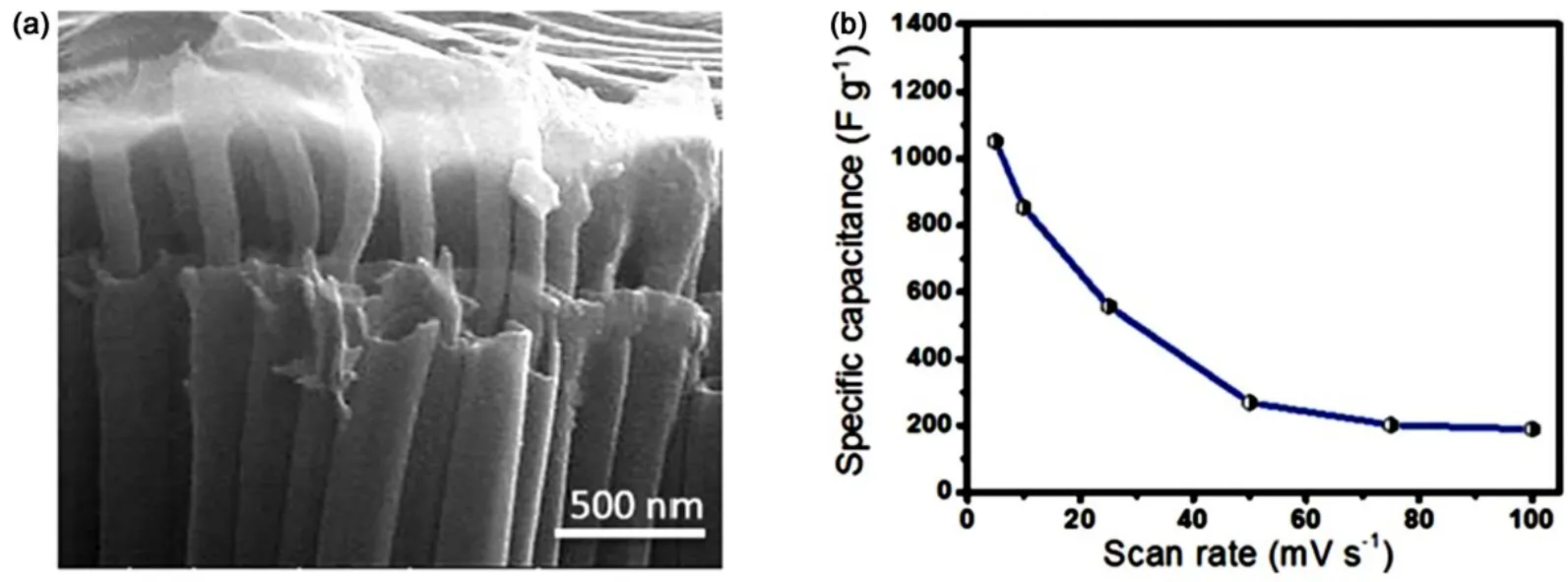
图22 (a)聚噻吩修饰TiO2纳米管阵列的形貌,(b)电化学性能82Fig.22 (a) Morphology and (b) electrochemical property of PTh-NFs in TiO2 nanotube arrays82.
2.4.4 金属氮化物
作为超级电容器电极材料研究热点之一,金属氮化物以其优良的导电性、化学稳定性以及电化学性能,吸引越来越多的学者对其研究78–80。大多数氮化物是通过将目标前驱体在氨气气氛中退火处理而获得的。2017年,Xie等81制备了MoNx与TiN纳米管阵列的复合材料,他们首先利用电沉积的方法将前驱体MoOx沉积到TiO2纳米管阵列基底上,然后将其在氨气气氛中退火同时实现了两种氧化物向氮化物的转变。该复合材料由TiN纳米管及其管口上部的MoNx纳米颗粒构成,且体现出了双电层电容的特性,在0.3 mA∙cm−2的电流密度下,其比电容(121.50 mF∙cm−2)高于TiN纳米管(69.05 mF∙cm−2),充分体现了 MoNx在提高电化学性能上发挥的作用(如图21)。
2.5 导电聚合物修饰
近年来,导电聚合物(即聚苯胺、聚吡咯和聚噻吩)基于其导电性高、环境友好、成本低、安全性高等优点而成为极具应用前景的超级电容器电极材料之一,导电聚合物不仅拥有有机聚合物的机械性能和柔性,又同时具备类似金属的电学性能,且其易于修饰与复合,可以直接与其他材料复合以提高目标产物的整体性能82–85。2011年,Xie等86利用电沉积法制备了聚苯胺纳米线与TiO2纳米管阵列的复合材料,在1 A∙g−1的电流密度下,该复合材料的比电容达到732 F∙g−1。2014年,Xie等87制备了聚苯胺与TiO2纳米管阵列的复合材料,他们首先将TiO2纳米管阵列修饰上γ-氨丙基三乙氧基硅烷(APTES),APTES作为结合剂通过共价键将苯胺分子与TiO2纳米管阵列结合起来,然后利用接合聚合的方法将聚苯胺沉积在APTES修饰后的TiO2纳米管阵列上,该复合材料表现出优异的电化学性能。Ambade等82,88在聚噻吩修饰TiO2纳米管阵列方面做了充分的研究工作(如图 22),制备了性能优异的超级电容器电极材料。
3 结论与展望
阳极氧化法制备的TiO2纳米管阵列具有制作方法简单、形貌可控以及化学稳定性良好等优点,并且可直接作为基底材料来负载不同的活性物质,避免了导电剂及粘结剂的使用,大大简化了电极制备过程,并提高了活性物质的利用率,已成为超级电容器电极材料的研究热点之一。然而,相比于金属氧化物,TiO2纳米管阵列的电化学性能仍然偏低,且基于TiO2纳米管阵列的活性物质修饰,一部分活性物质仅仅覆盖在TiO2纳米管阵列的表面,无法充分发挥TiO2纳米管阵列的作用。因此,研究与发展更多的掺杂或修饰技术,克服TiO2纳米管阵列本身较差的导电性及电化学活性的缺点,随之将TiO2纳米管阵列与其他材料有机结合起来,优化材料制备工艺,构建多元电极复合材料,利用协同效应提高材料的电化学性能,这仍然是今后研究的重点方向。此外,TiO2纳米管阵列在超级电容器中的应用仍然处于实验室研究阶段,应进一步探索与扩展其微纳器件化、产业化,相信未来TiO2纳米管阵列在发展高性能超级电容器电极材料中将发挥不可替代的重要作用。
(1) Wu, L.; Hao, L.; Pang, B.; Wang, G.; Zhang, Y.; Li, X. J. Mater.Chem. A 2017, 5, 4629. doi: 10.1039/c6ta10757e
(2) Mai, L. Q.; Yang, F.; Zhao, Y. L.; Xu, X.; Xu, L.; Luo, Y. Z. Nat.Commun. 2011, 2, 381. doi: 10.1038/ncomms1387
(3) Li, B.; Dai, F.; Xiao, Q.; Yang, L.; Shen, J.; Zhang, C.; Cai, M.Energy Environ. Sci. 2016, 9, 102. doi: 10.1039/c5ee03149d
(4) Zhu, J.; Childress, A. S.; Karakaya, M.; Dandeliya, S.; Srivastava, A.;Lin, Y.; Rao, A. M.; Podila, R. Adv. Mater. 2016, 28, 7185.doi: 10.1002/adma.201602028
(5) Wang, Y. Controllable Synthesis of TiO2Nanotube Arrays and Their Gas Sensing Properties. Ph. D. Dissertation, Hefei University of Technology, Hefei, 2012. [王 岩. TiO2纳米管阵列的可控制备及气敏性能研究[D]. 合肥: 合肥工业大学, 2012.]
(6) Yuan, B. Controllable Preparation and Modification of TiO2Nanotube Arrays. M. S. Dissertation, Hefei University of Technology, Hefei, 2013. [袁 宝. TiO2纳米管阵列可控制备及其改性研究[D]. 合肥: 合肥工业大学, 2013.]
(7) Bian, H. D. Homogenerous Ag Nanoparticles Decorated TiO2Nanotube Arrays and Their Photoelectrochemical Properties. M. S.Dissertation, Hefei University of Technology, Hefei, 2013. [卞海东.Ag纳米颗粒负载TiO2纳米管阵列及其光电性能[D]. 合肥: 合肥工业大学, 2013.]
(8) Mor, G. K.; Varghese, O. K.; Paulose, M.; Shankar, K.; Grimes, C. A.Sol. Energy Mater. Sol. Cells 2006, 90, 2011.doi: 10.1016/j.solmat.2006.04.007
(9) Veal, B. W.; Kim, S. K.; Zapol, P.; Iddir, H.; Baldo, P. M.; Eastman,J. A. Nat. Commun. 2016, 7, 11892. doi: 10.1038/ncomms11892
(10) Kelly, L. L.; Racke, D. A.; Schulz, P.; Li, H.; Winget, P.; Kim, H.;Ndione, P.; Sigdel, A. K.; Bredas, J. L.; Berry, J. J.; Graham, S.;Monti, O. L. A. J. Phys.: Condens. Matter 2016, 28, 094007. doi:10.1088/0953-8984/28/9/094007
(11) Lu, X; Wang, G; Zhai, T; Yu, M; Gan, J; Tong, Y; Li, Y. Nano Lett.2012, 12, 1690. doi: 10.1021/nl300173j
(12) Zhu, S.; Zhang, P.; Chang, L.; Zhong, Y.; Wang, K.; Shao, H.; Wang,J.; Zhang, J.; Cao, C. N. Phys. Chem. Chem. Phys. 2016, 18, 8529.doi: 10.1039/c6cp00372a
(13) Li, Z.;Ding, Y.; Kang, W.; Li, C.; Lin, D.; Wang, X.; Chen, Z.; Wu,M.; Pan, D. Electrochim. Acta 2014, 161, 40.doi: 10.1016/jelectacta2014.12.132
(14) Wu, H.; Li, D.; Zhu; X.; Yang; C.; Liu; D.; Chen, X.; Song; Y.; Lu,L. Electrochim. Acta 2014, 116, 129.doi: 10.1016/j.electacta.2013.10.092
(15) Zhou, H; Zhang, Y. J. Phys. Chem. C 2014, 118, 5626.doi: 10.1021/jp4082883
(16) Kim, C.; Kim, S.; Hong, S. P.; Lee, J.; Yoon, J. Phys. Chem. Chem.Phys. 2016, 18, 14370. doi: 10.1039/c6cp01799a
(17) Li, Z. Q.; Hu, R; Guo, J; Ru, L, Y.; Wang, H. H. Mater. Sci. Tech.2012, 20, 80. [李泽全, 胡 蓉, 郭 晶, 茹黎月, 王海华. 材料科学与工艺, 2012, 20, 80.] doi: 10.11951/j.i ssn.1005-0299.20120 215
(18) Salari, M.; Konstantinov, K.; Liu, H. K. J. Mater. Chem. 2011, 21,5128. doi: 10.1039/c0jm04085a
(19) Salari, M.; Aboutalebi, S. H.; Chidembo, A. T.; Konstantinov, K.;Liu, H. K. J. Alloy. Compd. 2014, 586, 197.doi: 10.1016/j.jallcom.2013.10.041
(20) Pei, Z.; Zhu, M.; Huang, Y.; Huang, Y.; Xue, Q.; Geng, H.; Zhi, C.Nano Energy 2016, 20, 254. doi: 10.1016/j.nanoen.2015.12.025
(21) Wu, H.; Xu, C.; Xu, J.; Lu, L.; Fan, Z.; Chen, X.; Song, Y.; Li, D.Nanotechnology 2013, 24, 455401.doi: 10.1088/0957-4484/24/45/455401
(22) Zhang, J.; Wang, Y.; Wu, J.; Shu, X.; Yu, C.; Cui, J.; Qin, Y.; Zhang,Y.; Ajayan, P. M.; Wu, Y. Chem. Eng. J. 2017, 313, 1071.doi: 10.1016/j.cej.2016.11.004
(23) Liu, F. L.; Xiao, P; Zhou, M; Hu, Y. Q.; He, H. C.; Zhang, Y. H.Chin. J. Inorg. Chem. 2012, 28, 861. [刘非拉, 肖 鹏, 周 明, 胡业琴, 何辉超, 张云怀. 无机化学学报, 2012, 28, 861.]doi: 10.16085/j.issn.1000-6613.2015.05.02 2
(24) Mohamed, A. E. R.; Rohani, S. Energy Environ. Sci. 2011, 4, 1065.doi: 10.1039/c0ee00488j
(25) Sun, L.; Li, J.; Wang, C. L.; Li, S. F.; Chen, H. B.; Lin, C. J. Sol.Energy Mater. Sol. Cells 2009, 93, 1875.doi: 10.1016/j.solmat.2009.07.001
(26) Zhong, W.; Sang, S.; Liu, Y.; Wu, Q.; Liu, K.; Liu, H. J. Power Sources 2015, 294, 216. doi: 10.1016/j.jpowsour.2015.06.052
(27) Gao, B.; Huang, C.; Li, Q.; Wu, K.; Zhang, X.; Huo, K. Materials China 2016, 35, 552. [高 标, 黄 超, 李庆伟, 吴 凯, 张旭明,霍开富. 中国材料进展, 2016, 35, 552. ]doi: 10.7502/j.issn.1674-3962.2016.07.10
(28) Dong, S.; Chen, X.; Gu, L.; Zhou, X.; Li, L.; Liu, Z.; Han, P.; Xu, H.;Yao, J.; Wang, H.; Zhang, X.; Shang, C.; Cui, G.; Chen, L. Energy Environ. Sci. 2011, 4, 3502. doi: 10.1039/c1ee01399h
(29) Xie, Y.; Fang, X. Electrochim. Acta 2014, 120, 273.doi: 10.1016/j.electacta.2013.12.103
(30) Ozkan, S.; Nguyen, N. T.; Hwang, I.; Mazare, A.; Schmuki, P. Small 2017, 1603821. doi: 10.1002/smll.201603821
(31) Nguyen, N. T.; Ozkan, S.; Hwang, I.; Zhou, X.; Schmuki, P. J. Mater.Chem. A 2017, 5, 1895. doi: 10.1039/c6ta10179h
(32) Jana, M.; Saha, S.; Samanta, P.; Murmu, N. C.; Kim, N. H.; Kuila, T.;Lee, J. H. J. Mater. Chem. A 2016, 4, 2188. doi: 10.1039/c5ta10297a
(33) Zhao, W.; Wang, S.; Wang, C.; Wu, S.; Xu, W.; Zou, M.; Ouyang,A.; Cao, A.; Li, Y. Nanoscale 2016, 8, 626. doi: 10.1039/c5nr05978j
(34) Zhu, C.; Liu, T.; Qian, F.; Han, T. Y. J.; Duoss, E. B.; Kuntz, J. D.;Spadaccini, C. M.; Worsley, M. A.; Li, Y. Nano Lett. 2016, 16, 3448.doi: 10.1021/acs.nanolett.5b04965
(35) Gao, Z.; Cui, Z.; Zhu, S.; Liang, Y.; Li, Z.; Yang, X. J. Power Sources 2015, 283, 397. doi: 10.1016/j.jpowsour.2015.02.080
(36) Gobal, F.; Faraji, M. Ionics 2015, 21, 525.doi: 10.1007/s11581-014-1177-1
(37) Gao, Biao; Li, X.; Ma, Y.; Cao, Y.; Hu, Z.; Zhang, X.; Fu, J.; Huo,K.; Chu, P. K. Thin Solid Films 2015, 584, 61.doi: 10.1016/j.tsf.2014.09.071
(38) Di, J.; Fu, X.; Zheng, H.; Jia, Y. J. Nanopart. Res. 2015, 17,doi: 10.1007/s11051-015-3060-z
(39) Zheng, L.; Wang, C.; Dong, Y.; Bian, H.; Hung, T. F.; Lu, J.; Li, Y.Appl. Surf. Sci. 2016, 362, 399. doi: 10.1016/j.apsusc.2015.11.172
(40) Song, Y. Y.; Li, Y. H.; Guo, J.; Gao, Z. D.; Li, Y. J. Mater. Chem. A 2015, 3, 23754. doi: 10.1039/c5ta05691h
(41) Gao, Z. D.; Zhu, X.; Li, Y. H.; Zhou, X.; Song, Y. Y.; Schmuki, P.Chem. Commun. 2015, 51, 7614. doi: 10.1039/c5cc00728c
(42) Yu, C.; Wang, Y; Zheng, H.; Zhang, J.; Yang, W.; Shu, X.; Qin, Y.;Cui, J.; Zhang, Y.; Wu, Y. J. Solid State Electrochem. 2017, 21,1069. doi: 10.1007/s10008-016-3441-y
(43) Xie, Y.; Zhou, L.; Huang, C.; Huang, H.; Lu, J. Electrochim. Acta 2008, 53, 3643. doi: 10.1016/j.electacta.2007.12.037
(44) Zhou, H.; Zhang, Y. J. Power Sources 2014, 272, 866.doi: 10.1016/j.jpowsour.2014.09.030
(45) Huang, Y. G.; Zhang, X. H.; Chen, X. B.; Wang, H. Q.; Chen, J. R.;Zhong, X. X.; Li, Q. Y. Int. J. Hydrogen Energy 2015, 40, 14331.doi: 10.1016/j.ijhydene.2015.05.014
(46) Liu, X. Y.; Gao, Y. Q.; Yang, G. W. Nanoscale 2016, 8, 4227.doi: 10.1039/c5nr09145d
(47) Liu, M.; Wang, X.; Zhu, D.; Li, L.; Duan, H.; Xu, Z.; Wang, Z.; Gan,L. Chem. Eng. J. 2017, 308, 240. doi: 10.1016/j.cej.2016.09.061
(48) Qin, Y.; Zhang, J.; Wang, Y.; Shu, X.; Yu, C.; Cui, J.; Zheng, H.;Zhang, Y.; Wu, Y. RSC Adv. 2016, 6, 47669.doi: 10.1039/c6ra08891k
(49) Zhou, X.; Chen, Q.; Wang, A.; Xu, J.; Wu, S.; Shen, J. ACS Appl.Mater. Interfaces 2016, 8, 3776. doi: 10.1021/acsami.5b10196
(50) Gao, Z.; Yang, W.; Wang, J.; Song, N.; Li, X. Nano Energy 2015, 13,306. doi: 10.1016/j.nanoen.2015.02.036
(51) Yu, D.; Wu, B.; Ge, L.; Wu, L.; Wang, H.; Xu, T. J. Mater. Chem. A 2016, 4, 10878. doi: 10.1039/c6ta04286d
(52) Singh, A. K.; Sarkar, D.; Karmakar, K.; Mandal, K.; Khan, G. G.ACS Appl. Mater. Interfaces 2016, 8, 20786.doi: 10.1021/acsami.6b05933
(53) Zhou, H.; Zou, X.; Zhang, Y. Electrochim. Acta 2016, 192, 259. doi:10.1016/j.electacta.2016.01.182
(54) Wang, Z.; Wang, Y.; Shu, X.; Yu, C.; Zhang, J.; Cui, J.; Qin, Y.;Zheng, H.; Zhang, Y.; Wu, Y. RSC Adv. 2016, 6, 63642.doi: 10.1039/c6ra13628a
(55) Zhang, J.; Wang, Y.; Qin, Y.; Yu, C.; Cui, L.; Shu, X.; Cui, J.; Zheng,H.; Zhang, Y.; Wu, Y. J. Solid State Chem. 2017, 246, 269.doi: 10.1016/j.jssc.2016.11.021
(56) Xu, J.; Liu, J. Q.; Li, J. W.; Wang, Y.; Lü, J.; Wu, Y. C. Acta Phys. -Chim. Sin. 2016, 32, 2545. [徐 娟, 刘家琴, 李靖巍, 王岩, 吕 珺, 吴玉程. 物理化学学报, 2016, 32, 2545.]doi: 10.3866/PKU.WHXB201606161
(57) Guan, D.; Gao, X.; Li, J.; Yuan, C. Appl. Surf. Sci. 2014, 300, 165.doi: 10.1016/j.apsusc.2014.02.029
(58) Cui, L. H.; Wang, Y.; Shu, X.; Zhang, J. F.; Yu, C. P.; Cui, J. W.;Zheng, H. M.; Zhang, Y.; Wu, Y. C. RSC Adv. 2016, 6, 12185.doi: 10.1039/c5ra25581c
(59) Yang, F.; Yao, J.; Liu, F.; He, H.; Zhou, M.; Xiao, P.; Zhang, Y.J. Mater. Chem. A 2013, 1, 594. doi: 10.1039/c2ta00055e
(60) Wu, H. B.; Pang, H.; Lou, X. W. Energy Environ. Sci. 2013, 6, 3619.doi: 10.1039/c3ee42101e
(61) Yu, C.; Wang, Y.; Zhang, J.; Shu, X.; Cui, J.; Qin, Y.; Zheng, H.;Liu, J.; Zhang, Y.; Wu, Y. New J. Chem. 2016, 40, 6881.doi: 10.1039/c6nj00359a
(62) Sarkar, A.; Singh. A. K.; Sarkar. D.; Khan G. G.; Kalyan. M. ACS Sustainable Chem. Eng. 2015, 3, 2254.doi: 10.1021/acssuschemeng.5b00519
(63) Ghicov, A.; Aldabergenova, S.; Tsuchyia, H.; Schmuki, P. Angew.Chem. Int. Ed. 2006, 45, 6993. doi: 10.1002/anie.200601957
(64) Kim, J. H.; Zhu, K.; Yan, Y.; Perkins, C. L.; Frank, A. J. Nano Lett.2010, 10, 4099. doi: 10.1021/nl102203s
(65) Yang, Y.; Kim, D.; Yang, M.; Schmuki, P. Chem. Commun. 2011, 47,7746. doi: 10.1039/c1cc11811k
(66) Ning, X.; Wang, X.; Yu, X.; Zhao, J.; Wang, M.; Li, H.; Yang, Y.Sci. Rep. 2016, 6, 22634. doi: 10.1038/srep22634
(67) Ning, X.; Wang, X.; Yu, X.; Li, J.; Zhao, J. J. Alloy. Compd. 2016,658, 177. doi: 10.1016/j.jallcom.2015.10.204
(68) Nguyen, T.; Boudard, M.; Carmezim, M. J.; Montemor, M. F. Sci.Rep. 2017, 7, 39980. doi: 10.1038/srep39980
(69) Ye, L.; Zhao, L.; Zhang, H.; Zan, P.; Gen, S.; Shi, W.; Han, B.; Sun,H.; Yang, X.; Xu, T. J. Mater. Chem. A 2017, 5, 1603.doi: 10.1039/c6ta09547j
(70) Xiong, G.; He, P.; Wang, D.; Zhang, Q.; Chen, T.; Fisher, T. S. Adv.Funct. Mater. 2016, 26, 5460. doi: 10.1002/adfm.201600879
(71) Shang, C.; Dong, S.; Wang, S.; Xiao, D.; Han P.; Wang X.; Gu L.;Cui, G. ACS Nano 2013, 7, 5430. doi: 10.1021/nn401402a
(72) Lu, F.; Zhou, M.; Li, W.; Weng, Q.; Li, C.; Xue, Y.; Jiang, X.; Zeng,X.; Bando, Y.; Golberg, D. Nano Energy 2016, 26, 313.doi: 10.1016/j.nanoen.2016.05.042
(73) Yang, J.; Yu, C.; Fan, X.; Liang, S.; Li, S.; Huang, H.; Ling, Z.; Hao,C.; Qiu, J. Energy Environ. Sci. 2016, 9, 1299.doi: 10.1039/c5ee03633j
(74) Kong, W.; Lu, C.; Zhang, W.; Pu, J.; Wang, Z. J. Mater. Chem. A 2015, 3, 12452. doi: 10.1039/c5ta02432c
(75) Hou, L.; Shi, Y.; Zhu, S.; Rehan, M.; Pang, G.; Zhang, X.; Yuan, C.J. Mater. Chem. A 2017, 5, 133. doi: 10.1039/c6ta05788h
(76) Yang, X.; Sun, H.; Zan, P.; Zhao, L.; Lian, J. J. Mater. Chem. A 2016,4, 18857. doi: 10.1039/c6ta07898b
(77) Ray, R. S.; Sarma, B.; Jurovitzki, A. L.; Misra, M. Chem. Eng. J.2015, 260, 671. doi: 10.1016/j.cej.2014.07.031
(78) Zhu, C.; Yang, P.; Chao, D.; Wang, X.; Zhang, X.; Chen, S.; Tay, B.K.; Huang, H.; Zhang, H.; Mai, W.; Fan, H. J. Adv. Mater. 2015, 27,4566. doi: 10.1002/adma.201501838
(79) Balogun, M. S.; Zeng, Y.; Qiu, W.; Luo, Y.; Onasanya, A.; Olaniyi,T. K.; Tong, Y. J. Mater. Chem. A 2016, 4, 9844.doi: 10.1039/ c6ta02492 k
(80) Wang, S.; Sun, C.; Shao, Y.; Wu, Y.; Zhang, L.; Hao, X. Small 2017,13, 1603330. doi: 10.1002/smll.201603330
(81) Xie, Y.; Tian, F. Mater. Sci. Eng. B 2017, 215, 64.doi: 10.1016/j.mseb.2016.11.005
(82) Ambade, R. B.; Ambade, S. B.; Shrestha, N. K.; Salunkhe, R. R.;Lee, W.; Bagde, S. S.; Kim, J. H.; Stadler, F. J.; Yamauchi, Y.; Lee,S.-H. J. Mater. Chem. A 2017, 5, 172. doi: 10.1039/c6ta08038c
(83) Huang, H.; Gan, M.; Ma, L.; Yu, L.; Hu, H.; Yang, F.; Li, Y.; Ge, C.J. Alloy. Compd. 2015, 630, 214. doi: 10.1016/j.jallcom.2015.01.059(84) Xie, Y.; Wang, D. J. Alloy. Compd. 2016, 665, 323.doi: 10.1016/j.jallcom.2016.01.089
(85) Peng, X.; Huo, K.; Fu, J.; Zhang, X.; Gao, B.; Chu, P. K. Chem.Commun. 2013, 49, 10172. doi: 10.1039/c3cc45997g
(86) Xie, K.; Li, J.; Lai, Y.; Zhang, Z.; Liu. Y.; Zhang, G.; Huang, H.Nanoscale 2011, 3, 2202. doi: 10.1039/c0nr00899k
(87) Xie, S.; Gan, M.; Ma, L.; Li, Z.; Yan, J.; Yin, H.; Shen, X.; Xu, F.;Zheng, J.; Zhang, J.; Hu, J. Electrochim. Acta 2014, 120, 408.doi: 10.1016/j.electacta.2013.12.067
(88) Ambade, R. B.; Ambade, S. B.; Shrestha, N. K.; Nah, Y. C.; Han, S.H.; Lee, W.; Lee, S. H. Chem. Commun. 2013, 49, 2308.doi: 10.1039/c3cc0 0065f
Recent Advances in the Multi-Modification of TiO2Nanotube Arrays and Their Application in Supercapacitors
YU Cui-Ping1WANG Yan1,*CUI Jie-Wu1LIU Jia-Qin2,3WU Yu-Cheng1,2,*
(1School of Materials Science and Engineering, Hefei University of Technology, Hefei 230009, P. R. China;2Key Laboratory of Advanced Functional Materials and Devices of Anhui Province, Hefei 230009, P. R. China;3Institute of Industry & Equipment Technology, Hefei University of Technology, Hefei 230009, P. R. China)
Anodized TiO2nanotube arrays are one of the key electrode materials for supercapacitors,because of their easy synthesis, controllable morphology, and environmentally friendly characteristics. In this paper, the multi-modification of TiO2nanotube arrays is presented. These modifications include the introduction of oxygen vacancies, and the modification of the arrays by metals, nonmetals, metal oxides and conductive polymers; these modifications provide scope to increase the electrochemical performance of the TiO2nanotube arrays. Recent advances of anodized TiO2nanotube arrays in supercapacitors are systematically summarized, providing guidance for the practical application of these arrays.
Anodization; TiO2nanotube arrays; Multi-modification; Supercapacitor;Electrochemical performance
April 3, 2017; Revised: April 26, 2017; Published online: May 17, 2017.
O646
10.3866/PKU.WHXB201705177 www.whxb.pku.edu.cn
*Corresponding authors: WANG Yan, Email: stone@hfut.edu.cn; Tel: +86-551-62905150. WU Yu-Cheng, Email: ycwu@hfut.edu.cn; Tel: +86-551-62901012.The project was supported by the National Natural Science Foundation of China (51302060, 51402081, 51402078), Specialized Research Fund for the Doctoral Program of Higher Education, China (20130111120019), Natural Science Foundation of Anhui Province, China (1708085ME100) and Fundamental Research
Funds for the Central Universities, China (JZ2017HGTB0203, JZ2016HGTB0719).
国家自然科学基金(51302060, 51402081, 51402078),高等学校博士学科点专项科研基金(20130111120019),安徽省自然科学基金(1708085ME100)和中央高校基本科研业务费专项资金资助(JZ2017HGTB0203, JZ2016HGTB0719)资助项目
© Editorial office of Acta Physico-Chimica Sinica
