Micro-122慢病毒抑制星状细胞-T6上皮间质转变
2017-11-01程变巧王丽惠洪发项林伟国
程变巧,朱 琪*,王丽惠,洪发项,林伟国
(厦门大学附属福州市第二医院肝胆内科,福建 福州 350007)
·论 著·
Micro-122慢病毒抑制星状细胞-T6上皮间质转变
程变巧,朱 琪*,王丽惠,洪发项,林伟国
(厦门大学附属福州市第二医院肝胆内科,福建 福州 350007)
目的初步探讨Micro -122对肝星状细胞上皮间质转变的影响。方法把Mirc0-122/GV369慢病毒载体转染TGF-β1刺激的肝星状细胞系T6后,荧光显微镜和QRT-PCR验证转染效果,QRT-PCR和免疫印迹分别检测转染前后E-Cadherin以及a-SMA的RNA及蛋白的表达情况。结果转染Mirc0-122/GV369慢病毒载体的肝星状细胞系T6内显示明显的绿色荧光,Mirc0-122显示了上调表达。E-cadherin在mRNA和蛋白水平都显示上调表达,相反a-SMA显示了下调表达,与对照组相比,P<0.05。结论Mirco-122在肝星状细胞的表达上调可抑制肝星状细胞的上皮间质转变,有望作为肝纤维化的靶向抑制指标。
Micro-122;肝星状细胞;肝纤维化;上皮间质转变
肝纤维是各种肝病发展的必经阶段,然而目前关于肝纤维化的干预手段还没有明显的作用。寻找肝纤维化的预测指标和治疗评估指标可望改善肝纤维化的发展,提高检测水平。
最近研究认为上皮间质转变参与肝纤维化过程,在这一过程中可出现代表上皮成分的E-cadherin表达下调,代表间质成分的a-SMA等表达上调[1-2]。抑制肝星状细胞的上皮间质转变可有望阻止肝纤维化的发展[3-4]。MicroRNA(Micro)是一类内生的、在进化上高度保守的长约20~24个核苷酸的非编码单链小RNA,是肝脏特异性miRNA,参与肝细胞生长代谢和应激反应等生理过程[5]。目前有研究认为Micro可能抑制肝星状细胞的上皮间质转变从而抑制肝纤维化的发展。因此本课题拟研究MicroRNA-122作用于活化的肝星状细胞后对上皮间质转变的影响,以此初步探讨MicroRNA-122是否可作为肝纤维化的治疗靶点。
1 材料与方法
1.1 试剂与仪器
MicroRNA-122慢病毒载体(15993-1)由上海吉凯基因公司构建,载体元件顺序为Ubi-MCS-SV40-EGFP-IRES-puromycin,滴度为4×108TU/ml,克隆位点为AgeI/ NheI,合成的microRNA-122基因序列(5'-3'),胎牛血清(以色列Biological Industries公司);Trizol、逆转录试剂盒(南京Vazyme公司);荧光定量试剂盒(美国Genecopoeia公司);引物由上海博尚生物技术有限公司合成并测序;单克隆兔抗人α-SMA(ab5694 abcam)、单克隆鼠抗人E-cadherin(ab76055 abcam);HRP标记羊抗小鼠或抗兔IgG、FITC标志的羊抗兔IgG(EMAR公司);细胞培养箱(美国Thermo Forma公司);超净工作台(苏州净化设备有限公司);荧光显微镜(日本OLYMPUS公司);实时荧光定量PCR仪及凝胶成像系统(美国Bio-Rad公司)。
1.2 细胞培养
大鼠HSC-T6株由福建中医药大学中西医结合学院施红教授惠赠,用含10%胎牛血清及100 U/mL青霉素、100 μg/mL庆大霉素的DMEM高糖培养基,置于37℃、5%CO2、饱和湿度培养箱中培养,每48 h更换1次培养液,细胞贴壁生长至培养瓶的70%~80%时传代1次。
1.3 试验方法
qRT-PCR法检测MicroRNA-122、E-cadherin mRNA和α-SMA表达量 实验组和对照组处理方法同细胞形态学观察,培养24 h后,Trizol试剂提取两组细胞的总RNA,用1%琼脂糖电泳检测RNA的完整性,计算OD260 nm/OD280 nm比值检验RNA纯度在1.8~2.2间再逆转录成cDNA,按95℃ 5 min预变性,95℃ 10 min,60℃ 30 s,共40个循环进行qRT-PCR反应。采用引物序列为:E-cadherin上游:5'-GCTCGCTGAACTCCTCTGA-3',下游:5'-TCGCCGCCACCATACATA;miR-122序列为5'-GCTGTGGAGTGTGACAATGGTG-3';U6(F)为5'-CGCTTCGGCAGCACATATACT-3',U6(R)为5'-GAATTTGCGTGTCATCCTTGC-3',α-SMA 上游引物:5'-CCACTGCTGCTTCCTCTTC-3',下游引物:5'-CGCCGACTCCATTCCAAT-3'.GAPDH上游:5'-ACGGCAAGTTCAACGGCACAG-3',下游:5'-GAAGACGCCAGTAGACTCCACGAC;采用RQ=2-ΔΔCt来计算基因的相对表达量。
1.4 Western blot法检测E-cadherin和a-SMA蛋白表达
以每孔30×104个细胞接种于六孔板,细胞贴壁生长12h后换液,在细胞培养箱中作用72 h,预冷的PBS洗涤3次,加适量裂解液(RIPA:PMSF=100:1),冰上裂解30 min,转移至EP管,4℃、12000 rpm离心15 min后取上清;用50 μg/泳道的蛋白上样,10%SDS-PAGE电泳分离蛋白质,转膜,5%脱脂牛奶封闭60 min,加入兔抗人E-cadherin和a-SMA(1:1000)、GAPDH(1:2000),4℃摇床孵育过夜,用TBST洗膜10 min×3次,加HRP标记的羊抗小鼠或抗兔IgG(1:2000)于室温孵育1 h,再次用TBST洗膜10 min×3次,ECL发光并显影。
1.5 统计学方法
采用SPSS 21.0软件对所有数据进行统计学分析,计量资料以均数±标准差(±s)表示,多组样本均数比较采用单因素方差分析,组间比较采用LSD法进行两两比较,P<0.05时差异有统计学意义。
2 结 果
2.1 免疫荧光和PCR技术观察mic-122慢病毒载体转染效率以及表达情况
荧光相差显微镜观察到miR-122转染组的细胞的胞质和细胞核内都出现明亮的荧光,部分肝星状细胞的胞核的荧光亮度强于胞质(图1A,1B),两图重叠后观察转染效率约80%,说明microRNA-122慢病毒载体在肝星状细胞-T6细胞系中成功转染。QRT-PCR结果显示,在转染组microRNA-122 mRNA表达量(4.92±0.09)明显高于阴性载体转染组(1.21±0.08)和空白对照组(1±0.11),组间比较,F=7.127(图2)。
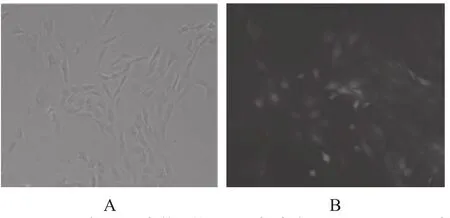
图1 HSC-T6在ENI.S.条件下的miR122转染结果,MOI=10 A图:转染miR-122慢病毒载体前肝星状细胞;B图:转染miR-122慢病毒载体后肝星状细胞免疫荧光染色

图2 QRT-PCR检测microRNA-122 在转染microRNA-122慢病毒载体的肝星状细胞中的表达
2.2 Mic-122慢病毒载体转染肝星状细胞后可显著上调E-cadherin的表达,而下调a-SMA的表达
为了研究micro-122对激活的肝星状细胞上皮间质转变是否有抑制作用,我们首先从基因水平对代表上皮成分的E-Cadherin和代表间质成分的a-SMA进行观察分析,结果显示,在Mic-122慢病毒载体转染肝星状细胞组,E-Cadherin表达(2.73±0.16 )与空质粒组(1.17±0.12)和空白对照组(1±0.20)相比,表达呈上调趋势,而a-SMA在转染组表达(0.21±0.13)与空质粒组(0.92±0.12)和空白对照组(1±0.20)相比,表达呈下调趋势。F值分别为16.208和7.145,组间比较,P<0.05。这初步说明,micro-122在肝星状细胞中的表达可以抑制其上皮间质转变。

图3 Qt-PCR检测microRNA-122慢病毒转染肝星状细胞后E-cadherin和a-SMA的表达情况。A图: E-cadherin在慢病毒转染后表达。B图:a-SMA在慢病毒转染后表达
2.3 免疫印迹观察
发现microRNA-122慢病毒转染肝星状细胞后可上调E-Cadherin,下调a-SMA蛋白的表达。从蛋白角度进一步说明了Micro-122上调表达可以抑制肝星状细胞的上皮间质转变。
a-SMA在正常肝星状细胞组的相对表达量为0.96±0.12,在阴性载体组的相对表达量为0.88±0.14,而miR-122转染组蛋白相对表达量为0.21±0.07,组间比较,F=7.145,有显著统计学意义。(P<0.05)。而E-cadherin在正常肝星状细胞组的相对表达量为0.36±0.11,在阴性载体组的相对表达量为0.41±0.13,而在转染组蛋白相对表达量为0.87±0.07,组间比较,F=10.145,有显著统计学意义。(P<0.05)
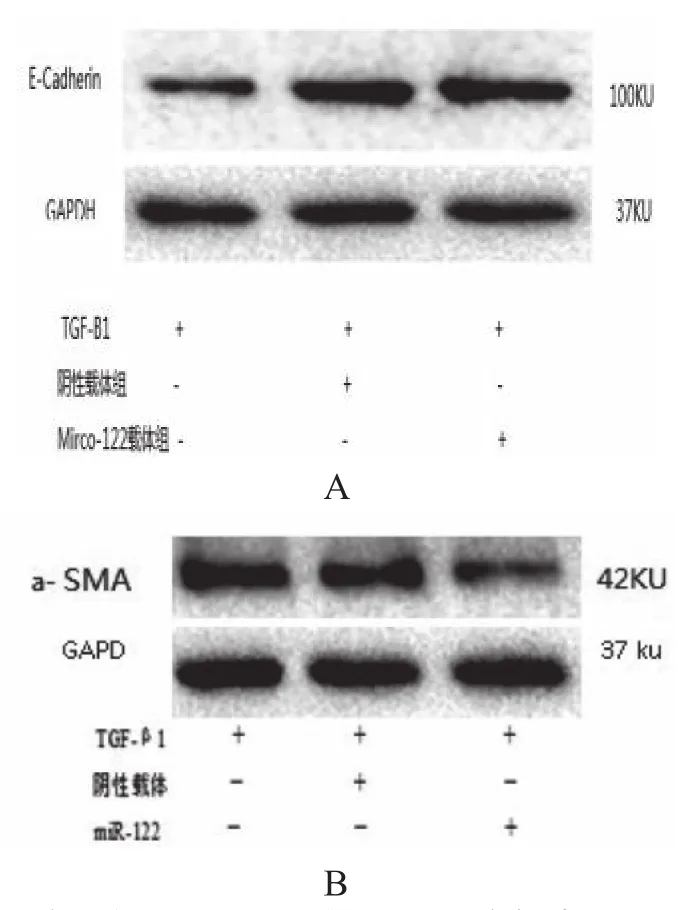
图4 免疫印迹观察E-cadherin蛋白和a-SMA在转染microRNA-122慢病毒载体的肝星状细胞中的表达。图A:a-SMA在不同处理肝星状细胞中的表达。图B:E-cadherin在不同处理肝星状细胞中的表达。
3 讨 论
肝星状细胞的活化是肝纤维化、肝硬化发展的主要原因,选择有效的阻断肝纤维化发展,也就是说抑制肝星状细胞的活化和增殖是阻断肝纤维化发展的关键。上皮间质细胞转化一直认为是肿瘤细胞特有的特点。最近相序在肾纤维化、肺纤维化以及腹膜纤维组织中均显示有上皮间质转化特点[3-4]。毕婉蓉[6]通过CCL4诱导小鼠肝纤维化模型中观察到代表上皮成分的E-钙粘附素的表达下调,代表间质成分的α-SMA表达上调,直接说明肝纤维化中也存在上皮间质转化。
我们课题组前期试验用TGF-β1刺激肝星状细胞的活化,发现在激活的肝星状细胞中代表上皮成分的E-Cadherin表达下调,F-actin荧光聚集形成粗大的应力纤维丝,沿细胞长轴成束状样分布,而代表间质成分的a -SMA以及vimentin、N-Cadherin等明显上调。这也进一步说明了肝星状细胞可以发生上皮间质转变。EMT是一个动态的可逆过程,以EMT为靶标的抗纤维化治疗,有望成为肝纤维化临床治疗的一个新策略。
Micro是一类内生的、在进化上高度保守的长约20~24个核苷酸的非编码单链小RNA,是肝脏特异性miRNA,参与肝细胞生长代谢和应激反应等生理过程[4-5]。目前研究发现,多种miRNA在肝纤维化进程中差异表达。如现已发现的miR-199a,miR-199a*,miR-200a和miR-200b在CCl4所致肝纤维化动物肝组织与人的肝纤维化组织中均差异性表达,并且与肝纤维化分级显著相关[7-8]。miR-122是最早发现的组织特异性表达的microRNA之一,它在肝脏中特异性表达,约占了所有肝脏表达的microRNAs的70%[9-10]。
本课题通过构建Micro-122慢病毒载体并成功转染活化的肝星状细胞,观察Micro-122对肝星状细胞上皮间质调控的影响。结果发现,无论从基因水平和蛋白水平,均发现E-cadherin在慢病毒载体转染组的表达明显高于在空质粒组和空白对照组的表达。而a-SMA的表达呈下调表达,这说明micro-122可以抑制肝星状细胞的上皮间质转变。
通过上述实验,我们只是初步探讨了micro-122对肝星状细胞上皮间质的调控作用。Micro-122如何调控肝星状的上皮间质转变还需要深入的研究。因为肝星状细胞激活后的调控不会是单一的调控,往往是一个复杂的信号网络相互作用,相互制约,因此进一步完善micro-122在肝纤维化中的调控作用有望成为阻断肝纤维化发展的关键靶点。
[1] Xu SY,Li J,Geng MY.The signal transduction and drug development of epithelial-mesenchymal transition[J],Chin pharmacol bull,2008,24(9):1131-1134.
[2] Kuroda N,Guo L,Miyazaki E,et al.The appearance of myofibroblasts and disappearance of CD3-positive stromal cells in the area adjacent to thexanthogranulomatous foci of chronic cholecystitis[J],Histol histopathol,2005,20(1):127-133.
[3] Saika S,Ikeda K,Yamanaka O,et al.Adenoviral gene transfer of BMP-7,ID2 ID3S up presses injury-induced epithelial to mesenchmal transition of lens epithelium mice[J].AM J Physiol cell physiol,2006,290(1):c282-c289.
[4] Das S,Becker BN, Hoffmann FM,et al.Complete reversal of epithelial to mesenchymal transitionrequires inhibiton of both ZEB expression and the Rho pathway[J].BMC cell Biol,2009.10:94.
[5] Bi WR,Yang CQ,Shi Q.Transforming growth factor-β1 induced epithelial-mesenchymal transition in hepatic fibrosis[J].Hepatogast roenterology,2012,59(118):191-194.
[6] 毕婉蓉,杨长青,吴艳红,郑圆媛,王兴媛.小鼠肝纤维化肝脏细胞上皮间质转换的研究.同济大学学报(医学版),2014(35)1:24-29.
[7] Murakami Y,Toyoda H,Tanaka M,et al.The progression of liver fibrosis is related with overexpression of the miR-199 and 200 families[J].PLoS One,2011,6(1):e16081.
[8] Chen C,Wu CQ,Zhang ZQ,et al.Loss of expression of miR-335 is implicated in hepatic stellate cell migration and activation[J].Experimental Cell Research,2011,317(12):1714-1725.
[9] Yi Zhang,Yin Jia,Ruiying Zheng,et al.Plasma MicroRNA-122 as a Biomarker for viral-,alcohol-,and chemical- Related Hepatic Diseases[J].Clinical Chemistry,2010,56(12):1830-1838.
[10] 牛 强,吕 伟,赵 玮,王 进,等.肝硬化患者血清MicroRNA-122 含量与分级关系.中华临床医师杂志(电子版),2015(9)22;4120-4123.
Inhibition of epithelial mesenchymal transition of hepatic stellate cells T-6 by micro-122 lentiviral vector
CHENG Bian-qiao, ZHU Qi, WANG Li-hui, HONG Fa-xiang, LIN Wei-guo
(The Second Hospital of Fuzhou Affiliated Xiamen University,Fujian Fuzhou 350007,China)
ObjectivePreliminary discussing the influence of micro-122 on the epithelial mesenchymal transition of hepatic stellate cells T-6.MethodsWe transfect Micro-122/GV369 lentiviral vector into hepatic stellate cells line T6 stimulated by TGF - beta 1,fluorescent microscope was used to transfection sfficiency, QRT-PCR was used to detect expression of Micro-122 mRNA、E-cadherin mRNA and a-SMA mRNA .The protein expression bouth E-cadherin and a-SMA were tested by Western blot.ResultsThere was obviously showing green fluorescence in Micro-122/T6 GV369 lenti viral vector, the nucleotide expressions of Micro-122、E-Cadherin in hepatic stellate cells transfected Micro-122/T6 GV369 lentiviral vector were higher than in control groups.But the expression of a-SMA was obvious down-regulation companying with two control groups,P<0.05. The result of Western blot was showed up-regulation of E-Cadherin but down-regulation of a-SMA in hepatic stellate cells transfected Micro-122/T6 GV369 lentiviral vector .there was statistical significanceP<0.05.ConclusionThe up-regulation expression of Micro-122 in hepatic stellate cells could inhibit its epithelial mesenchymal transition,which was a therapeutic target of hepatic fibrosis.
Micro-122; hepatic stellate cells; Hepatic fibrosis; Epithelial mesenchymal transition
R575.2
A
ISSN.2095-8242.2017.38.7327.03
福州市科技计划项目(NO.:2014-S-137-1,2014-S-137-5);福建省科技厅引导性项目(NO.:2015D002)
朱琪
本文编辑:吴玲丽
