马氏珠母贝生长性状相关QTL在两个群体中的验证
2017-11-01韦国建管云雁刘文广林坚士何毛贤
韦国建,管云雁,刘文广,林坚士,何毛贤
(1.中国科学院南海海洋研究所热带海洋生物资源与生态重点实验室广东省应用海洋生物学重点实验室,广东广州510301;2.中国科学院大学,北京100049)
马氏珠母贝生长性状相关QTL在两个群体中的验证
韦国建1,2,管云雁1,刘文广1,林坚士1,何毛贤1
(1.中国科学院南海海洋研究所热带海洋生物资源与生态重点实验室广东省应用海洋生物学重点实验室,广东广州510301;2.中国科学院大学,北京100049)
对两个通过遗传图谱构建定位的马氏珠母贝(Pinctada ucata)生长性状相关的QTL在两个不同群体中进行验证分析。结果显示:QTL471489在深圳群体中与壳高、壳宽显著相关(P<0.05),其CT基因型个体的壳高、壳宽和体质量显著大于CC基因型,CT为优势基因型;而在杂交群体中该QTL与生长性状关联不显著(P>0.05),但CT基因型的生长性状值仍最大。QTL410206在深圳群体中与生长性状关联不显著(P>0.05),而在杂交群体中该QTL与壳高、壳长、壳宽和体质量显著相关(P<0.05),AA为优势基因型。基于这两个QTL在这2个群体中分别构建二倍型,发现在深圳群体中C1(CTAT)型和杂交群体中D1(CTAA)、D2(TTAA)、D3(CCAT)、D4(TTAT)、D5(CTAA)型对马氏珠母贝的生长最为有利,可作为优选的基因型组合。
马氏珠母贝;数量性状位点;生长性状;验证
水产养殖动物的大多数经济性状不仅由多个基因控制,而且容易受环境等因素的影响,如体质量、体长和生长率等,它们都是数量性状(Gje原drem et al,2010)。挖掘数量性状位点(Quantita原tive trait locus,QTL)的最终目的就是利用与目标经济性状紧密连锁的分子标记,通过对分子标记基因型的检测,就能获知目标基因的选择,发展分子标记辅助选择育种(Molecular marker-assistedse原lection,MAS),即实现基因型选择育种,从而促进对性状的遗传改良(Naish et al,2008)。MAS与传统的育种方法相比,它可以大大提高选择的效率和可靠性(Ozaki et al,2012),因此已成为遗传育种研究的主要发展方向。尽管国内外在水产养殖动物的遗传作图、QTL定位以及性状关联分析方面取得了较大的进展,但是基于QTL结果进行指导育种的研究还很少,其主要原因就是定位到的QTL很少被鉴定,这些QTL的真实性和通用性还不清楚,因而限制了其应用。因此对QTL定位结果进行验证和鉴定是实施MAS的重要前提(Yue,2014)。目前仅在牙鲆(Paralichthys olivaceus)(Fuji et al,2007,Wang et al,2014)、大西洋鲑鱼(Salmo salar)(Moen et al,2009;Tsai et al,2015)、虹鳟(On原corhynchus mykiss)(Wringe et al,2010;Baerwald et al,2011;Vallejo et al,2014)、尖吻鲈(Lates calcar原ifer)(Wang et al,2008)、大黄鱼(Larimichthyscrocea)(刘贤德等,2013)、镜鲤(Cyprinus carpio)(鲁翠云等,2012)等少数鱼类的抗病和生长标记进行了验证,并且MAS已经成功应用于牙鲆抗淋巴囊肿病(LD)(Fuji et al,2007)、大西洋鲑鱼抗传染性胰脏坏死症(IPN)(Moen et al,2009)、半滑舌鳎(Cynoglossus semilaevis)的早期性别鉴定(Chen et al,2008)、镜鲤优良性状的培育(孙效文等,2009)等。在海洋贝类中,还极少见有对QTL定位结果进行鉴定和应用的报道。
马氏珠母贝(Pinctada fucata)是世界上重要的海水珍珠生产贝类,具有极高的经济价值。与大多数水产养殖动物一样,目前马氏珠母贝的育种方法主要是基于表型的传统选择,为了提高其育种效率,有必要开展基因型选择育种研究。最近,Shi等(2014)利用2b-RAD测序技术构建了马氏珠母贝高密度遗传连锁图谱,定位到6个与壳长、铰合线长、体质量、珍珠层厚度相关的QTL。Li等(2014)利用RAD测序技术获得了马氏珠母贝1373个SNP标记,构建其高密度遗传连锁图谱,定位到与壳高、壳长、壳宽、绞合线等7个生长性状相关的QTL,其中定位到QTL471489与软体部重显著相关,QTL410206与壳长、总重和软体部重显著相关。但是这些QTL定位结果都是基于单个家系构建遗传连锁图谱获得的,而且样本量小,导致获得的QTL结果可能并不适用于其他家系或群体。鉴于育种的繁殖群体多为来源于大样本随机群体,因此将获得的QTL结果在不同遗传背景的群体中进行验证十分必要。目前,仅有少数QTL标记被验证(韦国建等,2015)。本研究用马氏珠母贝两个不同遗传背景的群体对其中的两个QTL标记(471489和410206)进行验证(Li et al,2014),评估QTL标记与生长性状的关联性,为开展基于马氏珠母贝QTL结果的分子标记辅助选择育种奠定基础。
1 材料与方法
1.1 实验群体
实验所用的验证分析群体为深圳群体和1个杂交群体(其亲本为深圳群体和湛江养殖群体)。其中深圳养殖群体为8月龄贝,杂交群体为2月龄贝,均养殖于深圳大鹏澳海区。从深圳养殖群体和杂交群体中分别随机抽样170只和118只。每只贝的壳高、壳长和壳宽用游标卡尺测量,精确到0.01mm;体质量用电子天平称量,精确到0.01 g。测量完成后活体取样,即从活体的贝中取下一小块的鳃组织置于90%乙醇,于-20益保存。
1.2 基因组DNA的提取和基因分型
使用DNA提取试剂盒(Hipure Universal DNA Kit)提取鳃组织的基因组DNA,相关操作参照试剂盒说明书。提取DNA后,于1.0%的琼脂糖凝胶电泳检测其完整性;并用紫外分光光度计检测其纯度及浓度。提取的DNA于–20益保存。
将获得的QTL标记(471489和410206)所在的短序列作为源序列(Li et al,2014),在已公布的马氏珠母贝基因组草图(http://marinegenomics.oist.jp/)和本实验已有的马氏珠母贝转录组数据库中进行Blast比对,找出与之匹配的序列。利用基质辅助激光解吸电离飞行时间质谱法(MALDI-TOF-MS)对QTL标记SNP进行基因分型,由北京华诺时代科技有限公司完成。
1.3 数据统计与分析
利用PIC_CALC软件计算QTL标记的多态信息含量(polymorphism content information,PIC)。利用PopGene1.3软件计算QTL在群体中期望杂合度(expected heterozygosity,He)和观测杂合度(observed heterozygosity,Ho),并进行哈迪-温伯格平衡(Hardy-Weinberg equilibrium,HWE)的检验。利用SPSS19.0软件中的一般线性模型(GLM)进行标记与生长性状的相关性分析,模型如下:Yij=怎+Gior Di+eij,其中Yij表示基因型为i的第j个个体的指标,怎表示群体均值,Gi表示第i种基因型的效应,Di表示第i种二倍型的效应,eij表示随机误差变量;基因型对应性状均值之间的差异用Duancan进行多重比较分析,显著性差异设为P<0.05。
2 结果
2.1 QTL标记的遗传参数
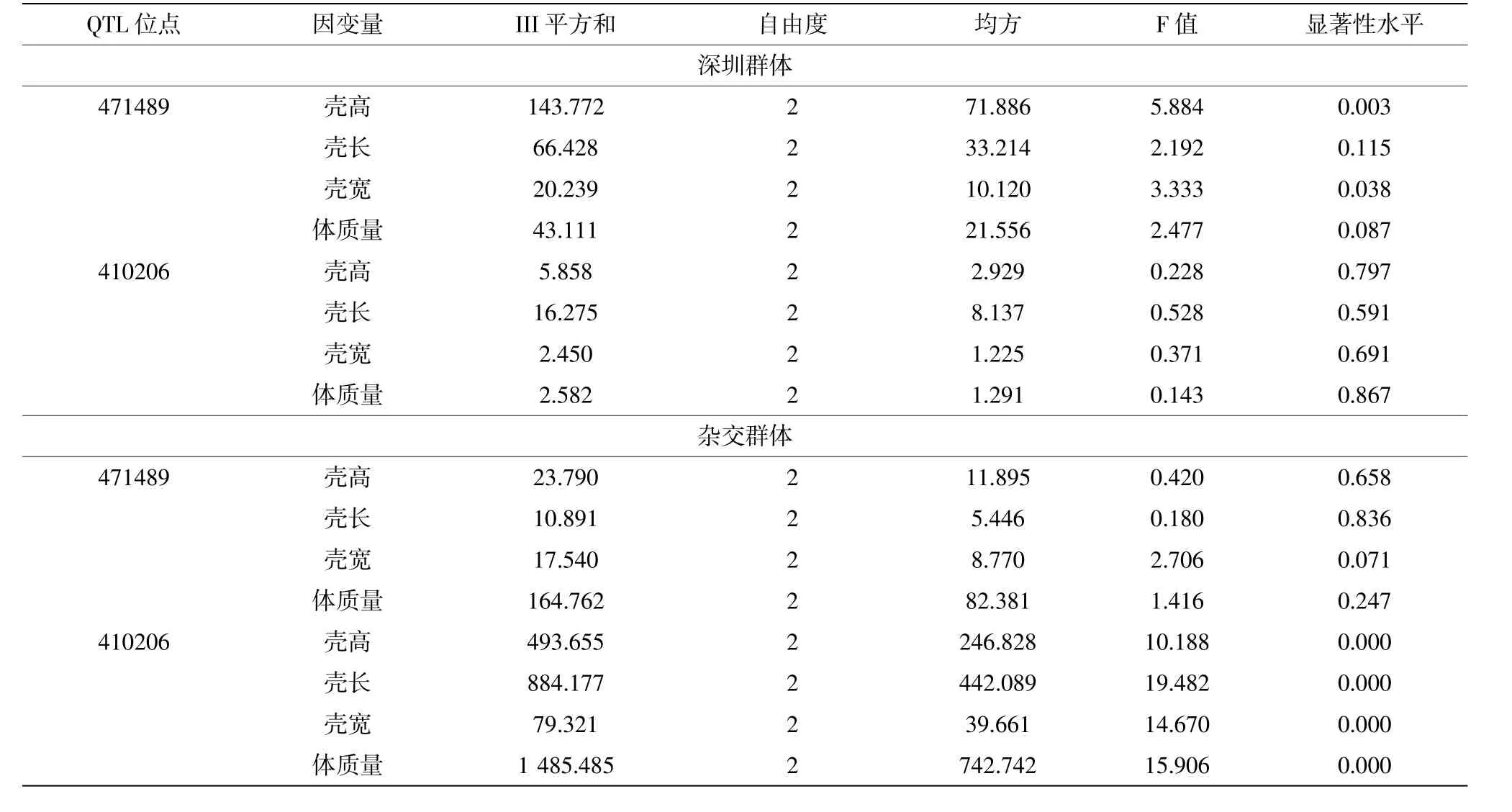
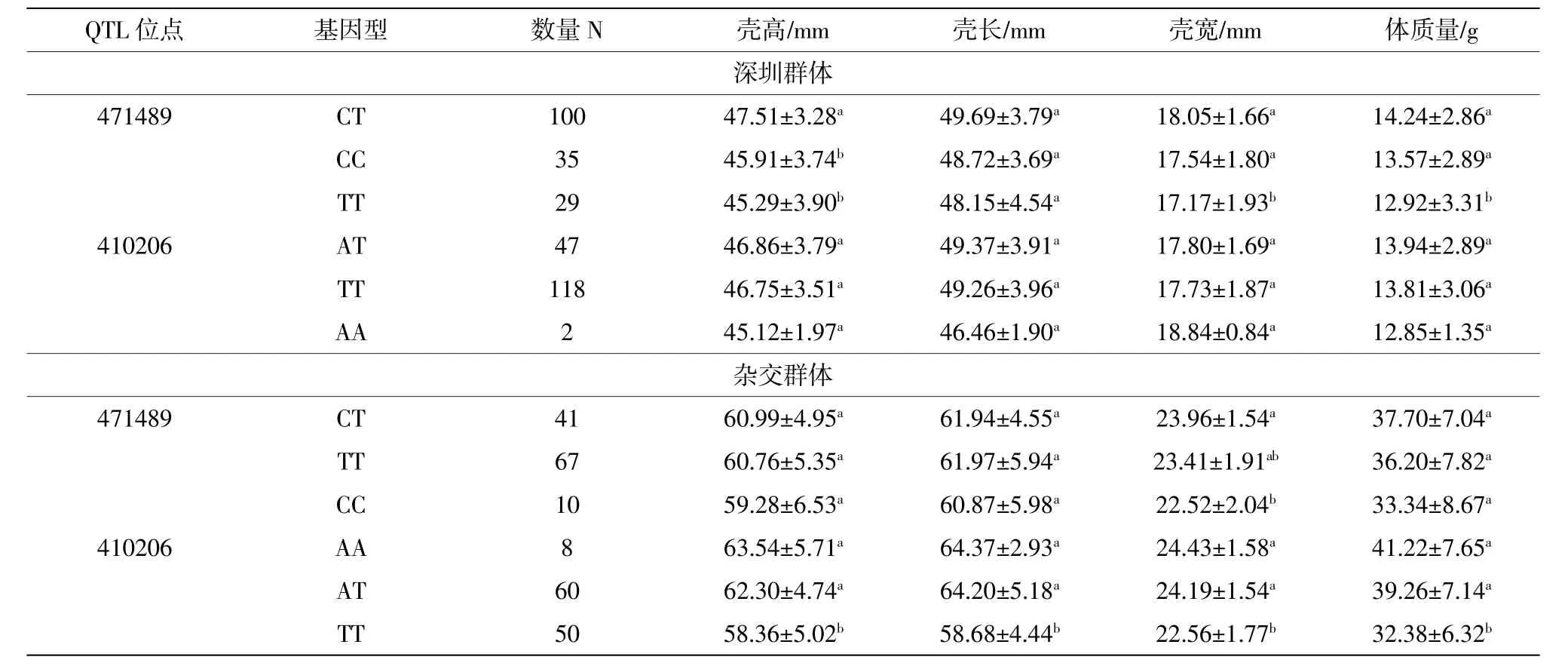
利用MALDI-TOF-MS法对深圳群体和杂交群体个体的QTL标记SNP进行了基因分型,将获得QTL471489和410206标记的基因分型数据,利用Popgene1.3软件和PIC_CALC软件分析这两个群体的2个QTL标记SNP的遗传多样性参数(见表1)。结果表明,QTL471489和410206标记在深圳群体中Ho和He分布区间分别为0.195 2~0.512 8和0.249 8~0.440 5,在杂交群体中Ho和He分布区间分别为0.283 1~0.613 5和0.252 4~0.500 1。根据中度多态性原则0.25 表1 QTL标记的遗传参数 生长性状分析表明,深圳群体和杂交群体的壳高、壳长、壳宽和总重均符合正态分布。经SPSS19.0软件的一般线性模型分析(GLM),QTL471489标记在深圳群体中与壳高、壳宽显著相关(P<0.05)(表2),基因型多重比较分析发现,CT基因型的个体在壳高、壳宽和体质量显著大于TT基因型,分别高出4.90%、5.13%和10.22%,CT为优势基因型(表3)。而在杂交群体中该QTL与生长性状关联不显著(P>0.05)(表2),但是经过不同基因型多重比较分析发现,CT基因型个体的生长性状均值仍最大,CT基因型的个体在壳宽显著大于CC基因型(表3)。 经过GLM模型分析,结果表明QTL410206标记在杂交群体中与壳高、壳长、壳宽和体质量显著相关(P<0.05)(表2);AA、AT基因型个体的壳高、壳长、壳宽和体质量显著高于TT基因,AA和AT基因型的生长性状值没有显著性差异,且AA基因型的生长性状值最大,AA为优势基因型,AA基因型个体在壳高、壳长、壳宽和体质量比TT基因型高出8.88%、9.70%、8.29%和27.30%(表3)。而在深圳群体中该QTL与生长性状关联不显著(P>0.05),AT基因型个体的生长性状值大于TT基因型。 表2 马氏珠母贝QTL标记与生长性状的GLM分析 表3 马氏珠母贝2个QTL标记不同基因型多重比较 为了进一步研究这两个QTL标记SNP与生长性状的作用,基于这两个QTL在这两个群体分别构建二倍型。经过SPSS19.0软件的GLM分析发现,这两个QTL标记在这两个群体中不存在交互作用(P>0.05)。但不同基因型在生长性状上差异显著,通过基因型多重比较分析发现,在深圳群体中二倍型C1(CTAT)个体在壳高、壳长、壳宽和体质量显著高于C6(TTAT)(P<0.05);在杂交群体中二倍型D1(CTAA)、D2(TTAA)、D3(CCAT)、D4(TTAT)、D5(CTAA)个体在壳高、壳长、壳宽和体质量显著大于二倍型D7(TTTT)、D8(CCTT)(P<0.05),二倍型D1、D2、D3、D4和D5的生长性状值没有显著差异(P>0.05)(表4)。 表4 QTL标记SNP二倍型与马氏珠母贝生长性状的关联分析 Andrew(2010)认为在一个理想的群体中各个等位基因应当是处于Hardy-Weinberg平衡状态,基因型的分布频率是稳定的,而且其杂合度之间的差异不显著。本研究中字2检验发现QTL471489标记在深圳群体和杂交群体中显著偏离了Hardy-Weinberg平衡状态。分析原因主要是由于人工选择和非随机交配等因素导致的(Waples et al,2015;Baird et al,2015)。QTL471489标记SNP的C等位基因频率在深圳群体为51.83%,而在杂交群体中的频率只有25.85%,这可能是由于人工选择育种造成的(Sun et al,2010)。 研究表明,QTL在不同的遗传背景、不同的养殖环境以及不同的发育时期中验证应该有不完全相同的结果。Baerwald等(2011)在虹鳟鱼(On原corhynchus mykiss)中定位到与眩晕症紧密连锁的QTL,在大样本的实验群体和验证家系中,获得了一个共同QTL区间位于染色体Omy9,家系间可解释的表型差异在50~86%间。Wang等(2008)用两个不同遗传背景的家系对尖吻鲈(Lates calcarifer)生长性状QTL进行验证,发现连锁群LG2上的QTL标记Lca371在两个家系中与体重具有显著的相关性,而其他QTL仅在一个家系表现出与性状的相关性。Laghari等(2013)定位到与鲤鱼(Cyprinus carpio)3个不同阶段体重相关的QTL,在第6连锁群上的1个QTL与3个阶段的体重都相关的QTL,而不同阶段也有特异的QTL存在。在本研究中,用两个不同遗传背景的马氏珠母贝群体对QTL471489和410206标记进行验证,发现QTL471489标记在深圳群体中与壳高、壳宽显著相关,CT为优势基因型;在杂交群体中与生长性状关联不显著,但CT基因型仍是生长性状值最大。QTL410206在杂交群体中与壳高、壳长、壳宽和体质量显著相关,而在深圳群体中与生长性状关联不显著,这可能是由于AA基因型频率过低,导致关联分析结果被低估或高估(Ferraz et al,2009)。这两个QTL标记在两个群体中验证的结果不一样的原因可能是由于不同遗传背景下QTL的等位基因频率不一样以及QTL间上位性效应的影响(Frankel et al,1996)。Mackay(2014)在用果蝇(Drosophila melanogaster)表型性状与基因间的相互作用时发现上位性效应对性状表型值具有重要的作用。本研究用到两个群体处于不同的发育阶段,也会影响QTL在群体中验证的结果。孙效文等(2009)认为同一物种但具有不同遗传背景的群体或家系应有不完全相同的QTL结果。因此,从已有的研究和本实验结果来看,影响QTL验证结果的因素是很多的、也很复杂,如遗传背景、发育阶段、群体数量、标记间的互作等等,要想筛选到一个能广泛应用的关联QTL标记,需进行大量的验证工作。 从本实验结果可以看到,这两个QTL标记均与多个生长性状相关,同时这两个标记位点又与同一生长性状相关,表现出一因多效或多因一效的现象,说明这些生长性状可能是由一个以上的QTL所控制的,该现象也符合QTL的定义(Liu et al,2004)。Li等(2014)定位到QTL471489标记与软体部质量显著相关,QTL410206标记与壳长、体质量和软体部质量显著相关。虽然有一些性状指标在该研究中没有检测,但在本研究中显著关联的性状仍与这篇文献的报道存在一定的差异。这是因为这些定位到的QTL一般是通过特定的小样本量家系作图获得的,获得的QTL结果可能不适合用于另外一个家系或群体。可见,对QTL定位结果进行验证十分必要。 单独的SNP位点进行性状的关联分析提供的信息往往是有限的。不同SNPs之间存在相互作用,因而通过2个或2个以上的SNP位点基因型组合可以提供更丰富的遗传信息来弥补单独SNP的缺陷(He et al,2008;He et al,2012)。Cong等(2014)的研究发现,太平洋牡蛎(Crassostrea gigas)IRR基因上的2个SNP标记构建的二倍型D3(GGTT)的生长性状表型值比其他二倍型大,对太平洋牡蛎的生长最为有利。在本研究中,基于这两个QTL标记在深圳群体和杂交群体中构建二倍型,发现在深圳群体中二倍型C1(CTAT)对马氏珠母贝生长最为有利,可作为优选的基因型组合;在杂交群体中二倍型D7(TTTT)、D8(CCTT)显著小于D1(CTAA)、D2(TTAA)、D3(CCAT)、D4(TTAT)和D5(CTAA)型,在选育过程中可以避免选择D7、D8型。这两个QTL的相互作用需要实验进一步验证。 致谢:本实验使用的马氏珠母贝材料在中国科学院大亚湾海洋生物综合试验站养殖培育。 Andrews C,2010.The Hardy-Weinberg Principle.Nature Education Knowledge,1(8):65. Baerwald M R,Petersen J L,Hedrick R P,et al,2011.A major effect quantitative trait locus for whirling disease resistance identified in rainbow trout(Oncorhynchusmykiss).Heredity,106(6):920-926. Baird S J E,2015.Exploring linkage disequilibrium.Molecular Ecology Resources,15(5):1017-1019. Chen S L,Deng S P,Ma h Y,et al,2008.Molecular marker-assisted sex control in half-smooth tongue sole(Cynoglossussemilaevis).Aquaculture,283(1):7-12. Cong R,Kong L,Yu H,et al,2014.Association between polymorphism in the insulin receptor-related receptor gene and growth traits in the Pacific oyster Crassostreagigas.Biochemical Systematics and Ecolo原gy,54(1):144-149. Ferraz J B S,Pinto L F B,Meirelles F V,et al,2009.Association of single nucleotide polymorphisms with carcass traits in Nellorecattle.Genet Mol Res,8(4),1360-1366. Frankel W N,Schork N J,1996.Who's afraid of epistasis?.Nature Genet-ics,14(4):371-373. Fuji K,Hasegawa O,Honda K,et al,2007.Marker-assisted breeding of a lymphocystisdisease-resistantJapaneseflounder(Paralichthysolivaceus).Aquaculture,272(1):291-295. Gjedrem T,Baranski M,2010.Selective breeding in aquaculture:an in-troduction.Springer Science&Business Media,155-159. He F,Wen H S,Dong S L,et al,2008.Identification of single nucleotide polymorphism cytochrome P450-c19a and its relation to reproduc-tive traits in Japanese flounder(Paralichthysolivaceus).Aquacul-ture,279(1):177-181. He X P,Xia J H,Wang C M,et al,2012.Significant associations of poly-morphisms in the prolactin gene with growth traits in Asian seabass(Latescalcarifer).Animal Genetics,43(2):233-236. Laghari M Y,Zhang Y,Lashari P,et al,2013.Quantitativetrait loci(QTL)associatedwithgrowthratetraitincommoncarp(Cyprinuscar-pio).AquacultureInternational,21(6):1 373-1 379. Li Y,He M,2014.Genetic mapping and QTL analysis of growth-related traits in Pinctadafucata using restriction-site associated DNA se-quencing.PLoS One,9(11):e111707. Liu Z J,Cordes J F,2004.DNA marker technologies and their applica-tions in aquaculture genetics.Aquaculture,238(1):1-37. Ma L,Qu Y J,Huai Y T,et al,2011.Polymorphisms identification and associations of KLF7 gene with cattle growth traits.Livestock Sci原ence,135(1):1-7. Mackay T F C,2014.Epistasis and quantitative traits:using model organ-isms to study gene-gene interactions.Nature Reviews Genetics,15(1):22-33. Moen T,Baranski M,Sonesson A K,et al,2009.Confirmation and finemapping of a major QTL for resistance to infectious pancreatic necrosis in Atlantic salmon(Salmosalar):population-level asso-ciations between markers and trait.BMC Genomics,10(1):368. NAISH K A,HARD J J,2008.Bridging the gap between the genotype and the phenotype:linking genetic variation,selection and adaptation in fishes.Fish and Fisheries,9(4):396-422. Ozaki A,Araki K,Okamoto H,et al,2012.Progress of DNA markerassisted breeding in mariculturedfinfish.Bulletin of Fisheries Research Agency,35(1):31-37. Shi Y H,Wang S,Gu Z F,et al,2014.High-density single nucleotide polymorphisms linkage and quantitative trait locus mapping of the pearl oyster,Pinctadafucatamartensii Dunker.Aquaculture,434(3):376-384. Sun J,Zhang C,Chen H,et al,2010.Two novel SNPs in coding region of the caprine Fat-inducing transcript gene and their association with growth traits.Molecular Biology Reports,37(1):485-490. Tsai H Y,Hamilton A,Guy D R,et al,2015.Verification of SNPs Associated with Growth Traits in Two Populations of Farmed Atlantic Salmon.International Journal of Molecular Sciences,17(1):5. Vallejo R L,Palti Y,Liu S,et al,2014.Validation of linked QTL for bacterial cold water disease resistance and spleen size on rainbow trout chromosome Omy19.Aquaculture,432(3):139-143. Wang C M,Lo L C,Feng F,et al,2008.Identification andverification of QTL associated with growth traits in twogenetic backgrounds of Barramundi(Latescalcarifer).Animal Genetics,39(1):34-39. Wang L,Fan C,Liu Y,et al,2014.A genome scan for quantitative trait loci associated with Vibrio anguillarum infection resistance in Japanese flounder(Paralichthysolivaceus)by bulked segregantan alysis.Marine Biotechnology,16(5):513-521. Waples R S,2015.Testing for Hardy-Weinberg proportions:have we lost the plot?.Journal of Heredity,106(1):esu062. Wringe B F,Devlin R H,Ferguson M M,et al,2010.Growth-related quantitativetraitlociindomesticandwildrainbowtrout(Oncorhynchusmykiss).BMC Genetics,11(1):63. Yue G H,2014.Recent advances of genome mapping and markerassisted selection in aquaculture.Fish and Fisheries,15(3):376-396. 刘贤德,隋班良,王志勇,等.2013.大黄鱼快长相关微卫星标记的筛选与验证.水生生物学报,37(6):1 036-1 043. 鲁翠云,曹顶臣,李超,等.2012.生长相关的微卫星标记在镜鲤繁殖群体中的验证.天津农学院学报,19(3):13-18. 孙效文,鲁翠云,曹顶臣,等.2009.镜鲤体重相关分子标记与优良子代的筛选和培育.水产学报,33(2):177-181. 孙效文,鲁翠云,贾智英,等.2009.水产动物分子育种研究进展.中国水产科学,16(6):981-990. 韦国建,刘文广,林坚士,等.2015.马氏珠母贝两个与生长性状相关QTL的验证.海洋科学,39(11):13-19. Verification of QTL associated with growth traits in two populations of Pearl oyster Pinctada fucata WEI Guo-jian1,2,GUAN Yun-yan1,LIU Wen-guang1,LIN Jian-shi1,HE Mao-xian1 (1.CAS Key Laboratory of Tropical Marine Bio-resources and Ecology,Guangdong Provincial Key Laboratory of Applied Marine Biology,South China SeaInstitute of Oceanology,Chinese Academy of Sciences,Guangzhou 510301,China;2.University of Chinese Academy of Sciences,Beijing 100049,China) Quantitative trait loci(QTL)affecting growth traits have been mapped in genetic map of Pinctadafucata.In this study,two of these QTL were verified in two populations with the different genetic backgrounds.The results showed that the QTL471489 was significantly associated with shell height and shell width in Shenzhen population(P<0.05),and oysters with genotype CT were bigger than those with the genotype TT in shell height,shell width and body mass,CT was the superior genotype.However,it was not significantly associated with growth traits in cross-population(P>0.05),and CT was still be the genotype with the maximal average of growth traits.QTL410206 was not significantly associated with growth traits in Shenzhen population(P>0.05),but it was significantly associated with shell height,shell length,shell width and body mass in cross-population(P<0.05),and AA was the superior genotype.Diplotypes were constructed based on the two QTLs,and association analyses revealed that C1(CTAT)in Shenzhen population and D1(CTAA),D2(TTAA),D3(CCAT),D4(TTAT)and D5(CTAA)in cross-population might be the most advantageous diplotypes for growth traits. Pinctadafucata;Quantitative trait locus(QTL);growth trait;verification Q341 A 1001原6932(圆园17)05原园547原07 10.11840/j.issn.1001-6392.2017.05.010 2015-09-12; 2016-11-07 广东省渔业科技与发展专项(Z2014014;Z2015014);广东省科技计划项目(2014B030301064)。 韦国建(1988-),硕士研究生,从事马氏珠母贝分子育种。电子邮箱:weiguojian2014@163.com。 何毛贤,博士,研究员,从事贝类遗传育种与分子生物学。电子邮箱:hmx@scsio.ac.cn。 (本文编辑:袁泽轶)
2.2 QTL标记与生长性状的关联分析
2.3 QTL标记SNP二倍型构建及与生长性状的关联分析

3 讨论
