孟鲁司特治疗儿童咳嗽变异性哮喘的临床研究
2017-11-01张鑫雨马莲美李晓梅李得志滨州医学院附属医院儿内科山东滨州256603
张鑫雨,马莲美,李晓梅,李得志(滨州医学院附属医院儿内科,山东滨州256603)
孟鲁司特治疗儿童咳嗽变异性哮喘的临床研究
张鑫雨*,马莲美,李晓梅,李得志(滨州医学院附属医院儿内科,山东滨州256603)
目的:探讨白三烯受体拮抗剂孟鲁司特治疗儿童咳嗽变异性哮喘对患儿炎症因子、气道解剖学和肺功能指标等的影响。方法:选取2010年4月-2015年8月我院收治的咳嗽变异性哮喘患儿86例,按照随机数字表法分为对照组与观察组,各43例。对照组患儿给予布地奈德气雾剂0.4 mg,bid;观察组患儿给予孟鲁司特钠咀嚼片,根据不同年龄选择不同剂量(2~6岁给予4 mg,tid;7~12岁给予5 mg,tid)。两组患儿均以4周为1个疗程,持续治疗2个疗程。检测两组患儿治疗前后的炎症因子水平、气道解剖学和肺功能指标,并观察不良反应发生情况。结果:治疗前,两组患儿上述各项指标比较,差异均无统计学意义(P>0.05)。与治疗前比较,治疗后两组患儿的白细胞介素4(IL-4)、IL-6、IL-8、肿瘤坏死因子α和超敏C反应蛋白水平均显著降低,气道壁厚度、基底膜厚度、气道壁厚度/外径比、气道壁总面积和气道壁总面积/气道总面积均显著减小,用力肺活量(FVC)、1 s用力呼气容量(FEV1)和FEV1/FVC均显著增大,最大呼气流速显著加快,且观察组各指标水平均显著优于对照组,差异均有统计学意义(P<0.05)。两组患儿的不良反应发生率比较,差异无统计学意义(P>0.05)。结论:孟鲁司特治疗儿童咳嗽变异性哮喘对改善患儿炎症反应、气道状态及肺功能的效果显著,且具有较高的安全性。
白三烯受体拮抗剂;孟鲁司特;儿童;咳嗽变异性哮喘;气道解剖学;炎症;肺功能
咳嗽变异性哮喘是临床上较为常见的一种呼吸道疾病,在儿童中具有较高的发病率[1]。该疾病是由多种因素引发的,除了患儿自身的免疫状态、遗传素质、内分泌状态、精神心理状态及健康状态外,病毒感染、变应原、气候、运动、药物及饮食等也是导致发病的重要因素[2]。由于咳嗽变异性哮喘的主要临床表现为咳嗽,临床特点不具备特异性,因而具有较高的误诊率[3]。59%~80%的儿童咳嗽变异性哮喘可发展为典型哮喘,故许多学者将咳嗽变异性哮喘认定为典型哮喘的前驱表现[4]。因此,对咳嗽变异性哮喘的及时诊断与有效治疗对预防哮喘的发生至关重要。目前,临床上治疗咳嗽变异性哮喘主要采用抗过敏药物、糖皮质激素、茶碱类及β2受体激动剂,短期内效果并不显著,而长期的疾病状态可严重损伤患儿的肺功能。白三烯受体拮抗剂是一类非甾体抗炎药,可对气道平滑肌中的白三烯多肽活性进行选择性抑制,从而抑制支气管痉挛发生及血管通透性增加,进而抑制炎症反应,最终达到抗哮喘、抗炎的目的[5]。本研究考察了白三烯受体拮抗剂孟鲁司特治疗儿童咳嗽变异性哮喘对患儿炎症因子、气道解剖学和肺功能指标等的影响,为临床治疗提供依据。
1 资料与方法
1.1 纳入与排除标准
纳入标准:(1)符合咳嗽变异性哮喘的诊断标准[6];(2)年龄2~14岁;(3)近1个月未接受过支气管扩张药物、糖皮质激素等药物治疗;(4)患儿监护人知情同意并签署知情同意书。
排除标准:(1)伴精神疾病者;(2)对本研究所用药物存在禁忌证者;(3)因其他慢性疾病引发咳嗽的患儿。
1.2 研究对象
本研究方案经医院医学伦理委员会审核通过后,选取2010年4月-2015年8月我院收治的咳嗽变异性哮喘患儿86例作为研究对象,按照随机数字表法分为对照组与观察组,各43例。其中,对照组患儿男性26例,女性17例;年龄2~12岁,平均年龄为(8.2±3.9)岁;病程2个月~1年,平均病程为(8.6±2.8)个月。观察组患儿男性28例,女性15例;年龄3~14岁,平均年龄为(8.3±4.2)岁;病程3个月~1年,平均病程为(8.9±2.7)个月。两组患儿的性别、年龄、病程等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
1.3 治疗方法
两组患儿在入院后均给予对症综合治疗,包括控制呼吸道感染、去除诱因、营养支持等。对照组患儿给予布地奈德气雾剂(鲁南贝特制药有限公司,批准文号:国药准字H20030987,规格:0.1 mg×200揿/瓶)0.4 mg,bid。观察组患儿给予孟鲁司特钠咀嚼片(四川大冢制药有限公司,批准文号:国药准字H20064828,规格:5 mg),根据不同年龄选择不同剂量:2~6岁给予4 mg,tid;7~12岁给予5 mg,tid。两组患儿均以4周为1个疗程,持续治疗2个疗程。
1.4 检测与观察指标
(1)检测两组患儿治疗前后的炎症因子水平。采集患儿当日清晨空腹血,采用酶联免疫吸附测定法检测白细胞介素4(Interleukin-4,IL-4)、IL-6、IL-8和肿瘤坏死因子α(Tumor necrosis factor-α,TNF-α)水平,采用化学发光法检测超敏C反应蛋白(Hypersensitive C-reactive protein,hs-CRP)水平。所用试剂盒均购自上海博麦德生物技术有限公司,所有操作均按试剂盒说明书进行。(2)检测两组患儿治疗前后气道解剖学指标水平。其中,气道壁厚度、气道壁厚度/外径比、气道壁总面积和气道壁总面积/气道总面积均采用德国西门子公司Somatom Emotion 16排高档螺旋CT进行检测;基底膜厚度采用苏木精-伊红(Hematoxylin-eosin,HE)染色法进行检测。(3)检测两组患儿的肺功能指标水平。采用日本Chest公司298型全自动肺功能检测仪检测用力肺活量(Forced vital capacity,FVC)、1 s用力呼气容量(Forced expiratory volume in 1 s,FEV1)、最大呼气峰流速(Peak expiratory flow,PEF)和FEV1/FVC。(4)观察两组患儿不良反应发生情况。
1.5 统计学方法
采用SPSS 20.0软件对数据进行统计分析。计量资料以±s表示,行t检验;计数资料以例数或率表示,行χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 两组患儿治疗前后炎症因子水平比较
治疗前,两组患儿各炎症因子水平比较,差异均无统计学意义(P>0.05)。与治疗前比较,治疗后两组患儿的IL-4、IL-6、IL-8、TNF-α和hs-CRP水平均显著降低,且观察组水平均显著低于对照组,差异均有统计学意义(P<0.05),详见表1。
表1 两组患儿治疗前后炎症因子水平比较(±s,n=43)Tab 1Comparison of inflammatory factor levels between 2 groups before and after treatment(±s,n=43)
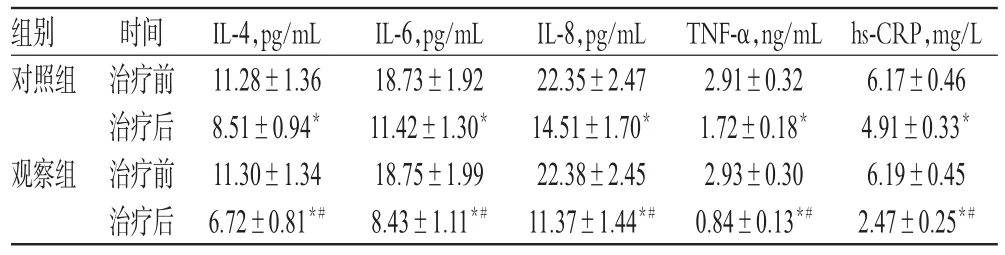
表1 两组患儿治疗前后炎症因子水平比较(±s,n=43)Tab 1Comparison of inflammatory factor levels between 2 groups before and after treatment(±s,n=43)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
hs-CRP,mg/L 6.17±0.46 4.91±0.33*6.19±0.45 2.47±0.25*#组别对照组观察组时间治疗前治疗后治疗前治疗后IL-4,pg/mL 11.28±1.36 8.51±0.94*11.30±1.34 6.72±0.81*#IL-6,pg/mL 18.73±1.92 11.42±1.30*18.75±1.99 8.43±1.11*#IL-8,pg/mL 22.35±2.47 14.51±1.70*22.38±2.45 11.37±1.44*#TNF-α,ng/mL 2.91±0.32 1.72±0.18*2.93±0.30 0.84±0.13*#
2.2 两组患儿治疗前后气道解剖学指标水平比较
治疗前,两组患儿各气道解剖学指标水平比较,差异均无统计学意义(P>0.05)。与治疗前比较,治疗后两组患儿的气道壁厚度、基底膜厚度、气道壁厚度/外径比、气道壁总面积和气道壁总面积/气道总面积均显著减小,且观察组水平均显著小于对照组,差异均有统计学意义(P<0.05),详见表2。
表2 两组患儿治疗前后气道解剖学指标水平比较(±s,n=43)Tab 2Comparison of airway anatomy indexes levels between 2 groups before and after treatment(±s,n=43)

表2 两组患儿治疗前后气道解剖学指标水平比较(±s,n=43)Tab 2Comparison of airway anatomy indexes levels between 2 groups before and after treatment(±s,n=43)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
气道壁总面积/气道总面积,%61.20±8.15 48.10±6.21*61.21±8.12 40.04±5.45*#组别对照组观察组时间治疗前治疗后治疗前治疗后气道壁厚度,mm 1.70±0.28 1.13±0.19*1.69±0.30 0.81±0.18*#基底膜厚度,mm 8.81±1.02 6.69±0.67*8.83±1.01 5.10±0.53*#气道壁厚度/外径比0.46±0.08 0.39±0.05*0.47±0.07 0.24±0.02*#气道壁总面积,mm2 7.88±1.14 5.11±0.93*7.90±1.12 3.44±0.81*#
2.3 两组患儿治疗前后肺功能指标水平比较
治疗前,两组患儿各肺功能指标水平比较,差异均无统计学意义(P>0.05)。与治疗前比较,治疗后两组患儿的FVC、FEV1和FEV1/FVC均显著增大,PEF显著加快,且观察组水平均显著大于或快于对照组,差异均有统计学意义(P<0.05),详见表3。
表3 两组患儿治疗前后肺功能指标水平比较(±s,n=43)Tab 3Comparison of lung function indexes levels between 2 groups before and after treatment(±s,n=43)

表3 两组患儿治疗前后肺功能指标水平比较(±s,n=43)Tab 3Comparison of lung function indexes levels between 2 groups before and after treatment(±s,n=43)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
FEV1/FVC,%79.25±5.32 85.58±6.50*79.27±5.30 90.60±7.13*#组别对照组观察组时间治疗前治疗后治疗前治疗后FVC,L 1.94±0.28 2.35±0.32*1.95±0.26 3.30±0.35*#FEV1,L 1.54±0.15 2.01±0.21*1.55±0.14 3.09±0.24*#PEF,L/s 1.19±0.17 1.52±0.21*1.15±0.18 2.01±0.28*#
2.4 不良反应
观察组患儿中出现2例轻微胃肠道反应、1例口腔念珠菌感染,不良反应发生率为6.98%(3/43);对照组患儿出现4例咽部不适、1例口腔念珠菌感染,不良反应发生率为11.63%(5/43)。两组患儿的不良反应发生率比较,差异无统计学意义(P>0.05),且不良反应经对症处理后均得以缓解。
3 讨论
咳嗽变异性哮喘是儿科常见的呼吸道疾病之一,多发生在凌晨或夜间,常表现为刺激性咳嗽,主要是由于慢性咳嗽久治不愈所引发,其病理改变为气道高反应性与持续气道炎症反应[7-8]。临床研究显示,咳嗽变异性哮喘患儿在发病时除了表现出基本症状咳嗽外,机体内多项指标也会受到较大的影响,其中以肺功能和气道结构相关指标的变化较为突出,表现出气道重塑及肺功能降低等,而这些变化给患儿的机体健康及生长发育带来了严重影响[9-12]。此外国内外多项研究证实,咳嗽变异性哮喘患儿多伴有炎症,以气道炎症反应为主,血清中的炎症因子水平呈现出异常变化,尤其以IL-4、IL-6、IL-8、TNF-α及hs-CRP的变化较为敏感[8,13-15]。因此,监测这些指标有助于了解咳嗽变异性哮喘患儿病情的发展情况。
孟鲁司特为新一代非甾体抗炎药,是一种白三烯受体拮抗剂,对治疗咳嗽变异性哮喘具有显著疗效[16]。该药主要是通过与白三烯进行竞争,阻滞白三烯与其受体结合,从而抑制机体出现的炎症反应,进而达到抗炎、抗哮喘的效果;同时,可有效控制哮喘持续症状,显著改善气道高反应,调控气道通气功能,有效抑制由于运动、二氧化硫和冷空气等刺激或者因多种变应原所引发的迟发性和速发性炎症反应[17-18]。孟鲁司特还能降低患儿支气管上皮的敏感性,降低其咳嗽的频率,使患儿接受全身性糖皮质激素治疗的概率显著降低;在有效控制机体症状的同时,减少了糖皮质激素的吸入量[19]。本研究结果显示,与治疗前比较,治疗后两组患儿的IL-4、IL-6、IL-8、TNF-α和hs-CRP水平均显著降低,气道壁厚度、基底膜厚度、气道壁厚度/外径比、气道壁总面积和气道壁总面积/气道总面积均显著减小,FVC、FEV1和FEV1/FVC均显著增大,PEF显著加快,且观察组各指标水平均显著优于对照组,差异均有统计学意义(P<0.05)。这提示孟鲁司特能够有效改善咳嗽变异性哮喘患儿的炎症反应、气道状态及肺功能,从而控制疾病进展。此外,两组患儿的不良反应发生率比较,差异无统计学意义(P>0.05),且所有不良反应经对症处理后均得以缓解,说明孟鲁司特治疗小儿咳嗽变异性哮喘具有较高的安全性。
综上所述,孟鲁司特治疗小儿咳嗽变异性哮喘对改善患儿炎症反应、气道状态及肺功能的效果显著,且具有较高的安全性。本研究的不足之处在于样本量较小,今后应扩大样本量进行深入研究。
[1]黄赞胜,马千里,廖秀清,等.咳嗽变异性哮喘临床特征及诊断初步研究[J/CD].中华哮喘杂志:电子版,2011,5(3):156-159.
[2]郭瑜修,覃大烈,李俊.舒利迭联合布地奈德、白三烯治疗儿童咳嗽变异性哮喘疗效观察[J].中国中西医结合儿科学,2015,7(5):491-494.
[3]张延伟.儿童咳嗽变异性哮喘误诊原因分析[J].中国实用医刊,2015,42(5):102-103.
[4]杨成刚.咳嗽变异性哮喘患儿尿LTE4水平与白三烯受体拮抗剂治疗反应的相关性[J].中国卫生标准管理,2014,5(20):114-115.
[5]张桂荣,白雪景,张艳梅,等.白三烯受体拮抗剂治疗咳嗽变异性哮喘[J].河北医药,2016,38(13):2054-2055.
[6]王幕狄.儿科学[M].5版.北京:人民卫生出版社,2002:286.
[7]吴海丽,李贤斌.气雾型布地奈德联合孟鲁司特钠治疗小儿咳嗽变异性哮喘疗效及对肺功能和血清炎症因子的影响[J].海南医学院学报,2016,22(5):467-469.
[8]Usta GB,Asilsoy S,Durmaz C.The assessment and management of chronic cough in children according to the British Thoracic Society guidelines:descriptive,prospective,clinical trial[J].Clin Respir J,2014,8(3):330-337.
[9]刘录,赵金凤.匹多莫德联合川芎嗪治疗小儿支气管哮喘的临床疗效观察[J].中国药房,2013,24(23):2189-2191.
[10]Niimi A,Ohbayashi H,Sagare H,et al.Cough variant and cough-predominant asthma are major causes of persistent cough:a multicenter study in Japan[J].J Asthma,2013,50(9):932-937.
[11]杨宇,刘明.阿奇霉素联合布地奈德雾化吸入对哮喘患者血浆炎症细胞因子和肺功能的影响[J].中国药房,2013,24(32):3008-3010.
[12]皮玉山,杨清峰.白三烯受体拮抗剂治疗咳嗽变异性哮喘临床分析[J].当代医学,2012,18(4):134-135.
[13]谈健民.孟鲁司特联合盐酸西替利嗪治疗儿童咳嗽变异性哮喘效果观察[J].西部医学,2011,23(11):50-51.
[14]Shimoda T,Obase Y,Kishikawa R,et al.The fractional exhaled nitric oxide and serum high sensinitric oxide and serum high sensitivity C-reactive protein levels in coughvariant asthma and typical bronchial asthma[J].Allergol Int,2013,62(2):251-257.
[15]杨皎莹,程静辉.孟鲁司特钠对咳嗽变异性哮喘患儿血清变态反应相关指标的影响研究[J].中外医疗,2014,33(4):27-28.
[16]刘磊.孟鲁司特与酮替芬治疗小儿咳嗽变异性哮喘的临床疗效分析[J].中国妇幼卫生杂志,2013,4(2):50.
[17]王秀娟,张磊.氯雷他定联合孟鲁司特治疗儿童咳嗽变异性哮喘的临床观察[J].中国校医,2013,27(5):396、封3.
[18]于兴梅,郝创利.儿童咳嗽变异性哮喘患者气道高反应的动态观察[J].中华医学杂志,2014,94(16):1215-1218.
[19]高明,任章平,谢彩,等.孟鲁司特钠治疗小儿咳嗽变异性哮喘的疗效分析[J].检验医学与临床,2014,11(21):3059-3060.
Clinical Study on Montelukast in the Treatment of Pediatric Cough Variant Asthma
ZHANG Xinyu,MA Lianmei,LI Xiaomei,LI Dezhi(Dept.of Pediatrics,the Affiliated Hospital of Binzhou Medical College,Shandong Binzhou 256603,China)
OBJECTIVE:To investigate the effects of leukotriene receptor antagonist montelukast on inflammatory factor,airway anatomy and lung function of children with cough variant asthma.METHODS:A total of 86 children with cough variant asthma selected from our hospital during Apr.2010 to Aug.2015 were divided into control group and observation group according to random number table,with 43 cases in each group.Control group was given Budesonide aerosol 0.4 mg,bid;observation group was given Montelukast sodium chewable tablets with different dose according to age(4 mg for 2-6 year-old,tid;5 mg for 7-12 year-old,tid).A treatment course of 2 groups lasted for 4 weeks,and both groups
2 courses of treatment.The levels of inflammatory factor,airway anatomy and lung function indexes were detected in 2 groups before and after treatment,and the occurrence of ADR was also observed.RESULTS:Before treatment,there was no statistical significance in above indexes between 2 groups(P>0.05).Compared to before treatment,the levels of IL-4,IL-6,IL-8,TNF-α and hs-CRP in 2 groups were decreased significantly after treatment;airway wall thickness,basement membrane thickness,airway wall thickness/outside diameter ratio,total area of airway wall,total area of airway wall/total area of airway were decreased significantly,while FVC,FEV1,FEV1/FVC,PEF were increased significantly;the indexes in observation group were significantly better than control group,with statistical significance(P<0.05).There was no statistical significance in the incidence of ADR between 2 groups(P>0.05).CONCLUSIONS:For pediatric cough variant asthma,montelukast can significantly improve inflammatory reaction,airway status and lung function with good safety.
Leukotriene receptor antagonist;Montelukast;Children;Cough variant asthma;Airway anatomy;Inflammation;Lung function
R256.12
A
1001-0408(2017)29-4103-04
DOI10.6039/j.issn.1001-0408.2017.29.19
*主治医师,硕士。研究方向:儿童呼吸内科疾病的诊治。电话:0543-3258671。E-mail:zhangxinyu1976@126.com
2016-10-24
2016-12-27)
