Mac-1基因缺失对黑色素瘤生长的影响
2017-11-01段有发叶志金王丽京章倩倩
陈 坚,段有发,叶志金,王丽京,章倩倩
(广东药科大学基础学院,血管生物学研究所,广州 510006)
研究报告
Mac-1基因缺失对黑色素瘤生长的影响
陈 坚,段有发,叶志金,王丽京,章倩倩*
(广东药科大学基础学院,血管生物学研究所,广州 510006)
目的探讨Mac-1缺失对黑色素瘤肿瘤生长的影响。方法Mac-1基因敲除(Mac-1-/-)小鼠扩群获得实验所需数量小鼠。设立对照组C57BL/6J小鼠和实验组Mac-1-/-小鼠,分别皮下注射B16-F10细胞,统计小鼠生存率、测量肿瘤体积和重量,通过免疫组化染色检测肿瘤细胞增殖及巨噬细胞浸润情况。结果Mac-1缺失后的黑色素瘤小鼠存活率较对照组C57BL/6J小鼠有显著性差异(P﹤0.001),肿瘤体积和重量较对照组C57BL/6J小鼠有显著性差异(P﹤0.001),肿瘤组织中增殖细胞数目与对照组相比较有显著性差异(P﹤0.01),并且肿瘤组织中巨噬细胞浸润显著减少。结论Mac-1基因缺失显著抑制黑色素瘤肿瘤生长。
Mac-1;黑色素瘤;肿瘤生长
表面受体整合素CD11b/CD18,又称为巨噬细胞抗原-1(macrophage associated antigen-1,Mac-1)、补体受体3(CR3)或αMβ2,在髓系来源白细胞上表达丰富并介导其关键的黏附运动[1,2]。研究表明Mac-1的表达与肿瘤进程有密切关系[3]。我们前期研究发现,Mac-1缺失会降低髓系细胞在肿瘤微环境的募集,进而减少肿瘤微环境中TNFα(tumor necrosis factor-α)含量,抑制Wnt/β-catenin信号通路,最终抑制肠道肿瘤的生长[4]。说明Mac-1可能在肿瘤的发生、发展过程中发挥重要的调控作用。恶性黑色素瘤是一种由黑色素细胞发展而来的恶性肿瘤,多发生于皮肤组织,也可发生于眼、肺、消化系统、中枢神经系统、淋巴结等其他组织[5]。黑色素瘤的治疗存活率普遍较低,寻找新的分子治疗靶点将有望推动黑色素瘤治疗的进展。目前Mac-1缺失对黑色素瘤生长的影响研究尚不明确,我们运用Mac-1基因敲除小鼠建立皮下移植瘤模型,研究Mac-1基因缺失对黑色素瘤发生发展的影响。为探讨Mac-1作为研究黑色素瘤治疗新靶点提供理论依据。
1 材料和方法
1.1实验动物
SPF级Mac-1敲除小鼠纯合子(Mac-1-/-),12只,雌性和雄性各6只,体重20~22 g,7周龄,购于美国Jackson实验室[B6.129S4-Itgamtm1Myd/J, stock No. 003991]。SPF级C57BL/6J小鼠(C57,雌性,体重20~22 g),23只,6~8周龄,广东省医学实验动物中心购买[SCXK(粤)2013-0002]。无菌手术在广东药科大学实验动物中心屏障环境内进行[SYXK(粤)2012-0125]。所有实验动物相关的操作均经过广东药科大学实验动物使用与管理委员会(ICUC)批准[批准号为:gdpulac2016]。
1.2细胞株
B16-F10黑色素瘤细胞株购于中科院上海生物化学与细胞生物学研究所,37℃贴壁培养在含有10%胎牛血清、100 U/mL青霉素和100 mg/L链霉素的DMEM高糖培养基中,待细胞处于指数生长期时进行实验。
1.3主要试剂与仪器
胎牛血清、胰蛋白酶和DMEM高糖培养基购自美国Gibco公司;Ki67抗体购自基因科技有限公司;CD68抗体购自Abcam公司;Omniscript® Reverse Transcription Kit购自Qiagen公司;QuantiTect® SYBR® Green PCR Kit购自Qiagen公司;独立通气笼IVC(苏杭科技器材有限公司);CO2培养箱(Thermo,美国)。
1.4实验方法
1.4.1 异体移植黑色素瘤模型建立
Mac-1-/-小鼠饲养于温度(25±3)℃,相对湿度40% ~60%,自动光控时间12 h明/12 h暗的SPF级环境中。Mac-1-/-小鼠(8~12周龄)以雄∶雌=1∶3的比例配种,共配两笼,母鼠怀孕后单独饲养,记录产仔日期和产仔数,3周龄时将仔鼠按照性别分笼饲养,并编号。
Mac-1-/-小鼠为实验组,C57小鼠为对照组,各22只,雌性,6周龄。取指数生长期B16细胞,胰酶消化后台盼蓝染色确定活细胞数95%以上,用无菌生理盐水将细胞稀释后每只小鼠右上肢腋下皮下接种1×105个细胞(0.2 mL)。
1.4.2 肿瘤体积及重量的测定
从细胞注射后第10天开始每组取10只小鼠,每天用游标卡尺测量肿瘤的长径(L)和短径(W)直至第17天,并按照公式统计肿瘤的体积V=0.5236×(L×W2)。第17天测量完毕将小鼠处死,剥离肿瘤并称重。
1.4.3 小鼠生存率统计
剩余小鼠每天观察生长生活情况,记录自然死亡时间统计小鼠生存率。
1.4.4 免疫组化染色
小鼠断颈处死并分离肿瘤组织,10%中性福尔马林固定过夜,石蜡包埋切片。4 μm厚切片脱蜡,脱水,并用10% BSA室温封闭30 min。一抗4℃孵育过夜,PBS洗三次,二抗室温孵育1 h,DAB显色,苏木素复染。然后在显微镜下观察拍照。
1.4.5 实时荧光定量PCR检测Mac-1缺失对肿瘤组织中炎症因子表达的影响
剪取50 mg肿瘤组织,于研钵中加入液氮研磨至粉状,加1 mL Trizol,收集至1.5 mL离心管,静置5 min。加入0.2 mL氯仿混匀,13 000 r/min 4℃离心15 min,吸取上层水相,加0.5 mL异丙醇混匀,沉淀10 min。13 000 r/min 4℃离心10 min,弃上清,加1 mL 75%乙醇混匀,7500 r/min 4℃离心5 min,弃上清,20 μL DEPC水溶解,测定浓度。参考文献方法,用Omniscript® Reverse Transcription Kit反转录,QuantiTect® SYBR® Green PCR Kit进行扩增[6]。反转录反应条件为:37℃ 15 min,85℃ 5 s。荧光定量PCR扩增程序为95℃ 3 min,95℃ 7 s、57℃ 10 s、72℃ 15 s 40个循环。按照文献报道方法进行结果分析[7],并对炎症因子表达差异在2倍以上的进行统计分析。
1.5统计学方法

2 结果
2.1Mac-1-/-小鼠繁育结果
Mac-1-/-小鼠按照雄∶雌=1∶3比例配种,扩大种群,平均每只母鼠的窝产仔数为8只,共产仔50只。
2.2Mac-1基因敲除对黑色素瘤模型小鼠生存时间的影响
小鼠在接种B16肿瘤细胞后第7天观察到体表明显成瘤。成瘤后第10天开始,每天观察小鼠生活状态,并记录小鼠的死亡时间,绘制小鼠生存曲线图(见图1)。注射B16细胞后C57BL/6J小鼠在13周开始出现死亡,在第27周时死亡率达100%;而Mac-1-/-小鼠则在15周时出现死亡,36周时死亡率达100%。与对照组相比,实验组Mac-1-/-小鼠生存时间延长,差异有显著性(P< 0.001)。
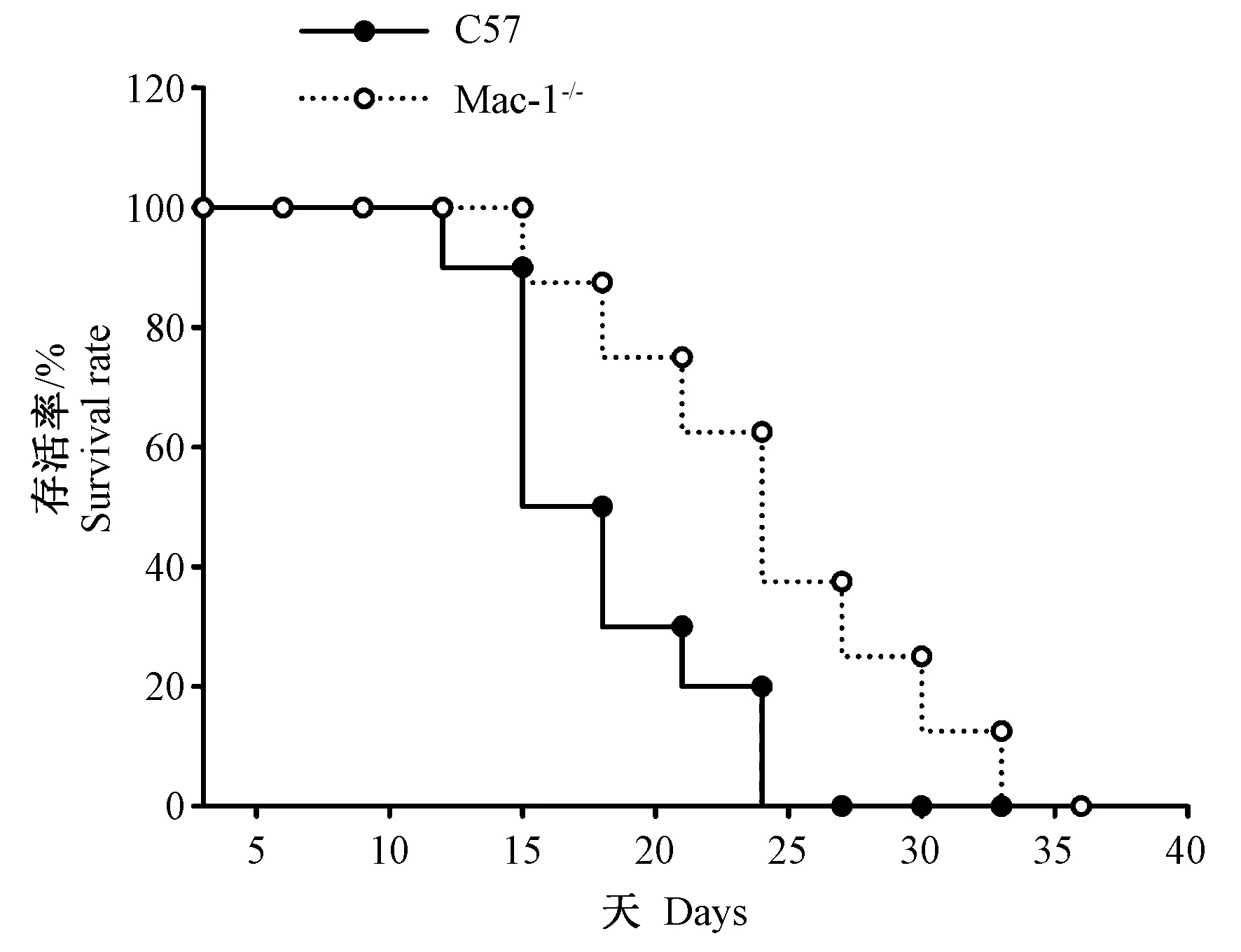
图1 皮下注射B16细胞后Mac-1-/-小鼠和C57BL/6J小鼠生存率(n=10)Fig.1 The survival rate of Mac-1-/- and C57BL/6J mice after subcutaneous injection of B16 cells
2.3Mac-1缺失对黑色素瘤生长的影响
分别在Mac-1敲除小鼠和C57小鼠右前肢皮下接种B16黑色素瘤细胞,10天后均形成可见瘤结节。成瘤后,每天测量移植瘤长、短径,计算体积,并绘制出移植瘤生长曲线(图2)。C57小鼠移植瘤生长较快,肿瘤体积由0.224 cm3增加到3.023 cm3;而Mac-1敲除小鼠移植瘤生长较缓慢,肿瘤体积由0.062 cm3仅增加到1.108 cm3。与C57小鼠移植瘤相比,Mac-1敲除小鼠移植瘤体积减小,差异有显著性(P<0.01)。
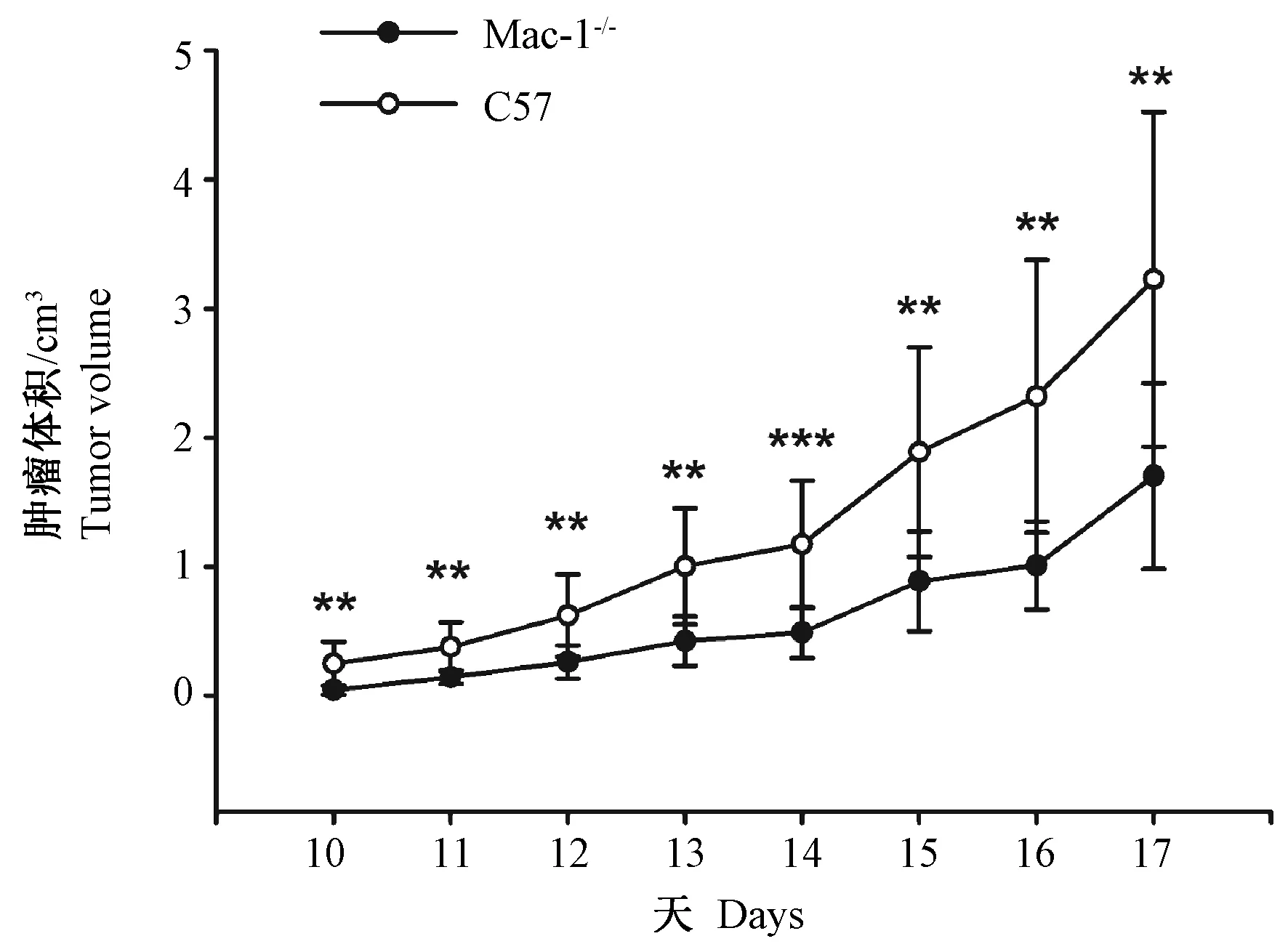
注:与C57组比较,** P< 0.01,***P< 0.001。图2 Mac-1敲除小鼠皮下移植黑色素瘤生长受到抑制(n=10)Note. Compared with the C57 group, ** P< 0.01,***P< 0.001.Fig.2 The tumor volume of Mac-1-/- mice was significantly inhibited compared with the C57BL/6J mice after subcutaneous injection of B16 cells
在接种肿瘤后第17天颈椎脱臼处死小鼠,剥取移植瘤称重。从图3可见,C57小鼠移植瘤生长较快,平均肿瘤重量为3.28 g,而Mac-1敲除小鼠移植瘤生长较慢,平均肿瘤重量仅为1.32 g。Mac-1敲除小鼠的肿瘤重量低于C57小鼠,差异有显著性(P< 0.001)。
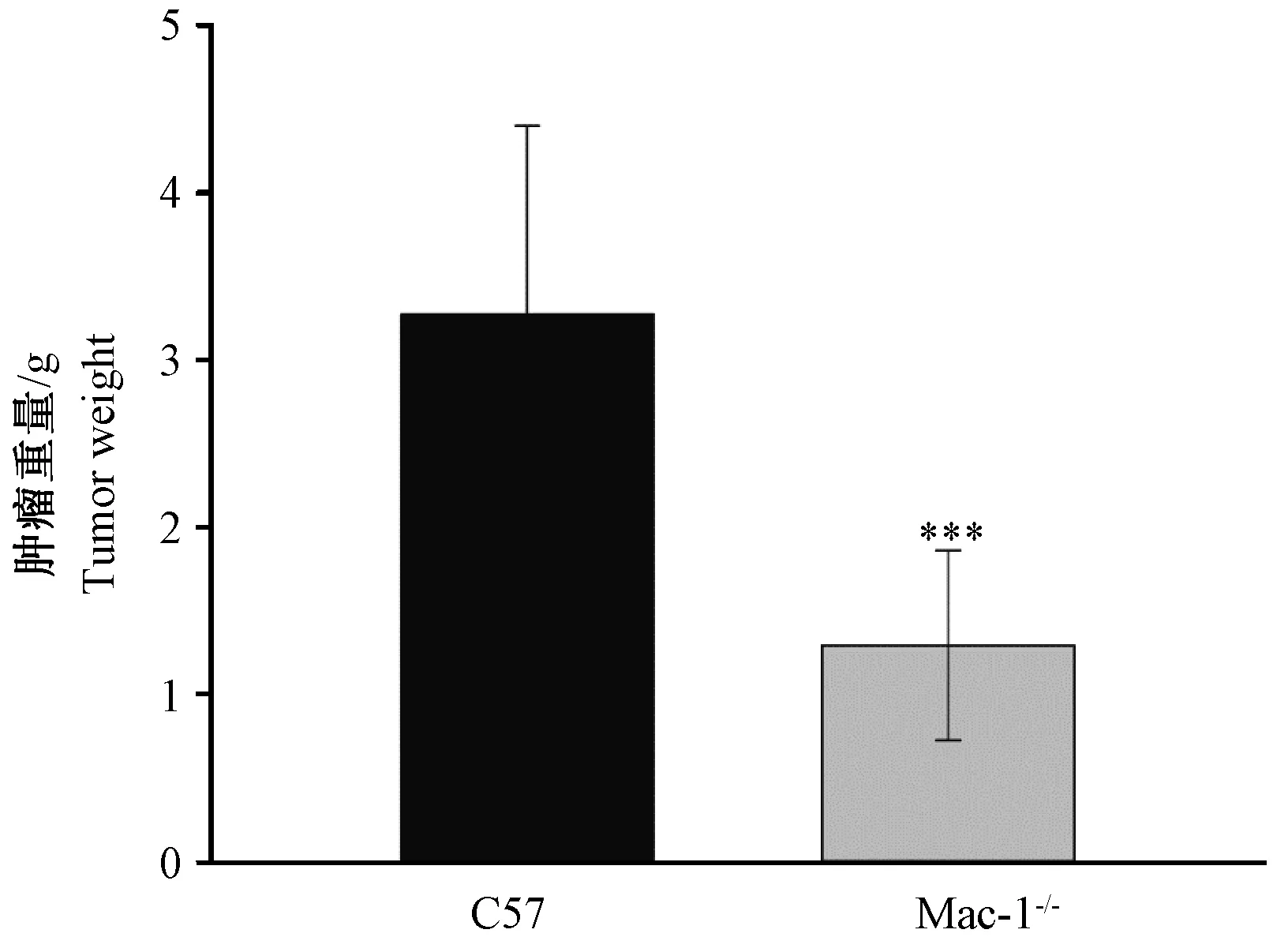
注:与C57组比较,***P< 0.001。图3 Mac-1敲除小鼠皮下移植黑色瘤的重量受到抑制(n=9)Note. Compared with the C57 group, ***P<0.001.Fig.3 The tumor weight of Mac-1-/- mice was the significantly inhibited compared with the C57BL/6J mice after subcutaneous injection of B16 cells
2.4Mac-1缺失对黑色素瘤肿瘤细胞增殖的影响
对肿瘤组织进行免疫组化染色,检测Mac-1缺失对肿瘤细胞增殖的影响。发现对照组小鼠肿瘤组织中,阳性染色的增殖细胞较多,而Mac-1缺失的小鼠肿瘤组织中,PCNA(proliferating cell nuclear antigen)阳性染色的增殖细胞较少。并且如图4统计结果显示,Mac-1缺失抑制小鼠肿瘤组织中肿瘤细胞的增殖,且差异有显著性(P< 0.01)。
2.5Mac-1缺失对肿瘤组织中巨噬细胞浸润的影响
肿瘤组织中通过对巨噬细胞标志物CD68进行免疫组化染色。如图5显示,Mac-1缺失肿瘤组织中巨噬细胞的浸润数目较少,而C57对照组肿瘤组织中有大量巨噬细胞浸润。

注:与C57组比较,** P< 0.01。图4 Ki67免疫组化染色Note. Compared with the C57 group, ** P< 0.01.Fig.4 Immunohistological staining for Ki67 in the tumor tissues
2.6Mac-1缺失对肿瘤组织中细胞因子的影响
通过对两种小鼠肿瘤组织进行总RNA提取,通过real-time PCR检测白细胞分泌的验证相关细胞因子进行筛选,对表达有2倍差异以上的基因进行统计,发现Mac-1缺失后,皮下移植黑色素瘤内细胞因子CXCL9(Cxc chemokine ligand-9)表达上调18倍,IFN-γ(interferon-γ)表达上调8.5倍(图6)。
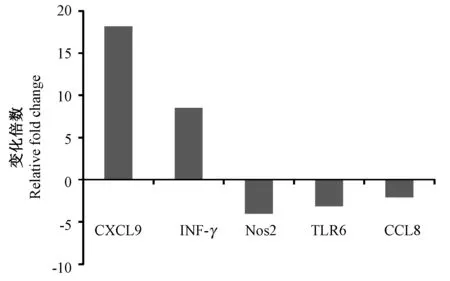
图6 细胞因子表达Fig.6 Cytokine expression in the tumor tissues
3 讨论
Mac-1是由α(CD11b)和β(CD18)两个亚基以非共价键的方式缔合而成的异二聚体,表达于白细胞表面参于机体防御及免疫反应的重要粘附分子,其主要影响白细胞粘附和迁移出内皮细胞或上皮细胞,到达炎症部位介导炎症反应[2]。Ahn等[8]证实抑制Mac-1的表达能减少白细胞在肿瘤微环境中的募集,减弱肿瘤的抗辐射能力。并且,Mac-1阳性白细胞大量分泌MMP9(matrix metalloproteinase-9)促进肿瘤血管新生[9]。Spicer等[10]发现中性粒细胞通过Mac-1/ICAM-1与肿瘤细胞黏附,协助肿瘤转移。我们前期研究表明,Mac-1阳性白细胞在结肠癌组织中大量浸润,缺失Mac-1能够抑制结肠癌肿瘤生长[4]。本研究应用Mac-1基因敲除小鼠建立移植瘤模型,探讨Mac-1缺失对恶性黑色素瘤肿瘤生长的影响。发现Mac-1缺失可以抑制黑色素瘤肿瘤生长及肿瘤细胞增殖,并且肿瘤微环境中巨噬细胞浸润数目减少。说明Mac-1缺失可能通过抑制肿瘤微环境中巨噬细胞浸润来抑制肿瘤的生长。
黑色素瘤是一种恶性程度较高的肿瘤,多发生于皮肤。其预后效果差,易转移的特点使得患者不能顺利地治愈。Li[11]团队最近发现抑制髓样细胞在肿瘤微环境中的募集能有效提高黑色素瘤免疫治疗。肿瘤的发展与髓样细胞的激活密切相关,其中肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)为肿瘤生长提供了所需的因子[12]。TAM是浸润在肿瘤组织中最多的白细胞,分泌多种炎症因子调节肿瘤的生长,因此我们主要检测肿瘤组织中巨噬细胞的浸润情况。根据巨噬细胞的活化类型及其在肿瘤微环境中的不同作用,TAM主要分为M1型和M2型巨噬细胞。IFN-γ刺激M1型巨噬细胞,诱导一氧化氮合酶和CXCL9等因子的表达,抑制肿瘤生长。而M2型巨噬细胞主要促进肿瘤生长。我们研究结果显示,Mac-1缺失后IFN-γ和CXCL9表达升高。同时Keane[13],Alshaker[14]等研究表明CXCL-9及IFN-γ能减弱血管生成和肿瘤生长。提示虽然肿瘤微环境中巨噬细胞浸润数目减少,但是可能是浸润的M2型巨噬细胞减少,而M1型巨噬细胞增多,抑制了肿瘤生长。对肿瘤具有杀伤作用的CD8+T细胞和NK细胞可以分泌IFN-γ,但是这两种白细胞在肿瘤组织中的浸润情况,以及IFN-γ升高是否由于这两种白细胞分泌尚不清楚,我们将进一步在今后的研究中深入探讨。
综上所述,Mac-1基因的缺失能够抑制黑色素瘤的生长,可能是通过促进IFN-γ分泌增加M1型、减少M2型巨噬细胞在肿瘤组织中浸润,促进CXCL9分泌,进而抑制抑制肿瘤生长。本研究对Mac-1作为临床治疗肿瘤靶点的开发具有重要理论指导意义。
[1] Sriramarao P, Languino LR, Altieri DC.Fibrinogen mediates leukocyte-endothelium bridging in vivo at low shear forces[J].Blood, 1996, 88(9): 3416-3423.
[2] Smith CW, Marlin SD, Rothlein R, et al. Cooperative interactions of LFA-1 and Mac-1 with intercellular adhesion molecule-1 in facilitating adherence and transendothelial migration of human neutrophils in vitro[J]. J Clin Invest, 1989, 83(6):2008-2017.
[3] Murdoch C, Muthana M, Coffelt SB, et al. The role of myeloid cells in the promotion of tumour angiogenesis[J].Nat Rev Cancer, 2008, 8(8): 618-631.
[4] Zhang QQ, Hu XW, Liu YL, et al. CD11b deficiency suppresses intestinal tumor growth by reducing myeloid cell recruitment[J]. Sci Rep, 2015,5:15948.
[5] Ravdel L, Robinson WA, Lewis K, et al.Metastatic melanoma in the breast: a report of 27 cases[J]. J Surg Oncol, 2006, 94(2): 101-104.
[6] 田雨光,王玉珏,庞炜,等.西藏小型猪IGF-1基因在不同生长发育阶段和不同组织器官中的差异表达[J].中国实验动物学报,2016, 24(6): 628-631.
[7] 马雨楠,游颖,沈欢欢,等. Noggin基因沉默对BMP和Wnt信号通路表达的影响[J].中国实验动物学报,2016, 24(5): 475-480.
[8] Ahn GO, Tseng D, Liao CH, et al. Inhibition of Mac-1 (CD11b/CD18) enhances tumor response to radiation by reducing myeloid cell recruitment[J].Proc Natl Acad Sci U S A, 2010,107(18):8363-8368.
[9] Yang L, DeBusk L, Fukuda K, et al. Expansion of myeloid immune suppressor Gr+CD11b+cells in tumor-bearing host directly promotes tumor angiogenesis[J]. Cancer Cell, 2004,6(4): 409-421.
[10] Spicer JD, McDonald B, Cools-Lartigue JJ, et al.Neutrophils promote liver metastasis via Mac-1-mediated interactions with circulating tumor cells[J]. Cancer Res, 2012,72(16):3919-3927.
[11] Shen L, Sundstedt A, Ciesielski M, et al.Tasquinimod modulates suppressive myeloid cells and enhances cancer immunotherapies in murine models[J]. Cancer Immunol Res, 2015, 3(2): 136-148.
[12] Pollard JW. Tumour-educated macrophages promote tumour progression and metastasis[J]. Nat Rev Cancer, 2004,4(1): 71-78.
[13] Keane MP,Belperio JA,Arenberg DA, et al. IFN-gamma-inducible protein-10 attenuates bleomycin-induced pulmonary fibrosis via inhibition of angiogenesis[J]. J Immunol, 1999, 163(10): 5686-5692.
[14] Alshaker HA, Matalka KZ. IFN-gamma, IL-17 and TGF-beta involvement in shaping the tumor microenvironment: The significance of modulating such cytokines in treating malignant solid tumors[J]. Cancer Cell Int, 2011, 11: 33.
EffectofMac-1deficiencyonthetumorgrowthofmelanomainmice
CHEN Jian, DUAN You-fa, YE Zhi-jin, WANG Li-jing, ZHANG Qian-qian*
(Institute of Vascular Biology, School of Basic Course, Guangdong Pharmaceutical University, Guangzhou 510006, China)
ObjectiveTo explore the influence ofMac-1 deficiency on tumor growth of melanoma.MethodsThe population ofMac-1 gene knock-out (Mac-1-/-) mice was expanded. B16-F10 cells were subcutaneously injected into the C57BL/6J mice (control group) andMac-1-/-mice (experiment group), respectively. Subsequently,the survival rate, tumor volume and body weight were recorded. The proliferation and infiltration of macrophages were detected by immunohistochemistry.ResultsThe survival rate ofMac-1-/-mice was significantly improved compared with the C57BL/6J mice (P﹤0.001). The tumor volume and body weight were remarkably decreased in theMac-1-/-mice compared with the control group (P﹤0.001). Meanwhile, the tumor cell proliferation index was decreased in theMac-1-/-mice compared with the control group (P﹤0.01).Furthermore, the infiltration of macrophages in the tumor tissues was also decreased in Mac-1-/-tumor mice compared with control group.ConclusionsMac-1 gene deletion can significantly suppress melanoma growth.
Mac-1; Melanoma; Tumor growth; Mice
R-33
A
1671-7856(2017) 10-0023-05
10.3969.j.issn.1671-7856. 2017.10.005
2016-12-16
国家自然科学基金(31712904);广东省科技计划(2015A030302083);广东省优秀青年教师培养计划(YQ2015100);广州市珠江科技新星(201610010045)。
陈坚(1993-),男,硕士研究生,研究方向:肿瘤药理,模式动物疾病模型。E-mail: chenjian_ivory@163.com
章倩倩(1981-),女,副研究员,研究方向:肿瘤药理,模式动物疾病模型。E-mail: vinny223@126.com
