电针对青春期慢性束缚应激模型大鼠不同时段血清TNF-α、IL-1β表达的影响*
2017-11-01俞秋云姜会梨赵冰骢杨昕婧梁星辰冯世醒
俞秋云,孙 岚,姜会梨,王 瑜,赵冰骢,杨昕婧,李 晶,梁星辰,孙 阳,李 想,冯世醒,施 鹏,图 娅△
(1.北京中医药大学针灸推拿学院精神神经疾患防治研究中心,北京100029;2.北京大学心理与认知科学学院,北京100871)
实验研究
电针对青春期慢性束缚应激模型大鼠不同时段血清TNF-α、IL-1β表达的影响*
俞秋云1,孙 岚2,姜会梨1,王 瑜1,赵冰骢1,杨昕婧1,李 晶1,梁星辰1,孙 阳1,李 想1,冯世醒1,施 鹏1,图 娅1△
(1.北京中医药大学针灸推拿学院精神神经疾患防治研究中心,北京100029;2.北京大学心理与认知科学学院,北京100871)
目的:观察电针干预对青春期慢性束缚应激模型(CRS)大鼠血清TNF-α(tumor necrosis factor alpha,TNF-α)、IL-1β(interleukin-1 beta,IL-1β)表达的影响,探讨与其相关的免疫学机制。方法:雄性5周龄SD大鼠60只,随机分为对照组、模型组和电针组,每组20只。对照组群养;采用孤养结合慢性束缚应激造模,每日束缚6 h(9:00—15:00);电针组每日应激前1 h给予电针刺激“百会”“印堂”穴,每天1次,每次20 min。以上3组同步平行干预28天,实验28天至35天,3组不作任何处理。以旷场试验评价抑郁模型大鼠行为学。采用Bio-Plex技术检测大鼠在第7、28和35天的血清中TNF-α、IL-1β表达水平。结果:行为学检测:实验0天,各组大鼠旷场行为总分无显著差异(P>0.05);实验28天,与模型组比较,电针组大鼠旷场行为总分有显著增加(P<0.01)。实验7天,与对照组比较,模型组TNF-α表达显著增加(P<0.01),IL-1β无显著差异(P>0.05);与模型组比较,电针组TNF-α表达显著降低(P<0.01)。实验28天,与对照组比较,模型组TNF-α和IL-1β表达显著增加(P<0.01);与模型组比较,电针组TNF-α和 IL-1β表达显著降低(P<0.01)。实验35天,3组之间TNF-α和IL-1β表达均无显著差异。结论:慢性束缚应激可诱导青春期大鼠血清TNF-α、IL-1β相应的表达升高和降低,而电针干预可显著对其进行调控,这可能是电针发挥抗抑郁作用的机制之一。
电针;青春期;慢性束缚应激;抑郁症;TNF-α;IL-1β
抑郁症在全球范围内有着很高的发病率,且有研究表明有46.4%的终身患病率,青春期是抑郁症高发的一个时段[1]。研究表明,抑郁症的起病与慢性、低程度的炎性反应有关[2]。炎症干扰已被确认为一个潜在的治疗包括抑郁症在内的精神疾病的靶点。针刺治疗抑郁症是已经被证实用于抑郁症疗效明确的一种治疗手段[3-4],实验研究证明针刺对抑郁模型大鼠血清和大脑中炎性细胞因子有调节作用[5]。
青春期是生长发育过程中的一个重要阶段,生理、心理和社会环境发生着巨大的改变,也是抑郁症高发的一个阶段[6],因抑郁症自杀的青少年人群发病率也在逐年攀升。目前针对青春期抑郁症主要集中在临床流行病学观察,针对青春期抑郁症的机制研究很少。青春期抑郁症有其生理的独特性,有研究表明青少年抑郁症患者治疗中使用抗抑郁药物有很高的转躁狂的风险[7-8],5-HT 再摄取抑制剂(SSRIS)类药物容易提高青少年自杀的风险[9]。对于青春期的抑郁症患者,在药物治疗之外,选择一个更为安全有效的治疗手段显得尤为必要。
本实验使用出生35天的雄性大鼠建立青春期慢性束缚应激模型,采用旷场实验来评价行为学,Bio-Plex技术检测血清中促炎性细胞因子TNF-α和IL-1β,探讨青春期抑郁模型大鼠体内炎性细胞因子不同时段的表达及针刺对其表达的影响。
1 材料
1.1 实验动物和分组
Sprague-Dawley(SD)大鼠,雄性,SPF级,5周龄,由北京维通利华实验动物有限公司提供,动物许可证编号:NO.SCXK(京)2012-0001。本实验动物均饲养于北京中医药大学动物实验室,温度:22℃ ~26℃,湿度:40% ±10%,自然昼夜节律。将60只SD大鼠随机分为对照组(Control group,C)、模型组(CRS group,CRS)和电针组(EA group,EA),每组20只。分别于实验第7天每组随机处死6只,第28天对照组、模型组、电针组各随机处死5、5、6只,第35天每组随机处死6只。以上3组同步平行实验持续35天,第1到27天各组干预如前,实验28天至35天,3组不作任何处理,自由饲养。
1.2 主要仪器和试剂
MILLIPLEX MAP Rat Cytokine/Chemokine Magnetic Bead Panel试剂盒(RECYTMAG-65K-0.4,Millipore公司);Bio-plex 100 system悬液芯片系统(Bio-rad公司);Bio-plex pro II wash station洗板机(Bio-rad公司);96孔板振荡器(Bio-rad公司);Shaking incubator振荡培养箱(Bio-rad公司);离心机(Eppendorf Centrifuge 5810R);水合氯醛(生产批号:30037517,上海)。
2 方法
2.1 动物模型制备和电针刺激方法
用慢性束缚应激结合孤养法建立抑郁大鼠模型[7]。将大鼠放入特制细铁丝网内,保持大鼠呼吸通畅,不压迫大鼠,仅使其活动受限,每天束缚6 h,束缚期间禁食禁水,造模结束后将被束缚的大鼠放回鼠笼,自由摄食摄水。电针组在每日应激之前1 h给予电针干预,针刺穴位参照《实验针灸学》[10]分别选取“百会”“印堂”穴,用30号1寸毫针(2.5 cm)平刺进针,然后接华佗SDZ-V型电针针疗仪,强度为1 mA,频率为2 Hz,每次电针20 min,每日1次。
2.2 旷场行为总分
观察各组大鼠在3 min内的运动总分,包括水平运动得分(为穿越格数)和垂直运动得分(为后肢直立次数),在每只大鼠测试完成后,进行酒精喷雾消毒处理,清除旷场内大鼠残留的气味,打扫旷场内排泄物。在实验前1天和实验第28天各测量1次。
2.3 检测指标与方法
采用Bio-Plex检测大鼠血清TNF-α、IL-1β的表达。以3.5 ml/Kg的10%水合氯醛腹腔注射麻醉大鼠后,于腹腔腹主动脉采血,静置后离心(4℃,3 000 rpm,15 min),取上清,-80℃保存。检测时严格按照Bio-Plex试剂盒(Bio-rad公司)说明书进行检测。
2.4 统计方法
3 结果
3.1 电针对慢性束缚应激模型大鼠行为学的影响
从表1、图1可见大鼠的旷场行为总分在实验前1天,各组之间没有显著性差异(P>0.05);实验28天,与模型组相比电针组大鼠的旷场行为总分有极显著差异(P <0.01)。

表1 应激0天、28天各组大鼠旷场行为总分的比较(M±Q)
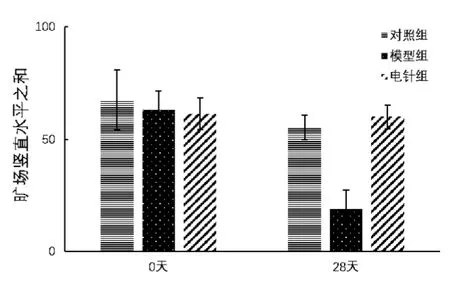
图1 各组大鼠旷场行为总分的比较
3.2 电针对慢性束缚应激模型大鼠血清TNF-α表达的影响
实验7天,与对照组比较,模型组TNF-α表达显著增加(P<0.01);与模型组比较,电针组TNF-α表达显著降低(P<0.01);实验28天,与对照组相比,模型组TNF-α表达显著增加(P<0.01);与模型组比较,电针组TNF-α表达显著降低(P<0.01);35天,3组大鼠之间TNF-α表达无显著差异(P>0.05)。见表2和图2。
表2 各组大鼠血清TNF-α表达的比较(±s,pg/ml)

表2 各组大鼠血清TNF-α表达的比较(±s,pg/ml)
注:与对照组相比,**P <0.01;与模型组相比,##P <0.01
组别 7天 28天 35天对照组(C)40.67 ±4.50 54.60 ±6.87 62.41 ±4.82模型组(CRS) 52.97 ±2.87** 71.70 ±10.15** 64.43 ±6.48电针组(EA) 43.65 ±4.70## 43.75 ±8.88## 57.60 ±2.40 F 14.667 14.004 3.126 P 0.000 0.001 0.073
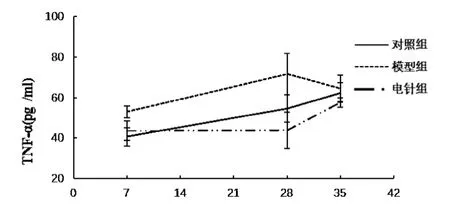
图2 各组大鼠血清TNF-α表达的比较(±s,pg/ml)
3.3 电针对慢性束缚应激模型大鼠血清IL-1β表达的影响
实验7天,3组大鼠之间IL-1β表达无显著差异(P>0.05);实验28天,与对照组相比,模型组IL-1β表达显著增加(P<0.01),电针组IL-1β表达无显著差异(P>0.05);与模型组相比,电针组IL-1β表达显著降低(P<0.01);35天,3组大鼠之间IL-1β表达无显著差异(P>0.05)。见表3、图3。
表3 各组大鼠血清IL-1β表达的比较(±s,pg/ml)

表3 各组大鼠血清IL-1β表达的比较(±s,pg/ml)
注:与对照组相比,**P <0.01;与模型组相比,##P <0.01
组别 7天 28天 35天61.33 ±11.60 60.71 ±15.77 116.33 ±17.00模型组(CRS) 61.17 ±11.10 134.1 ±34.25** 103.50 ±9.50电针组(EA) 60.77 ±8.70 73.4 ±16.18## 114.32 ±21.36对照组(C)F 0.005 14.53 1.027 P 0.995 0.000 0.382

图3 各组大鼠血清IL-1β表达的比较(±s,pg/ml)
4 讨论
1999年Maes提出了“抑郁症的炎性应答系统模型”(inflammatory response model of depression),并提出了“抑郁症的细胞因子假说”[11]。此后研究者们从多个角度阐明这一假说。慢性束缚应激模型是一种可靠的抑郁症模型,现在被广泛运用于抑郁症的研究中[12-14]。
行为学结果采用旷场实验总分的评价,来反映实验动物自主行为[15-17]。在本实验中,青春期CRS大鼠经过28天的实验后,旷场行为总分明显减少,说明青春期CRS大鼠运动活性降低、对新环境的探索行为减少。而电针可以逆转这一行为学改变。实验中还观察到,28天旷场实验中模型组大鼠排尿排便次数增多,理毛次数增加;电针组排尿排便和理毛次数都减少。
啮齿类哺乳动物在青春期的行为学表现和人类的青春期极为相似。SD雄鼠在正常的发育过程中,雄鼠出生以后23~25天睾丸开始下降,30~35日龄进入阴囊,45~60天产生精子,60以后性成熟[18]。Laviola等人,将大鼠出生后21天到60天称为青春期,21天到34天称为青春期前或者少年期,35天到46天称为青春期中期,47天到60天称为青春期晚期[19-20]。本实验选用的是出生后35天的雄性大鼠,实验进行到28天以后,实验动物进入成年阶段。
本研究中发现,在青春期,大鼠血清中TNF-α呈缓慢上升的趋势,这种上升趋势持续到成年后;而IL-1β则呈现低水平的表达,当大鼠成年后,IL-1β呈现出上升趋势。
抑郁症的发生与细胞因子水平的变化关系密切。以往研究者认为人脑是免疫豁免器官,然而,随着研究的深入,研究者开始意识到细胞因子能作用于与抑郁症病理生理相关的伏隔核、杏仁核、海马及前额叶皮质等脑区,通过一系列途径和胞内信号转导系统,导致神经内分泌功能障碍、神经递质代谢障碍及神经可塑性异常等[21]。
炎性细胞因子中的TNF-α、IL-1β被称为促炎性细胞因子,是启动炎症反应的关键细胞因子[22]。抑郁症患者血清中TNF-α与IL-1β明显高于正常人[23],临床研究表明抑郁症患者血清TNF-α水平与汉密尔顿抑郁量表总分和焦虑/躯体化、绝望感因子正相关,并且TNF-α与阻滞因子显著正相关[24]。研究表明TNF-α与IL-1β具有协同作用,并且低剂量的TNF-α 可以诱导 IL-1β 的产生[25]。
本研究发现CRS在大鼠青春期可以上调IL-1β、TNF-α的表达。而电针对其的作用是可以降低CRS青春期大鼠IL-1β、TNF-α的表达。7天的慢性束缚应激对青春期大鼠血清IL-1β影响不明显,但是显著上调了TNF-α的表达水平;而28天的慢性束缚应激对二者都产生显著影响。电针都能对两种细胞因子产生调节作用。在本实验中,大鼠性成熟后撤去对大鼠的一切干预手段,电针组和模型组的血清中TNF-α和IL-1β都逐渐恢复到对照组水平。说明青春期受到了应激,在成年后会继续受到其困扰,这种后续影响与TNF-α、IL-1β 无关。
本研究提示大鼠在青春期IL-1β表达水平和成年有显著的差异,慢性束缚应激模型可以使前炎性细胞因子TNF-α、IL-1β升高,抑郁症的发生可能与细胞因子失衡有关,电针可以通过调节细胞因子发挥抗抑郁效应。青春期受到的刺激对成年后的影响不涉及TNF-α和IL-1β。
[1]Kessler RC,Berglund P,Demler O,et al.Lifetime Prevalence and Age-of-Onset Distributions of DSM-IV Disorders in the National Comorbidity Survey Replication[J].Arch Gen Psychiatry,2005(62):593-602
[2]Leonard B,Maes M.Mechanistic explanations how cell-mediated immune activation,inflammation and oxidative and nitrosative stress pathways and their sequels and concomitants play a role in the pathophysiology of unipolar depression[J].Neuroscience & Biobehavioral Reviews,2012,36(2):764
[3]马学红,杨秀岩,许珂,等.针刺联合西药治疗轻中度抑郁症患者88例临床观察[J].中医杂志,2014(6):493-496
[4]陈海东,杨秀岩,马学红,等.针刺联合盐酸帕罗西汀片治疗轻中度抑郁症临床研究[J].中国中医药信息杂志,2014(8):35-38
[5]金树英,户丽,包伍叶,等.针刺对慢性应激抑郁大鼠血清和脑炎性细胞因子的影响[J].针灸临床杂志,2014(5):57-60
[6]Garrison CZ,Jackson KL,Marsteller F,et al.A longitudinal study of depressive symptomatology in young adolescents[J].Journal of the A-merican Academy of Child & Adolescent Psychiatry,1990,29(29):581-585
[7]Joseph MF,Youngstrom EA,Soares JC.Antidepressant-coincident mania in children and adolescents treated with selective serotonin reuptake inhibitors[J].Future Neurology,2009,4(1):87
[8]Martin A,Young C,Leckman JF,et al.Age Effects on Antidepressant-Induced Manic Conversion[J].Archives of Pediatrics & Adolescent Medicine,2004,158(158):773-780
[9]Amitai M,Chen A,Weizman A,et al.SSRI-Induced Activation Syndrome in Children and Adolescents—What Is Next? [J].Current Treatment Options in Psychiatry,2015,2(1):1-10
[10]张露芬.实验针灸学[M].北京:化学工业出版社,2010:219
[11]Maes M.Evidence for an immune response in major depression:a review and hypothesis[J].Prog Neuro-Psychopharmacol Biol Psychiat,1995,19(1):11-38
[12]范少光,查宏斌,李小蕊,等.束缚应激小鼠血中产生的免疫抑制因子及其调节[J].科学通报,1989(20):1584-1587
[13]唐已婷,陈家旭.慢性束缚应激动物模型的研究进展(综述)[J].北京中医药大学学报,2002,25(1):25-28
[14]迟强,许鹏,卢山,等.慢性束缚应激动物模型生物学特性及相关机制研究进展[J].临床军医杂志,2013,41(12):1299-1301
[15]林晓春,李云鹏,卞艳芳,等.大鼠旷场实验指标检测及参考值的探讨[J].毒理学杂志,2010(3):224-225
[16]曾莉,张旻,卜碧涛.实验啮齿类动物行为学评估[J].神经损伤与功能重建,2008,3(5):352-356
[17]孙世光,王婧婧,李自发,等.旷场实验:昆明小鼠行为学评价方法的重测信度检验[J].中华行为医学与脑科学杂志,2010,19(12):1093-1095
[18]贺争鸣.动物管理与使用指南[M].北京:科学出版社,2016:131
[19]Laviola G,Macrì S,Morley-Fletcher S,et al.Risk-taking behavior in adolescent mice:psychobiological determinants and early epigenetic influence[J].Neuroscience & Biobehavioral Reviews,2003,27(1-2):19-31
[20]Adriani W,Macrì S,Pacifici R,et al.Peculiar Vulnerability to Nicotine Oral Self-administration in Mice during Early Adolescence[J].Neuropsychopharmacology,2002,27(2):212-224
[21]马柯,张洪秀,王广燕,等.TNF-α在抑郁症中的作用和机制研究[J].生命科学,2015 ,27(5):574-581
[22]黄满丽,许毅.抑郁症与细胞因子的研究进展[J].国际精神病学杂志,2012,39(1):14-17
[23]刘传新,韩莉莉,杨真真,等.抑郁症患者血清细胞因子水平及相关因素分析[J].中华行为医学与脑科学杂志,2014,23(9):801-804
[24]范长河,谢光荣,陈凤华,等.抑郁症患者血清炎症细胞因子和急性期反应蛋白水平及其意义[J].中国神经精神疾病杂志,2000,26(5):272-275
[25]孙卫民,王惠琴.细胞因子研究方法学[M].北京:人民卫生出版社,2000:494-539
Impact of Electro-acupuncture on Pubescent CRS Rats:Expressions of TNF-α and IL-1β at Different Time-points
YU Qiu-yun1,SUN Lan2,JIANG Hui-li1,WANG Yu1,ZHAO Bing-cong1,YANG Xin-jing1,LI Jing1,LIANG Xing-chen1,SUN Yang1,LI Xiang1,FENG Shi-xing1,SHI Peng1,TU Ya1△
(1.Mental Disorder Control Center,School of Acupuncture and Tuina,Beijing University of Chinese Medicine,Beijing 100029,China;2.School of Psycology and Congnitive Science,Peking University,Beijing 100871,China)
Objective:To investigate the antidepressant effect of electro-acupuncture(EA)on the expressions of TNF-α and IL-1β in the pubescent rats with chronic restraint stress(CRS),and to explore the relative immune mechanism.Methods:60 SD rats(male,five weeks)were randomized into the blank control group(group A,n=20),the model group(group B,n=20),and the electro-acupuncture group(group C,n=20).The rats in group A were bred in groups;CRS models were established by separate breeding combined with chronic restraint stress(immobilization for 6h daily from 9:00 to 15:00);in group C,electro-acupuncture intervention was applied on point GV20 and point GV29 for 20mins one hour before the restraint,once daily for 28 days.From the 28th day to 35th day,there was no treatment application in the three groups.Open-field test was used to assess the behavior of the CRS rats.Serum levels of TNF-α and IL-1β were detected with Bio-Plex method on 7th,28th and 35th day respectively.Results:In terms of scores of the open-filed test,there was no significant difference in the three groups before the experiment;on 28th day,the scores of group C were remarkably increased compared to those of group B(P < 0.01).In terms of serum levels of TNF-α and IL-1β on 7th day,TNF-α level increased considerably in group B compared to that in group A(P <0.01),but there was no significant differences in IL-1β level between the two groups(P >0.05);compared to group B,TNF-α expression was down-regulated significantly in group C(P <0.01).On 28th day,levels of TNF-α and IL-1β increased significantly in group B compared to those in group A(P <0.01);however,they decreased obviously in group C when compared to group B(P <0.01).On 35th day,there were no significant differences in serum levels of TNF-α and IL-1β among the three groups(P >0.05).Conclusion:CRS can raise TNF-α level and reduce IL-1β level in pubescent rats,and electro-acupuncture can regulate these changes,which may contribute to its antidepressant effect.
Electro-acupuncture;Puberty;Chronic restraint stress;Depression;TNF-α;IL-1β
R245.97
A
1005-0779(2017)10-0056-04
国家自然科学基金,编号:81173334,81373729;北京中医药大学在读研究生项目,编号:2017-JYB-xs-047。
俞秋云(1992-),女,2015级针灸推拿专业硕士研究生。
△通讯作者:图娅(1955-),女,教授,博士研究生导师,研究方向:针灸经典理论的现代研究。
2017-04-18
