申克孢子丝菌酵母相对人THP⁃1巨噬细胞样细胞p38MAPK激活及白细胞介素6表达的影响
2017-11-01刘彩霞杜蕾蕾段志敏曾荣沈永年胡素泉刘维达陈青李岷
刘彩霞 杜蕾蕾 段志敏 曾荣 沈永年 胡素泉 刘维达 陈青 李岷
210042南京,中国医学科学院 北京协和医学院 皮肤病研究所真菌科(刘彩霞、杜蕾蕾、段志敏、曾荣、沈永年、胡素泉、刘维达、李岷);江苏省血液中心研究室(陈青)
申克孢子丝菌酵母相对人THP⁃1巨噬细胞样细胞p38MAPK激活及白细胞介素6表达的影响
刘彩霞 杜蕾蕾 段志敏 曾荣 沈永年 胡素泉 刘维达 陈青 李岷
210042南京,中国医学科学院 北京协和医学院 皮肤病研究所真菌科(刘彩霞、杜蕾蕾、段志敏、曾荣、沈永年、胡素泉、刘维达、李岷);江苏省血液中心研究室(陈青)
目的探讨申克孢子丝菌酵母相对人急性单核细胞白血病细胞(THP⁃1)巨噬细胞样细胞p38丝裂原活化蛋白激酶(p38MAPK)活化及白细胞介素6(IL⁃6)表达的影响。方法实时荧光定量反转录PCR分析申克孢子丝菌酵母相刺激THP⁃1巨噬细胞样细胞3、6 h后IL⁃6 mRNA表达水平变化,酶联免疫吸附法检测刺激24 h后IL⁃6分泌量;Western印迹法分析2×106CFU/ml申克孢子丝菌酵母相体外作用于THP⁃1巨噬细胞样细胞30 min和60 min后p38MAPK磷酸化水平的变化,同时检测100 nmol/L地塞米松(p38MAPK抑制剂)预处理THP⁃1巨噬细胞样细胞30 min后p38MAPK磷酸化水平及IL⁃6 mRNA表达水平的变化。采用SPSS19.0统计软件,进行多因素方差分析、单因素方差分析,组间多重比较采用LSD检验。结果刺激THP⁃1巨噬细胞样细胞3 h后,酵母相组、凝胶多糖组、空白对照组IL⁃6 mRNA表达水平分别为56.81±7.36、26.69±1.22、0.97±0.05,刺激6 h后分别为378.03±16.67、276.24±39.13、1.02±0.04,组间差异有统计学意义(F=5 552.22,P<0.001)。申克孢子丝菌酵母相刺激6 h后IL⁃6 mRNA表达高于刺激3 h后(q=16.74,P<0.001),申克孢子丝菌酵母相与THP⁃1巨噬细胞样细胞共孵育24 h后,酵母相组、凝胶多糖组及空白组细胞上清液中IL⁃6浓度分别为(59.96± 18.16)、(91.01± 17.27)、(5.50± 2.30)pg/L,组间差异有统计学意义(F=26.62,P<0.01);酵母相组高于空白对照组(P<0.01)。地塞米松处理后,酵母相组IL⁃6 mRNA表达水平(4.46±1.03)低于未用地塞米松处理组(493.52±113.87,P<0.001)。申克孢子丝菌酵母相作用THP⁃1巨噬细胞样细胞30、60 min后,磷酸化p38MAPK蛋白相对表达量均高于空白对照组(P<0.01)。地塞米松预处理THP⁃1巨噬细胞样细胞后,磷酸化p38MAPK水平低于未用地塞米松处理组,差异有统计学意义(q=10.81,P<0.01)。结论人THP⁃1巨噬细胞样细胞体外与申克孢子丝菌酵母相作用后,通过激活p38MAPK信号通路促进IL⁃6表达。
孢子丝菌属;巨噬细胞;白细胞介素6;p38丝裂原活化蛋白激酶类
作为一种致病性双相真菌,申克孢子丝菌(Sporothrix schenckii)室温下呈菌丝相,在感染部位转化为酵母相后可致病,引起皮肤黏膜、皮下组织及局部淋巴组织的感染,病重者可经血行或淋巴管播散至骨骼和内脏等,引起全身性系统感染,甚至危及生命[1]。宿主单核巨噬细胞能够识别并吞噬、杀伤、清除入侵的申克孢子丝菌,在机体抵抗申克孢子丝菌感染中发挥重要作用[2]。本研究旨在探讨申克孢子丝菌酵母相(简称酵母相)对人急性单核细胞白血病细胞(THP⁃1)巨噬细胞样细胞p38丝裂原活化蛋白激酶(p38MAPK)通路激活与白细胞介素6(IL⁃6)表达的影响。
材料和方法
一、主要试验材料
THP⁃1细胞株来自美国模式培养物集存库(American Type Culture Collection,ATCC)。申克孢子丝菌标准株CMCC(F)D1a由中国微生物菌种保藏管理委员会医学真菌中心提供。兔抗人p38MAPK、p38MAPK磷酸化蛋白(p⁃p38MAPK)和β肌动蛋白抗体(美国Cell Signaling Technology公司),IL⁃6酶联免疫吸附(ELISA)试剂盒(深圳欣博盛生物科技有限公司),反转录酶试剂盒(PrimeScript RT Master Mix)(日本TaKaRa公司),荧光定量PCR试剂盒(iTaq Universal SYBR Green Supermix)(美国Bio⁃rad公司),佛波酯、凝胶多糖(美国Sigma公司),地塞米松(美国Invivogen公司)。
二、试验方法
1.酵母相诱导:申克孢子丝菌接种至沙堡弱固体培养基25℃培养7 d,活化3次后转种于含2%葡萄糖的脑心浸液琼脂培养基37℃、5%CO2下培养,每14 d传代,观察菌落及革兰染色后显微镜下形态,至完全转化为酵母相后制备酵母相菌液,生理氯化钠溶液冲洗2遍,计数后配制成2×109菌落形成单位(CFU)/ml的菌悬液待用。
2.THP⁃1巨噬细胞样细胞培养:THP⁃1细胞用含10%胎牛血清、1%青链霉素的RPMI 1640培养基于37℃、5%CO2细胞培养箱中培养、传代。将细胞制备成2×105/ml细胞悬液,接种于12孔细胞培养板(每孔1 ml)及6孔细胞培养板(每孔2 ml),加入100 μg/L佛波酯刺激48 h诱导形成巨噬细胞待用。
3.酵母相对THP⁃1巨噬细胞样细胞IL⁃6表达水平的影响:将THP⁃1巨噬细胞样细胞与2×106CFU/ml酵母相(酵母相组)、100 mg/L IL⁃6阳性刺激物凝胶多糖(凝胶多糖组)或培养基(空白对照组)共培养,分别于培养3、6 h后检测IL⁃6 mRNA的表达。
根据预实验,酵母相刺激THP⁃1巨噬细胞样细胞后,ELISA检测到上清液IL⁃6含量明显升高,且刺激24 h后上清液IL⁃6含量达到最高。于共培养24 h时ELISA检测各组细胞上清液中IL⁃6的表达。
4.酵母相对THP⁃1巨噬细胞样细胞p38MAPK通路的影响:酵母相及凝胶多糖分别与THP⁃1巨噬细胞样细胞共培养30、60 min后检测p38MAPK蛋白及p⁃p38MAPK蛋白的表达水平。
5.地塞米松对酵母相刺激的THP⁃1巨噬细胞样细胞IL⁃6 mRNA表达及p38MAPK通路的影响:将酵母相、凝胶多糖分别与100 nmol/L地塞米松预处理30 min的THP⁃1巨噬细胞样细胞和未用地塞米松处理的THP⁃1巨噬细胞样细胞共培养30 min时检测各组p⁃p38MAPK的表达水平,培养6 h时检测各组IL⁃6 mRNA的表达水平。
6.实时荧光定量反转录PCR检测IL⁃6 mRNA的表达:TRIzol试剂盒抽提处理后THP⁃1总RNA,按反转录酶试剂盒说明书将总RNA反转录为cDNA,使用ABI 7300 PCR仪(美国ABI公司)对目的基因进行扩增。以β肌动蛋白作为内参照,IL⁃6及β肌动蛋白引物由生工生物工程(上海)股份有限公司合成,引物序列:IL⁃6:正向引物5′⁃TTCGGCAAATG TAGCATG⁃3′,反向引物5′⁃AATGGGCAAATGTAGC ATC⁃3′;β肌动蛋白:正向引物5′⁃TCTGGCACCACA CCTTCAT⁃3′,反向引物5′⁃AGGCATACAGGGACAG CAC⁃3′。PCR反应条件:95℃预变性10 min,95℃变性15 s,60℃退火30 s,72℃延伸30 s,循环数40。采用2-△△Ct法计算目的基因的变化水平,△Ct=目的基因-内参照(β肌动蛋白);△△Ct=样品△Ct-对照组△Ct。2-△△Ct值为实验组目的基因的表达较对照组目的基因表达的倍数。
7.Western印迹法检测p38MAPK蛋白及p⁃p38MAPK蛋白的表达:收集处理后的THP⁃1巨噬细胞样细胞,蛋白裂解液裂解细胞,提取总蛋白。用二喹啉甲酸定量法计算蛋白浓度,煮沸变性,SDS⁃聚丙烯酰胺凝胶电泳分离,湿转至聚偏二氟乙烯膜上。5%血清白蛋白(BSA)封闭2 h,兔抗人单克隆抗体4℃孵育过夜,辣根过氧化物酶标记的山羊抗兔IgG抗体孵育2 h,化学发光底物显色发光。实验至少重复3次取均值。
8.统计学处理:采用SPSS19.0统计软件,实验数据以±s表示,进行多因素方差分析、单因素方差分析,组间多重比较采用LSD、Dunnett及Bonferroni检验。P<0.05为差异有统计学意义。
结 果
一、酵母相对THP⁃1巨噬细胞样细胞IL⁃6 mRNA及IL⁃6表达水平的影响
见表1。刺激3 h和6 h后,酵母相组、凝胶多糖组、空白对照组IL⁃6 mRNA表达水平差异有统计学意义(F=5 552.22,P< 0.001)。刺激6 h后IL⁃6 mRNA表达与刺激3 h后之间差异有统计学意义(F=1 994.31,P< 0.001)。酵母相刺激后6 h IL⁃6 mRNA表达高于刺激后3 h(t=16.74,P<0.001)。
酵母相与THP⁃1巨噬细胞样细胞共孵育24 h后,酵母相组、凝胶多糖组及空白对照组的上清液中IL⁃6浓度差异有统计学意义(F=26.62,P<0.01)。酵母相组高于空白对照组,差异有统计学意义(q=4.59,P< 0.01)。
无论是否用地塞米松处理,酵母相组、凝胶多糖组及空白组之间IL-6 mRNA表达水平差异有统计学意义(F=19 893.26,P<0.001)。地塞米松处理的3组IL⁃6 mRNA表达水平与未用地塞米松处理的3组间差异有统计学意义(F=202.86,P<0.001);酵母相组地塞米松处理后IL⁃6 mRNA表达水平低于未用地塞米松处理组(q=10.42,P<0.001)。见表2。
表1 申克孢子丝菌酵母相对THP⁃1巨噬细胞样细胞IL⁃6 mRNA及分泌水平的影响(±s)
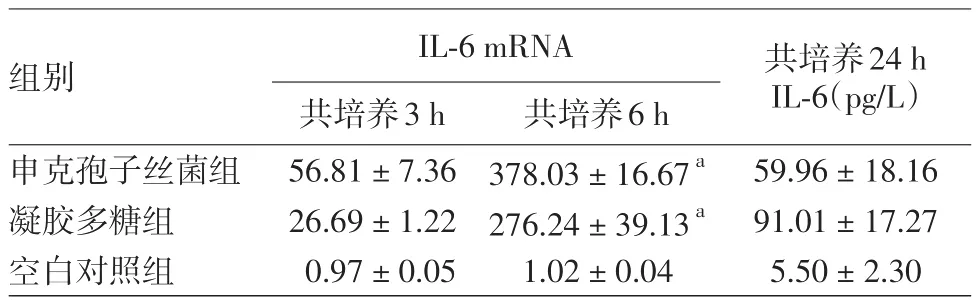
表1 申克孢子丝菌酵母相对THP⁃1巨噬细胞样细胞IL⁃6 mRNA及分泌水平的影响(±s)
注:n=3。a:与共培养后3 h比较,差异有统计学意义(P<0.01)
组别申克孢子丝菌组凝胶多糖组空白对照组IL⁃6 mRNA共培养3 h 56.81±7.36 26.69±1.22 0.97±0.05共培养6 h 378.03±16.67a 276.24±39.13a 1.02±0.04共培养24 h IL⁃6(pg/L)59.96±18.16 91.01±17.27 5.50±2.30
表2 地塞米松对申克孢子丝菌酵母相上调THP⁃1巨噬细胞样细胞IL⁃6 mRNA水平的影响(±s)

表2 地塞米松对申克孢子丝菌酵母相上调THP⁃1巨噬细胞样细胞IL⁃6 mRNA水平的影响(±s)
注:n=3。a:与空白对照组比较,P < 0.01;b:与未用地塞米松阻断组比较,P<0.01;c:与未用地塞米松阻断组比较,P<0.05
组别酵母相组凝胶多糖组空白对照组未用地塞米松阻断493.52±113.87a 274.12±15.44a 1.60±0.35地塞米松阻断4.46±1.03b 11.44±3.32c 1.04±0.24
二、酵母相对THP⁃1巨噬细胞样细胞p38MAPK通路的影响
见图1。刺激30 min后,酵母相组p⁃p38MAPK蛋白相对表达量为2.31±0.31,p38MAPK蛋白为1.14±0.09;刺激60 min后分别为2.19±0.06和1.12± 0.10。空白对照组(刺激0 min)p⁃p38MAPK蛋白、p38MAPK蛋白均为1.00。p⁃p38MAPK蛋白相对表达量组间差异有统计学意义(F=380.186,P<0.001),刺激30、60 min后酵母相组p⁃p38MAPK蛋白相对表达量高于空白对照组(q=6.75、6.13,均P<0.01)。p38MAPK蛋白相对表达量组间差异无统计学意义(F=0.07,P=0.81)。
地塞米松处理后,酵母相组p⁃p38MAPK蛋白相对表达量为2.29±0.37,空白对照组为1.13±0.04;未用地塞米松处理时,酵母相组p⁃p38MAPK蛋白相对表达量为4.55±0.46,空白对照组为1.00±0.00,组间差异有统计学意义(F=61.69,P<0.001)。地塞米松处理后酵母相组p⁃p38MAPK蛋白表达低于未用地塞米松处理酵母相组(q=10.81,P<0.01)。见图2。
讨 论
申克孢子丝菌在宿主体内和37℃培养时为酵母相,且孢子丝菌病患者的组织病理切片和电镜标本中仅见酵母相[3],故本研究选用酵母相为研究对象。THP⁃1细胞是一种人急性单核细胞白血病细胞,经PMA诱导可分化为成熟的巨噬细胞,常用于单核-巨噬细胞的功能研究,故本研究选用经PMA诱导的THP⁃1巨噬细胞样细胞作为细胞模型。

图1 申克孢子丝菌酵母相对THP⁃1巨噬细胞样细胞p38MAPK通路的影响 与空白对照组比较,申克孢子丝菌酵母相刺激30、60 min时磷酸化p38MAPK蛋白水平明显升高,而p38MAPK蛋白水平均无变化
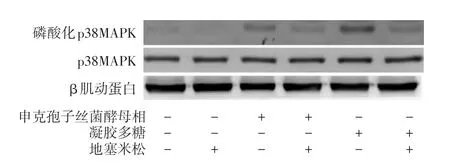
图2 地塞米松对申克孢子丝菌酵母相激活THP⁃1巨噬细胞样细胞p38MAPK通路的影响 地塞米松预处理后申克孢子丝菌酵母相诱导的磷酸化p38MAPK水平降低,p38MAPK蛋白水平无明显改变
以往研究显示,单核细胞、巨噬细胞等固有免疫细胞能快速识别、吞噬清除入侵机体的病原真菌并合成分泌IL⁃1β、IL⁃6、IL⁃12、IL⁃17、IL⁃22、肿瘤坏死因子(TNF⁃α)等多种细胞因子,在机体抵御申克孢子丝菌感染中发挥重要作用[4⁃11]。IL⁃6是一种多效性前炎症因子,通过诱导急性时相反应蛋白合成、增强吞噬细胞功能等发挥抗感染效应。IL⁃6可由几乎所有的基质细胞和免疫细胞分泌,而TNF⁃α、IL⁃1β能促进IL⁃6表达,表达过程受多种细胞信号通路调控[12]。IL⁃6可促进T淋巴细胞增殖、分化和生长,IL⁃6缺失严重影响固有免疫及适应性免疫的转换[13]。
本研究发现,酵母相刺激THP⁃1巨噬细胞样细胞后,IL⁃6 mRNA表达水平呈现时间依赖效应,刺激3 h后表达水平上升,6 h表达水平为3 h时的6.65倍。凝胶多糖是一种β⁃1,3-D-葡聚糖,被单核巨噬细胞表面受体C-型凝集素受体1(Dectin⁃1)识别后,激活细胞内信号通路,合成分泌多种细胞因子[14]。我们选用凝胶多糖作为激活THP⁃1巨噬细胞样细胞的阳性对照物,实验中诱导IL⁃6 mRNA表达与酵母相有相似的时间依赖性效应,刺激6 h后IL⁃6 mRNA水平比3 h时升高10.35倍。酵母相作用THP⁃1巨噬细胞样细胞24 h后,上清液中IL⁃6蛋白含量较空白对照组明显升高,表明酵母相不仅在mRNA水平诱导THP⁃1巨噬细胞样细胞上调IL⁃6转录,还在蛋白水平提高其分泌量。Sassá等[5]和de C Negrini等[10]用申克孢子丝菌脂类抗原刺激野生小鼠腹腔巨噬细胞或脾细胞,能诱发炎症反应,使IL⁃6、IL⁃1β等表达增加。
Romo⁃Lozano等[6]用酵母相刺激肥大细胞,通过激活ERK信号通路,诱导IL⁃6、TNF⁃α分泌,引发固有免疫反应。树突细胞受酵母相或外抗原100刺激后,IL⁃6、IL⁃12等表达增加[11]。角质形成细胞与酵母相或分生孢子共孵育后,IL⁃6、IL⁃8等细胞因子转录及翻译水平均明显升高[15]。本研究结果与上述研究一致,提示IL⁃6在抗申克孢子丝菌感染中发挥重要作用。
真菌入侵机体后,细胞因子的产生依赖于固有免疫细胞通过模式识别受体识别真菌表面病原体相关分子模式,活化下游信号通路MAPK等[16]。MAPK主要包括ERK、p38MAPK及c⁃Jun氨基末端激酶(JNK)几个亚族,广泛参与细胞增殖、分化、凋亡等多功能调控。既往研究发现,THP⁃1巨噬细胞样细胞通过活化p38MAPK信号通路并分泌TNF⁃α等细胞因子,参与抗念珠菌感染的免疫反应[17]。本研究中酵母相刺激THP⁃1巨噬细胞样细胞30 min和60 min后,p38MAPK磷酸化水平均升高,表明酵母相能够激活p38MAPK信号通路。
研究证明,100 nmol/L地塞米松能阻断p38MAPK信号通路并抑制IL⁃6等细胞因子的表达[18]。本研究中,100 nmol/L地塞米松预处理THP⁃1巨噬细胞样细胞后抑制了酵母相诱导的p38MAPK通路的磷酸化并使IL⁃6 mRNA表达明显降低,进一步证明100 nmol/L地塞米松可通过阻断p38MAPK通路影响下游IL⁃6的表达。但地塞米松为非特异性阻断剂,不能排除对实验的其他影响,为本研究的不足之处。
本研究结果表明,人THP⁃1巨噬细胞样细胞经酵母相刺激后激活p38MAPK信号通路并分泌IL⁃6,参与抗申克孢子丝菌固有免疫反应。
[1]López⁃Romero E,Reyes⁃Montes MR,Pérez⁃Torres A,et al.Sporothrix schenckiicomplex and sporotrichosis,an emerging health problem[J].Future Microbiol,2011,6(1):85⁃102.DOI:10.2217/fmb.10.157.
[2]Guzman⁃Beltran S,Perez⁃Torres A,Coronel⁃Cruz C,et al.Phagocytic receptors on macrophages distinguish between differentSporothrix schenckiimorphotypes[J].Microbes Infect,2012,14(12):1093⁃1101.DOI:10.1016/j.micinf.2012.06.001.
[3]Lopes⁃Bezerra LM,Schubach A,Costa RO.Sporothrix schenckiiand sporotrichosis[J].An Acad Bras Cienc,2006,78(2):293 ⁃308.DOI:/S0001⁃37652006000200009.
[4]Rivera A,Siracusa MC,Yap GS,et al.Innate cell communication kick⁃starts pathogen⁃specific immunity[J].Nat Immunol,2016,17(4):356⁃363.DOI:10.1038/ni.3375.
[5]Sassá MF,Ferreira LS,Ribeiro LC,et al.Immune response againstSporothrix schenckiiin TLR ⁃4 ⁃deficient mice[J].Mycopathologia,2012,174(1):21⁃30.DOI:10.1007/s11046⁃012⁃9523⁃1.
[6]Romo⁃Lozano Y,Hernández⁃Hernández F,Salinas E.Sporothrix schenckiiyeasts induce ERK pathway activation and secretion of IL⁃6 and TNF⁃α in rat mast cells,but no degranulation[J].Med Mycol,2014,52(8):862⁃868.DOI:10.1093/mmy/myu055.
[7]Franco DL,Nascimento RC,Ferreira KS,et al.Antibodies againstSporothrix schenckiienhance TNF⁃α production and killing by macrophages[J].Scand J Immunol,2012,75(2):142⁃146.DOI:10.1111/j.1365⁃3083.2011.02636.x.
[8]Ferreira LS,Gonçalves AC,Portuondo DL,et al.Optimal clearance ofSporothrix schenckiirequires an intact Th17 response in a mouse modelofsystemic infection [J].Immunobiology,2015,220(8):985 ⁃992.DOI:10.1016/j.imbio.2015.02.009.
[9]Negrini TC,Ferreira LS,Alegranci P,et al.Role of TLR⁃2 and fungal surface antigens on innate immune response againstSporothrix schenckii[J].Immunol Invest,2013,42(1):36 ⁃48.DOI:10.3109/08820139.2012.719982.
[10]de C Negrini T,Ferreira LS,Arthur RA,et al.Influence of TLR⁃2 in the immune response in the infection induced by fungusSporothrix schenckii[J].Immunol Invest,2014,43(4):370⁃390.DOI:10.3109/08820139.2013.879174.
[11]Verdan FF,Faleiros JC,Ferreira LS,et al.Dendritic cell are able to differentially recognizeSporothrix schenckiiantigens and promote Th1/Th17 responsein vitro[J].Immunobiology,2012,217(8):788⁃794.DOI:10.1016/j.imbio.2012.04.006.
[12]Hunter CA,Jones SA.IL⁃6 as a keystone cytokine in health and disease[J].Nat Immunol,2015,16(5):448⁃457.DOI:10.1038/ni.3153.
[13]Jones SA.Directing transition from innate to acquired immunity:defining a role for IL⁃6[J].J Immunol,2005,175(6):3463⁃3468.
[14]Tukulula M,Hayeshi R,Fonteh P,et al.Curdlan⁃conjugated PLGA nanoparticles possess macrophage stimulant activity and drug delivery capabilities[J].Pharmaceutical Research,2015,32(8):2713⁃2726.DOI:10.1007/s11095⁃015⁃1655⁃9.
[15]Li M,Liu ZH,Chen Q,et al.Insoluble beta⁃glucan from the cell wall ofCandida albicansinduces immune responses of human THP ⁃1 monocytes through Dectin ⁃1[J].Chin Med J(Engl),2009,122(5):496⁃501.
[16]Hontelez S,Sanecka A,Netea MG,et al.Molecular view on PRR cross⁃talk in antifungal immunity[J].Cell Microbiol,2012,14(4):467⁃474.DOI:10.1111/j.1462⁃5822.2012.01748.x.
[17]段志敏,杜蕾蕾,曾荣,等.白念珠菌对人急性单核细胞白血病细胞系产生肿瘤坏死因子α、活化信号分子p38MAPK的影响[J].中华皮肤科杂志,2015,48(8):535⁃538.DOI:10.3760/cma.j.issn.0412⁃4030.2015.08.004.
[18]Bhattacharyya S,Ratajczak CK,Vogt SK,et al.TAK1 targeting by glucocorticoids determines JNK and IkappaB regulation in Toll⁃like receptor⁃stimulated macrophages[J].Blood,2010,115(10):1921⁃1931.DOI:10.1182/blood⁃2009⁃06⁃224782.
Effects of the yeast form ofSporothrix schenckiion activation of p38MAPK and expression of interleukin⁃6 in human THP⁃1 macrophage⁃like cells
Liu Caixia,Du Leilei,Duan Zhimin,Zeng Rong,Shen Yongnian,Hu Suquan,Liu Weida,Chen Qing,Li Min
Department of Mycology,Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China(Liu CX,Du LL,Duan ZM,Zeng R,Shen YN,Hu SQ,Liu WD,Li M);Research Laboratory,Jiangsu Province Blood Center,Nanjing 210042,China(Chen Q)
s:Li Min,Email:drlimin@sina.cn;Chen Qing,Email:qngchen@hotmail.com
ObjectiveTo evaluate effects of the yeast form ofSporothrix schenckiion activation of p38 mitogen⁃activated protein kinase(p38MAPK)and expression of interleukin⁃6(IL⁃6)in macrophage⁃like THP⁃1 cells,which were differentiated from the human acute monocytic leukemia cell line THP⁃1.MethodsTHP⁃1 macrophage⁃like cells were divided into 3 groups to be treated with the yeast form ofSporothrix schenckiiat a concentration of 2 × 106colony⁃forming units(CFU)/ml(yeast form group),100 mg/L curdlan(curdlan group) and RPMI 1640 medium (blank control group) respectively.Real⁃time fluorescence⁃based quantitative PCR was performed to measure the mRNA expression of IL⁃6 in THP⁃1 macrophage⁃like cells in the above 3 groups after 3⁃and 6⁃hour treatment separately,and enzyme⁃linked immunosorbent assay(ELISA)to detect the level of IL⁃6 in the culture supernatant of THP⁃1 macrophage⁃like cells after 24⁃hour treatment.Western blot analysis was conducted to determine the protein expression of p38MAPK and phosphorylated p38MAPK(p⁃p38MAPK)in the above 3 groups after 30⁃and 60⁃minute treatment separately.Other THP⁃1 macrophage⁃like cells were pretreated with 100 nmol/L dexamethasone(a p38MAPK inhibitor)for 30 minutes,and then were divided into 3 groups to be treated with the yeast form ofSporothrix schenckii,curdlan and RPMI 1640 medium respectively,and changes in the level of p⁃p38MAPK and mRNA expression of IL⁃6 were also detected.Statistical analysis was carried out with SPSS19.0 software by using one⁃way or multi⁃way analysis of variance and least significant difference(LSD)test.ResultsSignificant differences in the mRNA expression of IL⁃6 in THP⁃1 macrophage⁃like cells were observed among the yeast form group,curdlan group and blank control group(F=5 552.22,P<0.001)after 3⁃hour treatment(56.81 ± 7.36,26.69 ± 1.22 and 0.97 ± 0.05,respectively)and 6⁃hour treatment(378.03± 16.67,276.24 ± 39.13 and 1.02 ± 0.04,respectively).Additionally,the yeast form group showed significantly higher mRNA expression of IL⁃6 after 6⁃hour treatment than that after 3⁃hour treatment(q=16.74,P< 0.001).After 24⁃hour treatment,the level of IL⁃6 in the culture supernatant of THP⁃1 macrophage⁃like cells also significantly differed among the yeast form group,curdlan group and blank control group(59.96±18.16 pg/L,91.01±17.27 pg/L,5.50±2.30 pg/L,respectively;F=26.62,P< 0.01),and was significantly higher in the yeast form group than in the blank control group(P< 0.01).After 30⁃and 60⁃minute treatment,the protein expression of p⁃p38MAPK was significantly higher in the yeast form group than in the blank control group(bothP< 0.01).Moreover,the mRNA expression of IL⁃6(4.46±1.03vs.493.52±113.87,P<0.001)and protein expression of p⁃p38MAPK(2.29±0.37vs.4.55±0.46,q=10.81,P< 0.01)were both significantly lower in the yeast form group with dexamethasone pretreatment than in that without dexamethasone pretreatment.ConclusionIn vitrotreatment with the yeast form ofSporothrix schenckiican enhance the expression of IL⁃6 in human THP⁃1 macrophage⁃like cells by activating the p38MAPK signaling pathway.
Sporothrix;Macrophages;Interleukin⁃6;p38 Mitogen⁃activated protein kinases
李岷,Emal:drlimin@sina.cn;陈青,Email:qngchen@hotmail.com
10.3760/cma.j.issn.0412⁃4030.2017.08.004
国家自然科学基金(81502739);江苏省自然科学基金(BK20150068);北京协和医学院协和青年基金(3332016108);北京协和医学院研究生创新基金(1002⁃01⁃18)
Fund programs:National Natural Science Foundation of China(81502739);Natural Science Foundation of Jiangsu Province of China(BK20150068);PUMC Youth Fund(3332016108);PUMC Innovation Fund(1002⁃01⁃18)
2016⁃09⁃13)
(本文编辑:颜艳)
