浮床栽培鱼腥草对吉富罗非鱼血清免疫因子的影响
2017-10-24胡庚东裘丽萍赵志祥范立民孟顺龙陈家长
郑 尧, 胡庚东, 裘丽萍, 赵志祥, 宋 超, 范立民, 孟顺龙, 徐 跑①, 陈家长,3②
(1.中国水产科学研究院淡水渔业研究中心/ 农业部长江下游渔业生态环境监测中心/农业部水产品质量安全环境因子风险评估实验室(无锡), 江苏 无锡 214081; 2.南京农业大学无锡渔业学院, 江苏 无锡 214081; 3.农业部水产品质量安全控制重点实验室, 北京 100141)
浮床栽培鱼腥草对吉富罗非鱼血清免疫因子的影响
郑 尧1,2, 胡庚东1, 裘丽萍1, 赵志祥2, 宋 超1, 范立民1, 孟顺龙1, 徐 跑1,2①, 陈家长1,2,3②
(1.中国水产科学研究院淡水渔业研究中心/ 农业部长江下游渔业生态环境监测中心/农业部水产品质量安全环境因子风险评估实验室(无锡), 江苏 无锡 214081; 2.南京农业大学无锡渔业学院, 江苏 无锡 214081; 3.农业部水产品质量安全控制重点实验室, 北京 100141)
为探究构建鱼腥草-罗非鱼共生体系能否对罗非鱼(Oreochromisniloticus)产生免疫增强效应,研究池塘中浮床栽培鱼腥草(Houttuyniacordata)(种植面积分别为0、5%、10%和15%)对不同免疫反应阶段吉富罗非鱼血清免疫因子的影响,测定免疫识别阶段免疫球蛋白(IgM)和表皮生长因子(EGF),炎症反应阶段相关因子干扰素-γ(IFN-γ)、白细胞介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)和白细胞介素-8(IL-8),以及效应阶段金属硫蛋白(MT)和转铁蛋白(TRF)等指标。结果表明,10%鱼腥草处理组吉富罗非鱼血清EGF、IL-8、IL-10、TNF-α和TRF含量显著高于其他处理组和对照组,5%鱼腥草处理组吉富罗非鱼血清IgM、IFN-γ含量显著高于其他处理组和对照组,且没有造成血清MT含量的降低。吉富罗非鱼养殖池塘种植鱼腥草(5%)能显著提高其不同免疫反应阶段血清免疫因子的活性。
生物浮床; 鱼腥草; 免疫因子; 吉富罗非鱼
吉富罗非鱼(Oreochromisniloticus)是1993年后在菲律宾利用尼罗罗非鱼的4个非洲品系和4个亚洲品系等广泛的优良种质资源选育而成的新品种,目前该品种已在海南、广东、广西、云南及苏北地区大量养殖,已被诸多学者作为试验鱼类使用[1]。水体富营养化指水体中N、P等营养盐含量过多而引起的水质污染现象[2],池塘养殖水体富营养化尤为严重,采用循环水和种植水上植物是水质净化最常见的方式之一[3-4]。近几年来,水上种植中草药已被广泛用于调控池塘水质和增强鱼类免疫能力,优点主要在于中草药能治疗(或预防)鱼类的单殖吸虫等疾病[5],且种植获得的中草药重金属污染小。鱼腥草(Houttuyniacordata)生长于阴湿处或山涧边,在中国中部、东南至西南部各省区有大量种植,研究表明浮床栽培鱼腥草不仅可以改善罗非鱼池塘水质指标,还可明显提高吉富罗非鱼非特异免疫能力。
在鱼类免疫反应中,胸腺和血液分别主要用于产生和运输淋巴细胞,其增殖过程会产生免疫因子介导免疫反应。免疫反应可分为免疫识别、细胞因子增殖和效应阶段。在免疫识别中,免疫球蛋白(immunoglobulin M,IgM)是鱼类适应性体液免疫应答中最主要的介质[6];表皮生长因子(epidermal growth factor,EGF)刺激胸腺再生,加快淋巴T/B及吞噬细胞的生成(吞噬病毒病菌和癌细胞),提高机体免疫功能[7]。炎症反应实质上是机体与促炎因子进行抗争的反映,炎症相关因子包括促炎因子(proinflammatory cytokines)和抗炎因子(antiinflammatory cytokines)。在炎症细胞因子增殖阶段,抗炎因子干扰素-γ(interferon γ,IFN-γ)和白细胞介素-10(interleukin-10,IL-10)分别在抗病毒感染、皮肤免疫和免疫功能调节中发挥重要作用[8],且后者是前者的抑制子[9]。促炎症因子中,肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)是一种能杀伤某些肿瘤细胞并使体内肿瘤组织发生坏死的因子[10],而白细胞介素-8(interleukin-8,IL-8)嗜中性粒细胞因子,是炎症性疾病的重要介质,在抗感染、免疫反应调节以及抗肿瘤方面有重要作用。研究表明虹鳟肠黏膜组织中存在能够合成IL-8、TNF-α和IFN-γ的功能细胞[11],用于抗菌、抗病毒等免疫反应中。在炎症反应效应阶段的诸多抗菌免疫因子中,金属硫蛋白(metallothionein,MT)能够调节机体必需重金属的稳态及对有害重金属进行解毒,并起氧化应激防护作用[12];转铁蛋白(transferrin,TRF)负责机体中Fe3+在吸收、储存和利用部位间的传递[13]。
针对鱼腥草-罗非鱼共生这一实例,探究种植鱼腥草后其对吉富罗非鱼血清不同免疫应答阶段几种免疫因子的影响,旨在从增强鱼类免疫角度为鱼腥草-罗非鱼共生体系的应用前景及推广提供数据支撑。
1 材料与方法
1.1 试验材料与设计
试验基地为中国水产科学研究院淡水渔业研究中心宜兴屺亭养殖基地。每口试验用池塘面积为1 333 m2,水深1.5 m,并配备微孔增氧系统。养殖品种为“新吉富”罗非鱼越冬种,平均投放规格为(42±2.1) g·尾-1,养殖密度为1 750尾·(667 m2)-1,同时搭配少量滤食性鲢(20尾·塘-1)、鳙(30尾·塘-1)。浮床植物选用鱼腥草,试验分4口塘进行种植,浮床面积占池塘面积比例分别为0、5%、10%和15%(图1)。试验于2015年5月开始,至10月结束。每天8:00定量投喂1次,饲料为天邦罗非鱼膨化料(编号5532、5533、5534、5536),饲料投喂量为鱼体质量的3%。养殖期间的病害防控及日常管理基本一致,除池塘水分渗漏、蒸发补水外,养殖过程中池塘不换水。
试验选用PVC管材料(φ=50 mm)制作浮床,规格为2 m×2 m。浮床两面分别用网孔为30 mm(便于鱼腥草扦插)的网片包裹。试验开始前,将预先培育好的鱼腥草苗(株高20 cm),按株距30 cm×行距20 cm进行扦插,种植前根茎和叶总质量在43~129 g·m-2之间,收割后根茎和叶总质量在173~519 g·m-2之间,浮床集中固定在池塘中排列整齐,每3个浮床用尼龙绳连接成组。
1.2 不同阶段几种免疫因子测定
试验结束后,从每个处理组中随机挑选30 尾鱼〔体质量(772.6±6.7) g,体长(316.0±4.6) mm〕,采集吉富罗非鱼血液,冰箱中静置24 h,3 000 r·min-1离心5 min(离心半径为3 cm)后得到血清上清。免疫应答不同阶段几种免疫指标包括:(1)免疫识别:免疫球蛋白(IgM,检测范围0.05~10 mg·mL-1)、表皮生长因子(EGF,检测范围5~2 000 ng·L-1);(2)炎症反应:干扰素-γ(IFN-γ,检测范围 5~1 000 ng·L-1)、白细胞介素-10(IL-10,检测范围2~600 ng·L-1)、肿瘤坏死因子-α(TNF-α,检测范围3~900 ng·L-1)、白细胞介素-8(IL-8,检测范围0.5~200 ng·L-1);(3)效应阶段:金属硫蛋白(MT,检测范围0.05~20 ng·mL-1)和转铁蛋白(TRF,检测范围5~2 000 mg·L-1),其测定方法均按酶联免疫试剂盒说明书进行,试剂盒购自于南京建成生物工程研究所。
1.3 统计学分析
2 结果
与对照组相比,5%、10%和15%鱼腥草处理组吉富罗非鱼血清IgM含量显著提高(图1,P<0.05)。5%、10%和15%处理组吉富罗非鱼血清EGF含量均显著高于对照组,5%处理组EGF含量显著低于10%处理组,但显著高于15%处理组(P<0.05)。
与对照组相比,5%、10%处理组吉富罗非鱼血清IFN-γ含量显著提高(图2),且5%处理组显著高于10%处理组。鱼腥草处理组吉富罗非鱼血清IL-10含量均显著高于对照组,且5%处理组显著低于10%处理组,显著高于15%处理组。与对照组相比,5%、15%处理组吉富罗非鱼血清TNF-α含量均显著降低,但10%处理组吉富罗非鱼血清TNF-α含量显著高于对照组。鱼腥草处理组吉富罗非鱼血清IL-8含量均显著提高,且5%处理组显著低于10%处理组,显著高于15%处理组。

同一幅图中直方柱上方英文小写字母不同表示不同处理组间某指标差异显著(P<0.05)。
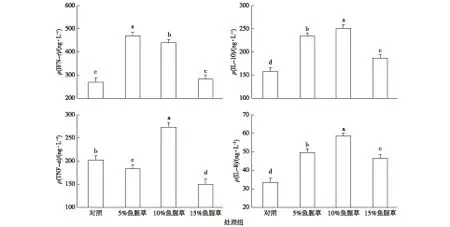
同一幅图中直方柱上方英文小写字母不同表示不同处理组间某指标差异显著(P<0.05)。
与对照组相比,10%和15%处理组吉富罗非鱼血清MT含量显著降低(图3),5%处理组与对照组没有显著差异。鱼腥草处理组均显著提高吉富罗非鱼血清TRF含量,且5%处理组TRF含量显著低于10%处理组,并显著高于15%处理组。
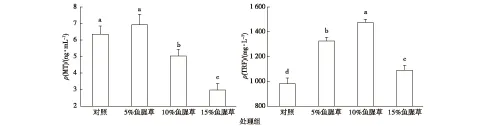
同一幅图中直方柱上方英文小写字母不同表示不同处理组间某指标差异显著(P<0.05)。
3 讨论
鱼类参加免疫应答的细胞主要有巨噬细胞和淋巴细胞,这些免疫细胞产生的细胞因子包括免疫识别阶段的IgM(免疫应答)、EGF(促免疫细胞分化);炎症反应相关的因子,如白细胞介素(参与免疫和炎症过程)、IFN-γ(参与免疫调节)和TNF-α(参与机体免疫调节,巨噬细胞活化)等。炎症反应相关的免疫因子之间能相互作用(如彼此间提供胞内信号)[14],如IFN-γ、TNF-α和白细胞介素共同参与促或抗炎症反应。研究表明鱼体在受到毒物(草甘膦)污染时,草鱼IFN-γ、IL-1β(IL-1亚型)和TNF-α含量改变进而破坏鱼类非特异性免疫能力[15]。该研究中,5%鱼腥草处理组吉富罗非鱼血清IgM、IFN-γ含量显著高于其他处理组和对照组;10%鱼腥草组血清EGF、IL-8、IL-10、TNF-α和TRF含量显著高于其他处理组和对照组,这与之前的结果[15]相类似,与虹鳟受到病原菌(黄杆菌,Flavobacteriumpsychrophilum)感染时免疫器官中MT、IL1β和TNF-β基因表达量显著改变的结果[16]相类似,一方面表明鱼腥草种植后改变了吉富罗非鱼血清中免疫因子含量,此外,这些均说明鱼类免疫系统虽不如其他高等动物健全,但鱼体在自身健康受到威胁时,不同阶段的免疫因子可能会呈现不同的响应。至于促炎和抗炎因子之间如何平衡和调控[9,17],尚需要进一步研究。
吉富罗非鱼养殖池塘中种植鱼腥草起到增强鱼类免疫作用,可能主要是通过改善水质、释放抗菌物质和根部被罗非鱼啃食增强鱼类免疫能力来实现。在水质改善方面,课题组的早期研究结果表明,吉富罗非鱼在低浓度氨氮和亚硝酸盐氮胁迫下,鱼自身机体采取一种主动调节措施;但随着氨氮和亚硝酸盐氮浓度的升高,一些免疫相关酶活性(以氧化应激等为主)则呈下降趋势[18]。大菱鲆在氨氮胁迫下MT、促炎症因子(TNF-α和IL-1β)基因表达量显著上升,但IgM和IGF-1基因表达量显著下降[19]。10%鱼腥草处理组促炎症因子(TNF-α和IL-10)含量最高,且10%鱼腥草处理组炎症抑制因子(IFN-γ)显著低于5%鱼腥草处理组,说明较低种植面积的鱼腥草(5%)就能刺激鱼体巨噬细胞产生细胞因子,介导各种免疫反应。此外,5%鱼腥草处理组血清IgM、EGF、TRF含量升高,MT含量没有显著降低,且TNF-α含量显著降低(图2)。这说明5%鱼腥草种植能在不激发炎症反应的同时,在免疫识别和效应阶段增强鱼类的免疫能力。
鱼腥草根部释放的化感物质如何提高吉富罗非鱼的免疫能力?如何与免疫因子进行互作?在吞食鱼腥草根系的情况下,吉富罗非鱼如何提高其自身免疫能力?这些都是值得进行进一步研究的课题,这些研究将为开发池塘综合种养技术提供新的思路。
4 结论
10%鱼腥草处理组吉富罗非鱼血清EGF、IL-8、IL-10、TNF-α和TRF含量显著高于其他处理组和对照组,5%鱼腥草处理组吉富罗非鱼血清IgM、IFN-γ含量显著高于其他处理组和对照组。吉富罗非鱼养殖池塘5%鱼腥草种植面积能显著提高不同免疫阶段血清免疫因子活性的含量。
[1] 郑尧,邴旭文,裘丽萍,等.浮床栽培鱼腥草对吉富罗非鱼胆汁液中八种免疫因子的影响[J].农业环境科学学报,2016,35(9):1680-1685.[ZHENG Yao,BING Xu-wen,QIU Li-ping,etal.Changes of Eight Biliary Immune Factors of GIFT Tilapia After Floating-Bed Cultivation ofHouttuyniacordataThunb[J].Journal of Agro-Environment Science,2016,35(9):1680-1685.]
[2] 胡庚东,宋超,陈家长,等.池塘循环水养殖模式的构建及其对氮磷的去除效果[J].生态与农村环境学报,2011,27(3):82-86.[HU Geng-dong,SONG Chao,CHEN Jia-zhang,etal.Modeling of Water Circulating Pond Aquaculture System and Its N&P Removal Effect[J].Journal of Ecology and Rural Environment,2011,27(3):82-86.]
[3] 罗思亭,张饮江,李娟英,等.沉水植物与生态浮床组合对水产养殖污染控制的研究[J].生态与农村环境学报,2011,27(2):87-94.[LUO Si-ting,ZHANG Yin-jiang,LI Juan-ying,etal.Effect of Combination of Submerged Macrophyte With Ecological Floating Bed on Aquacultural Pollution Controlling[J].Journal of Ecology and Rural Environment,2011,27(2):87-94.]
[4] 王高学,徐钰,王建华,等.29种天然植物提取物对指环虫杀灭作用的研究[J].淡水渔业,2006,36(3):3-8.[WANG Gao-xue,XU Yu,WANG Jian-hua,etal.Study on the Killing of the 29 Species of Plants Extraction to theDactylogyrus[J].Freshwater Fisheries,2006,36(3):3-8.]
[5] 肖凡书,聂品.鱼类免疫球蛋白重链基因与基因座的研究进展[J].水产学报,2010,34(10):1617-1627.[XIAO Fan-shu,NIE Pin.Immunoglobulin Heavy Chain Genes and Their Loci in Fish:Progress and Perspectives[J].Journal of Fisheries of China,2010,34(10):1617-1627.]
[6] 朱文杰,黄桂菊,张东玲,等.合浦珠母贝表皮生长因子样(EGF-like)基因的克隆与表达分析[J].水产学报,2015,39(5):648-657.[ZHU Wen-jie,HUANG Gui-ju,ZHANG Dong-ling,etal.Cloning and Expression of an Novel EGF-like Gene FromPinctadamartensii[J].Journal of Fisheries of China,2015,39(5):648-657.]
[7] 黄贝,陈善楠,黄文树,等.斜带石斑鱼IFN-γ基因的克隆与表达分析[J].中国水产科学,2013,20(2):269-275.[HUANG Bei,CHEN Shan-nan,HUANG Wen-shu,etal.Molecular Characterization and Expression of Interferon Gamma (IFN-γ) in Orange-Spotted Grouper (Epinepheluscoioides)[J].Journal of Fishery Sciences of China,2013,20(2):269-275.]
[8] SCHINAGL A,THIELE M,DOUILLARD P,etal.Oxidized Macrophage Migration Inhibitory Factor is a Potential New Tissue Marker and Drug Target in Cancer[J].Oncotarget,2016,7(45):73486-73496.
[9] 蔡中华,宋林生,ZOU Jun,等.虹鳟肿瘤坏死因子(TNFα)基因体外表达与纯化的研究[J].水生生物学报,2003,27(6):596-601.[CAI Zhong-hua,SONG Lin-sheng,ZOU Jun,etal.InvitroExpression and Purification of Rainbow Trout (Oncorhynchusmykiss)TNFα[J].Acta Hydrobiologica Sinica,2003,27(6):596-601.]
[10] MULDER I E,WADSWORTH S,SECOMBES C J.Cytokine Expression in the Intestine of Rainbow Trout (Oncorhynchusmykiss) During Infection WithAeromonassalmonicida[J].Fish and Shellfish Immunology,2007,23(4):747-759.
[11] 冯仁勇,周小秋.鱼类金属硫蛋白基因的表达与调控[J].水产学报,2005,24(9):52-54.[FENG Ren-yong,ZHOU Xiao-qiu.The Expression and Control of Metallothionein Gene in Fish[J].Fisheries Science,2005,24(9):52-54.]
[12] CAIPANG C M,LAZADO C C,BRINCHMANN M F,etal.Infection-Induced Changes in Expression of Antibacterial and Cytokine Genes in the Gill Epithelial Cells of Atlantic Cod,Gadus Morhua During Incubation With Bacterial Pathogens[J].Comparative Biochemistry and Physiology B,2010,156(4):319-325.
[13] BISWAS G,KORENAGA H,NAGAMINE R,etal.Cytokine Mediated Immune Responses in the Japanese Pufferfish (Takifugurubripes) Administered With Heat-KilledLactobacillusparacaseispp.paracasei(06TCa22) Isolated From the Mongolian Dairy Product[J].International Immunopharmacology,2013,17(2):358-365.
[14] MA J G,LI X Y.Alteration in the Cytokine Levels and Histopathological Damage in Common Carp Induced by Glyphosate[J].Chemosphere,2015,128:293-298.
[15] ORIEUX N,DOUET D G,LE HÉNAFF M,etal.Prevalence ofFlavobacteriumpsychrophilumBacterial Cells in Farmed Rainbow Trout:Characterization of Metallothionein A and Interleukin1-β Genes as Markers Overexpressed in Spleen and Kidney of Diseased Fish[J].Veterinary Microbiology,2013,162(1):127-135.
[16] ATWELL D M,GRICHNIK K P,NEWMAN M F,etal.Balance of Proinflammatory and Antiinflammatory Cytokines at Thoracic Cancer Operation[J].The Annals of Thoracic Surgery,1998,66(4):1145-1150.
[17] 臧学磊.三种环境因子胁迫下罗非鱼(GIFTOreochromisniloticus)机体免疫力的变化及其对海豚链球菌易感性的影响[D].南京:南京农业大学,2010:43-44.[ZANG Xue-lei.The Immune Response of GIFTOreochromisniloticusand Its Susceptibility toStreptococcusiniaeUnder Stress in Three Environmental Factors[D].Nanjing:Nanjing Agricultural University,2010:43-44.]
[18] JIA R,LIU B L,HAN C,etal.The Physiological Performance and Immune Response of Juvenile Turbot (Scophthalmusmaximus) to Nitrite Exposure[J].Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology,2016,181/182:40-46.
EffectsofCultivationofHouttuyniacordataonFloatingBedsonSerumalImmuneFactorsofGIFTTilapia.
ZHENG Yao1,2, HU Geng-dong1, QIU Li-ping1, ZHAO Zhi-xiang2, SONG Chao1, FAN Li-min1, MENG Shun-long1, XU Pao1,2, CHEN Jia-zhang1,2,3
[1.Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences/ Fishery Eco-Evironment Monitoring Center of Lower Reaches of Yangtze River, Ministry of Agriculture/ Laboratory of Quality & Safety Risk Assessment for Aquatic Products on Environmental Factors(Wuxi), Ministry of Agriculture, Wuxi 214081, China; 2.Wuxi Fishery College of Nanjing Agricultural University, Wuxi 214081, China; 3.Key Laboratory of Quality and Safety Control for Aquatic Products, Ministry of Agriculture, Beijing 100141, China]
To explore whether the symbiont ofHouttuyniacordata(0, 5%, 10% and 15% in plant area) and GIFT tilapia may enhance immunological effects of serumal immune factors of the fish at different phases via pond cultivation of the plants on floating beds, immunoglobulin M (IgM), epidermal growth factor (EGF); iterferon-γ (IFN-γ), interleukin-10 (IL-10), tumor necrosis factor-α (TNF-α), interleukin-8 (IL-8); metallothionein (MT) and transferrin (TRF) of the fish was measured. Results show that the fish in the 10% group were significantly higher than those in any other groups in serumal EGF, IL-8, IL-10, TNF-α and TRF, and that the fish in the 5% group were significantly higher than those in any other groups in IgM and IFN-γ without showing any adverse effect on MT in the fish. Apparently, plantingHouttuyniacordataup to 5% in area in the fish pond of GIFT tilapia can significantly enhance activities of serumal immune factors at different phases of the immune reaction.
biological floating bed;Houttuyniacordata; immune factor;Oreochromisniloticus
2016-09-06
国家科技支撑计划(2015BAD13B03); 现代农业产业技术体系专项(CARS-46); 中央级科研院所基本科研业务费(2015JBFR03)
① 通信作者E-mail: xup@ffrc.cn
② 共同通信作者E-mail: chenjz@ffrc.cn
X954
A
1673-4831(2017)10-0950-05
10.11934/j.issn.1673-4831.2017.10.012
郑尧(1986—),男,安徽安庆人,助理研究员,博士,研究方向为渔业生态环境保护。E-mail: zhengy@ffrc.cn
责任编辑: 陈 昕)
