基于Biolog技术的外来种意大利苍耳与本地种苍耳根际土壤微生物功能多样性的比较
2017-10-21张明莉常宏磊马淼
张明莉,常宏磊,马淼
(石河子大学生命科学学院,新疆 石河子 832003)
基于Biolog技术的外来种意大利苍耳与本地种苍耳根际土壤微生物功能多样性的比较
张明莉,常宏磊,马淼*
(石河子大学生命科学学院,新疆 石河子 832003)
通过盆栽试验,采用Biolog技术对比研究了外来入侵植物意大利苍耳与本地植物苍耳根际土壤微生物群落功能多样性及对土壤碳源利用的差异,以未种植任何植物土壤为空白对照。结果表明,入侵植物意大利苍耳的土壤微生物群落功能多样性显著高于本地植物苍耳的土壤微生物群落功能多样性。意大利苍耳显著提高了根际土壤微生物31种碳源的平均颜色变化率(AWCD)(72 h,P<0.05),AWCD变化规律如下:意大利苍耳>苍耳>CK(对照);意大利苍耳的Shannon多样性指数(H)、优势度指数(D)和丰富度指数(S)均显著高于苍耳和空白对照,与苍耳相比,意大利苍耳的H,D,S分别增加了3.13%,0.77%和21.67%,与CK相比,意大利苍耳的H,D,S分别增加了4.59%,0.89%和35.18%,CK最低;碳代谢指纹图谱分析表明意大利苍耳和苍耳的碳源利用存在显著差异,意大利苍耳显著提高了根际微生物对胺类、酚酸类、氨基酸类和糖类等碳源的利用;主成分分析(PCA)表明,两种植物根际土壤微生物碳源利用特征出现分异,意大利苍耳集中在第一主成分,得分系数3.3103,苍耳主要分布在第二主成分,得分系数-1.9616;糖类物质、羧酸类化合物、多聚物和氨基酸类是根际微生物利用的主要碳源。改变入侵地土壤微生物群落的结构与功能,提高根际土壤微生物的代谢活性,形成对自身有益的土壤微生态环境可能是意大利苍耳成功入侵的原因之一。
生物入侵;微生物功能多样性;意大利苍耳;苍耳
外来生物入侵是当今生态学的热点问题之一,造成了入侵地生物多样性的锐减和生态环境的严重破坏,对当地经济的发展造成了巨大的影响[1-3]。外来入侵植物不仅改变了入侵地植物多样性的水平,而且还强烈影响了入侵地土壤生态系统的组成[4-5]。
微生物是土壤生态系统的重要组成部分,亦是土壤生态系统中最活跃的因子,直接参与植物代谢,物质循环,氧化分解等过程,对植物的生长和竞争具有举足轻重的作用[6-8]。植物与土壤是相互依存的,植物可以调节根际土壤微环境,而适宜的土壤环境又为植物提供了有利的生存条件[6,9-10]。入侵植物扩散到新的栖息地并形成稳定的种群,就会通过各种途径引起土壤生物多样性和生态系统发生改变,进而为其营造更好的生存条件,反过来这种改变有利于外来植物在与本土植物的竞争中占据优势,从而加剧外来植物的扩散[11-12]。因此,研究入侵植物对土壤微生物和生态系统的影响,对其入侵机理的揭示有着重要的科学意义[6,9]。
意大利苍耳(Xanthiumitalicum)是菊科苍耳属一年生草本植物,原产于北美和南欧[13],20世纪90年代入侵我国。该植物于2012年在新疆被首次记录[14],现已广泛分布于北疆的大部分地区和南疆的乌恰县,因其适应能力强,繁殖能力高,种子扩散结构发达,个体竞争能力强,极易在入侵地形成单一优势种群落,种群扩张速度快,已经对当地的本土植物多样性、畜牧业及农业生产造成了严重的危害[15]。对入侵植物的有效防治是各国政府及科研人员面临的一项严峻挑战[16],目前对意大利苍耳的研究主要集中在外部形态特征、种群分布[17-18]、化学成分及化感作用[19]等方面,有关其对入侵地土壤微生物群落影响的研究尚未见报道。本研究在严格受控条件下,以未种植植物的土壤为对照,对比研究了意大利苍耳和本地土著植物苍耳(Xanthiumsibiricum)对根际土壤微生物功能多样性的影响,旨在为揭示该外来植物成功入侵的机理提供科学依据。
1 材料与方法
1.1供试材料
供试植物:意大利苍耳与苍耳的种子均于2014年9月采自石河子市郊,带回实验室,阴干后置于干燥室温条件下储存备用。供试土壤:均为沙土。
1.2试验设计
于2015年4月20日在盛有沙土的育苗盘中播种意大利苍耳和苍耳的种子,置于25 ℃光照培养箱中育苗,昼夜时间为14 h/10 h,光照强度为450 μmol/(m2·s)。出苗10 d后选择长势一致的幼苗移栽至盛有沙土的花钵中,花钵高10 cm,直径为9 cm,沙土厚度为8 cm,意大利苍耳和苍耳各20盆,每个花钵里种1株苗,以不种植任何植物的沙土为空白对照,定时等量浇水。3个月后均生长至果期,分别取意大利苍耳和苍耳根系周围的土壤混匀过1 mm筛,4 ℃冰箱保存备用。
1.3测定方法
土壤微生物功能多样性的测定采用Biolog 生态板(Biolog-Eco PlateTM)的方法[20],Biolog EcoPlate有96个微孔,每32个孔为1个重复,共3次重复,32个微孔中除对照孔内无碳源外,其他各孔都含有一种不同的有机碳源和相同含量的四唑紫染料。在一定温度条件下,通过将微生物溶液接种至微孔内进行培养,微生物呼吸产生的电子发生转移,使微孔内的染料四唑发生氧化还原反应而变色,颜色的深浅反映了微生物对相应碳源的利用能力。通过Biolog系统的微平板读数器,测定Eco板在590 nm波长下的吸光值,完成数据的采集与存储。Eco板的31种单一碳源可分为六大类:糖类(10种)、羧酸类(7种)、氨基酸类(6种)、多聚物类(4种)、多胺类(2种)和芳香化合物类(2种)[21-23]。
1.4试验方案
称取相当于10 g烘干土的鲜土加入装有100 mL已灭菌的0.85%生理盐水三角瓶中,室温震荡60 min,然后用0.85%的生理盐水稀释至1000倍,再震荡30 min后,吸取稀释液接种到生态板(ECO板)中,每孔加150 μL。将接种好的Biolog-Eco微平板置于25 ℃的保湿恒温箱中培养,每隔12 h在Biolog EmaxTM读数器上读取波长为590 nm下的光密度值,持续至156 h。
1.5数据处理
用31个孔的平均颜色变化率(AWCD)表示微生物代谢的整体活性。计算Shannon物种多样性指数(H),Shannon均匀度指数(E),Shannon优势度指数(D),碳源利用丰富度指数(S)。
(1)微平板孔中溶液吸光值平均颜色变化率(AWCD)用于描述土壤微生物代谢活性,计算公式如下:
AWCD=∑(Ci-Ri)/n
式中:Ci为每个孔的光密度值;Ri为对照孔的光密度值;n=31,为ECO板的孔数。
(2)Shannon指数(H)用于评估物种的丰富度,计算公式如下:
H=-∑Pi(lnPi)
式中:Pi为第i孔的相对吸光值与整个微平板所有孔中相对吸光值总和的比值,计算公式如下:
Pi=(Ci-Ri)/∑(Ci-Ri)
(3)Shannon均匀度指数(E),计算公式如下:
E=H/logS
式中:S为颜色变化孔数。
(4)Simpson优势度指数(D)用于评估某些最常见种的优势度,计算公式如下:
D=1-∑Pi2
(5)碳源利用丰富度指数(S):
S=被利用碳源的总数
1.6数据分析
采用SPSS 22.0软件对72 h的实验数据进行单因素方差分析、碳代谢指纹图谱分析和主成分分析(PCA);利用Excel 2003软件作图。
2 结果与分析
2.1根际土壤微生物AWCD的比较分析
由31种碳源AWCD值的变化格局(图1)可知,随着培养时间的延长,意大利苍耳和苍耳根际土壤微生物利用总碳源代谢强度呈逐渐增加的趋势,0~12 h内,AWCD值均为0,12 h后,AWCD值都很小,表明碳源基本未被利用;培养24 h之后AWCD值快速升高,说明碳源利用率快速增加,相比而言,意大利苍耳根际微生物碳源利用率增加速度显著快于苍耳根际土和空白对照。在培养至144 h时,AWCD值均趋于稳定。在72 h时,苍耳与意大利苍耳的AWCD值均显著高于CK(P<0.05),较之CK分别增加了29.47%和76.84%,并且意大利苍耳的根际土壤微生物AWCD值极显著地高于本地植物苍耳(P<0.01),较苍耳高出了36.59%。说明,意大利苍耳和苍耳根际土壤的微生物代谢活性显著地高于未种植物的空白对照,且意大利苍耳根际土壤微生物群落利用总碳源的能力极显著地高于苍耳,这种格局在整个培养期间一直存在。
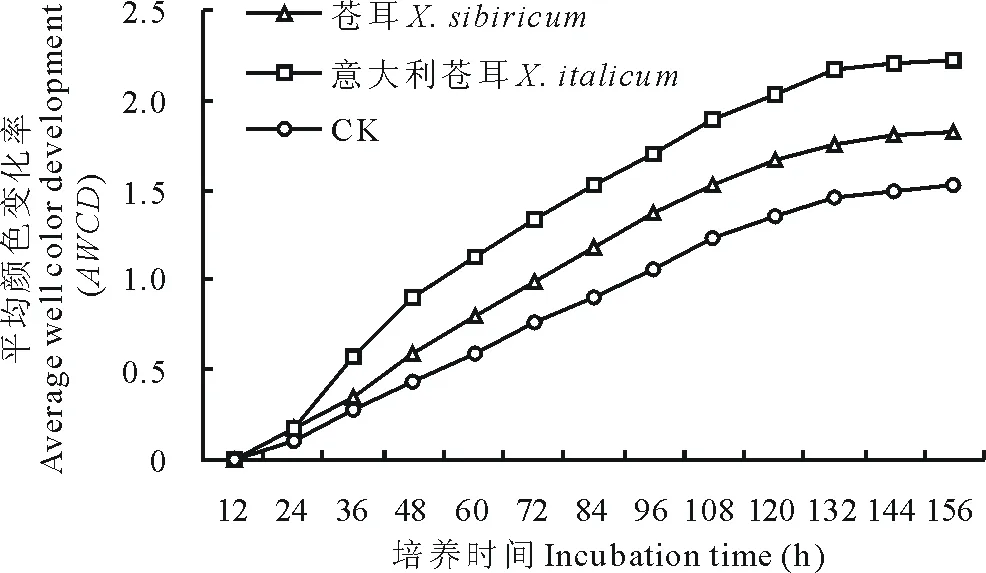
图1 土壤根际微生物群落AWCD值随培养时间的变化Fig.1 AWCD changes with incubation time of different treatments
2.2根际土壤微生物群落多样性指数的比较分析
如图2所示,入侵植物意大利苍耳根际土壤微生物的H、D、S均显著高于本地植物苍耳和CK(P<0.05),与苍耳相比,意大利苍耳的H、D、S分别增加3.13%、0.77%和21.67%,与CK相比,意大利苍耳的H、D、S分别增加4.59%、0.89%和35.18%,而意大利苍耳根际土壤微生物群落的E显著低于苍耳和CK(P<0.05),且苍耳与CK的H、D、S、E无显著差异。
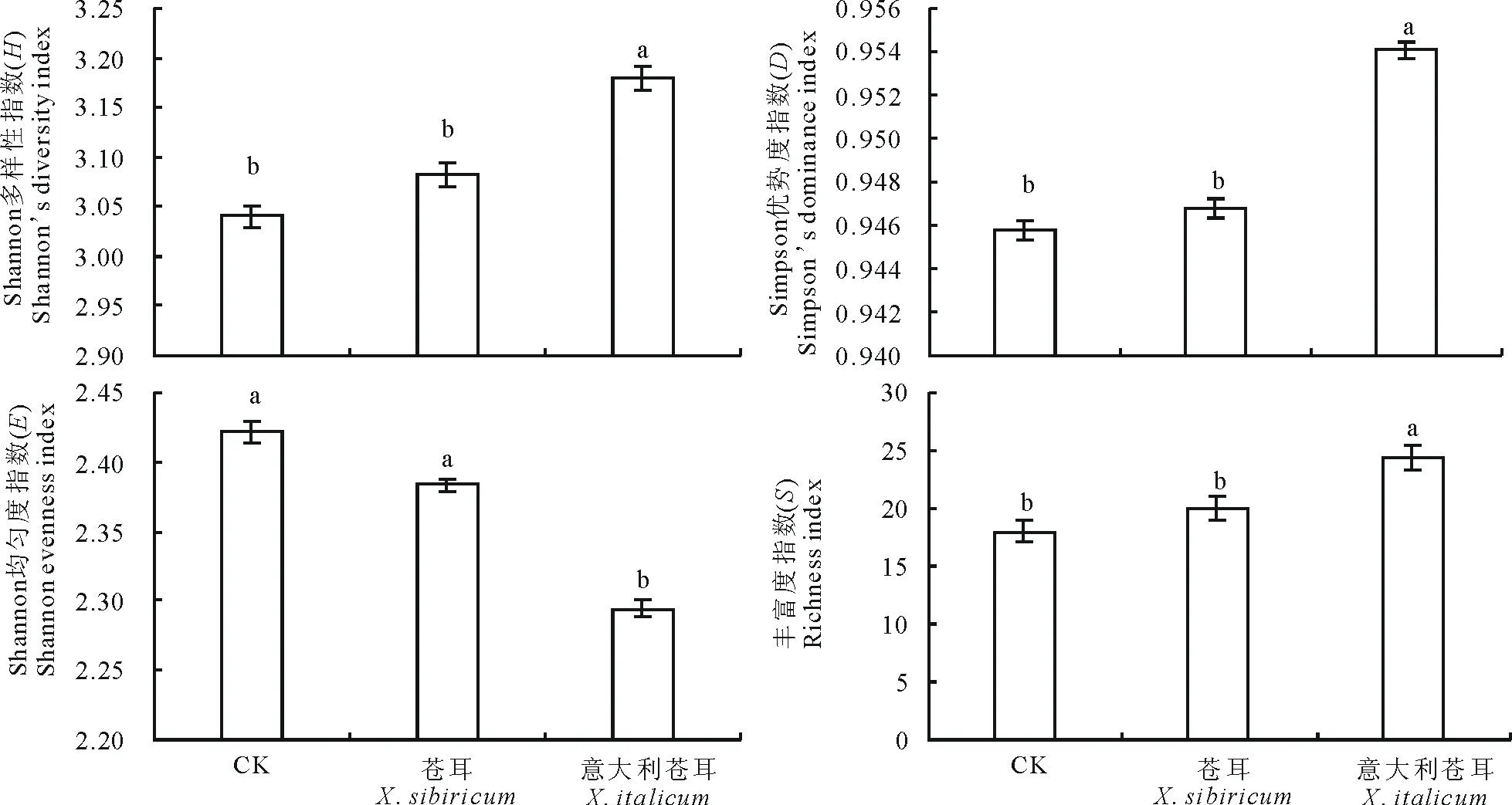
图2 根际土壤微生物群落多样性指数Fig.2 Diversity indices for rhizosphere soil microbial communities不同字母表示差异显著(P<0.05)。下同。Different letters indicate significant difference at P<0.05. The same below.
2.3根际微生物碳代谢指纹图谱的比较分析
微生物对ECO板上不同碳源的利用能力图被定义为Biolog代谢指纹图谱。图3表明,与CK(对照组)相比,意大利苍耳根际土壤微生物显著提高了对D-半乳糖内酯、D-甘露醇、N-乙酰基-D-葡萄胺、D-纤维二糖、α-D-乳糖、L-精氨酸、L-天冬酰胺酸、L-丝氨酸、α-环式糊精、肝糖、D-半乳糖醛酸、α-羟基丁酸、D-葡萄胺酸、衣康酸、D-苹果酸、苯乙基胺、腐胺、2-羟苯甲酸以及4-羟基苯甲酸等19种碳源的利用率。
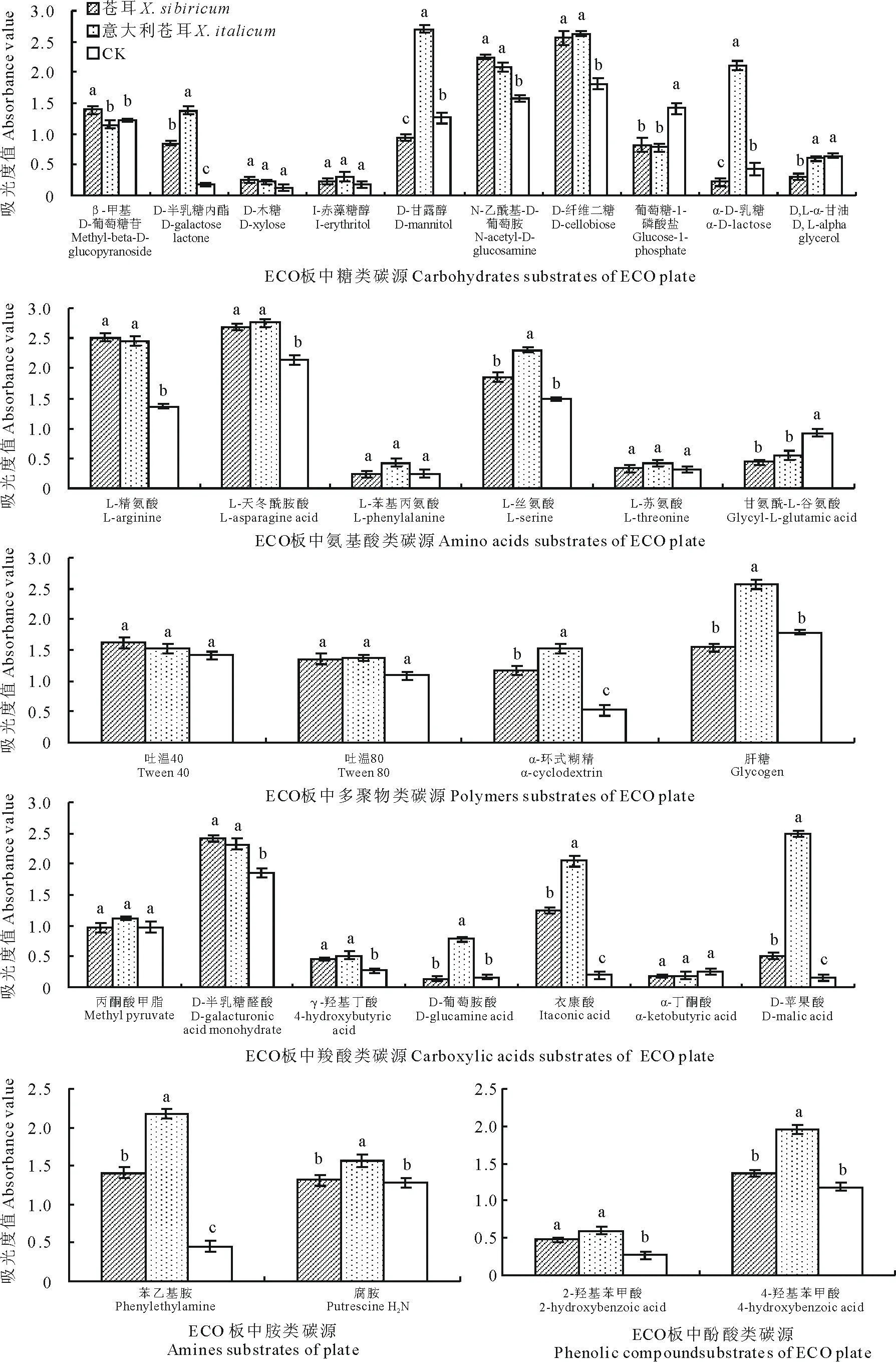
图3 不同处理土壤根际微生物对31种碳源的利用Fig.3 Different treatment of soil rhizosphere microorganisms of 31 kinds of the use of carbon source
与本地植物苍耳相比,意大利苍耳显著提高了根际土壤微生物对糖类碳源D-半乳糖内酯、D-甘露醇、α-D-乳糖、D,L-α-甘油,氨基酸类碳源L-丝氨酸,聚合物类碳源α-环式糊精、肝糖,羧酸类碳源D-葡萄胺酸、衣康酸、D-苹果酸, 胺类碳源苯乙基胺、 腐胺和酚酸类碳源4-羟基苯甲酸等13种碳源的利用效率(P<0.05), 其对D-甘露醇和α-D-乳糖的利用效率分别是苍耳的1.8和8.7倍,对α-环式糊精和肝糖的利用效率分别是苍耳的1.30和1.67倍,对D-葡萄胺酸、衣康酸和D-苹果酸的利用效率分别是苍耳的1.65、5.60和4.87倍,对胺类碳源苯乙基胺和腐胺的利用效率分别是苍耳的1.55和1.20倍,对4-羟基苯甲酸的利用效率是苍耳的1.44倍。
2.4根际土壤微生物对碳源代谢的主成分分析
通过对培养72 h的31种碳源底物利用情况进行主成分分析,共提取了2个主成分,第一主成分(PC1)和第二主成分(PC2)分别可以解释所有变量的72.98%和27.02%,2个主成分累积方差贡献率达到100%,可以全面的概括31个变量的特征。由表1可知,苍耳在PC2上的得分高,意大利苍耳在PC1上的得分高。
因子载荷反映了主成分与碳源利用的相关程度,因子载荷绝对值越接近于1,表示该碳源对主成分的影响越大。表2显示,与第一主成分有较高相关性的碳源有21个,分别是胺类的苯乙基胺和腐胺;聚合物类的吐温80和α-环式糊精;氨基酸类的L-精氨酸,L-天冬酰胺酸,L-苯基丙氨酸,L-丝氨酸和甘氨酰-L-谷氨酸;酚酸类化合物的2-羟苯甲酸;羧酸类化合物丙酮酸甲脂,D-半乳糖醛酸,γ-羟基丁酸,D-葡萄胺酸,衣康酸,α-丁酮酸和D-苹果酸;糖类物质的β-甲基D-葡萄糖苷,D-甘露醇,N-乙酰基-D-葡萄胺和D-纤维二糖。而与第二主成分相关性较高的碳源仅有2个,是糖类物质的D-木糖和D,L-α-甘油。
3 讨论
平均颜色变化率(AWCD)表征了微生物群落的碳源利用率,是用于描述土壤微生物代谢活性的重要指标[24],AWCD值越大,微生物群落的代谢活性就越强[25-26]。研究表明,AWCD的变化从适应期—对数期—稳定期,代谢速率相应的从慢—快—慢,这与一般微生物的增长规律一致[27]。在为期156 h的整个培养阶段,意大利苍耳的AWCD值均显著高于苍耳和空白对照,说明意大利苍耳根际土壤微生物的代谢活性和碳源利用率显著地高于苍耳和空白对照,这与赵晓红等[28]、陈华[29]对外来植物与土壤微生物关系的研究结果基本一致。

表1 主成分得分及贡献率Table 1 Scores and contribution rate of principal component (PCA)
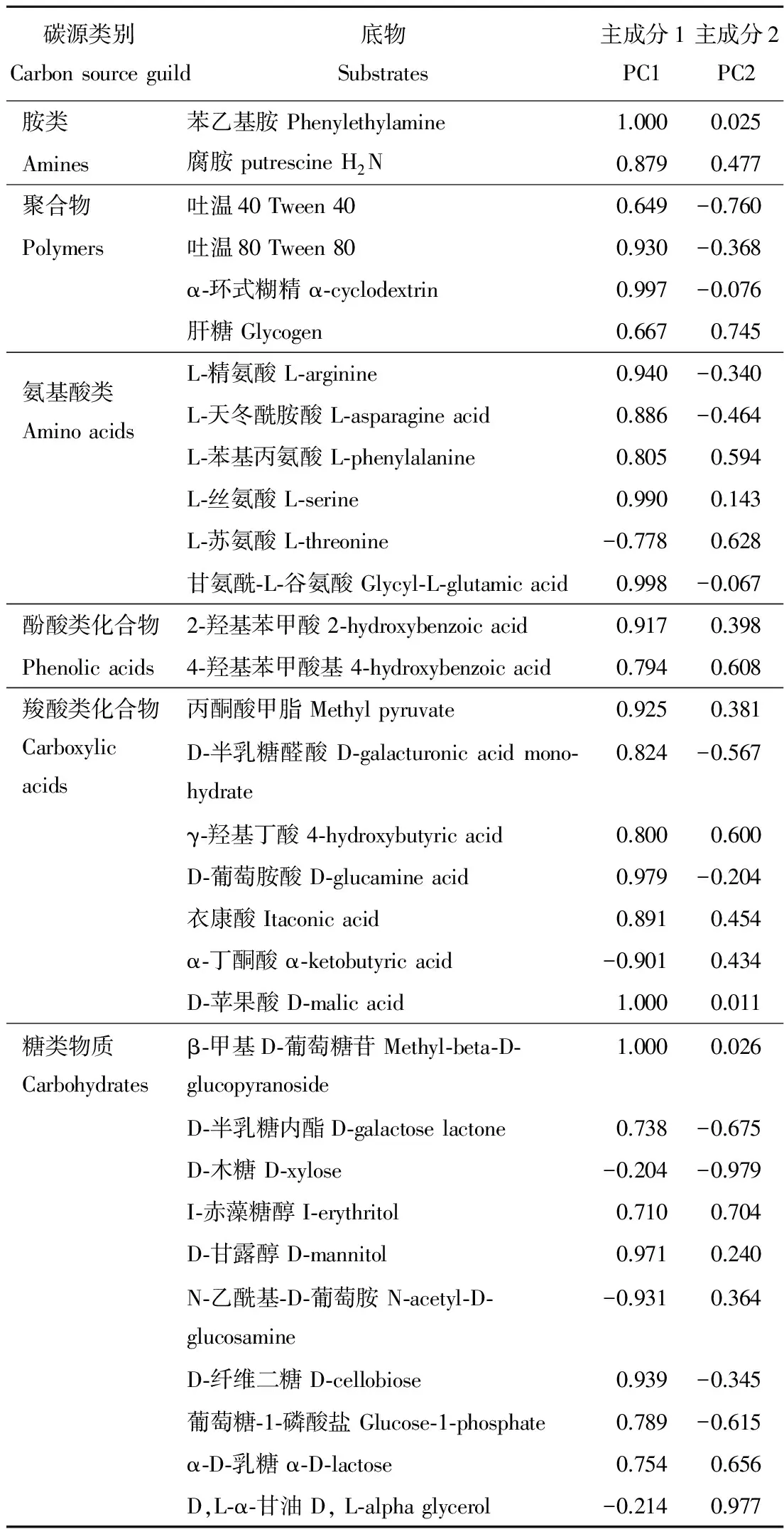
表2 31种碳源的因子载荷Table 2 Factor loading of 31 carbon sources
微生物代谢的多样性指数分析能够准确地反映微生物群落功能多样性的变化, Shannon多样性指数(H、D、E)和碳源利用丰富度指数(S)是表征群落多样性的常用指标[30]。D值越高,群落多样性越高;H值越高,说明所含物种越丰富;E值越高,说明群落越均一;S值越高,说明可利用碳源种类越多[31]。意大利苍耳的H、D和S均显著地高于苍耳和CK。说明意大利苍耳根际土壤微生物群落的功能多样性显著高于苍耳和对照,这与上述结果一致。
将ECO板上的31种碳源分为6类,即聚合物类、氨基酸类、羧酸类、糖类、胺类和酚酸类。与苍耳相比,意大利苍耳明显提高了微生物对胺类和酚酸类碳源的利用,且提高了根际微生物对糖类碳源(4个)、氨基酸类碳源(1个)、多聚物类碳源(2个)和羧酸类碳源(3个)的利用。糖类、氨基酸类和羧酸类是植物根系分泌物的主要成分,糖类是微生物代谢利用最广的碳源,羧酸类与病菌的感染密切相关,酚酸类是重要的化感物质[32],有研究表明菊科入侵植物有分泌化感物质和聚集对自身有益微生物的能力,从而抑制周围本土植物的生长[33],Seema等[34]发现飞机草(Eupatoriumodoratum)对土壤微生物有聚集作用。
主成分分析(PCA)能较好地描述不同土壤微生物群落对碳源的利用状况及其代谢特征[35],用以分析不同种类植物对土壤微生物碳源的利用是否存在差异[36-37]。样本在主成分上的得分和微生物对碳源底物的利用能力相关[38]。荷载因子表示绝对值越大,该碳源影响较大,第一主成分解释了大部分变异,与第一主成分有较高相关性的碳源有21个,胺类2个,聚合物类2个,氨基酸类5个,酚酸类化合物1个,羧酸类化合物7个,糖类物质4个。结果表明入侵植物意大利苍耳改变了根际微生物对碳源的利用,其中糖类物质,羧酸类化合物、氨基酸类和聚合物类是微生物利用的主要碳源。
本研究表明入侵植物意大利苍耳和本地植物苍耳土壤微生物群落功能多样性存在明显差异,且意大利苍耳根际的土壤微生物群落功能多样性显著高于苍耳。大量研究表明外来植物入侵改变了入侵地的土壤微生物群落结构[39-41],并认为对入侵地土壤微生物群落的影响是其成功入侵的原因之一[42-43]。入侵植物之所以会改变入侵地的土壤微生物群落功能多样性,是因为不同植物根系分泌物不同,根系分泌物的化学成分亦不同,根系周转速率通常存在差异,因此外来植物在成功入侵后会改变根际与土壤间的物质运输,从而影响土壤微生物的结构和功能[30];另外,外来植物与本地植物地上部分的差异(例如凋落物数量和质量)也会影响土壤微生物[44]。此外,外来植物也会通过影响入侵地土壤的水分、pH和土壤的理化特性等间接地影响土壤微生物的多样性[4]。
4 结论
通过对入侵植物意大利苍耳、本地植物苍耳和对照的土壤微生物群落功能多样性的研究表明,意大利苍耳显著提高了根际土壤微生物31种碳源的平均颜色变化率(AWCD)(72 h,P<0.05),AWCD变化规律如下:意大利苍耳>苍耳>CK,意大利苍耳的AWCD值分别比苍耳和CK的高36.59%和76.84%;意大利苍耳的H、D、S均显著高于苍耳和空白对照;碳代谢指纹图谱分析表明意大利苍耳和苍耳的碳源利用存在显著差异,意大利苍耳显著提高了根际微生物对胺类、酚酸类、氨基酸类和糖类等碳源的利用;主成分分析(PCA)表明,两种植物根际土壤微生物碳源利用特征出现分异,糖类物质、羧酸类化合物、多聚物和氨基酸类是根际微生物利用的主要碳源。意大利苍耳改变了入侵地土壤微生物群落的结构及功能,显著提高了根际土壤微生物的功能多样性和对土壤碳源的利用效率,形成了有益于自身生长的土壤微生态环境,这很可能是其成功入侵并疯狂扩散的原因之一。
References:
[1] Yan X L, Shou H Y, Ma J S,etal. The problem and status of the alien invasive plants in China. Plant Diversity and Resources, 2012, 34(3): 287-313.
闫小玲, 寿海洋, 马金双, 等. 中国外来入侵植物研究现状及存在的问题. 植物分类与资源学报, 2012, 34(3): 287-313.
[2] Callaway R M, Thelen G C, Rodriguez A,etal. Soil biota and exotic plant invasion. Nature, 2004, 427(6976): 731-733.
[3] Reinhart K O, Callaway R M. Soil biota and invasive plants. New Phytologist, 2006, 170(3): 445-457.
[4] Chen H L, Li Y J, Li B,etal. Impacts of exotic plant invasions on soil biodiversity and ecosystem processes. Chinese Biodiversity, 2005, 13(6): 555-565.
陈慧丽, 李玉娟, 李博, 等. 外来植物入侵对土壤生物多样性和生态系统过程的影响. 生物多样性, 2005, 13(6): 555-565.
[5] Bais H P, Vepachedu R, Gilroy S,etal. Allelopathy and exotic plant invasion: from molecules and genes to species interactions. Science, 2003, 301(5638): 1377-1380.
[6] Dai Y T, Hou X Y, Yan Z J,etal. Rhizophere microbial fuctional diversity affected by vegetation restoration in the Hobq Sand Land, Inner Mongolia, China. Acta Prataculturae Sinica, 2016, 25(10): 56-65.
戴雅婷, 侯向阳, 闫志坚, 等. 库布齐沙地两种植被恢复类型根际土壤微生物群落功能多样性研究. 草业学报, 2016, 25(10): 56-65.
[7] Jones D L. Organic acids in the rhizosphere -a critical review. Plant and Soil, 1998, 205(1): 25-44.
[8] Liu B R, Jia G M, Chen J,etal. A review of methods for studying microbial diversity in soils. Pedosphere, 2006, 16(1): 18-24.
[9] Beest M, Stevens N, Olff H,etal. Plant-soil feedback induces shifts in biomass allocation in the invasive plantChromolaenaodorata. Journal of Ecology, 2009, 6: 1281-1290.
[10] Jordan N R, Larson D L, Huerd S C. Soil modification by invasive plants: effects on native and invasive species of mixed-grass prairies. Biological Invasions, 2008, 10: 177-190.
[11] Ehrenfeld J G, Scott N. Invasive species and the soil: effects on organisms and ecosystem processes. Ecological Applications, 2001, 11(5): 1259-1260.
[12] Levine J M, Vila M, Dukes J S,etal. Mechanisms underlying the impacts of exotic plant invasions. Proceedings of the Royal Society of London Series B-Biological Sciences, 2003, 270(1517): 775-781.
[13] Wang R, Wan F H. Prediction of the potential survival area ofXanthiumitalicumin China. Acta Prataculturae Sinica, 2010, 19(6): 222-230.
王瑞, 万方浩. 外来入侵植物意大利苍耳在我国适应区预测. 草业学报, 2010, 19(6): 222-230.
[14] Ma J S. The Survey Report on Chinese Alien Invasive Plants[M]. Part I. Beijing: Higher Education Press, 2014: 233.
马金双. 中国外来入侵植物调研报告上卷[M]. 北京: 高等教育出版社, 2014: 233.
[15] Liu H Y, Ming G H. Distribution status and control method of invasive plantXanthiumitalicumin China. Bulletin of Biology, 2008, 43(5): 15-16.
刘慧圆, 明冠华. 外来入侵种意大利苍耳的分布现状及防控措施. 生物学通报, 2008, 43(5): 15-16.
[16] Chen J Q, Li B, Ma Z J,etal. Challenges Facing Ecologists: Questions and Approaches[M]. Beijing: Higher Education Press, 2005: 2-3.
陈吉全, 李博, 马志军, 等. 生态学家面临的挑战—问题与途径[M]. 北京: 高等教育出版社, 2005: 2-3.
[17] Che J D, Hu B. Invasive plantXanthiumitalicumin China. Weed Science, 2017, (2): 57-59.
车晋滇, 胡彬. 外来入侵杂草意大利苍耳. 杂草科学, 2017, (2): 57-59.
[18] Li N, Zhu L N, Zhai Q,etal. A new alien invasive plant—XanthiumitalicumMoretti. in Liaoning Province. Plant Quarantine, 2010, (5): 49-52.
李楠, 朱丽娜, 翟强, 等. 一种新入侵辽宁省的外来有害植物——意大利苍耳. 植物检疫, 2010, (5): 49-52.
[19] Tai F J, Han C X, Shao H,etal. Comparison of the allelopathic effects of the volatile oils from different parts ofXanthiumitalicumMoretti. Journal of Biology, 2015, 32(2): 36-41.
邰凤娇, 韩彩霞, 邵华, 等. 入侵植物意大利苍耳不同部位挥发油的化感作用及其化学成分的比较分析. 生物学杂志, 2015, 32(2): 36-41.
[20] Dong Y, Yang Z X, Dong K,etal. Effects of nitrogen application rate on faba bean fusarium wilt and rhizospheric microbial metabolic functional diversity. Chinese Journal of Applied Ecology, 2013, 24(4): 1101-1108.
董艳, 杨智仙, 董坤, 等. 施氮水平对蚕豆枯萎病和根际微生物代谢功能多样性的影响. 应用生态学报, 2013, 24(4): 1101-1108.
[21] Chen S N. Effects of inoculating azotobacter on soil enzyme activities and bacterial community functional diversity in the rhizosphere of maize (ZeamaysL.). Plant Nutrition and Fertilizer Science, 2012, 18(2): 444-450.
陈胜男. 接种自生固氮菌对玉米根际土壤酶活性和细菌群落功能多样性的影响. 植物营养与肥料学报, 2012, 18(2): 444-450.
[22] Song S, Chen X M, Xiao W,etal. Response of soil cultivatable microorganisms to Uranium contamination based on BIOLOG fingerprint analysis method. Journal of Nuclear Agricultural Sciences, 2016, 30(6): 1169-1177.
宋收, 陈晓明, 肖伟, 等. 基于BIOLOG指纹解析土壤可培微生物对铀污染的响应. 核农学报, 2016, 30(6): 1169-1177.
[23] Choi K H, Dobbs F C. Comparison of two kinds of biolog microplates (GN and ECO) in their ability to distinguish among aquatic microbial communities. Journal of Microbiological Methods, 1999, 36(3): 203-213.
[24] Diosma G, Aulicino M, Chidichimo H,etal. Effect of tillage and N fertilization on microbial physiological profile of soils cultivated with wheat. Soil & Tillage Research, 2006, 91: 236-243.
[25] Garland J. Analysis and interpretation of community-level physiological profiles in microbial ecology. Fems Microbiology Ecology, 1997, 24(4): 289-300
[26] Konopka A, Oliver L, Turco J R F. The use of carbon substrate utilization patterns in environmental and ecological microbiology. Microbial Ecology, 1998, 35(2): 15-103.
[27] Shen P, Chen X D. Microbiology[M]. The 2nd edition. Beijing: Higher Education Press, 2006: 134-136.
沈萍, 陈向东. 微生物学[M]. 第2版. 北京: 高等教育出版社, 2006: 134-136.
[28] Zhao X H, Huangfu C H, Qu B,etal. Effects ofFlaveriabidentisinvasion on soil microbial functional diversity. Journal of Agricultural Resources and Environment, 2014, 31(2): 182-189.
赵晓红, 皇甫超河, 曲波, 等. 黄顶菊(Flaveriabidentis)入侵对土壤微生物功能多样性的影响. 农业资源与环境学报, 2014, 31(2): 182-189.
[29] Chen H. The Researches about the Relation between Exotic Plants and Soil Biota[D]. Jinan: Shangdong University, 2011.
陈华. 外来植物与土壤微生物的关系研究[D]. 济南: 山东大学, 2011.
[30] Kourtev P S, Ehrenfeld J G, Haeggblom M. Exotic plant species alter the microbial community structure and function in the soil. Ecology, 2002, 83(11): 3152-3166.
[31] Dang W, Gao C H, Zhang Q,etal. Screening of preprocessing methods of biolog for soil microbial community functional diversity. Chinese Agricultural Science Bulletin, 2015, 31(2): 153-158.
党雯, 郜春花, 张强, 等. Biolog 法测定土壤微生物群落功能多样性预处理方法的筛选. 中国农学通报, 2015, 31(2): 153-158.
[32] Dong Y, Dong K, Tang L,etal. Relationship between rhizosphere microbial community functional diversity and faba bean fusarium wilt occurrence in wheat and faba bean intercropping system. Acta Ecologica Sincia, 2013, 33(23): 7445-7454.
[33] Zhao X H, Yang D L, Qu B,etal. Effects ofFlaveriabidentisinvasion on soil ammonia- oxidizing bacterial community structure and diversity. Chinese Journal of Ecology, 2014, 33(6): 1492-1500.
赵晓红, 杨殿林, 曲波, 等. 黄顶菊入侵对土壤氨氧化细菌群落结构及多样性的影响. 生态学杂志, 2014, 33(6): 1492-1500.
[34] Seema M I, Ragan M. Exotic invasive plant accumulates native soil pathogens which inhibit native plants. Ecology, 2008, 96: 58-67.
[35] Shi X H. Soil Microbial Activity and Community Functional Diversity inEucalyptusplantation[D]. Nanning: Guangxi University, 2012: 29-38.
石贤辉. 桉树人工林土壤微生物活性与群落功能多样性[D]. 南宁: 广西大学, 2012: 29-38.
[36] Juliet P M, Lynne B, Randerson P F. Analysis of microbial community functional diversity using sole-carbon-source utilization profiles a critique. Microbiology Ecology, 2002, 42(1): 1-14.
[37] Cooksona W R, Daniel V M, Margaret M R. Characterizing the relationships between soil organic matter components and microbial function and composition along a tillage disturbance gradient. Soil Biology and Biochemistry, 2008, 40(3): 763-777.
[38] Garland J L, Mills A. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole-carbon-source utilization. Applied and Environmental Microbiology, 1991, 57(8): 2351-2359.
[39] Beckstead J, Parker I M. Invasiveness ofAmmophilaarenaria: release from soil-borne pathogens. Ecology, 2003, 84(11): 2824-2831.
[40] Bever J D. Negative feedback within a mutualism: host-specific growth of mycorrhizal fungi reduces plant benefit. Proceeding of Royal Society London B, 2002, 269: 2595-2601.
[41] Roberts K J, Anderson R C. Effects of garlic mustard (Alliariapetiolata(Beib. Cavaraand Grande)) extracts on plants and arbuscular mycorrhizal (AM) fungi. The American Midland Naturalist, 2001, 146: 146-152.
[42] Bais H P, Prithiviraj B, Jha A K,etal. Mediation of pathogen resistance by exudation of antimicrobials from roots. Nature, 2005, 434: 217-221.
[43] Zhu L X, Zhang J E, Liu W G. Review of studies on interactions between root exudate and rhizopheric microorganisms. Ecology and Environment, 2003, 12(1): 102-105.
朱丽霞, 章家恩, 刘文高. 根系分泌物与根际微生物相互作用研究综述. 生态环境, 2003, 12(1): 102-105.
[44] Saggar S, Mc Intosh P D, Hedley C B,etal. Changes in soil microbial biomass, metabolic quotient, and organic matter turnover underHieracium(H.pilosellaL.). Biology and Fertility of Soils, 1999, (30): 232-238.
ComparisonoffunctionaldiversityofrhizospheresoilmicroorganismsbetweentheexoticplantXanthiumitalicumanditsnativepartnerXanthiumsibiricumbytheBiologmethod
ZHANG Ming-Li, CHANG Hong-Lei, MA Miao*
LifeScienceCollege,ShiheziUniversity,Shihezi832003,China
The aim of this research was to analyze differences in functional diversity and the carbon source utilization of the rhizosphere soil microbial community between the invasive plantXanthiumitalicumand its native partner,Xanthiumsibiricum. The two plants were cultivated in a put experiment and their soil microbial communities were analyzed using the Biolog technique. Soil with no plants served as the blank control (CK). The results indicated that the functional diversity of the soil microbial community was significantly higher for the invasive plantX.italicumthan for the native plantX.sibiricum. The rhizosphere soil microbes fromX.italicumsignificantly increased the average well color development (AWCD) (72 h,P<0.05) for 31 carbon sources. The treatments were ranked, from largest change in AWCD to smallest, as follows:X.italicum>X.sibiricum>CK. The values of Shannon’s diversity index (H), Simpson’s dominance index (D), and substrate richness index (S) were significantly higher forX.italicumrhizosphere soil microbes than for those ofX.sibiricumand CK. The Shannon’s indexes (H, D, S) of theX.italicumrhizosphere soil microbial community were 3.13%, 0.77%, and 21.67% higher, respectively, than those ofX.sibiricum; and 4.59%, 0.89%, and 35.18% higher, respectively, than those of CK. The lowest values of H, D, and S, were in CK. The carbon metabolic fingerprint analysis showed that carbon source utilization differed significantly betweenX.italicumsoil microbes andX.sibiricumsoil microbes. The rhizosphere soil microbes ofX.italicumshowed the highest utilization of amines, phenolic acids, amino acids, and sugars. A principal component analysis (PCA) showed that the carbon utilization features of soil microbial communities differed between the two plants. The soil microbial community ofX.italicumwas concentrated in the first principal component (score coefficient, 3.3102) and that ofX.sibiricumwas concentrated in the second principal component (score coefficient, -1.9616). Carbohydrates, carboxylic acids, polymers, and amino acids were the major carbon sources utilized by rhizosphere soil microbes. Therefore, the reasons for the successful invasion forX.italicumcould include: (1) changes in the structure and function of soil microbial communities; (2) increased metabolic activity of rhizosphere soil microbes; and (3) the formation of a soil microenvironment that benefits its own growth.
biological invasion; microbial functional diversity;Xanthiumitalicum;Xanthiumsibiricum
10.11686/cyxb2016500http//cyxb.lzu.edu.cn
张明莉, 常宏磊, 马淼. 基于Biolog技术的外来种意大利苍耳与本地种苍耳根际土壤微生物功能多样性的比较. 草业学报, 2017, 26(10): 179-187.
ZHANG Ming-Li, CHANG Hong-Lei, MA Miao. Comparison of functional diversity of rhizosphere soil microorganisms between the exotic plantXanthiumitalicumand its native partnerXanthiumsibiricumby the Biolog method. Acta Prataculturae Sinica, 2017, 26(10): 179-187.
2016-12-28;改回日期:2017-03-13
国家自然科学基金项目(编号:31360047)资助。
张明莉(1991-),女,甘肃平川人,在读硕士。E-mail:zhangmingli11@126.com
*通信作者Corresponding author. E-mail:mamiaogg@126.com
