姜黄素逆转非小细胞肺癌TKI靶向药物耐药机制的研究
2017-10-20张卫平王珏冉冉
张卫平+王珏+冉冉

[摘要] 目的 探討姜黄素逆转非小细胞肺癌(NSCLC)酪氨酸激酶抑制剂(TKI)靶向药物耐药的分子机制。 方法 选用非小细胞肺癌NCI-H1975细胞,分别采用相应药物进行处理。采用MTT法检测姜黄素对NCI-H1975细胞增殖的抑制作用,同时检测姜黄素对NCI-H1975细胞耐药性的逆转作用,采用流式细胞术检测姜黄素对NCI-H1975细胞凋亡率的影响,采用Western Blot法检测各组NCI-H1975细胞p-PI3K、p-Akt、p-Ras、p-ERK蛋白表达水平。 结果 与对照组比较,姜黄素5 μmol/L组、10 μmol/L组、15 μmol/L组、20 μmol/L组、40 μmol/L组在24 h、48 h、72 h对NCI-H1975细胞增殖抑制率明显较高(P<0.05),并且具有剂量及时间依赖性;对NCI-H1975细胞TKI耐药性的逆转倍数比较,预处理+姜黄素+吉非替尼组>姜黄素+吉非替尼组>预处理+吉非替尼组(P<0.05)。与对照组比较,各组NCI-H1975细胞凋亡率较高,其中联合用药组>吉非替尼组>姜黄素组(P<0.05)。与对照组比较,各组NCI-H1975细胞p-PI3K、p-Akt、p-Ras、p-ERK蛋白表达水平较低,其中联合用药组<吉非替尼组<姜黄素组(P<0.05)。 结论 姜黄素能有效逆转NCI-H1975细胞TKI靶向药物耐药性,抑制细胞增殖并促进其凋亡,最佳给药方式是姜黄素预处理后再与吉非替尼联用,作用机制可能与下调p-PI3K、p-Akt、p-Ras、p-ERK蛋白水平有关。
[关键词] 姜黄素;非小细胞肺癌;TKI靶向药物;耐药机制
[中图分类号] R734.2 [文献标识码] A [文章编号] 1673-9701(2017)25-0037-05
Study on the resistance mechanism of curcumin in reversing TKI targeted drugs in non-small cell lung cancer
ZHANG Weiping WANG Jue RAN Ran
Department of Oncology, the Third Affiliated Hospital of Zhejiang Medical Chinese University, Hangzhou 310005, China
[Abstract] Objective To investigate the molecular mechanism of curcumin in reversing the drug resistance of tyrosine kinase inhibitor(TKI) targeted drugs in non-small cell lung cancer(NSCLC). Methods NCI-H1975 cells of NSCLC were selected and treated with corresponding drugs. MTT assay was used to detect the inhibitory effect of curcumin on the proliferation of NCI-H1975 cells. The reversal effect of curcumin on NCI-H1975 cell resistance was also detected. The effect of curcumin on the apoptosis rate of NCI-H1975 cells was detected by flow cytometry. The expression levels of p-PI3K, p-Akt, p-Ras and p-ERK proteins in NCI-H1975 cells were detected by Western Blot method. Results Compared with the control group, the cell proliferation inhibitory rate of NCI-H1975 cells was significantly higher in the curcumin 5 μmol/L group, 10 μmol/L group, 15 μmol/L group, 20 μmol/L group and 40 μmol/L group at 24 h, 48 h and 72 h(P<0.05), showing a dose and time dependence; the reversing fold of TKI resistance of NCI-H1975 cells was compared, and pretreatment+curcumin+gefitinib group>curcumin+gefitinib group>pretreatment+gefitinib group(P<0.05). Compared with the control group, the apoptosis rate of NCI-H1975 cells in each group was higher, and the combined drug use group>gefitinib group>curcumin group(P<0.05). Compared with the control group, the expression levels of p-PI3K, p-Akt, p-Ras and p-ERK protein in NCI-H1975 cells in each group were lower, and the combined drug use group gefitinib group
[Key words] Curcumin; Non-small cell lung cancer; TKI targeted drugs; Resistance mechanism
肺癌是世界范围内发病率及死亡率最高的恶性肿瘤,非小细胞肺癌(non-small cell lung cancer, NSCLC)是最常见的肺癌类型,约占80%[1]。流行病学资料显示,2012年全球有182万新发肺癌患者,158万患者死亡,已经成为世界性健康问题[2]。我国随着吸烟人数增加、人口老龄化程度加深等,近年来肺癌发病率也呈现不断上升趋势,关于肺癌治疗手段的研究也备受关注。分子靶向药物是NSCLC治疗的新手段,具有靶向性、安全性等优点[3],其中以酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)最为常见。TKI类药物以人表皮生长因子受体(epidermal growth factor receptor,EGFR)突变引起的酪氨酸激酶异常活化为作用靶点,能有效阻断EGFR磷酸化,调节细胞凋亡相关信号通路,促进肿瘤细胞凋亡,疗效确切,已经被推荐用于EGFR突变阳性患者的一线治疗[4]。但有研究发现,一般治疗8~11个月会有获得性耐药现象产生[5],影响治疗效果。姜黄素是提取自中药姜黄的多酚类物质,具有逆转肿瘤多药耐药的作用[6],但关于其对NSCLC细胞TKI耐药性的影响及机制的研究较少。本研究即探讨姜黄素逆转NSCLC细胞TKI靶向药物耐药的分子机制。现报道如下。
1 材料与方法
1.1 材料
1.1.1 材料来源 人非小细胞肺癌NCI-H1975细胞株,品牌:ATCC,购自北京中原公司。
1.1.2 药品与试剂 姜黄素,CAS号:458-37-7,纯度:≥98%,品牌:克拉玛尔,购自上海紫一试剂厂,采用二甲基亚砜(dimethyl sulfoxide,DMSO)溶解后加双蒸水配制成浓度为500 μmol/L的溶液,用RPMI-1640培养液稀释至所需浓度;吉非替尼片,规格:0.25 g,国药准字J20100014,购自英国阿斯利康制药有限公司,采用DMSO溶解配制25 mmol/L溶液,用RPMI-1640培养液稀释至所需浓度;磷酸盐缓冲溶液(Phosphate buffer solution,PBS),购自北京奥博来科技有限责任公司;RPMI-1640培养基、0.25%胰蛋白酶消化液,购自美国GIBCO公司;胎牛血清(FBS),以色列Biological Industries公司产品;DMSO、四甲基偶氮唑蓝(MTT),购自山海索莱宝生物科技有限公司;细胞培养用青霉素-链霉素、BCA蛋白浓度测定试剂盒,碧云天生物技术研究所产品;Annexin V-FITC/PI双染细胞凋亡检测试剂盒,购自上海铭博生物科技有限公司;增强型化学发光底物(enhanced chemiluminescence substrate,ECL)检测试剂盒,购自上海炎熙生物科技有限公司;小鼠磷酸化磷脂酰肌醇3-激酶(phosphorylated phosphatidylinositol 3-kinase,p-PI3K)、磷酸化蛋白激酶B(phosphorylated protein kinase B,p-Akt)、p-Ras、磷酸化胞外信号调节的激酶(phosphorylated extracellular signal regulated kinase,p-ERK)抗体,厦门慧嘉生物科技有限公司产品;辣根过氧化物酶标记的羊抗小鼠IgG,购自上海朗顿生物科技有限公司。
1.1.3 仪器 细胞培养板、75 cm2细胞培养瓶,购自北京思齐生物技术有限公司;3121型CO2恒温细胞培养箱、902-ULTS超低温冰箱,美国Thermo Scientific Forma公司产品;DK-8D型电热恒温水槽,购自上海优耳仪器科技有限公司;TD5M型低速离心机,购自长沙湘智离心机仪器有限公司;K40型倒置显微镜,日本OLYMPUS公司产品;680型台式酶标仪,美国Bio-Rad公司;EPICS-XL型流式细胞仪、DC-7型紫外分光光度计,美国Beckman Coulter公司;DYY-7C型电泳仪,购自北京六一仪器厂;JS-680全自动数码凝胶成像分析仪,购自上海培清科技有限公司;SRC20BA型高速冷冻离心机,日本HITACHI公司产品。
1.2 方法
1.2.1 细胞复苏及培养 取出冻存的非小细胞肺癌NCI-H1975细胞株,37℃恒温水浴融化,之后置于培养瓶内,培养瓶中有含10%灭活FBS、100 U/mL青霉素及100 g/mL链霉素的RPMI-1640完全培养液,在5%CO2、饱和湿度、37℃恒温细胞培养箱内进行细胞培养,每3~4天进行换液传代,待传代至第3代,NCI-H1975细胞贴壁生长至占满培养瓶80%时,即处于对数生长期,收集对数生长期的细胞作为实验对象。
1.2.2 姜黄素对NCI-H1975细胞增殖的抑制作用检测 取对数生长期NCI-H1975细胞,滴加0.25%胰蛋白酶消化液0.5 mL消化,孵育3 min后加入RPMI-1640完全培养液制备单细胞悬液,调整细胞浓度为2×105个/mL,将细胞液接种于96孔板内,每孔100 μL,分别滴加浓度为5 μmol/L、10 μmol/L、15 μmol/L、20 μmol/L、40 μmol/L的姜黄素溶液200 μL,每个浓度设6个复孔,另外设置姜黄素浓度为0 μmol/L的对照组以及不含细胞的空白组,空白组加入200 μL完全培养基,于5%CO2、饱和湿度、37℃恒温细胞培养箱内培养,分别孵育24 h、48 h、72 h后,滴加5 mg/mL MTT溶液20 μL/孔,培养4 h,采用高速冷冻离心机500 r/min離心10 min,弃上清,沉淀内加入100 μL DMSO溶液,振荡10 min充分溶解,采用680型台式酶标仪,在490 nm波长处测定各培养孔的光密度(OD值)。计算NCI-H1975细胞增殖抑制率(%)=(1-实验组OD值/对照组OD值)×100%,并计算作用48 h后,姜黄素的半数抑制量(IC50)及IC15值。endprint
1.2.3 姜黄素对NCI-H1975细胞耐药性的逆转作用检测 取对数生长期NCI-H1975细胞,滴加0.25%胰蛋白酶消化液0.5 mL消化,孵育3 min后加入RPMI-1640完全培养液制备单细胞悬液,调整细胞浓度为2×105个/mL,将细胞液接种于96孔板内,每孔100 μL,设置吉非替尼组、预处理+姜黄素+吉非替尼组、姜黄素+吉非替尼组、预处理+吉非替尼组、对照组及空白组,每组设6个复孔,吉非替尼组分别滴加0.01、0.04、0.1、0.4 μmol/L吉非替尼溶液200 μL;预处理+姜黄素+吉非替尼组首先采用100 μL 10 μmol/L姜黄素溶液预处理,孵育30 min后,分别滴加10 μmol/L姜黄素溶液100 μL及0.01、0.04、0.1、0.4 μmol/L吉非替尼溶液200 μL;姜黄素+吉非替尼组不经预处理,直接分别滴加10 μmol/L姜黄素溶液100 μL及0.01、0.04、0.1、0.4 μmol/L吉非替尼溶液200 μL;预处理+吉非替尼组采用100 μL 10 μmol/L姜黄素溶液预处理,孵育30 min后,分別滴加0.01、0.04、0.1、0.4 μmol/L吉非替尼溶液200 μL;对照组加入200 μL完全培养基;空白组不含细胞,只含200 μL完全培养基。继续孵育24 h、48 h、72 h后,按照1.2.2的步骤,采用MTT法检测各培养孔OD值,计算细胞增殖抑制率,并据此计算各组IC50值,根据逆转倍数=吉非替尼组IC50/姜黄素干预组IC50,计算逆转倍数。
1.2.4 流式细胞术(FCM)检测NCI-H1975细胞凋亡率 取对数生长期NCI-H1975细胞,制备浓度为2×105个/mL的单细胞悬液,取6孔板,接种细胞悬液2 mL/孔,加入RPMI-1640完全培养基200 μL,于5%CO2、饱和湿度、37℃恒温细胞培养箱内培养24 h,设置吉非替尼组、姜黄素组、联合用药组及对照组,每组设6个复孔,吉非替尼组加入0.1 μmol/L吉非替尼溶液200 μL,姜黄素组加入10 μmol/L姜黄素溶液200 μL,联合用药组首先采用100 μL 10 μmol/L姜黄素溶液预处理,孵育30 min后,分别滴加10 μmol/L姜黄素溶液100 μL+0.1 μmol/L吉非替尼溶液200 μL,对照组加入200 μL完全培养基,培养72 h后,加入0.25%胰蛋白酶4 mL进行消化,采用离心机1000 r/min速度离心5 min,弃上清液,PBS冲洗3次后,采用500 μL binding buffer重悬细胞,滴加异硫氰酸荧光素(FITC)标记的 Annexin V 10 μL,4℃70%乙醇5 mL进行固定;过夜后,1000 r/min速度离心5 min,弃乙醇,200 μL PBS重悬细胞,避光孵育 15 min后滴加碘化丙啶(PI)5 μL,避光孵育5 min后采用流式细胞仪检测各组NCI-H1975细胞凋亡率。
1.2.5 Western Blot法检测NCI-H1975细胞p-PI3K、p-Akt、p-Ras、p-ERK蛋白表达水平 按照1.2.4中的方法培养细胞及分组干预,每组取100 mg细胞,加入组织裂解液,提取组织蛋白质,按照试剂盒说明书操作,采用BCA法测定总蛋白浓度;取20 g蛋白质样品,采用电泳仪,通过10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法(SDS-PAGE),将凝胶转移到 PVDF 膜上,滴加5%脱脂奶粉,封闭90 min后,分别滴加小鼠p-PI3K、p-Akt、p-Ras、p-ERK一抗(1∶1000稀释),分子量为42 KD的β-Actin抗体(1∶400稀释)作为内参,孵育2 h,滴加辣根过氧化物酶标记的羊抗小鼠 IgG二抗(1∶1000稀释),孵育1 h,按照ECL检测试剂盒说明,进行显影、定影。采用数码凝胶成像分析仪扫描图像,分析电泳结果,计算p-PI3K、p-Akt、p-Ras、p-ERK蛋白表达水平。
1.3 统计学分析
采用SPSS17.0统计学软件包分析,符合正态性的计量资料以均数±标准差(x±s)表示,多组间资料比较采用单因素方差分析(One-Way ANOVA),采用GraphPad Prism软件绘制图表。P<0.05为差异有统计学意义。
2 结果
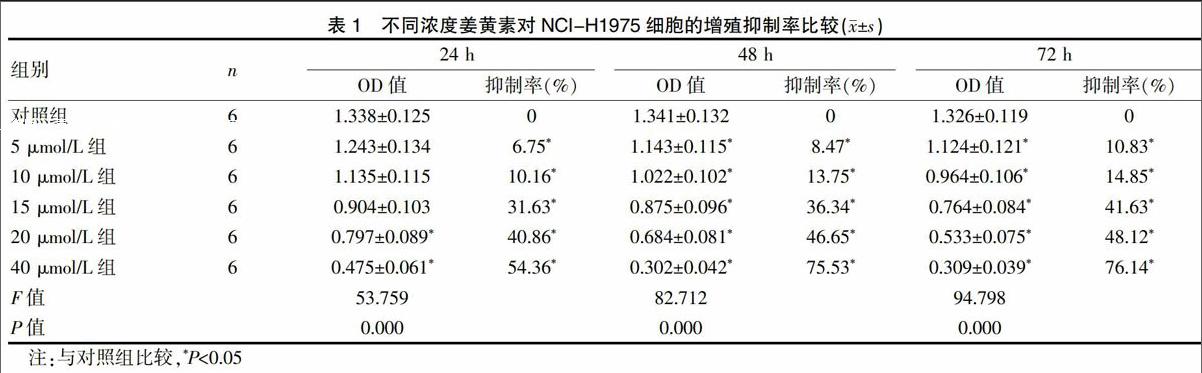
2.1 不同浓度姜黄素对NCI-H1975细胞的增殖抑制率比较
MTT法检测结果显示,与对照组比较,姜黄素5 μmol/L组、10 μmol/L组、15 μmol/L组、20 μmol/L组、40 μmol/L组在24 h、48 h、72 h对NCI-H1975细胞增殖抑制率明显较高,差异有统计学意义(P<0.05),并且具有剂量及时间依赖性。经计算姜黄素48 h对NCI-H1975细胞的IC50为25.1 μmol/L,IC15为10.75 μmol/L,选用10 μmol/L作为姜黄素后续实验浓度。见表1。
2.2 姜黄素不同用药方式对NCI-H1975细胞耐药性的逆转作用比较
结果显示,姜黄素能够明显逆转NCI-H1975细胞对吉非替尼的耐药性,且逆转倍数比较,预处理+姜黄素+吉非替尼组>姜黄素+吉非替尼组>预处理+吉非替尼组,差异有统计学意义(P<0.05)。见表2。
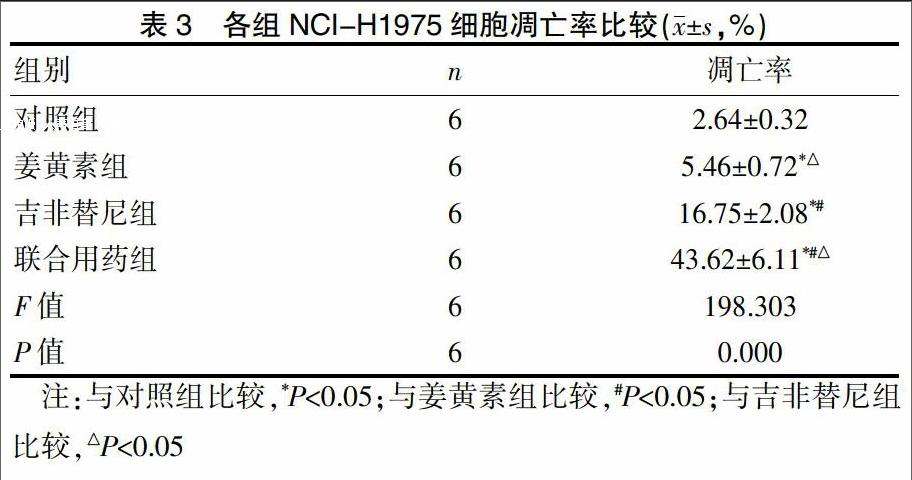
2.3 各组NCI-H1975细胞凋亡率比较
与对照组比较,吉非替尼组、姜黄素组、联合用药组NCI-H1975细胞凋亡率明显较高,差异有统计学意义(P<0.05),其中联合用药组>吉非替尼组>姜黄素组,差异有统计学意义(P<0.05)。见表3。
2.4 各组NCI-H1975细胞p-PI3K、p-Akt、p-Ras、p-ERK蛋白表达水平比较
与对照组比较,各组NCI-H1975细胞p-PI3K、p-Akt、p-Ras、p-ERK蛋白表达水平明显较低,差异有统计学意义(P<0.05),其中联合用药组<吉非替尼组<姜黄素组,差异有统计学意义(P<0.05)。见表4、封三图6。endprint
3讨论
NSCLC的发病率及死亡率近年来不断增加,给我国造成沉重的社会负担。目前,NSCLC治疗的主要手段仍为外科手术,但是只适用于早期患者,而大部分患者在确诊时已经发展至中晚期,失去手术治疗时机。传统的放疗、化疗等手段能一定程度延长患者生存期,但疗效有限,且副作用较多。分子靶向治疗是目前研究的热点,吉非替尼等TKI类药物是治疗EGFR突变阳性NSCLC的有效靶向药物,能显著延长患者无疾病进展生存期[7]。但是,吉非替尼治疗肺腺癌的缓解期仅为9~11个月,之后极易产生耐药性,影响药物疗效。吉非替尼耐药包括原发耐药和继发耐药,原发耐药可能与EGFR下游信号分子K-ras突变、抑癌基因PTEN功能丧失等机制有关[8],继发耐药的产生可能与EGFR基因exon-20二次突变、MET原癌基因扩增、肿瘤微环境改变等机制有关[9-10]。逆转吉非替尼耐药性对于提高治疗效果、改善患者预后意义重大。中药中多酚、黄酮、生物碱等多种成分在逆转肿瘤对化疗药物耐药性方面具有较好作用,姜黄素是提取自中药姜黄的多酚类活性成分,具有抗炎、抗氧化應激、诱导肿瘤细胞凋亡、抑制肿瘤血管形成等药理作用[11-13]。此外,姜黄素还是一种有效的肿瘤多药耐药逆转剂,有研究认为,姜黄素能够通过抑制p-糖蛋白(P-gp)表达,来降低乳腺癌耐药细胞株MCF-7/ADR对紫杉醇的耐药性[14];姜黄素还能通过抑制多药耐药相关蛋白(MRP)表达量,来提高吉西他滨对胰腺癌耐药株BXPC-3细胞移植瘤的治疗效果[15]。而目前关于姜黄素逆转TKI耐药性的研究较少。
本次研究选择吉非替尼耐药细胞株NCI-H1975细胞常规进行传代培养,分别采用5 μmol/L、10 μmol/L、15 μmol/L、20 μmol/L、40 μmol/L的姜黄素溶液进行干预,通过MTT法对各组细胞增殖抑制率进行检测,结果显示,与对照组比较,各浓度姜黄素在24 h、48 h、72 h对NCI-H1975细胞增殖抑制率明显较高,且浓度越高、作用时间越长,细胞增殖抑制率越高(P<0.05),表明姜黄素对于NCI-H1975细胞增殖有良好抑制作用,并且具有剂量及时间依赖性。姜黄素不同用药方式对NCI-H1975细胞耐药性的逆转作用比较结果显示,姜黄素能够明显逆转NCI-H1975细胞对吉非替尼的耐药性,且逆转倍数比较,预处理+姜黄素+吉非替尼组>姜黄素+吉非替尼组>预处理+吉非替尼组(P<0.05),表明经姜黄素预处理后,再给予姜黄素联合吉非替尼的用药方式能取得最好的逆转效果。表3检测结果显示,与对照组比较,吉非替尼组、姜黄素组、联合用药组NCI-H1975细胞凋亡率明显较高,且联合用药组>吉非替尼组>姜黄素组(P<0.05),表明姜黄素具有促进NCI-H1975细胞凋亡的作用,与吉非替尼联合使用促凋亡作用更强,二种药物具有协同作用。
TKI靶向药物是EGFR抑制剂,EGFR在许多NSCLC细胞中过高表达,主要通过PI3K-Akt和Ras-Raf-MEK-ERK两条下游信号通路来诱导肿瘤细胞增殖、侵袭、血管生成、肿瘤转移等,TKI类药物则可抑制信号通路信号转导,诱导细胞阻滞,加速细胞凋亡,起到抗肿瘤作用[16-18]。TKI的耐药性也与EGFR下游通路信号转导子的改变密切相关[19]。PI3K-Akt的信号转导子主要包括PI3K、磷脂酰肌醇依赖性激酶(PDK)、Akt等,在肿瘤血管形成和转移中起重要作用;Ras-Raf-MEK-ERK通路则主要包含细胞膜小分子蛋白Ras、Raf激酶、丝裂原活化的细胞外信号调节激酶(MEK)、ERK等,主要参与细胞增殖及凋亡相关基因转录的调节过程[20]。信号通路中相关蛋白分子的磷酸化水平与该信号通路的活化程度正相关。本研究结果显示,与对照组比较,各组NCI-H1975细胞p-PI3K、p-Akt、p-Ras、p-ERK蛋白表达水平明显较低,其中联合用药组<吉非替尼组<姜黄素组(P<0.05),表明姜黄素联合吉非替尼能够下调NCI-H1975细胞p-PI3K、p-Akt、p-Ras、p-ERK蛋白水平,抑制PI3K-Akt和Ras-Raf-MEK-ERK通路磷酸化水平,这可能是姜黄素逆转NCI-H1975细胞TKI耐药性的机制。
综上所述,姜黄素能有效逆转NCI-H1975细胞TKI靶向药物耐药性,抑制细胞增殖并促进其凋亡,最佳给药方式是姜黄素预处理后再与吉非替尼联用,作用机制可能与下调p-PI3K、p-Akt、p-Ras、p-ERK蛋白水平有关。
[参考文献]
[1] 丁宁宁,毛友生. 早期非小细胞肺癌淋巴结转移规律与清扫方式研究进展[J]. 中国肺癌杂志,2016,19(6):359-363.
[2] 戴莉,杨炯,潘雪凯,等. 姜黄素对肺腺癌A549细胞裸鼠移植瘤的抑制作用及其机制[J]. 中华实验外科杂志,2016,33(10):2358-2361.
[3] 金静思,贺巾钊,周黎明. 非小细胞肺癌分子靶向治疗药物的现状及进展[J]. 中国肿瘤临床,2015,42(17):881-885.
[4] Shi Y,Sun Y,Ding C,et al. China experts consensus on icotinib for non-small cell lung cancer treatment(2015 version)[J]. Annals of Translational Medicine,2015,3(18):489-494.
[5] Chong CR,J?覿nne PA. The quest to overcome resistance to EGFR-targeted therapies in cancer[J]. Nature Medicine,2013,19(11):1389.endprint
[6] 周豫昆,吴兰珍,韩芸,等. 姜黄素逆转多药耐药的研究进展[J]. 新疆中医药,2016,34(2):110.
[7] 谢亚琳,梁继珍,苏宁. 吉非替尼与厄洛替尼在EGFR基因敏感突变晚期NSCLC患者一线治疗中的疗效比较[J]. 南方医科大学学报,2015,35(3):446-449.
[8] Scrima M,De Marco C,Fabiani F,et al. Signaling networks associated with AKT activation in non-small cell lung cancer (NSCLC)[J]. Plos One,2012,7(2):e30427.
[9] Wu SB,Chou HC. Secretomic analysis uncovers the mechanisms of gefitinib resistance innon-small-cell lung carcinoma[J]. Biomarkers & Genomic Medicine,2014,6(4):167-170.
[10] 张婷,许海柱,陆俊彦,等. 吉非替尼在非小细胞肺癌治疗中耐药机制的研究进展[J]. 中国肿瘤临床与康复,2013,20(2):189-190.
[11] 周晶晶,郑昱辰,李明月,等. 姜黄素的药理作用研究进展[J]. 吉林医药学院学报,2016,37(4):304-307.
[12] 石翔翔,唐涛,张颖杰,等. 姜黄素对人肺腺癌NCI-H1975细胞放射的增敏作用[J]. 国际呼吸杂志,2016, 36(8):580-583.
[13] 汪丛丛,庄静,冯福彬,等. 姜黄素抑制肺癌细胞血管拟态形成机制探讨[J]. 中华肿瘤防治杂志,2015,22(4):243-246.
[14] Wang J,Wang F,Li F,et al. A multifunctional poly(curcumin) nanomedicine for dual-modal targeted delivery,intracellular responsive release,dual-drug treatment and imaging of multidrug resistant cancer cells[J]. Journal of Materials Chemistry B Materials for Biology & Medicine,2016,4(17):2954.
[15] 张洪军,张兆伟,刘峰,等. 姜黄素增强胰腺癌细胞移植瘤对吉西他滨化疗敏感性的实验研究[J]. 中华临床医师杂志:电子版,2013,7(21):119-121.
[16] 张璇. 中医药抑制NSCLC对EGFR-TKI药物获得性耐药的研究进展[J]. 医学综述,2012,18(8):1222-1224.
[17] 李优,王剑,牟好,等. 姜黄素通过PI3K/AKT/mTOR通路抑制TGF-β1诱导的肺癌细胞上皮间质转化[J]. 腫瘤学杂志,2016,22(8):607-614.
[18] 李松霖,谭群友,王如文,等. 新型姜黄素纳米粒对Lewis肺癌细胞增殖、凋亡的影响[J]. 第三军医大学学报,2015,37(2):141-145.
[19] 车丽娜,陈军. 晚期非小细胞肺癌EGFR-TKI获得性耐药机制及治疗策略[J]. 现代中西医结合杂志,2015, 24(30):3410-3412.
[20] 赵莹,李英姿. 姜黄素对非小细胞肺癌 A459细胞增殖及 CDH13甲基化状态的影响[J]. 山东医药,2017,57(6):9-12.endprint
