神经修复导管管壁结构研究进展
2017-10-19张婉衡刘萍萍郑国强
张婉衡,刘萍萍,郑国强
(1.郑州大学 材料科学与工程学院, 河南 郑州 450001;2.郑州大学 基础医学院, 河南 郑州 450001)
·综述·
神经修复导管管壁结构研究进展
张婉衡1,刘萍萍2,郑国强1
(1.郑州大学 材料科学与工程学院, 河南 郑州 450001;2.郑州大学 基础医学院, 河南 郑州 450001)
神经导管是运用组织工程学的原理和方法,用生物或非生物材料制成的、可以在周围神经损伤断端建立神经桥接的管状结构,它为损伤的神经提供适当的神经再生微环境。神经导管不同的管壁结构对神经再生有一定的影响。神经导管由单层结构发展到双层结构和多层结构,通过不同管壁结构的探索来提高神经修复和再生的效果取得了一定进展。但是目前尚未完全仿制出具有天然神经结构的支架,无论单层、双层还是多层结构的神经修复导管仍存在一些问题。神经导管在神经修复中的应用前景广阔,制造出力学相容性优异、生物降解性良好、同时具有完整三维结构的神经导管是具有探索意义的一个方向。
神经修复; 神经导管; 神经再生; 管壁结构
Abstract:Nerve conduits with tubular structure using the principle and method of tissue engineering,made of biomaterial or non-biomaterial materials are used to bridge the gap between the proximal and the distal nerve stumps.It could provide appropriate micro-environment for nerve repair and regeneration.Nerve conduits with different wall structures take good effect on nerve regeneration.The researches on different wall structure have made some progress.While the tubular nerve constructs with highly aligned architecture mimicking the native tissue have not yet developed.Both the single-layer/double-layer and multilayer structure of nerve conduits still have some problems.The development of nerve conduits is promising but how to fabricate a nerve conduit with excellent mechanical properties,good biodegradability,and complete three-dimensional structure is a meaningful direction.
Keywords:nerve repair; nerve conduit; nerve regeneration; wall structure
0 前言
近年来,随着工业和交通运输业的快速发展,周围神经损伤发生率逐年上升。周围神经损伤会导致运动和感觉功能障碍并有可能引发终身残疾[1],因此神经再生问题成为了医学界的重大难题[2]。当神经缺损距离较短时,通常采用“端对端”吻合技术,直接对神经两断端进行缝合[3],但长距离神经缺损却无法直接进行缝合,所以自体神经移植被应用于修复长距离的神经损伤,成为目前临床进行神经修复的主要手段[4]。然而由于供体来源有限、组织结构难以匹配等原因,未能在临床上广泛使用[5],而其他方法(如:异体移植)会不可避免地带来免疫排斥反应,需要联合应用免疫抑制剂,影响患者的生活质量,并且移植成功率较低[6],这些问题引发了研究者们对神经修复进行进一步的探索。目前随着组织工程的发展,用组织工程学的基本原理和方法构建神经修复导管成为研究热点[7-10]。它是根据神经再生的生物学特性,运用组织工程学的原理和方法,用生物或非生物材料设计和制作的管状结构,可应用于修复周围神经损伤。它能在断损神经两端建立桥接,使神经轴突沿着管壁从近端向远端生长[11]。神经修复是非常复杂的生物学问题,调节不同的导管构型对神经再生修复有着良好的作用。现将不同结构神经修复导管的最新进展作如下综述。目前常用的神经修复导管按其管壁结构可分为:单层、双层和多层结构神经导管。
1 单层结构神经导管
科学家们最早对具有单层结构的神经导管进行了相关研究。早在19世纪末就出现了首例关于神经再生导管的报道,Gluck首次尝试采用脱骨钙制成骨制导管桥接神经缺损部位,来进行周围神经损伤的修复。随后,Vanliar应用去石灰骨导管成功桥接并修复3 cm长的神经损伤。1898年,Forssan提出了神经趋化生长学说,为神经导管的应用提供了理论基础。20世纪90年代,Lundborg等[12]利用Y型硅胶管实验首次建立了神经再生室的模型,成功修复了大鼠10 mm的坐骨神经缺损。此后,关于神经导管修复神经损伤的研究开始进入快速发展的时期[13-15]。有大量研究证明,在轴突形成的过程中,具有引导神经细胞生长的取向结构和加入一定的生长因子可以促进轴突生长[16]。Chen等[17]通过设计组装了新的接收装置和调节静电纺丝的工艺参数,成功制备出纤维表面具有纵向沟槽的单层的完整管状支架,将其植入大鼠坐骨神经损伤模型中进行观察研究,并与纤维表面无沟槽的管状支架和自体神经移植进行对照实验。经过电生理、大鼠行进路线、腓肠肌、三重免疫荧光法和免疫组织化学法等一系列分析表明,纳米纤维表面的纵向沟槽可以有效提高坐骨神经的再生。因为纤维表面纵向沟槽的引入,使之形成高度有序的二级结构,同时比表面积大大增加,有利于细胞黏附和生长。这种由取向纳米纤维组成且纤维表面上具有纵向排列沟槽的多孔导管支架为周围神经修复与再生提供了新的方法。Johnson等[18]利用3D打印的方法设计并制作了单层结构的神经导管。3D打印方法可以程序化地整合神经通路的仿生物理结构和生化功能,制备出解剖学准确、结构较复杂的几何支架;同时它可以提供重要信息,包括原生的仿生学解剖结构、特定的物理引导(如:微槽结构及以梯度释放生长因子形式表现的生化信号)。在神经修复中,当面对复杂的分岔混合神经通路时,可以将原始组织结构作为几何基板进行仿制和应用,为复杂的不同部位神经修复再生问题提供了较为普遍的解决策略,如图1所示。图1(b)中箭头处为“经染色的细胞”部位。

(a) 表面具有取向结构

(b) 原始神经元细胞在神经导管上的培养情况
Yucel等[19]设计了一种可生物降解的聚酯基神经导管,将电纺的纳米纤维放到表面经过微处理的多孔薄膜上,然后卷绕多孔薄膜使之成为管状结构,再用丙烯酸酯作为胶黏剂固定后得到神经导管。这种导管包含内外两种结构:外部的单层管壁是用模板法浇铸成型的多孔膜,它为导管提供了足够的力学支撑;内部填充物是静电纺丝纳米纤维,它为轴突生长提供了导向作用,同时起到保护作用的外管的降解速率小于内部的取向纤维,在神经修复得以完全实现后逐渐降解。外部管状结构的尺寸、孔隙率和孔径显示它能保证原生的适合神经再生细胞的迁徙、排列和存活,且具有较高的力学强度,能为神经再生提供保护作用;内部的取向纳米纤维沿着外管管壁纵向沟槽的方向排布,其性能尤其受到聚合物浓度的影响。这一结构设计在神经修复再生的研究上具有重要的意义,为神经修复的发展提供了一种新的思路。
许多研究证明,在体外实验中材料表面形貌会影响细胞的生物学行为。Wang等[20]利用静电纺丝技术成功制备出了微管阵列膜,并研究了具有独特的纵向表面形貌的微管阵列膜在体内和体外实验中促进周围神经再生的效率,通过将雪旺细胞、脊髓运动神经元和背根神经节神经元种植在微管阵列膜上,研究这种纵向排布结构对神经细胞的生物学特性和生物学行为的影响。结果表明,微管阵列膜在不影响其他关键生物学特性表达(如:细胞增殖及神经营养因子表达)的情况下,可有效引导雪旺细胞的定向迁移。此外,微管阵列膜还可以引导不同类型的神经元突起进行定向延伸。同时,由扫描电子显微镜(SEM)的结果显示,微管阵列膜的定向引导作用是由基体中较小的神经纤维和微管阵列膜中胶原纤维协同作用的结果。这一研究表明,这种微管阵列膜可以通过修改重要的生物学行为及引导定向神经生长来促进周围神经再生,具有极为重要的意义。图2所示为左旋聚乳酸(PLLA)微管阵列纤维膜表面的SEM图。

(a) 表面上有纵向排列的沟槽
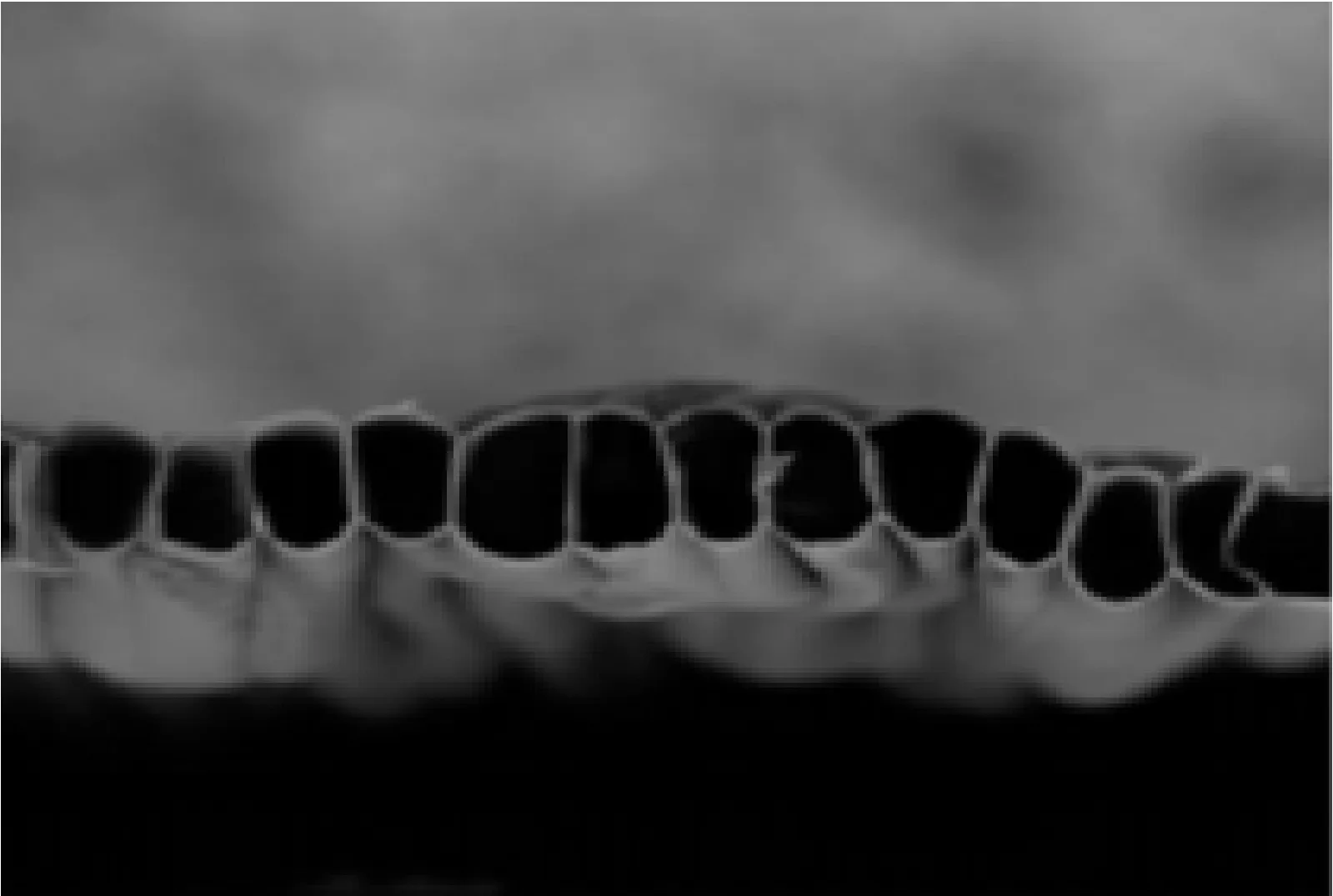
(b) 微管阵列的薄膜的横截面结构

(c) 高分辨率下孔洞可见

(d) 微管阵列纤维膜以及神经导管结构
一般来说,这种单层结构的导管结构简单,易于制作,同时它可以提供引导轴突生长的取向的表面形貌结构,具有较好的修复效果,在神经修复的早期一直是研究热点,许多研究者都致力于怎样提供表面取向结构而最大化细胞迁移和排列生长的效果,并取得了一定的进展[21-22]。但是,单层管状结构的神经导管存在着诸多问题,比如力学相容性问题。当力学强度过小时,神经导管在外科手术过程中无法提供一定的力学支撑,导致导管撕裂变形;而当力学强度过大时,导管在植入动物体后,又会对其他组织造成机械性损伤。所以,良好的力学相容性对神经导管在神经修复中的应用是十分重要的。
2 双层结构神经导管
随着神经导管的发展和对结构要求的进一步提高,双层结构神经导管应运而生。它具有更好的力学相容性,能为神经再生提供稳定的微环境。Zhu等[23]通过静电纺丝过程制作了具有双层结构的三维无缝的多孔纳米纤维神经导管。其内腔表面有纵向对齐的电纺纤维,外层是随机排列的纳米纤维,以提供结构支撑。实验证明,这种结构有利于纤维被膜的形成,经过组织形态学和电生理学测评发现,这种双层结构的修复效果堪与自体神经移植相媲美。
Xie等[24]利用静电纺丝的方法构建模仿神经再生模式的双层结构神经导管。与由单层取向纳米纤维构成的神经导管不同,双层的神经导管由内层的取向纳米纤维和外层的无序排列纳米纤维构成,因为无序排列纳米纤维各向同性的力学特性,双层神经导管优异的力学性能而使其在外科手术期间有更好的耐撕裂特性。分别将背根神经节种植在双层神经导管支架上和植入大鼠坐骨神经损伤模型中,通过评估神经突起的生长、骨形态计量学分析和功能表征表明,双层神经导管支架在促进轴突再生和功能恢复上存在巨大的潜力和应用价值。如图3所示,箭头所指处即为背根神经节在取向的聚己内酯(PCL)纳米纤维上的生长情况。

(a) 双层结构神经导管示意图

(b) 背根神经节在取向的聚己内酯(PCL)纳米纤维上的生长情况
图3双层管壁结构和施旺细胞在神经导管中生长情况
Duda等[25]利用直接的“浇铸—凝固技术”[26-28]制作了神经导管的壳聚糖芯层结构,进而通过静电纺丝技术,在芯层结构的基础上包裹了PCL壳层结构,形成了芯—壳双层结构的神经导管并植入神经缺损10 mm大鼠体内。通过组织切片、电生理记录、功能测试等一系列表征发现,神经导管引发了免疫排斥反应,而将芯层和壳层分开移植后发现,引发免疫排斥反应的是PCL降解过程中的降解碎片。
刘国华等[29]用聚乳酸聚羟基乙酸共聚物(PLGA)丝经过二维三相编织[30-31]得到具有编织结构的导管,之后采用手工浸渍涂层法[32-33]将管状编织物和壳聚糖的复合,热定型后即得到具有一定力学性能以及可控编织结构的双层神经再生导管。首先,通过编织的方法制成多孔中空的管状支架,作为所需神经导管的外壁;接着,采用浸泡涂层的方法,将其浸于壳聚糖浆液中,待干燥定型抽出芯轴后得到PLGA纤维。经径向压缩性能测试、轴向拉伸性能测试、体外降解实验以及动物实验的研究表明,该支架具有适合的力学强度、孔隙率以及在组织工程应用中必需的生物可降解性,同时编织成型的微孔外壁为细胞与外界之间的营养交换提供了可能,可有效地桥接周围神经缺损。
双层结构的神经导管不仅为神经纤维的再生提供了引导作用,而且使导管的力学强度有了极大的改善,这使神经导管的研究发展进入到新的阶段。但与此同时,人工合成的双层神经导管支架的生物降解力[34]欠佳,过高的降解率导致对再生轴突的保护不足,而过慢的降解亦会引起排异反应,并造成神经压迫症状。双层导管在获得表面取向结构上具有一定限制,同时在导管降解时期往往出现块状崩塌现象,其碎片会引起不良炎症反应,同时还导致局部pH值下降,酸性过大,不利于细胞生长和神经的修复再生。
3 多层结构神经导管
为了进一步延伸对表面取向结构的探索,研究者们在双层神经导管的基础上研究出多层结构神经导管。Li等[35]研制了一种具有多层壁结构的神经导管。首先从导管表面沿纵轴排列的取向形貌入手,之后综合利用溶液浇铸、物理打印和滚动烧结的方法,经过卷绕得到神经导管。制备的导管具有多个管腔壁以及精确地沿纵轴排列的形貌,与传统中空导管相比,其比表面积增大了4倍到8倍,同时导管的物理参数,比如管壁厚度、管腔数量、导管的长度和直径都是人为可控的。这些结果显示,这种结构有利于细胞浸润和增殖。同时,这种成型技术非常灵活,可以在多个高分子体系上使用,为替代自体神经修复周围神经缺损和脊髓损伤提供了潜在的应用价值,具有十分广阔的应用前景,如图4所示。其工艺过程大致如下:将溶解的PLLA覆盖在主模板上,允许溶剂挥发不完全,之后第二层模板完全覆盖PLLA膜,然后双面PLLA膜从模板上取下,放到玻璃板上。分别采用两种不同的制备方法:(1)一根不锈钢金属线用PLLA溶液固定于膜上,其余金属线沿着长度方向每隔一定距离放置在膜上,进行卷绕,拿去不锈钢金属线得到的导管;(2)用PLLA条带作为间隔器进行卷绕,卷绕和固定PLLA边缘后得到的导管。

图4 双面具有特定形貌的左旋聚乳酸(PLLA)膜和多层导管的制作过程
Mobasseri等[36]研究了聚己内酯/聚乳酸(PCL/PLA)膜表面不同取向沟槽的类型和管壁不同厚度(70、100、120和210 μm)对神经再生的作用。将PCL和PLA(4∶1)溶于二氯甲烷后浇铸到用带有不同沟槽形貌的硅基板上,分别得到SL(斜坡状)型、V型、SQ(方形)型等表面不同形貌微槽的薄膜。其中微槽深度约为5 μm,经过卷绕并在热台上密封后即得到神经导管。通过对比SL型沟槽神经导管管壁的不同厚度对神经再生的影响,以及无沟槽、L型沟槽、V型沟槽和SQ型微槽的神经再生效果,结果表明,带有取向沟槽表面结构的神经导管其细胞粘附、增殖和再生效果与无沟槽结构相比均得到了提高,其中SL型沟槽管壁壁厚为70 μm的神经导管的神经再生效果最好,堪比自体神经修复,同时在体外大鼠坐骨神经修复实验中也取得了良好的效果。
Kim等[37]探索出在同一张膜上电纺出取向纤维和无序纤维的新方法。通过这种方法制备的薄膜经过层层卷绕后成为多层导管,它的较内层具有取向结构为轴突再生提供导向作用,较外层为无序的纳米纤维层,实验显示,它不仅可以促进神经元细胞的增殖,而且可以弥补取向纤维层力学性能上的不足。这种方法简单易行,可较具规模的制备,同时其两端的取向纤维膜是透明的,这在神经重建手术期间为后续密切观察起着至关重要的作用,如图5所示。

(a) 卷绕过程

(b) 卷绕后得到的数码照片

(c) 导管管壁的SEM图

(d) 神经导管截面的SEM图
由于碳纳米管优异的化学性能、力学性能和电性能以及碳纳米管在脊髓损伤中起到的重要作用[38-40],Ahn等[41]用酸氧化法将羧基化的碳纳米管接枝在玻璃纤维表面[42],并巧妙地利用表面接枝碳纳米管的磷酸盐玻璃纤维、聚乳酸纳米纤维膜和三维L/DL聚乳酸(PLDLA)管构造了多层神经导管支架,并将其植入神经缺损10 mm的大鼠体内,实验结果显示,16周后轴突数量增加,肌肉功能有所恢复,电生理表现良好,得到了较好的修复效果。
Goto等[43]在卷绕成型的多层神经导管中引入雪旺细胞层,以提高神经再生的效果。首先将海藻酸纳溶液均匀铺展在孔径约为3 μm的多孔膜上,再浸渍到CaCl2溶液中2 min,随即在表面形成海藻酸钙凝胶薄层。将胶原、低糖型DMEM(—种含各种氨基酸和葡萄糖的培养基)和磷酸盐缓冲溶液(PBS)的混合溶液(pH约为7)浇注到海藻酸钙凝胶层上恒温静置24 h,可得到胶原蛋白凝胶层。然后在层表面上涂覆一层层粘连蛋白后,将雪旺细胞接种到其表面上。再将含有雪旺细胞的胶原凝胶层浸入到柠檬酸钠溶液中,多孔膜上较薄的海藻酸钙凝胶层溶解掉。至此雪旺细胞/胶原凝胶层能够很容易的从多孔膜上脱离,然后用平头镊子人工地卷绕,即可以得到所需的神经导管。与神经修复中常用的雪旺细胞、神经元细胞、PC12细胞和背根神经节细胞分别共培养后发现,它非常有效地促进轴突生长,取得了良好的再生效果,同时胶原蛋白凝胶层与层之间的间隙可以使神经细胞进行迁移和神经轴突纵深生长。
多层结构神经导管在双层结构的基础上,进一步优化了力学性能,同时在探索表面引导结构方面有了更大的发挥余地,可以从不同角度、不同方法上探索不同的取向形貌对神经再生的作用。但是生物降解力不佳以及降解时出现块状崩塌的问题仍然没有得到有效改善,这些问题有待研究者进行下一步研究。不仅如此,多层神经导管后期的成型过程多是通过卷绕成型,有黏接缝的存在,导致了非完整的三维结构,这也是多层导管不能稳定发挥其功能的主要原因。
4 结论与展望
神经导管在神经修复领域具有广阔的应用前景,尽管神经导管的种类繁多,但多数仍处于实验室研究阶段,尚未进入临床,且目前还没有一种能够完全代替自体神经移植来修复周围神经缺损。另外,组织工程化人工神经的研究在国内外还处于初级阶段,许多关键问题尚需细胞学、材料学、临床医学等专家联合攻关解决。以上报道的单层、双层以及多层结构的神经修复导管虽然有一定的先进性,但仍存在一些共性问题,比如降解时导管会出现块状崩塌现象,降解过程中酸性降解产物堆积导致的无菌性炎症反应。基于以上问题,本课题组期望设计出一种具有梯度降解管壁结构的神经导管,这样的结构使得神经导管在降解过程中,由内到外梯度降解,整个降解过程更加缓和有序,尽可能地避免了块状降解产物的出现并大大降低了无菌性炎症出现的几率,使得其在神经修复领域有更大的潜在应用价值。与此同时,制造出具有力学相容性优异、梯度逐层降解、同时具有完整三维结构的神经导管是具有探索意义的一个方向,值得我们进行更进一步的研究和探索。
[1] ESER F,AKTEKIN L A,BODUR H,et al.Etiological factors of traumatic peripheral nerve injuries [J].Neurology India,2009,57(4):434-437.
[2] JIA H,WANG Y,TONG X J,et al.Biocompatibility of acellular nerves of different mammalian species for nerve tissue engineering [J].Artificial Cells Blood Substitutes & Immobilization Biotechnology,2011,39(6):366-375.
[3] SANGHVI A B,MURRAY J L,SCHMIDT C E.Tissue engineering of peripheral nerve [J].Chapter,2008:2811-2819.
[4] LI M,LIU F,SHI S,et al.Bridging gaps between the recurrent laryngeal nerve and ansa cervicalis using autologous nerve grafts [J].Journal of Voice Official Journal of the Voice Foundation,2013,27(3):381-387.
[5] RAY W Z,MACKINNON S E.Management of nerve gaps: autografts,allografts,nerve transfers,and end-to-side neurorrhaphy [J].Experimental Neurology,2010,223(1):77-85.
[6] RUSTEMEYER J,DICKE U.Correlation of three sciatic functional indices with histomorphometric findings in a rat sciatic nerve allograft repair model [J].Microsurgery,2009,29(7):560-567.
[7] SUBRAMANIAN A,KRISHNAN U M,SETHURAMAN S.Development of biomaterial scaffold for nerve tissue engineering: Biomaterial mediated neural regeneration [J].Journal of Biomedical Science,2009,16(1):108.
[8] HADLOCK T,SUNDBACK C,HUNTER D,et al.A polymer foam conduit seeded with schwann cells promotes guided peripheral nerve regeneration [J].Tissue Engineering,2000,6(2):119-127.
[9] BINI T B,XU G X.Peripheral nerve regeneration by microbraided poly (L-lactide-co-glycolide) biodegradable polymer fibers [J].Journal of Biomedical Materials Research Part A,2004,68(2):286-295.
[10] KIM I Y,SEO S J,MOON H S,et al.Chitosan and its derivatives for tissue engineering applications [J].Biotechnology Advances,2008,26(1):1-21.
[11] TAN A,RAJADAS J,SEIFALIAN A M.Biochemical engineering nerve conduits using peptide amphiphiles [J].Journal of Controlled Release Official Journal of the Controlled Release Society,2012,163(3):342-352.
[12] LUNDBORG G,LONGO F M,VARON S.Nerve regeneration model and trophic factors in vivo [J].Brain Research,1982,232(1):157-161.
[13] 刁云峰,商崇智.神经导管生物材料在神经修复中的应用[J].中国组织工程研究与临床康复,2011,15(34):6424-6427.
[14] 谢峰,李青峰,顾彬,等.神经导管修复周围神经损伤的临床应用[J].整形再造外科杂志,2004,1(3):144-146.
[15] 杨华林.神经导管生物材料修复周围神经损伤的动物实验[J].中国组织工程研究与临床康复,2010,14(29):5439-5442.
[16] CHWALEK K,DENING Y,HINÜBER C,et al.Providing the right cues in nerve guidance conduits: biofunctionalization versus,fiber profile to facilitate oriented neuronal outgrowth [J].Journal of Physical Organic Chemistry,2016,26(4):327-334.
[17] CHEN H,OUYANG Y,NIU H,et al.Nerve guidance conduits from aligned nanofibers: improvement of nerve regeneration through longitudinal nanogrooves on a fiber surface [J].ACS Applied Materials & Interfaces,2015,7(13):7189-7196.
[18] JOHNSON B N,LANCASTER K Z,ZHEN G,et al.3D printed anatomical nerve regeneration pathways [J].Advanced Functional Materials,2015,25(39):6205-6217.
[19] YUCEL D,KOSE G T,HASIRCI V.Polyester based nerve guidance conduit design [J].Biomaterials,2010,31(7):1596-1603.
[20] WANG Y,WANG W,YAN W,et al.Orientated guidance of peripheral nerve regeneration using conduits with a microtube array sheet (MTAS) [J].Acs Applied Mate-rials & Interfaces,2015,7(16):8437-8450.
[21] 黄晨.静电纺管状支架的制备及其在组织工程中的应用[D].上海:东华大学,2013.
[22] 胡旭东,王光林.静电纺丝纳米纤维支架在神经组织工程中的研究进展[J].中国修复重建外科杂志,2010,24(9):1133-1137.
[23] ZHU Y,WANG A,PATEL S,et al.Engineering bi-la-yer nanofibrous conduits for peripheral nerve regeneration [J].Tissue Engineering Part C Methods,2011,17(7):705-715.
[24] XIE J,MACEWAN M R,LIU W,et al.Nerve guidance conduits based on double-layered scaffolds of electrospun nanofibers for repairing the peripheral nervous system [J].Acs Applied Materials & Interfaces,2014,6(12):9472-9480.
[25] DUDA S,DREYER L,BEHRENS P,et al.Outer electrospun polycaprolactone shell induces massive foreign body reaction and impairs axonal regeneration through 3D multichannel chitosan nerve guides[J].Biomed Research International,2014(3):835269.
[26] KUBERKA M,HESCHEL I,GLASMACHER B,et al.Preparation of collagen scaffolds and their applications in tissue engineering[J].Biomedical Engineering-biomedi-zinische Technik,2002,47(s1a):485-487.
[27] SCHOOF H,BRUNS L,FISCHER A,et al.Dendritic ice morphology in unidirectionally solidified collagen suspensions [J].Journal of Crystal Growth,2000,209(1):122-129.
[28] SCHOOF H,APEL J,HESCHEL I,et al.Control of pore structure and size in freeze-dried collagen sponges [J].Journal of Biomedical Materials Research Part A,2001,58(4):352-357.
[29] 刘国华.编织结构生物可降解神经再生导管的制造及性能研究[D].上海:东华大学,2006.
[30] 黄故.现代纺织复合材料[M].北京:中国纺织出版,2001.
[31] 杨桂,敖大新,张志勇,等.编织结构复合材料制作、工艺及工业实践[M].北京:科学出版社,1999.
[32] 罗瑞林.织物涂层[M].北京:中国纺织出版社,1994.
[33] 胡传炘,宋幼慧.涂层技术原理和应用[M].北京:化学工业出版社,2000.
[34] RUITER G C W D,MALESSY M J A,YASZEMSKI M J,et al.Designing ideal conduits for peripheral nerve repair[J].Neurosurgical Focus,2009,26(2):E5.
[35] LI J,SHI R.Fabrication of patterned multi-walled poly-l-lactic acid conduits for nerve regeneration [J].Journal of Neuroscience Methods,2007,165(2):257-264.
[36] MOBASSERI A,FARONI A,MINOGUE B M,et al.Polymer scaffolds with preferential parallel grooves enhance nerve regeneration [J].Tissue Engineering Part A,2015,21(5-6):1152.
[37] KIM J I,HWANG T I,AGUILAR L E,et al.A controlled design of aligned and random nanofibers for 3D bi-functionalized nerve conduits fabricated via a novel electrospinning set-up [J].Scientific Reports,2016(6):23761.
[38] LEE H J,PARK J,YOON O J,et al.Amine-modified single-walled carbon nanotubes protect neurons from injury in a rat stroke model[J].Nature Nanotechnology,2011, 6(2):121-125.
[39] ROMAN J A,NIEDZIELKO T L,HADDON R C,et al.Single-walled carbon nanotubes chemically functionalized with polyethylene glycol promote tissue repair in a rat model of spinal cord injury[J].Journal of Neurotrauma,2011,28(11):2349-2362.
[40] MATTSON M P,HADDON R C,RAO A M.Molecular functionalization of carbon nanotubes and use as substrates for neuronal growth:US6670179[P].2003.
[41] AHN H S,HWANG J Y,MIN S K,et al.Carbon-nanotube-interfaced glass fiber scaffold for regeneration of transected sciatic nerve [J].Acta Biomaterialia,2014,13:324-334.
[42] KIM Y P,LEE G S,KIM J W,et al.Phosphate glass fibres promote neurite outgrowth and early regeneration in a peripheral nerve injury model [J].Journal of Tissue Engineering & Regeneration Medicine,2015,9(3):236-246.
[43] GOTO E,MUKOZAWA M,MORI H,et al.A rolled sheet of collagen gel with cultured schwann cells: model of nerve conduit to enhance neurite growth [J].Journal of Bioscience & Bioengineering,2010,109(5):512-518.
ResearchandDevelopmentsofNerveConduitswithWallStructure
ZHANGWan-heng1,LIUPing-ping2,ZHENGGuo-qiang1
(1.College of Materials Science and Engineering,Zhengzhou University,Zhengzhou 450001,Henan, China; 2.School of Basic Medical Sciences,Zhengzhou University,Zhengzhou 450001,Henan, China)
R 318.08
A
1009-5993(2017)03-0001-08
2017-05-07)
张婉衡(1993—),女,硕士研究生,主要从事医用导管的研究。
