动态增强磁共振成像在肺癌脊柱转移判别诊断中的应用
2017-10-19LANGNing
郎 宁 LANG Ning
苏敏英2 SU Minying
张恩龙3 ZHANG Enlong Hon J.Yu2
袁慧书1 YUAN Huishu
动态增强磁共振成像在肺癌脊柱转移判别诊断中的应用
郎 宁1LANG Ning
苏敏英2SU Minying
张恩龙3ZHANG Enlong Hon J.Yu2
袁慧书1YUAN Huishu
作者单位
1. 北京大学第三医院放射科 北京100191
2. 加州大学Tu&Yun肿瘤功能成像中心 美国加利福尼亚州 CA 92697-5020
3. 北京大学国际医院放射科 北京 102206
目的 探讨动态增强磁共振成像(DCE-MRI)在肺癌脊柱转移判别诊断中的应用价值。资料与方法 对61例脊柱转移癌患者行DCE-MRI,对扫描获得的图像进行后处理,获得信号强度-时间曲线、曲线上升期信号强度增幅(Peak SE%)、曲线最大上升线性斜率(Max Wash-in SE%)、曲线下降斜率(Wash-out SE%)等半定量参数,应用双室药物代谢动力学分析获得容积转运常数(Ktrans)和速率常数(Kep)等定量参数。应用CHAID法建立决策树模型,确定最佳分类参数,并识别最优分割。结果 61例脊柱转移癌患者的DCE-MRI扫描参数中Wash-out SE%、Kep在肺癌与其他肿瘤脊柱转移之间差异有统计学意义(P<0.01),而Peak SE%、Max Wash-in SE%、Ktrans在两者之间差异无统计学意义(P>0.05);当Wash-out SE%>-660.6%且Max Wash-in SE%>98.0%时约94.7%的患者原发灶可能来源于肺;使用本研究建立的决策树进行判别时,10-折交叉验证显示其错误率为(29.5±5.8)%。结论 采用DCE-MRI半定量及定量分析参数进行肺癌脊柱转移的判别诊断具有可行性,可以为脊柱转移癌的来源鉴别及临床治疗提供参考依据。
肺肿瘤;肿瘤转移;脊椎肿瘤;磁共振成像;图像增强;诊断,鉴别
脊柱转移癌是脊柱常见占位性病变,约占骨转移的70%[1]。进行脊柱MRI检查的患者主要分两种情况,一种是已经明确原发病灶,出现脊柱转移后进行MRI检查以了解转移的位置、范围、数量等情况;另一种是出现神经受压、腰背部疼痛等症状就诊,脊柱转移癌是首次发现,对于此类患者,寻找原发灶成为临床最为关注的问题。在常规影像上,不同原发灶的脊柱转移癌一般特征相似,因此难以明确原发灶的来源,临床上为了寻找原发癌往往要进行多种辅助检查,且大多需要有创穿刺活检明确。目前尚未见应用无创影像学方法寻找转移瘤原发灶的研究,本研究通过收集并分析脊柱转移癌患者的动态增强磁共振成像(DCEMRI)半定量和定量分析参数,希望借助这种无创的方法对脊柱转移癌的原发灶来源作出提示,从而为临床诊断及治疗提供参考依据。
1 资料与方法
1.1 研究对象 回顾性分析2011年9月-2015年8月于北京大学第三医院诊治的经病理或者临床治疗随诊证实、有明确原发灶的61例脊柱转移癌患者,所有患者均行脊柱DCE-MRI。纳入标准:进行MRI前临床医师怀疑脊柱肿瘤,且未经任何治疗(如手术、放化疗)或穿刺活检;MRI检查后进行病理学或临床治疗随访确诊为转移癌。排除标准:有治疗史或穿刺活检史;无法配合或拒绝接受MRI增强扫描者。61例脊柱转移癌患者中男32例,女29例;年龄27~82岁,平均(56.6±12.1)岁,患者年龄均为确诊脊柱转移癌时的实际年龄,按原发灶部位分为来源于肺及来源于其他部位两类:肺癌30例,其他肿瘤31例,包括乳腺癌9例,前列腺癌6例,甲状腺癌7例,肝癌6例,肾癌3例。
1.2 仪器与方法 使用Siemens Trio 3T或GE MR 750超导型全身MR扫描仪,先行MR常规平扫检查,扫描序列包括横轴位T2WI(TR/TE=639 ms/14 ms)、矢状位T2WI(TR/TE=2800 ms/109 ms)、矢状位T1WI(TR/TE=550 ms/11 ms)和脂肪抑制T2WI(TR/TE=3100 ms/98 ms)。常规平扫后进行DCE-MRI扫描,采用高压注射器注入造影剂,按照0.2 mmol/kg经肘正中静脉注入Gd-DTPA,注射流速为2 ml/s,注射后用20 ml生理盐水冲洗管道。扫描序列为FLASH 3D VIBE序列,成像参数:TR 4.1 ms,TE 1.5 ms,翻转角10°,空间分辨率256×192,视野250 mm×250 mm,1个层块,层厚3 mm,间隔0.6 mm,使用体线圈,单次扫描10~14 s,动态增强扫描总时间120~168 s,第一次扫描结束即刻开始注射造影剂。动态增强扫描后采用T1WI脂肪抑制序列(TR/TE=884 ms/12 ms)进行常规MR增强扫描。1.3 图像分析 由2名副主任医师进行阅片,确定增强最明显区域作为感兴趣区(ROI),面积0.5~1.2 cm2,避开囊变、坏死、钙化和出血区。使用Siemens Sygno Mean Curve软件在线生成信号强度-时间曲线。将信号强度-时间曲线分为3型[2]:①速降型,上升期前1 min内信号强度达到峰值,达峰后曲线呈下降趋势,下降程度>10%;②持续增强型,在整个扫描时限内信号强度持续升高,扫描结束时的信号强度与1 min时相比上升>10%;③平台型,上升期前1 min内未达到明显峰值,1 min后呈缓慢上升趋势,与1 min时的信号强度相比上升<10%。根据公式(1)~(4)计算信号强度-时间曲线的曲线上升期信号强度增幅(Peak SE%)、曲线最大上升线性斜率(Max Wash-in SE%)、曲线下降斜率(Wash-out SE%)。
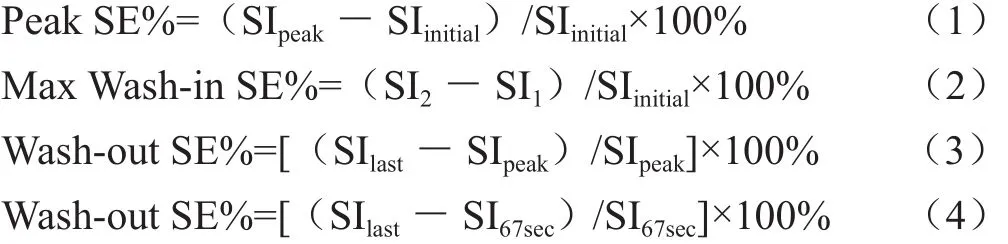
其中,SIpeak代表曲线上升期结束时信号强度(对于持续增强型SIpeak代表扫描结束时的信号强度),SIinitial代表注药前信号强度,SI2和SI1代表信号强度-时间曲线上升信号增幅最大的两点的信号强度,SIpeak为曲线达到峰值时的信号强度,SIlast为采集结束时信号强度;如果曲线在最初的60 s内未出现峰值,则采用第67 s和采集结束时的信号强度计算曲线下降期斜率,如公式(4)所示。
1.4 药物代谢动力学分析 应用双室药学动力学Tofts模型进行定量参数分析获得转运常数(Ktrans)及速率常数(Kep)[3],拟合过程中采用快速血流曲线进行拟合获得Ktrans和[4]。
1.5 统计学分析 采用SPSS 22.0软件,用非参数检验Kruskal Wallis法分析Peak SE%、Max Wash-in SE%、Wash-out SE%、Ktrans、Kep5种DCE-MRI半定量和定量参数在肺癌和其他肿瘤的脊柱转移癌的差异。以上述5种参数作为分类节点,同时父节点设定为10,子节点设定为5,拆分节点显著性水平α=0.05,利用卡方自动交互检测法(Chi-squared automatic interaction detection,CHAID)作决策树分析,并对样本进行最优分割,建立量化的肺癌脊柱转移癌判别模型。P<0.05表示差异有统计学意义。
2 结果
2.1 肺癌与其他肿瘤的脊柱转移癌的DCE-MRI参数分析 图1和图2分别为乳腺癌和肺癌脊柱转移的MRI图像和信号强度-时间曲线。表1显示肺癌与其他肿瘤脊柱转移癌DCE-MRI的各参数分析,Wash-outSE%、Kep在肺癌与其他肿瘤脊柱转移之间差异有统计学意义(P<0.01),而Peak SE%、Max Wash-in SE%、Ktrans在两者之间则无明显差异。
2.2 决策树的模型分析 将脊柱转移癌原发灶是否来源于肺作为目标变量,上述5种DCE-MRI参数作为解释变量,对其进行CHAID分析,得到决策树的结构图(图3),由图3可见,Wash-out SE%≤ -660.6%的患者患肺癌的可能性最小,未患肺癌者占该节点构成的76.7%;Wash-out SE%>-660.6%且Max Wash-in SE%≤98.0%的患者患肺癌的可能性也比较低,患肺癌者约占该节点构成的41.7%;而Wash-out SE%>-660.6%且Max Wash-in SE%>98.0%的患者患肺癌的可能性最大,占该节点的94.7%。为验证结果的可靠性,分别采用建立决策树数据重新代入模型、10-折交叉验证两种方法对所建立的模型进行判别准确性评价,两种方法判断错误率(风险统计量)分别为(21.3±5.2)%和(29.5±5.8)%(对应正确率分别为78.7%和70.5%)。
3 讨论
3.1 研究的必要性 恶性肿瘤患者多数由于转移和并发症导致死亡而非原发肿瘤本身。肿瘤最常见的转移部位是肝脏,其次是肺和骨骼。脊柱是骨骼系统中最易被转移肿瘤侵犯的部位,据统计,在癌症患者尸检中,90%已发生了脊柱转移,脊柱转移癌约占骨转移的70%,5%~20%的脊柱转移癌患者最终导致脊髓压迫[1]。部分以神经受压、腰背部疼痛等症状就诊的患者,脊柱转移癌是首次发现,寻找原发灶成为临床最为关注的问题,往往为了寻找原发癌要进行多种辅助检查,甚至需要进行PET/CT等较为昂贵的检查或者进行有创的穿刺活检获取病理来确诊原发灶。在常规影像上,脊柱转移癌一般无特征性的影像表现,以溶骨性转移最为常见,在影像学上表现为发生于椎体的溶骨性骨质破坏,伴有软组织肿块,最易发生在椎弓根处,可同时累及椎体和附件,典型的转移癌具有特征性表现,但常规影像学方法极易受局部骨髓纤维变性、梗死、水肿、病理性压缩骨折和感染的影响[5],并且难以准确把握转移癌的血供情况,因此也难以明确原发灶的来源。由于脊柱转移癌位置特殊,临床医师需要进行术中出血量预测,以便进行术前准备,如果术前能利用无创性检查获得转移癌的血供情况,则可对术中出血量进行预估,以改善患者预后[6]。
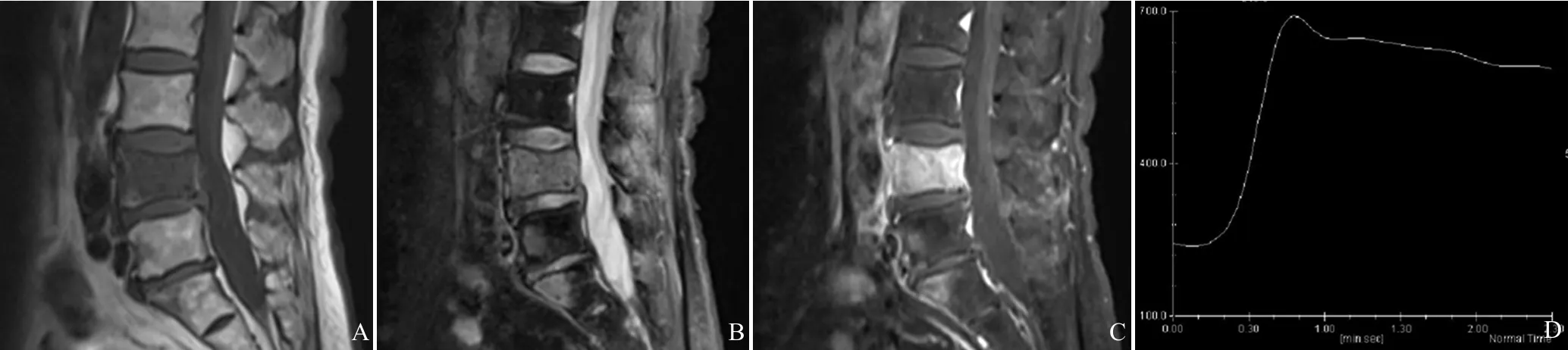
图1 女,71岁,乳腺癌脊柱转移。T1WI矢状位,L4、S1椎体骨质破坏,呈低信号,椎体变扁(A);T2WI脂肪抑制矢状位,L4、S1椎体骨质破坏,肿块呈高信号(B);T1WI增强扫描,病变明显强化(C);病变的信号强度-时间曲线呈速降型(D)

图2 男,53岁,肺癌脊柱转移。T1WI矢状位,C1椎体骨质破坏,呈低信号,椎体变扁(A);T2WI脂肪抑制矢状位,C1椎体骨质破坏,肿块呈高信号(B);T1WI增强扫描,病变可见强化(C);病变的信号强度-时间曲线呈平台型(D)

表1 肺癌与其他肿瘤脊柱转移癌DCE-MRI参数(x±s)

图3 肺癌脊柱转移决策树结构图及判断路径
3.2 研究结果分析 DCE-MRI是近年来迅速发展的MR技术[7]。与常规MRI相比,DCE-MRI可同时提供肿瘤病变解剖、生理和血流动力学信息,可用来评估组织对比剂的浓度、微血管密度、毛细血管通透性以及血流灌注等。国内外对脊柱转移癌DCE-MRI的研究较少,部分局限于脊柱转移癌和其他肿瘤的鉴别诊断,如Lang等[2,8]对脊柱转移癌和骨髓瘤以及脊柱结核分别进行了鉴别诊断,得到不同DCE-MRI参数的鉴别诊断阈值。另有部分研究应用DCE-MRI对个别种类的脊柱转移癌的血供情况进行研究,如Saha等[9]利用DCE-MRI半定量及定量参数对富血供的肾癌和乏血供的前列腺癌的脊柱转移癌进行了鉴别,结果证实可以应用DCE-MRI对脊柱转移癌的富血供与乏血供进行鉴别,临床上可为患者术前是否需进行栓塞治疗提供依据,以减少术中出血量。Khadem等[10]通过DCE-MRI半定量参数对26例不同原发灶的脊柱转移癌进行血供情况分析,结果表明根据转移癌的血供情况可以提示原发灶的大概来源,但是该研究选取样本量较小,各结果参数标准差较大,并且缺少药代动力学的定量分析。临床上寻找脊柱转移癌的原发灶,是医师普遍关注的问题,而利用上述研究的分析结果仍不能准确地判别具体原发灶。因此,本研究拟对脊柱转移癌进行原发灶来源的准确判别。
本研究通过对5种DCE-MRI半定量及定量分析参数进行分析,发现肺癌转移中代表造影剂流出的参数Wash-out SE%、Kep与其他肿瘤的合并组之间有显著差别,并且利用分类决策树模型对脊柱转移癌是否原发于肺进行判别,以树形图的方式清楚、直观地显示出了分析过程及结果,发现Wash-out SE%、Max Wash-in SE%是其中最显著的判别参数,以一定的阈值组成的模型对原发灶进行判别时验证结果显示其错误率较低。因此,应用此阈值可以为肺癌来源的转移和其他转移进行鉴别,并为临床提供有用的信息。
3.3 DCE-MRI参数病理解释 大量研究表明,肿瘤的生长与转移有赖于新生血管的形成,丰富的血管是肿瘤生长的物质条件,其中,血管内皮生长因子主要通过增加微血管的通透性或直接作用于内皮细胞上的特异性受体促进内皮细胞增殖、迁移进行血管形成的调节[11-13]。刘旭剑等[14]将脊柱肿瘤分为上皮来源肿瘤和间质来源肿瘤,上皮来源的肿瘤出血量明显高于间质来源的转移癌,血管内皮生长因子、Id-l蛋白及微血管密度与脊柱转移癌中术中出血量呈正相关。有研究表明,细胞间质成分的多少与动态增强曲线下降也有对应关系[2]。本研究未能对病理组织的血管内皮生长因子进行测定,但根据既往研究结果[2,9-10],肿瘤的血供及细胞间质等情况可能是造成曲线上升和下降参数不同的原因,推测肺癌和其他来源的肿瘤之间曲线参数的差异可能是由于不同来源的转移瘤之间的血管情况和细胞成分有所差异造成的。
总之,本研究在5种DCE-MRI参数的基础上,通过分类决策树模型对脊柱转移癌原发灶是否来源于肺进行判别时,结果的正确率较高,因此利用该模型可使影像诊断医师早期识别肺癌的脊柱转移癌,为临床医师进一步进行临床决策提供参考。
[1] Robson P. Metastatic spinal cord compression: a rare but important complication of cancer. Clin Med (Lond), 2014,14(5): 542-545.
[2] Lang N, Su MY, Yu HJ, et al. Differentiation of myeloma and metastatic cancer in the spine using dynamic contrast-enhanced MRI. Magn Reson Imaging, 2013, 31(8): 1285-1291.
[3] Tofts PS, Kermode AG. Measurement of the blood-brain barrier permeability and leakage space using dynamic MR imaging. 1. Fundamental concepts. Magn Reson Med, 1991,17(2): 357-367.
[4] Lang N, Su MY, Xing X, et al. Morphological and dynamic contrast enhanced MR imaging features for the differentiation of chordoma and giant cell tumors in the axial skeleton. J Magn Reson Imaging, 2017, 45(4): 1068-1075.
[5] Moulopoulos LA, Maris TG, Papanikolaou N, et al. Detection of malignant bone marrow involvement with dynamic contrastenhanced magnetic resonance imaging. Ann Oncol, 2003,14(1): 152-158.
[6] 金永明, 郑嘉寅, 张骏, 等. 脊柱转移性肿瘤后路360度减压内固定手术时间和出血量的影响因素分析. 浙江医学,2014, 36(6): 489-493.
[7] Buckley DL, Roberts C, Parker GJ, et al. Prostate cancer:evaluation of vascular characteristics with dynamic contrastenhanced T1-weighted MR imaging--initial experience.Radiology, 2004, 233(3): 709-715.
[8] Lang N, Su MY, Yu HJ, et al. Differentiation of tuberculosis and metastatic cancer in the spine using dynamic contrastenhanced MRI. Eur Spine J, 2015, 24(8): 1729-1737.
[9] Saha A, Peck KK, Lis E, et al. Magnetic resonance perfusion characteristics of hypervascular renal and hypovascular prostate spinal metastases. Spine (Phila Pa 1976), 2014, 39(24):E1433-E1440.
[10] Khadem NR, Karimi S, Peck KK, et al. Characterizing hypervascular and hypovascular metastases and normal bone marrow of the spine using dynamic contrast-enhanced MR imaging. Am J Neuroradiol, 2012, 33(11): 2178-2185.
[11] Esser S, Wolburg K, Wolburg H, et al. Vascular endothelial growth factor induces endothelial fenestrations in vitro. J Cell Biol, 1998, 140(4): 947-959.
[12] Ozdemir F, Akdogan R, Aydin F, et al. The effects of VEGF and VEGFR-2 on survival in patients with gastric cancer. J Exp Clin Cancer Res, 2006, 25(1): 83-88.
[13] 许立功, 吴爽, 张景峰, 等. 肿瘤血管生成拟态的影像学新进展. 中国医学影像学杂志, 2016, 24(3): 227-229.
[14] 刘旭剑, 王小玲, 冯建刚, 等. Id-1,VEGF及微血管密度与脊柱转移瘤术中出血量及肿瘤来源间的关系. 中国脊柱脊髓杂志, 2012, 22(8): 678-681.
(本文编辑 张晓舟)
Dynamic Contrast-enhanced MRI in Identification and Diagnosis of Metastasis of Lung Cancer
Purpose To explore the application value of dynamic contrast enhanced MRI(DCE-MRI) in judging and diagnosing metastasis of lung cancer. Material and Methods Sixty-one metastatic spinal tumor patients received DCE-MRI and their images acquired after scanning were post-processed. Signal intensity-time curve, signal intensity amplification in rising period of the curve (Peak SE%), maximum ascending linear slope of the curve(Max Wash-in SE%) and descending slope of the curve (Wash-out SE%) and other semiquantitative parameters were acquired. Double chamber pharmacokinetics was adopted to analyze and obtain Ktrans, rate constant (Kep) and other quantitative parameters. CHAID method was taken to establish tree structure model to confirm optimal sorting parameter and identify optimal division. Results For the DCE-MRI scanning parameters for 61 metastatic spinal tumor patients, differences of Wash-out SE% and Kepbetween lung cancer and other tumor spinal metastasis were statistically significant (P<0.01), while differences of Peak SE%, Max Wash-in SE% and Ktransbetween the two were not statistically significant(P>0.05). When Wash-out SE%>- 660.6% and Max Wash-in SE%>98.0%, original focus of about 94.7% was possible to come from lung. When taking tree structure model set up in the study for identification, 10-fold cross-validation indicated (29.5±5.8)% error rate.Conclusion Taking DCE-MRI semi-quantitative and quantitative analysis parameters for identification and diagnosis of metastasis of lung cancer is feasible. It can provide reference evidence for source identification of spinal sarcoma and clinical treatment.
Lung neoplasms; Neoplasm metastasis; Spinal neoplasms; Magnetic resonance imaging; Image enhancement; Diagnosis, differential
10.3969/j.issn.1005-5185.2017.09.015
袁慧书
Department of Radiology, Peking University Third Hospital, Beijing 100191,China
Address Correspondence to: YUAN Huishu E-mail: huishuy@sina.com
北京市自然科学基金(7164309);国家自然科学基金(81701648)。
R445.3;R734.2
2017-05-08
修回日期: 2017-08-06
中国医学影像学杂志
2017年 第25卷 第9期:690-694
Chinese Journal of Medical Imaging 2017 Volume 25 (9): 690-694
