氢氧化钠改性沸石对水中Cu2+的吸附特性研究
2017-10-18柯俊锋何晓曼雷娜娜张其武
杨 敏 柯俊锋 何晓曼 雷娜娜 张其武
(武汉理工大学资源与环境工程学院,湖北 武汉430070)
氢氧化钠改性沸石对水中Cu2+的吸附特性研究
杨 敏 柯俊锋 何晓曼#雷娜娜 张其武
(武汉理工大学资源与环境工程学院,湖北 武汉430070)
利用氢氧化钠对天然沸石进行改性,将天然沸石和改性沸石用于吸附去除水中的Cu2+,分析了pH、温度、Cu2+初始浓度、吸附时间对Cu2+吸附性能的影响,并对吸附过程的吸附等温模型及吸附动力学进行研究。结果表明,改性沸石对Cu2+的吸附性能明显优于天然沸石,当沸石投加量为10g/L,Cu2+为200mg/L,pH为6.67,温度为50 ℃时,天然沸石和改性沸石对Cu2+的吸附量分别为2.02、2.69mg/g。Langmuir和Freundlich吸附等温模型均能较好地描述两种沸石对Cu2+的吸附过程。天然沸石对Cu2+的吸附行为更符合准一级动力学方程,而准二级动力学方程对改性沸石的吸附行为拟合度更好。两种沸石对Cu2+的吸附均为非均相吸附,且内扩散过程不是唯一的速控步骤。
沸石Cu2+吸附等温模型 吸附动力学方程
随着冶炼、金属加工等工业的发展,工业生产所排放的废水量不断加大,废水中的铜离子含量也在不断增加。含铜废水排入水体后会严重影响水体质量,威胁人类健康。目前处理含铜废水的方法主要有化学沉淀法、电解法和吸附法等。化学沉淀法简单、高效,但需要加入大量的化学药剂,容易造成二级污染。电解法虽然可以回收重金属离子,但耗能较大。吸附法可高效吸附水体中的重金属离子,吸附剂经过再生处理后可以重复利用,经济性较好。
沸石是一种多孔性铝硅酸盐矿物晶体,由于构成沸石的基本骨架是由氧原子连接的硅氧四面体和铝氧四面体,铝为三价,因此铝氧四面体中有1个氧原子的电价未能得到中和,产生过剩负电荷,这些负电荷通常被碱金属或碱土金属阳离子所平衡,因此沸石具有良好的离子交换性能[1-2]。此外,沸石还是一类天然的分子筛,可以选择性吸附多种物质,可用于废水中重金属离子的吸附处理。考虑到天然沸石吸附容量相对较低,本研究采用氢氧化钠对天然沸石进行改性,一方面,碱处理可以有效地脱除天然沸石结构中的硅,将Na+引入到沸石中平衡过剩的负电荷,从而增强其阳离子交换性能[3-4];另一方面,氢氧化钠改性可以清除沸石孔隙中的杂质,增大比表面积[5]。分别采用天然沸石和改性沸石吸附处理模拟含铜废水,考察了pH、温度、Cu2+初始浓度、吸附时间等因素对吸附效果的影响,探讨吸附机制,以期为实际应用提供参考。
1 材料和方法
1.1实验材料
天然沸石化学组成为:SiO271.68%(质量分数,下同)、Al2O310.25%、Mg0.75%、CaO0.53%、Na2O0.74%、K2O1.36%、TiO20.10%,烧失量12.59%。实验所用Cu(NO3)2·3H2O、氢氧化钠、盐酸、硝酸均为分析纯。实验用水均为去离子水。
1.2实验仪器
不锈钢电热板、数显恒温水浴锅、电热鼓风干燥箱、恒温振荡器、台式低速自动平衡离心机、PHS-3C型酸度计、JSM-5610LV型扫描电子显微镜(SEM)、ZEEnit700P型火焰-石墨炉原子吸收光谱仪、三头研磨机。
1.3实验方法
1.3.1天然沸石的预处理及改性
采用去离子水将天然沸石清洗至上清液澄清,然后加入适量去离子水放于超级恒温循环槽中煮沸2h,弃去上清液,再加入适量去离子水煮沸2h,自然风干。
取一定经过预处理的天然沸石加入到3.0moL/L的氢氧化钠溶液中,70℃下处理7h,冷却过滤,用水清洗后放入烘箱中,在105℃下干燥5h,研磨过筛,得到改性沸石,放置于干燥器中保存。
1.3.2吸附实验
取100mL一定浓度的Cu2+溶液置于125mL锥形瓶中,加入适量天然沸石或改性沸石,调节pH,在恒温振荡器中加热到指定温度进行振荡吸附,定时取样,静止10min,用低速离心机以2000r/min的转速离心10min,取上清液,测定上清液中Cu2+的浓度,采用式(1)计算沸石对Cu2+的吸附量:
q=(c0-c1)/m
(1)
式中:q为沸石对Cu2+的吸附量,mg/g;c0、c1分别为吸附前后Cu2+的质量浓度,mg/L;m为沸石投加量,g/L。
2 结果与讨论
2.1pH的影响
将天然沸石和改性沸石以10g/L的投加量分别加入到Cu2+为200mg/L的溶液中,在30℃下吸附60min,调节pH分别为3.16、5.93、6.67、7.00、8.30,观察pH对Cu2+吸附的影响,结果如图1所示。
由图1可见,改性沸石对Cu2+的吸附量高于天然沸石。随着pH的增加,天然沸石和改性沸石对Cu2+的吸附量均逐渐增加;当pH大于5.93时吸附量随pH的增幅更加明显。这是因为pH会影响吸附剂表面电荷及吸附质的电离度和形态[6-8],当pH较低时,溶液中的H+与Cu2+存在竞争吸附,大量H+分布在沸石表面,使Cu2+的吸附位点减少[9],导致吸附量偏低。随着pH的增加,Cu2+的吸附量明显增加,但当pH高于6.67时,溶液中出现微量的絮状沉淀,说明溶液中的OH-与Cu2+生成沉淀物质,溶液中Cu2+的减少不仅仅是由于沸石的吸附作用所致,为了排除OH-的沉淀作用,后期吸附实验的pH定为6.67。
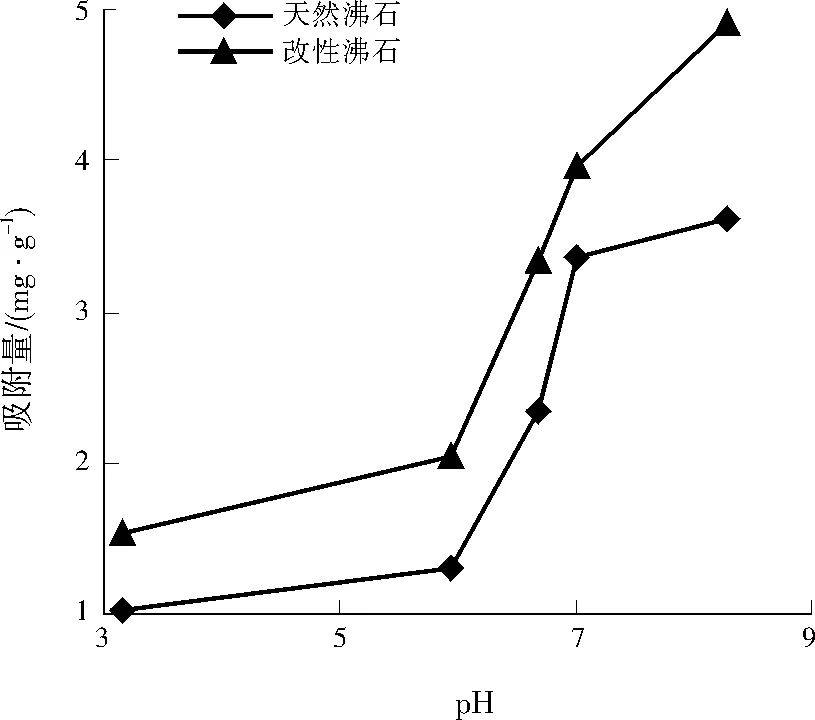
图1 pH对Cu2+吸附的影响Fig.1 Influence of pH on Cu2+ adsorption
2.2 温度的影响
将天然沸石和改性沸石以10 g/L的投加量分别加入到Cu2+为200 mg/L的溶液中,在pH为6.67下吸附60 min,控制吸附温度分别为30、35、40、45、50 ℃,考察温度对Cu2+吸附的影响,结果如图2所示。
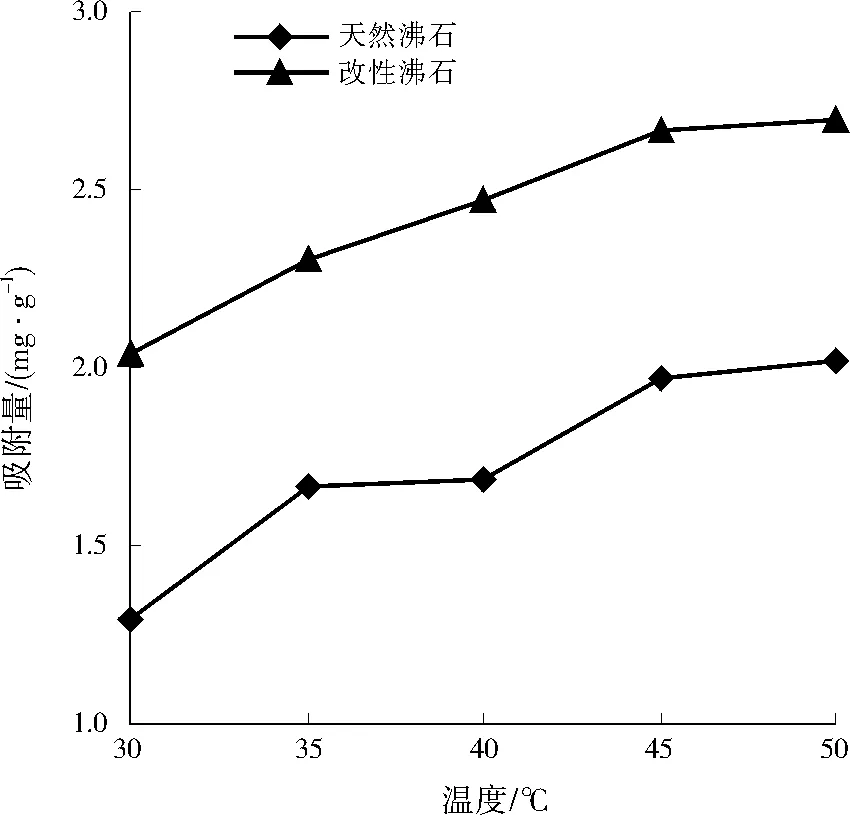
图2 温度对Cu2+吸附的影响Fig.2 Influence of temperature on Cu2+ adsorption
由图2可见,随着温度的升高,改性沸石和天然沸石对Cu2+的吸附量逐渐增加,这是因为温度越高,溶液中分子的动能越大,分子的无规则运动更加剧烈[10],有利于吸附位点与Cu2+的充分接触,使吸附剂上的吸附位点被充分利用,改善吸附效果。当温度为50 ℃时,天然沸石和改性沸石对Cu2+的吸附量分别为2.02、2.69 mg/g。
2.3 吸附等温模型研究
将天然沸石和改性沸石以10 g/L的投加量分别加入到Cu2+初始质量浓度为100、200、300、400、500 mg/L的溶液中,在pH=6.67、30 ℃下吸附60 min,考察Cu2+初始质量浓度对Cu2+吸附的影响,结果如图3所示。

图3 Cu2+初始质量浓度对Cu2+吸附的影响Fig.3 Influence of initial Cu2+ concentration on Cu2+ adsorption
由图3可见,随着Cu2+初始浓度的增加,天然沸石和改性沸石对Cu2+的吸附量也逐渐增加。当Cu2+初始质量浓度从100 mg/L增至500 mg/L时,改性沸石对Cu2+的吸附量由1.51 mg/g增至3.58 mg/g,而天然沸石对Cu2+的吸附量也从1.15 mg/g增加到1.91 mg/g。这是因为随着Cu2+初始质量浓度的增加,液相与固相中Cu2+的浓度差增大,交换反应的动力也增大,有利于Cu2+向矿物内部迁移,进入沸石内部孔道并吸附在内壁上,使大量未经利用的内部吸附位点得到有效利用[11],因此Cu2+吸附量增大。
利用Langmuir和Freundlich吸附等温模型拟合天然沸石和改性沸石对Cu2+的吸附过程。Langmiur模型适于描述单层吸附过程,Freundlich模型则适用于描述固相上存在多种吸附位点和非均相吸附表面对中低浓度吸附质的吸附过程[12]。Langmuir和Freundlich模型分别见式(2)、式(3),吸附等温模型拟合的相关参数见表1。
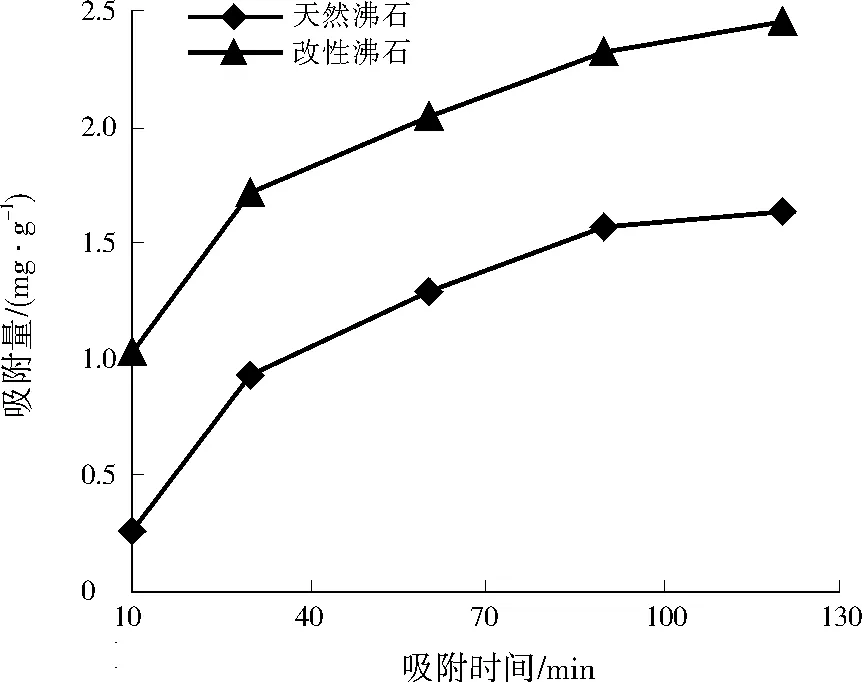
图4 吸附时间对Cu2+吸附的影响Fig.4 Influence of adsorption time on Cu2+ adsorption
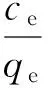
(2)
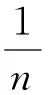
(3)
式中:ce为吸附平衡时溶液中Cu2+的质量浓度mg/L;qe为吸附平衡时沸石对Cu2+的吸附量mg/g;qm为沸石对Cu2+的最大吸附量,mg/g;ka为Langmuir常数,L/mg,ka与吸附自由能有关;kf为Freundlich常数,mg/(g·mg1/n·L1/n);n为Freundlich等温式中与吸附强度相关的常数。
由表1可见,两种吸附等温模型均能较好地描述天然沸石和改性沸石对Cu2+的吸附过程。由Langmuir模型拟合结果可知,改性沸石对Cu2+的最大吸附量分别为2.271、5.405 mg/g。ka为正值,说明在该温度下吸附反应是自发进行的[13]。Freundlich模型中,当1/n在0.1~0.5时表明吸附反应容易进行;1/n>2时,表明吸附反应较难进行[14-15]。由Freundlich模型拟合结果可知,改性沸石对Cu2+的吸附反应总体看来是易于进行的。
2.4 吸附动力学研究

表1 吸附等温模型拟合参数

表2 吸附动力学参数
将天然沸石和改性沸石以10 g/L的投加量分别加入到Cu2+为200 mg/L的溶液中,在pH=6.67、30 ℃下进行吸附,吸附10、30、60、90、120 min后取样,考察吸附时间对Cu2+吸附的影响,结果如图4所示。
由图4可见,天然沸石和改性沸石对Cu2+的吸附量均随吸附时间的延长而增加,其中10~30 min为快速吸附阶段,30~90 min吸附量增速放缓,90~120 min吸附量变化总体不大。这是由于在吸附前期,沸石表面有大量未被Cu2+占据的吸附位点,随着吸附的进行,沸石表面的吸附位点逐渐减少,导致吸附量增速放缓,90 min后,吸附基本达到饱和,延长吸附时间对Cu2+吸附量影响不明显。吸附120 min时,天然沸石和改性沸石对Cu2+的吸附量分别达到1.64、2.46 mg/g。
分别采用准一级动力学方程(见式(4))、准二级动力学方程(见式(5))、Elovich方程(见式(6))、内扩散速率方程(见式(7))对吸附实验数据进行拟合分析,结果见表2。
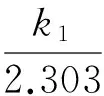
(4)
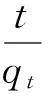
(5)
qt=C1+k3lnt
(6)
qt=C2+k4t1/2
(7)
式中:qt为吸附时间为t时沸石对Cu2+的吸附量,mg/g;k1为准一级吸附速率常数,min-1;k2为准二级吸附速率常数,g/(mg·min);C1为Elovich方程拟合常数,mg/g;k3为Elovich吸附速率常数;C2为内扩散方程边界常数,mg/g;k4为内扩散速率常数,mg/(g·min1/2)。
由表2可见,4种动力学方程对吸附过程的拟合度都很好。准一级动力学方程更适合描述天然沸石的吸附行为,说明其离子交换机制比较单一[16];准二级动力学方程则对改性沸石的吸附行为拟合度更好,由于化学键的形成是影响准二级动力学吸附的主要影响因子,说明改性沸石对Cu2+的吸附过程以化学吸附为主[17]。通过准一级动力学方程和准二级动力学方程推算出天然沸石和改性沸石对Cu2+平衡吸附量的理论值分别为1.85、2.86 mg/g。Elovich方程适用于活化能变化较大的反应过程[18],如果实验数据具有较好的拟合性,则反应过程为非均相扩散过程[19],可见天然沸石和改性沸石吸附Cu2+的过程均为非均相吸附。内扩散速率方程适合描述离子在颗粒内扩散的动力学过程[20-21],内扩散速率方程拟合得到的C2不等于0,表明颗粒内扩散并不是该吸附过程的唯一速控步骤,可能还受表面吸附和颗粒外液膜扩散的影响。
2.5 比表面积分析
对天然沸石和改性沸石进行比表面积测试,结果如表3所示。
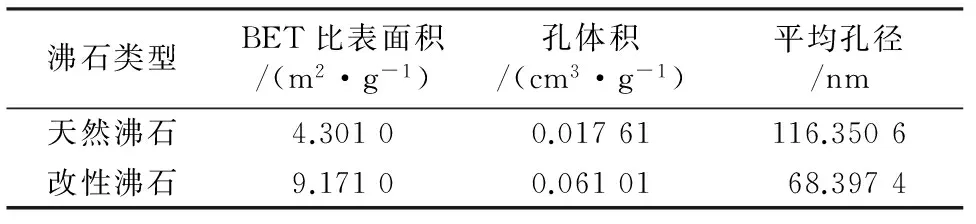
表3 天然沸石及改性沸石的比表面积及孔参数
由表3可见,天然沸石经过氢氧化钠改性后,BET比表面积从4.301 0 m2/g增大到9.171 0 m2/g,孔体积也明显增大,平均孔径却减小,说明氢氧化钠改性使沸石内部的微孔数量增加,沸石内部更加疏松多孔,导致沸石的吸附能力增强。
2.6 SEM表征分析
由天然沸石和改性沸石样品的SEM扫描图(见图5)可以看出,天然沸石的表面形态比较致密,具有一定的空隙结构,主要为微孔结构,而且孔洞大小不一。而改性沸石结构疏散、孔洞均匀一致。由此可见,氢氧化钠改性使沸石结构得到改善,层状结构更加明显,表面变得粗糙疏松,进而增强其吸附能力。
3 结 论
(1) 氢氧化钠改性能够显著提高沸石对Cu2+的吸附性能,沸石的吸附量随着pH和温度的增加而增加。当沸石投加量为10g/L,Cu2+为200mg/L,pH为6.67,温度为50℃时吸附60min,天然沸石和改性沸石对Cu2+的吸附量分别为2.02、2.69mg/g。

图5 沸石样品的SEM图Fig.5 SEM images of zeolite samples
(2) Langmiur和Freundlich均能较好描述天然沸石和改性沸石对Cu2+的等温吸附过程。
(3) 天然沸石的吸附行为更符合准一级动力学方程,准二级动力学方程对改性沸石的吸附行为拟合度更好,说明改性沸石对Cu2+的吸附主要是化学吸附。两种沸石对Cu2+的吸附均为非均相吸附,且内扩散过程不是唯一的速控步骤。
(4) 氢氧化钠改性后,沸石的比表面积显著增加,层状结构更明显,表面变得粗糙疏松,因此对Cu2+的吸附能力有所增强。
[1] 张曦,吴为中,温东辉,等.氨氮在天然沸石上的吸附及解吸[J].环境化学,2003,22(2):166-171.
[2] 张昕,塔娜.沸石在污水处理中的应用研究进展[J].工业水处理,2011,31(7):13-17.
[3] WANG Shaobin,PENG Yuelian.Natural zeolites as effective adsorbents in water and wastewater treatment[J].Chemical Engineering Journal,2010,156(1):11-24.
[4] KRAGOVIC M,DAKOVIC A,MARKOVIC M,et al.Characterization of lead sorption by the natural and Fe(Ⅲ)-modified zeolite[J].Applied Surface Science,2013,283(11):764-774.
[5] DESSAU R M,VALYOCSIK E W,GOEKE N H.Aluminum zoning in ZSM-5 as revealed by selective silica removal[J].Zeolites,1992,12(7):776-779.
[6] 张志华,窦涛,张瑛.沸石的碱溶液处理改性[J].工业催化,2004,12(10):49-53.
[7] CHANG Yue,LIU Hongwei,ZHA Fei,et al.Adsorption of Pb(Ⅱ) by N-methylimidazole modified palygorskite[J].Chemical Engineering Journal,2011,167(1):183-189.
[8] BAO Weiwei,LIU Lu,ZOU Haifeng,et al.Removal of Cu2+from aqueous solutions using Na-A zeolite from oil shale ash[J].Chinese Journal of Chemical Engineering,2013,21(9):974-982.
[9] YANG Xin,YANG Shubin,YANG Shitong,et al.Effect of pH,ionic strength and temperature on sorption of Pb(Ⅱ) on NKF-6 zeolite studied by batch technique[J].Chemical Engineering Journal,2011,168(1):86-93.
[10] 薛美香,陈建琴,林玉凤.微波辅助改性沸石对水中铜的吸附研究[J].工业水处理,2014,34(3):36-39.
[11] 王峰,梁成华,杜丽宇,等.天然蛭石和沸石吸附铜和锌的特性研究[J].沈阳农业大学学报,2007,38(4):531-534.
[12] LI Jiaxing,HU Jun,SHENG Guodong,et al.Effect of pH,ionic strength,foreign ions and temperature on the adsorption of Cu(Ⅱ) from aqueous solution to GMZ bentonite[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2009,349(1/2/3):195-201.
[13] 李倩囡,张建强,谢江,等.人工湿地基质吸附磷素性能及动力学研究[J].水处理技术,2011,37(9):64-67.
[14] 甄豪波,胡勇有,程建华.壳聚糖交联沸石小球对Cu2+、Ni2+及Cd2+的吸附特性[J].环境科学学报,2011,31(7):1369-1376.
[15] CHEN Changlun,WANG Xiangke.Sorption of Th(Ⅳ) to silica as a function of pH,humic/fulvic acid,ionic strength,electrolyte type[J].Applied Radiation and Isotopes,2007,65(2):155-163.
[16] WANG Shaobin,TERDKIATBURANA T,TADE M O.Adsorption of Cu(Ⅱ),Pb(Ⅱ) and humic acid on natural zeolite tuff in single and binary systems[J].Separation and Purification Technology,2008,62(1):64-70.
[17] 柏静儒,王擎,秦宏,等.油页岩飞灰对重金属离子的吸附动力学及热力学[J].燃料化学学报,2011,39(5):378-384.
[18] 涂从.土壤体系中的化学动力学方程及其应用[J].热带亚热带土壤科学,1994(3):175-182.
[19] AHARONI C,LEVINSON S,RAVINA I,et al.Kinetics of soil chemical reactions: relationships between empirical equations and diffusion models[J].Soil Science Society of America Journal,1991,55(5):1307-1312.
[20] KANNAN N,SUNDARAM M M.Kinetics and mechanism of removal of methylene blue by adsorption on various carbons - a comparative study[J].Dyes & Pigments,2001,51(1):25-40.
[21] 丁洋,靖德兵,周连碧,等.板栗内皮对水溶液中镉的吸附研究[J].环境科学学报,2011,31(9):1933-1941.
AdsorptionofCu2+inaqueoussolutionbysodiumhydroxidemodifiedzeolite
YANGMin,KEJunfeng,HEXiaoman,LEINana,ZHANGQiwu.
(CollegeofResourcesandEnvironmentalEngineering,WuhanUniversityofTechnology,WuhanHubei430070)
Natural zeolites and sodium hydroxide modified zeolites were used to remove Cu2+in aqueous solution. The effects of pH,temperature,Cu2+initial concentration and adsorption time on the Cu2+adsorption capacity of two zeolites were studied. The isotherm and kinetics of adsorption process were also studied. The results showed that modified zeolite had a better adsorption capacity than natural zeolite. When the zeolite dosage was 10 g/L,Cu2+was 200 mg/L,pH was 6.67,and the temperature was 50 ℃,the Cu2+adsorption capacities of natural zeolites and modified zeolites were 2.02,2.69 mg/g,respectively. Both Langmuir and Freundlich isotherm could well fit the Cu2+adsorption process on natural and modified zeolites. Adsorption process of natural zeolite conformed to pseudo-first order kinetic equation,while pseudo-second order kinetic equation was better for fitting the adsorption process of modified zeolites. The adsorption of Cu2+on zeolites was heterogeneous adsorption and intraparticle diffusion was not the only rate-determining step for this adsorption prosess.
zeolite; Cu2+; adsorption isotherm model; adsorption kinetic equation
杨 敏,女,1993年生,硕士研究生,主要从事重金属污染修复研究。#
。
10.15985/j.cnki.1001-3865.2017.03.017
2016-09-05)
