镉胁迫对大麻幼苗生长及生理生化影响
2017-10-18黄玉敏邓勇李德芳赵立宁唐慧娟黄思齐
黄玉敏,邓勇,李德芳,赵立宁,唐慧娟,黄思齐
(中国农业科学院麻类研究所,长沙410205)
镉胁迫对大麻幼苗生长及生理生化影响
黄玉敏,邓勇,李德芳,赵立宁,唐慧娟,黄思齐*
(中国农业科学院麻类研究所,长沙410205)
以3个主栽品种大麻(云麻1号、庆大麻、皖大麻1号)为材料,研究了不同镉胁迫浓度(5、20、50μmol/L)对其种子萌发的影响。以“云麻1号”大麻为材料,研究了不同镉胁迫浓度(5、20、50μmol/L)对大麻幼苗生长、根与叶 3,3′-二氨基联苯胺(DAB)染色、丙二醛(MDA)含量以及抗氧化酶活性等的影响。结果显示:种子萌发率随镉浓度升高而降低,发芽率依次为:云麻1号>庆大麻>皖大麻1号。“云麻1号”大麻幼根伸长在CdCl2处理下较对照显著降低,高浓度CdCl2处理,诱导脂质过氧化,染色着色深,大麻幼根与叶片中MDA含量在20、50μmol/L CdCl2处理时较对照显著升高。此外,镉胁迫诱导“云麻1号”大麻幼根与叶片中超氧化物歧化酶(SOD)、过氧化物酶(POD)活性呈现先升高后降低趋势。结果表明:镉胁迫抑制大麻种子萌发、抑制“云麻1号”大麻幼根伸长;染色着色深、MDA含量增加可能与镉胁迫引起脂质过氧化,破坏细胞膜完整性有关;此外,大麻幼根与叶在镉胁迫下可通过提高抗氧化酶SOD、POD活性来清除活性氧的产生,降低脂质过氧化,保护自身免遭氧化损伤。
大麻;镉胁迫;生理生化反应
镉(Cadmium,Cd)是环境中一种常见的重金属,具有较强的毒性和生物迁移性[1],很容易被植物吸收,且在植物体内累积,影响植物的生长和发育,亦可经过食物链进入人体,危害身体健康[2]。目前,根据我国环境保护部和国土资源部联合发布的《全国土壤污染状况调查公报》显示,全国土壤重金属超标率为16.1%,其中,镉的点位超标率最高为7.0%,是中国耕地、林地、草地以及未利用地的主要污染物之一[3]。因此,预防和减少Cd污染,已经成为一项紧迫任务。大麻(Cannabis sativa L.)作为一种经济作物,具有生长周期短、抗重金属能力强、不易将重金属带入食物链等特点[4],是目前研究修复镉污染较好的材料。
作为一种不参与氧化还原反应的重金属,Cd可以很容易地在水中溶解并迅速被植物根部吸收[5],植物在受到Cd胁迫时,会发生萎黄病,出现发育迟缓等现象[6]。苑丽霞等[7]对镉胁迫下油菜生长发育过程中生理生化特性进行研究,结果表明,低浓度的镉对油菜生长起促进作用,高浓度的镉则抑制油菜生长。植物在受到Cd胁迫时,体内也会诱导产生大量的活性氧(ROS),抗氧化酶不能及时有效的清除,导致膜质过氧化,其产物丙二醛(MDA)含量增加,同时超氧化物歧化酶(SOD)、过氧化物酶(POD)及其它保护酶的活性下降。随着ROS积累过多,也会使膜脂产生脱酯化作用,磷脂游离,膜结构被破坏。如果胁迫强度增大,或胁迫时间延长,植物就有可能死亡[8]。Panda等[9]研究了镉胁迫诱导下水稻的氧化应激反应。刘俊[10]研究了Cd胁迫下黄瓜、番茄Cd生理响应,发现黄瓜根较于叶丙二醛(MDA)升高趋势明显,高浓度Cd会降低番茄中还原性糖含量,影响番茄品质。
前人对于大麻响应镉胁迫生理活性研究较少。Citterio等[11]对大麻、玉米耐镉、铬、镍等重金属及其积累量进行了研究,发现大麻对于重金属的积累主要为根部,相比于玉米,大麻对重金属的耐受性较强。曾民等[12]对4种大麻修复重金属污染土壤能力做了研究,结果发现低水平Pb、Zn、Cd处理对大麻株高及干物质积累有轻微的促进作用,而在高水平Pb、Zn、Cd处理下,4种大麻的生长均受到不同程度抑制,其对重金属的耐性及富集能力依次为云麻2号>云麻108号>云麻1号>云麻164号。本文分别选取生长于云南、安徽、黑龙江地域的主栽工业大麻品种云麻1号、皖大麻1号、庆大麻进行研究,分析镉毒害对其种子萌发的影响,并对耐镉性强的大麻品种进行生长指标以及生理活性的测定,研究镉胁迫对大麻幼苗生长以及生理生化的影响,以期为利用大麻修复镉污染土壤提供一定的理论依据。
1 材料与方法
1.1 试验材料
试验选用云麻1号、皖大麻1号、庆大麻,由中国农业科学院麻类研究所一年生麻类作物遗传改良创新团队提供。
1.2 试验方法
1.2.1 萌发试验
选取籽粒饱满、大小均匀的云麻1号、皖大麻1号、庆大麻种子各400粒,用10%的次氯酸钠消毒10 min,双蒸水反复冲洗,浸种催芽8 h后,置于铺有3层滤纸培养盒里,每个培养盒里加入等体积不同浓度的CdCl2溶液,分别设置空白对照(CK)、5、20、50μmol/L 4个处理,空白对照用双蒸水代替,每盒100粒种子,培养盒置于25℃培养箱中,黑暗条件下萌发72 h,统计发芽数。
1.2.2 幼苗培养
将未进行镉处理的幼苗转移至等体积的1/4 Hogland营养液中进行水培,培养5 d,条件如下:光周期16/8 h,昼夜温度为30/26℃,相对湿度为60%,光强为700μmol·m2·s。Hogland营养液配方如下:Ca(NO3)25.79mmol/L,KNO38.02mmol/L,NH4H2PO41.35mmol/L,MgSO44.17 mmol/L,MnSO48.90μmol/L,H3BO348.3μmol/L,ZnSO40.94μmol/L,CuSO40.20μmol/L,(NH4)2MoO40.015μmol/L,Fe-EDTA 72.6μmol/L,用 NaOH调节 pH 5.8左右。
1.2.3 试验设计
本试验设置空白对照(CK)、5、20、50μmol/L 4个处理,待幼苗长至5 d,用 CdCl2溶液进行处理,用营养液做空白对照,处理3天,重复3次。
1.2.4 根长测定
CdCl2处理开始,记为0,每隔1 d测一次根长,测到处理3 d为止。
1.2.5 3,3′-二氨基联苯胺(DAB)染色
将DAB粉末先溶于1 mol/L HCl中,完全溶解后,再溶于双蒸水中,配制成0.75 mol/L的DAB溶液,剪取不同浓度CdCl2处理3 d的大麻幼苗根、叶,分别染色1、12 h,对照组用DAB溶液代替。95%酒精脱色,拍照。
1.3 取样测定
镉处理72 h后取样,取各处理组的大麻幼苗,去离子水冲洗干净。分别称取大麻根、叶鲜重,冰水浴充分研磨,4000 r/min离心,取上清,分别用于MDA含量、SOD和POD活性检测。
MDA含量和SOD、POD活性检测均采用试剂盒法,试剂盒由南京建成生物工程研究所提供。
1.4 数据分析
利用Excel2016分析数据,所有数据均以平均值±标准差(x±s)表示,组间比较采用t检验,以p<0.05有统计学意义。
2 结果与分析
2.1 镉胁迫下不同大麻品种种子萌发情况
以幼芽长度相当于种子一倍长作为发芽标准,统计萌发3 d之后发芽数。如表1所示,不同水平Cd处理,发芽率不同,相比于对照组,发芽率都随Cd处理浓度的升高而降低,其中,云麻1号相比于对照组发芽率降低14.8%;皖大麻1号相比于对照组发芽率降低19.4%;庆大麻相比于对照组发芽率降低15.5%。综上,相同条件下,发芽率由高到低依次为:云麻1号>庆大麻>皖大麻1号。基于大麻发芽情况,选取云麻1号为相对耐镉品种,进行后续试验。

表1 Cd胁迫下不同大麻品种种子萌发率Tab.1 The seed germination rate of different hemp varieties to Cd stress
2.2 镉胁迫下大麻幼苗根生长情况
不同浓度Cd处理的大麻幼苗,随着处理时间的增长,根生长情况不同。图1结果表明,对照组,3 d之间,根由4.3 cm生长到7.7 cm,伸长约79%,其中,相比于对照,第1 d伸长达到显著(p<0.05),第2天达到极显著(p<0.01)。5μmol/L CdCl2处理组,根伸长约78%,其中,第1天,根伸长显著高于对照(p<0.05)。20μmol/L CdCl2处理组,伸长约43%,其中,第3天时,根伸长显著高于对照(p<0.05)。50μmol/L CdCl2处理组,根伸长约38%。由此可以得出:随着处理时间不断增加,CdCl2处理浓度越高,大麻幼苗根的生长越缓慢,高浓度的CdCl2对大麻幼苗根的生长有抑制作用。

图1 不同浓度CdCl2处理大麻幼苗根长变化Fig.1 Effects of Cd on the root length of hemp seedlings
2.3 镉胁迫下大麻幼苗根与叶DAB染色
DAB染色是一种常用的过氧化物酶(Peroxidase,POX)染色法,其原理是细胞内的POX能将无色的DAB的氢原子传递给过氧化氢,使前者催化成有色染料沉积在细胞质中的POX所在部位[13]。不同浓度的CdCl2分别处理大麻根部与叶,引起过氧化物酶增加,用DAB染色、脱色后,有明显的棕红色物质出现。如图2所示:对照组,大麻幼根呈正常色;5μmol/L CdCl2处理组,开始有棕红色物质积累;20μmol/L CdCl2处理组,棕红色物质积累增加;50μmol/L CdCl2处理组,大麻幼根呈棕色。随着镉处理浓度的增加,根部棕红色物质积累增加。如图3所示:对照组,大麻叶片脱色后呈米白色;5μmol/L CdCl2处理组,脱色后,叶脉呈现出棕红色;20μmol/L CdCl2处理组,叶脉与叶片均呈现棕红色;50μmol/L CdCl2处理组,整个叶片呈现棕黑色。因此,CdCl2处理浓度越高,棕红色物质积累越多,对大麻毒性越大。

图2 不同浓度 Cd2+处理大麻幼苗根DAB染色Fig.2 The DAB staining of hemp seedlings under Cd stress

图3 不同浓度Cd2+处理大麻幼苗叶DAB染色Fig.3 The DAB staining ofhemp leaves under Cd stress
2.4 镉胁迫对大麻幼根与叶MDA含量的影响
MDA是膜脂过氧化作用的产物,会影响植物的生长发育,被认为是氧化应激诱导的细胞损伤的良好指标,也是经常用来衡量植物对逆境反应强弱的指标之一[14]。如图4所示:相比于对照,用5μmol/L CdCl2处理大麻幼根组织,MDA含量增加不显著;而20、50μmol/L CdCl2处理组,MDA含量升高分别达到显著(p<0.05)和极显著(p<0.01)。如图5所示:相比于对照,用5μmol/L CdCl2处理大麻叶片组织,MDA含量增加不显著;而20、50μmol/L CdCl2处理组,MDA含量升高分别达到显著(p<0.05)和极显著(p<0.01)。因此,不同浓度CdCl2处理均可导致大麻幼苗根与叶组织中的MDA含量增加,且随着镉处理浓度的增加,MDA含量呈现上升趋势。其原因在于,高浓度的CdCl2会诱导大麻幼苗根细胞与叶细胞发生膜质过氧化,对细胞造成了明显的毒害作用。

图4 镉胁迫对大麻幼根MDA含量影响Fig.4 Effect of Cd on MDA content in hemp roots

图5 镉胁迫对大麻幼叶MDA含量影响Fig.5 Effect of Cd on MDA content in hemp leaves
2.5 镉胁迫对大麻幼根与叶SOD活性的影响
SOD是植物体内一类重要的保护酶,在抗逆境胁迫中起着关键作用,其活性的变化被认为是衡量植物体清除活性氧能力的重要标志[15]。如图6所示:不同浓度的镉处理大麻根组织,相比于对照,5~20μmol/LCdCl2处理组,SOD活性呈上升趋势,20μmol/LCdCl2处理组,上升3.6%。而50μmol/L CdCl2处理组,SOD活性开始呈下降趋势,且下降幅度较大,降低约23%。如图7所示:不同浓度的镉处理大麻叶组织,0~5μmol/L CdCl2处理组,SOD活性呈上升趋势,相比于对照,上升5.3%,而20μmol/L CdCl2处理组,SOD活性开始呈下降趋势,50μmol/L CdCl2处理组,下降18.6%。由此说明:不同浓度的镉处理大麻根与叶组织,在一定范围内,SOD活性都呈现出随镉浓度增加呈先上升后降低的趋势,以此起到防御作用。

图7 镉胁迫对大麻幼叶SOD活性影响Fig.7 Effect of Cd on SOD activity in hemp leaves
2.6 镉胁迫对大麻幼根与叶POD活性的影响
POD是植物体内一类应对氧化应激的重要酶,主要通过清除体内过多的脂质过氧化产物来保护细胞免受伤害[16]。如图8所示:不同浓度的镉处理大麻根组织,5μmol/L CdCl2处理组,POD活性呈上升趋势,相比于对照,上升6.9%,而20μmol/L CdCl2处理组,POD活性开始呈下降趋势,50μmol/L CdCl2处理组,相比于对照,下降2.4%。如图9所示:不同浓度的镉处理大麻叶组织,POD活性整体呈现先上升后降低趋势,5、20、50μmol/L CdCl2处理组,相比于对照,分别上升11.2%、9.4%、7%。因此,镉胁迫会导致大麻幼苗叶组织POD活性上升,上升幅度与镉处理浓度有关。

图8 镉胁迫对大麻幼根POD活性影响Fig.8 Effect of Cd on POD activity in hemp roots
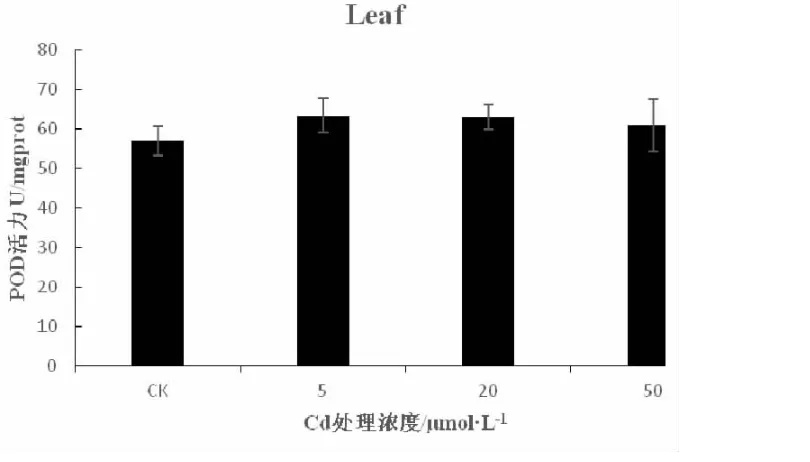
图9 镉胁迫对大麻幼叶POD活性影响Fig.9 Effect of Cd on POD activity in hemp leaves
3 讨论
3.1 镉胁迫对大麻种子萌发的影响
种子萌发阶段为植物生长发育的重要阶段,对Cd胁迫较为敏感,种子发芽力会降低。曾翔等[17]研究表明:在10 mg/L CdCl2处理下,水稻的萌发率相比于对照降低了1.3%,陈仲英等[18]分析了工业大麻萌发期及幼苗前期重金属Pb耐性,发现Pb对大麻萌发有抑制作用。本研究中云麻1号、皖大麻1号、庆大麻发芽率与对照相比分别下降12%、14%、13.5%,其中,云麻1号耐镉性相对较强。植物的耐镉性大小是由植物的遗传特性决定的,其中植物的发育阶段和植物种类与其耐镉性密切相关[19]。云麻1号耐镉性强可能与其长时间处于镉胁迫环境有很大关系。
3.2 镉胁迫下大麻幼苗根生长情况
根是直接接触和吸收重金属的部位,对Cd毒害十分敏感。刘敏[20]认为Cd胁迫会不同程度的抑制玉米幼根的伸长,且抑制程度随着Cd处理浓度的增加而增加。本研究表明:随着Cd处理浓度的增加,对大麻幼苗根生长抑制越明显,20μmol/L CdCl2处理组抑制率为57%,50μmol/L CdCl2处理组抑制率达到62%。这可能由于过量Cd积累于大麻根部,对大麻产生明显的毒害作用。
3.3 镉胁迫下大麻幼苗根与叶DAB染色
POX是由微生物或植物所产生的一类能催化很多反应、以过氧化氢为电子受体催化底物氧化的氧化还原酶,POX可使有毒物质失活,利用过氧化氢等各种底物将有毒物质氧化成无毒物质,当植物或微生物受到有毒物质侵害时,体内过氧化物酶会增加[13]。杨颖丽等[21]研究发现Cd2+胁迫下,小麦通过增强POD酶的活性来清除叶片中的活性氧,使叶片免受氧化损伤。细胞中POX常用DAB来染色,着色程度表明POX含量多少,也表明植物体受毒害程度。本研究中:不同程度CdCl2处理大麻幼苗,经过DAB染色,根与叶都表现出:着色程度均随CdCl2处理浓度的增加而增加,其中,50μmol/L CdCl2处理根与叶,相比于对照,着色加深极为明显,呈棕黑色。因此,CdCl2浓度越高对大麻幼苗毒性越大,POX增加越多,对机体损伤越严重。
3.4 镉胁迫对大麻幼根与叶MDA含量的影响
逆境环境中,需氧植物细胞会产生过量的自由基,诱发脂质过氧化,产生大量MDA,进而破坏细胞质膜,大量胞内电解质外渗[22]。吴旭红等[23]研究发现,50 mg/L Cd2+处理的大豆幼苗,分泌物溶液电导率增加达到极显著,可能是由于逆境下膜脂过氧化产物MDA在体内积累导致膜结构的损伤所致。目前,普遍认为植物不同组织MDA含量能反映细胞膜脂质过氧化强弱以及细胞质膜变性程度[24]。本研究结果表明,受CdCl2胁迫影响,大麻幼苗根与叶组织脂质过氧化非常明显,MDA含量随着CdCl2处理浓度的增加而增加,幼苗受到的毒害作用也越大。
3.5 镉胁迫对大麻幼根与叶SOD活性的影响
SOD作为生物应对氧化应激的一种重要酶,在抵御重金属胁迫中起着重要作用,SOD主要通过清除O2-来降低膜脂的过氧化作用,保护细胞免受侵害[25]。本研究结果表明:随CdCl2处理浓度增加,大麻幼苗根与叶SOD活性均表现为先上升后降低的趋势,幼根与叶分别在50、20μmol/L CdCl2处理时,SOD活性表现为下降趋势。Cd胁迫使得大麻幼根与叶中产生过量O2-,大麻自身通过增加SOD活性清除过量的O2-,抵御Cd毒害。SOD活性变化与CdCl2处理浓度有关。
3.6 镉胁迫对大麻幼根与叶POD活性的影响
H2O2积累是植物组织遭受氧化胁迫的一个重要特征,POD作为植物体内一种应对胁迫反应较为敏感的保护酶,有研究[26]指出,其可能通过减少H2O2的积累来降低膜脂过氧化。本文研究结果表明:随CdCl2处理浓度增加,大麻幼根与叶POD活性表现为先增高后降低趋势,Cd胁迫对大麻幼苗根与叶造成了不同程度的氧化损伤,POD活性升高,通过清除H2O2等活性氧来保护大麻幼苗免受伤害。
综上所述,大麻幼苗受镉毒害程度随镉处理浓度的增加而加重。表现出:在较高的镉胁迫下,其幼根生长明显受抑制;DAB染色,根与叶均着色明显。而植株自身则通过提高抗氧化酶SOD、POD活性来抵御镉胁迫。
[1]Bolan N S,Makino T,Kunhikrishnan A,et al.Chapter Four-Cadmium Contamination and Its Risk Management in Rice Ecosystems[J].Advances in Agronomy,2013,119(47):183-273.
[2]Sun H,Wang D,Zhou Z,etal.Association of cadmium in urine and blood with age in a general population with low environmental exposure[J].Chemosphere,2016,156:392-397.
[3]环境保护部,国土资源部.全国土壤污染状况调查公报[J].中国环保产业,2014(5):10-11.
[4]杨永红,黄琼,白魏.正确认识大麻,合理使用生物资源[J].中国麻业科学,2000,22(1):39-41.
[5]Kan Q,Wu W,Yu W,et al.Nitrate reductase-mediated NO production enhances Cd accumulation in Panax notoginseng roots by affecting root cellwall properties[J].Journal of Plant Physiology,2016,193:64-70.
[6]Wang J,Li T,Liu G,et al.Unraveling the role of dark septate endophyte(DSE)colonizingmaize(Zeamays)under cadmium stress:physiological,cytological and genic aspects[J].Scientific Reports,2016,6(1):22028.
[7]苑丽霞,孙毅,杨艳君.镉胁迫对油菜生长发育中生理生化特性的影响[J].安徽农业科学,2014(9):2544-2547.
[8]王玉清,朱祝君,何君.外源一氧化氮对盐胁迫下黄瓜幼苗叶片膜脂过氧化的缓解作用[J].浙江大学学报,2007,33(5):533-538.
[9]Panda P,Nath S,Chanu T T,etal.Cadmium stress-induced oxidative stress and role of nitric oxide in rice(Oryza sativa,L.)[J].Acta Physiologiae Plantarum,2011,33(5):1737-1747.
[10]刘俊.镧、硒对镉胁迫下番茄、黄瓜产量品质及Cd含量的调控作用[D].重庆:西南大学,2014.
[11]Citterio S,Santagostino A,Fumagalli P,et al.Heavymetal tolerance and accumulation of Cd,Cr and Niby Cannabissativa,L[J].Plant&Soil,2003,256(2):243-252.
[12]曾民,郭鸿彦,郭蓉,等.大麻对重金属污染土壤的植物修复能力研究[J].土壤通报,2013,44(2):472-476.
[13]宋悦凡,曲翊,张锦友,等.小轴海绵小球细胞的3,3′-二氨基联苯胺染色标记法研究[J].中国水产科学,2011,18(1):8-15.
[14]石贵玉,秦丽凤,陈耕云.铬对烟草组培苗生长和某些生理指标的影响[J].广西植物,2007,27(6):899-902.
[15]陈宏,徐秋曼,王葳,等.镉对小麦幼苗脂质过氧化和保护酶活性的影响[J].西北植物学报,2000,20(3):399-403.
[16]Asada K,Foyer CH,Mullineaux PM.Production and action ofactive oxygen species in photosynthetic tissues.[J].Pure&Applied Chemistry,1994,79(12):2217-2227.
[17]曾翔,张玉烛,王凯荣,等.镉对水稻种子萌发的影响[J].应用生态学报,2007,18(7):1665-1668.
[18]陈仲英,龙瑜菡,徐云,等.工业大麻品种萌发期及幼苗前期重金属Pb耐性评价研究[J].中国麻业科学,2016,38(3):97-104.
[19]陈志德,仲维功,王军,等.镉胁迫对水稻种子萌发和幼苗生长的影响[J].江苏农业学报,2009,25(1):19-23.
[20]刘敏.玉米对重金属铅镉的抗性及累积性研究[D].南宁:广西大学.2010.
[21]杨颖丽,王文瑞,尤佳,等.Cd2+胁迫对小麦种子萌发、幼苗生长及生理生化特性的影响[J].西北师范大学学报(自然科学版),2012,48(3):88-94.
[22]曲凯丽,张艺馨,朱宏.镉胁迫对小麦种子萌发的影响[J].哈尔滨师范大学自然科学学报,2014,30(6):94-98.
[23]吴旭红,张树权.镉胁迫下大豆幼苗生理生化特性分析[J].黑龙江环境通报,2001,25(3):65-68.
[24]胡晓辉,杜灵娟,邹志荣.Spd浸种对盐胁迫下番茄(Solanum lycopersicum)幼苗的保效应[J].生态学报,2009,29(9):5152-5157.
[25]Cakmak I,HorstW J.Effectofaluminium on lipid peroxidation,superoxide dismutase,catalase,and peroxidase activities in root tips of soybean(Glycinemax)[J].Physiologia Plantarum,2006,83(3):463-468.
[26]刘凤,魏雨蒙,刘霜平,等.镉胁迫对小麦生长和生理特性的影响[J].山东化工,2017,46(3):24-26.
Effect of Growth and Physiology-Chemistry of Hemp(Cannabis sativa)Seedlings under Cadmium Stress
HUANG Yumin,DENG Yong,LIDefang,ZHAO Lining,TANG Huijuan,HUANG Siqi*
(Institute of Bast Fiber Crops,Chinese Academy of Agricultural Sciences,Changsha 410205,China)
Threemain cultivars of Hemp(Yunma No.1,Qingdama,Wandama No.1)were employed to analyze changes of seed germination in response to CdCl2stress with different concentrations(5μmol/L,20μmol/L and 50μmol/L).The Hemp of“Yunma No.1”was used to study seedling growth,3,3'-diaminobenzidine staining on roots and leaves,MDA content,and physiological properties in response to cadmium stress with different concentrations(5μmol/L,20μmol/L and 50μmol/L).The results shows:The rate of seed germination decreased with the increase of cadmium concentration,and the germination ratewas as follows:Yunma No.1>Qingdama>Wandama No.1.The rootelongation of“Yunma No.1”decreased remarkably under each CdCl2concentration in comparison with control;meanwhile,high concentration of CdCl2induce lipid peroxidation,deep staining,and the MDA content of root and leaves was significantly increased at 20μmol/L,50μmol/L CdCl2treatment compared with control.In addition,cadmium stress induced the activity of SOD and POD in roots and leaves of“Yunma No.1”which increased first and then decreased.In conclusion,cadmium stress inhibited the seed germination and the seedlings elongation of“Yunma No.1”;deep staining and the incresing of MDA contentmay be associated with lipid peroxidation,destruction of cell membrane integrity caused by cadmium stress.Additionally,the root and leaves of hemp can reduce the activity of reactive oxygen species,decrease the lipid peroxidation and protect itself from oxidative damage by increasing the activities of SOD and POD.
hemp;cadmium stress;physiology-chemistry reaction
S563.3
A
1671-3532(2017)05-0227-07
2017-08-02
国家重点研发计划专项(2017YFD0801105)
黄玉敏(1993-),女,在读硕士,主要从事大麻非生物胁迫逆境机理研究。E-mail:2697565671@qq.com
*通讯作者:黄思齐(1982-),男,副研究员,主要从事红麻、大麻育种以及非生物胁迫逆境机理研究。E-mail:siqihuang@caas.cn
