AhSOS2转基因水稻基因表达及抗逆性分析
2017-10-17李颖秀张国嘉王莹莹王庆国王一帆李臻潘教文刘炜
李颖秀,张国嘉,王莹莹,王庆国,王一帆,4,李臻,潘教文,刘炜
(1.山东省农业科学院生物技术研究中心/山东省作物遗传改良与生理生态重点实验室,山东 济南 250100;2.山东师范大学生命科学学院,山东 济南 250014;3.山东省农业科学院,山东 济南 250100;4.青岛农业大学生命科学学院,山东 青岛 266000)
AhSOS2转基因水稻基因表达及抗逆性分析
李颖秀1,2,张国嘉1,王莹莹3,王庆国1,王一帆1,4,李臻1,潘教文1,刘炜1
(1.山东省农业科学院生物技术研究中心/山东省作物遗传改良与生理生态重点实验室,山东 济南 250100;2.山东师范大学生命科学学院,山东 济南 250014;3.山东省农业科学院,山东 济南 250100;4.青岛农业大学生命科学学院,山东 青岛 266000)
SOS2 (salt overly sensitive 2) 作为植物中一类重要的耐盐相关基因,在调控细胞内离子平衡、参与植物对盐害的响应及适应过程中具有重要作用。前期已从花生叶片中分离到基因AhSOS2(GenBank登录号为HG797656),其属于SOS2类基因,编码446个氨基酸,为丝氨酸/苏氨酸蛋白激酶。本研究以该基因的转基因水稻株系SOS2-1、SOS2-2、SOS2-3、SOS2-7为材料进行荧光定量PCR,分析基因转录表达情况。结果发现,AhSOS2基因在四个转基因株系中均有表达,且在株系SOS2-3中的表达量高于其它株系。对转基因水稻株系进行 250 mmol/L NaCl处理后,检测其相对电导率和脯氨酸、MDA含量,以及抗氧化酶SOD、POD、CAT、APX酶活等胁迫相关的生理指标。结果显示,胁迫条件下,转基因水稻株系相对电导率低于对照,参与胁迫响应的酶活高于对照,说明AhSOS2对提高受体材料的抗盐及抗胁迫能力具有一定作用。该结果为进一步研究AhSOS2及SOS2基因家族功能、解析其对盐害等逆境的适应机制奠定基础。
水稻;SOS2基因家族;AhSOS2;表达模式;生理指标;逆境
AbstractSOS2 (saltoverlysensitive2) is an important class of salt tolerance related genes, which is known to play important roles in the processes of regulation of intracellular ion balance, stress response and adaption of plants to salt damage. In our previous research,AhSOS2(GenBank accession number as HG797656) had been cloned from peanut leaves. Bio-informatic analysis showed that it belonged toSOS2 gene family and encoded 446 amino acids, which belonged to serine/threonine protein kinase. In this research, fourAhSOS2 transgenic rice lines named SOS2-1, SOS2-2, SOS2-3 and SOS2-7 were obtained. Fluorogenic quantitative RT-PCR analysis showed thatAhSOS2 expressed in all the four transgenic lines, and the expression level in SOS2-3 was the highest. After treating with 250 mmol/L NaCl, the physiological indexes of transgenic rice lines such as relative electronic conductivity, contents of proline and MDA, activities of antioxidant enzymes such as SOD, POD, CAT and APX were detected. The results showed that under stress conditions, the relative electronic conductivity of transgenic lines were lower than that of control, and the activities of antioxidant enzymes related to stress response were higher than that of control. It indicated thatAhSOS2 had certain functions in promoting the resistance abilities to salt and stress conditions of acceptor materials. This research laid a solid foundation for further study of function and resistance mechanism ofAhSOS2 and SOS2 gene family.
KeywordsRice; SOS2 gene family;AhSOS2; Expression pattern; Physiological index; Stress
土壤盐渍化又称土壤盐碱化或土壤盐化,主要指土壤中积聚盐、碱且其含量超过正常水平,导致作物生长受到伤害的现象。我国的盐渍土面积约为1.0×108hm2。水稻作为重要的粮食作物,其耐盐新品种的筛选及培育具有极其重要的意义。
在长期进化过程中,水稻自身形成了一定的防御系统,并选择性地积累了部分胁迫抗性基因,对植株维持生命力及对逆境的适应意义重大[1]。但目前与水稻耐盐抗逆及其在胁迫下体内离子稳态调节及适应机制有关的报道仍较少[2]。因此,利用现代生物技术,将抗逆基因转入水稻植株中并开展抗逆转基因育种具有非常重要的意义。
研究证明,植物的耐盐性与植物自身对Na+的吸收、外排以及其在液泡中的储存等过程相关。SOS1基因编码一个Na+/H+反向转运体,其定位于质膜上,不仅在细胞水平参与Na+的外排,还参与Na+由根部向地上部分的运输过程[3,4],SOS1基因的过量表达能提高拟南芥对高盐胁迫的耐受性[5]。SOS2基因编码一个ser/thr蛋白激酶,其N末端有一个催化区域,C末端有一个调控区域[6],该调控区域通过与SOS3发生互作,从而激活SOS2的活性[7,8]。激活的SOS2可对SOS1蛋白进行磷酸化,进而增强SOS1的转运活性[9]。SOS3基因编码一个Ca2+结合蛋白,可参与盐胁迫响应过程[10]。因此,SOS信号传导模式为:胞外的高Na+环境诱导胞内Ca2+浓度的升高,Ca2+与SOS3结合,使其能够与SOS2结合,从而解除SOS2的自我抑制,激活SOS2激酶的活性,SOS3与SOS2的复合物通过磷酸化质膜上的SOS1转运体,从而增强其向胞外转运Na+的能力。
前期研究中,本项目组以花生“鲁花14”为试验材料,结合RACE技术,从花生叶片中分离得到SOS基因家族成员SOS2基因的全长序列,并构建了AhSOS2基因的植物双元表达载体,目前已获得水稻转基因株系。鉴于AhSOS2蛋白序列与大豆、番茄、拟南芥等植物中的SOS2类成员相比,同源性高达70%[11],推测其可能与拟南芥等植物中已报道的SOS2具有相似的生物学功能, 在植物响应干旱、高盐、渗透胁迫等多种信号途径中发挥作用。本研究在获得AhSOS2转基因水稻的基础上,对四个转基因株系进行基因表达分析,并结合高盐胁迫,对其相对电导率、脯氨酸等生理指标进行测定,以期为进一步研究该基因在胁迫下的生理功能及作用机制奠定基础。
1 材料与方法
1.1材料与试剂
以项目组前期构建的AhSOS2植物双元表达载体pCAMBIA1301P-AhSOS2为基础,以其转化水稻“中花11”愈伤组织所得到的四个转基因株系,SOS2-1、SOS2-2、SOS2-3、SOS2-7的T1代种子为材料,以水稻“中花11”种子作为对照(以WT表示)。供试种子经水培,置于光照16 h、25℃,黑暗8 h、20℃条件下培养两周备用。
TransZol Plant试剂盒购于Transgen公司(山东济南雨同生物科技有限公司);PrimeScript Ⅱ 1st Strand cDNA Synthesis Kit试剂盒购于TAKARA公司;RT-PCR所用FastStart Universal SYBR Green Master(Rox)试剂购自罗氏公司;荧光定量引物由上海英潍捷基公司合成;其余试剂为进口或国产分析纯。
1.2试验方法
1.2.1 qRT-PCR检测AhSOS2基因的表达模式 按照TransZol Plant 试剂盒说明书对所取叶片材料进行RNA提取,并参照PrimeScript Ⅱ1st Strand cDNA Synthesis Kit试剂盒说明书对所提RNA进行反转录,得到单链cDNA。
根据AhSOS2基因全长,设计AhSOS2基因qRT-PCR引物AhSOS2R:5′-AGGTGCTAGGCAATCAAGGTTATG-3′,AhSOS2T:5′-CATTATCAAAGGACCTCCCTCAGTAC-3′;以Actin为内对照,其引物序列为P677F:5′-GTCATCGTCATCCTCTTCTC-3′,P677R:5′-CATTCCTGTTCCATTGTCAC-3′。反应在ABI PRISM 7900HT (Applied Biosystems)荧光定量PCR仪上进行,反应体系为20 μL,方法参考FastStart Universal SYBR Green Master (Rox) (13135900罗氏)说明书,反应条件为:95℃ 10 min;95℃ 10 s,60℃ 20 s,72℃ 20 s;40个循环。按照2-ΔΔCT法计算AhSOS2基因在SOS2-1、SOS2-2、SOS2-3、SOS2-7株系中的相对表达量。
1.2.2AhSOS2转基因株系耐盐相关指标的检测 (1)水稻株高及根长测定。AhSOS2转基因株系与WT幼苗水培至两周时,每个株系取30株用含有250 mmol/L NaCl的水稻营养液进行盐处理培养,分别在处理0、24、48 h时对水稻植株进行拍照及株高、根长的测量。
(2)电导率的测定。分别在250 mmol/L NaCl处理0、24、48 h时称取WT、SOS2-1、SOS2-2植株叶片各0.1 g(尽量保证叶片的完整性,少含茎节)进行测定。具体为取大小相当的水稻叶片,用自来水冲洗后再用蒸馏水冲洗干净,用滤纸吸净表面水分,将叶片切割成大小一致的小块,混合均匀,每个时间点取完立即进行电导率测定。
(3)生理指标测定。分别在250 mmol/L NaCl 处理0、24、48 h时取水稻各株系叶片0.5 g,经液氮速冻后,保存于-80℃冰箱备用。
参照氮蓝四唑(NBT)光还原法和愈创木酚法等对所取材料进行脯氨酸、丙二醛含量以及超氧化物歧化酶等抗氧化酶活性检测。
2 结果与分析
2.1AhSOS2基因在不同转基因株系中的表达模式
图1所示,AhSOS2基因在四个转基因株系中均有表达,且株系SOS2-3中的表达量约为其他株系的4.5倍,SOS2-1与SOS2-7表达量类似,SOS2-2相比较而言表达量最低。

图1AhSOS2在转基因株系中的相对表达量
2.2 NaCl处理下AhSOS2转基因水稻表型分析
水培期间显示转基因株系比野生型萌发晚且发育迟缓,推测AhSOS2基因的过量表达可能对植株生长发育存在一定的影响。进行盐处理后,如图2所示,WT叶片黄化和萎蔫程度都很严重,茎秆因脱水严重而变细、抗倒伏能力降低,且根部生长受到抑制;而转基因水稻叶片在短时间高盐处理下仅出现轻微的黄化和萎蔫,茎部相对粗壮、抗倒伏能力较好,虽然根部生长也受到一定程度的抑制,但整体生长状态较好(图3、图4)。
2.3盐处理对AhSOS2转基因株系相对电导率的影响
如图5所示,经250 mmol/L NaCl处理48 h后,与WT相比,转基因植株的相对电导率较低,且SOS2-1株系比对照低近22%,两个转基因株系之间相差18%。
2.4生理指标测定结果
2.4.1 脯氨酸 脯氨酸是植物在盐胁迫下的主要渗透调节物质之一。大量研究结果证实,随着外界盐浓度的增加,植物体内脯氨酸含量升高[11-14],Sanada[15]和Santa-Cruz[16]等认为,脯氨酸的积累是植物为了对抗盐胁迫而采取的一种保护性措施。如图6所示,未经盐处理之前,AhSOS2转基因株系的脯氨酸含量均高于对照,经250 mmol/L NaCl处理48 h时,在各水稻株系中游离脯氨酸含量有所不同,表现为:SOS2-3>SOS2-1>SOS2-2>WT,且SOS2-3中游离脯氨酸含量是WT的2.2倍。

图2 250 mmol/L NaCl处理0、24、48 h后植株表型

图3 250 mmol/L NaCl处理0、24、48 h后株高

图4 250 mmol/L NaCl处理0、24、48 h后植株根长
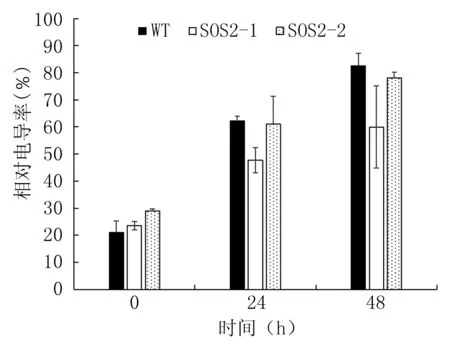
图5 250 mmol/L NaCl处理0、24、48 h后相对电导率
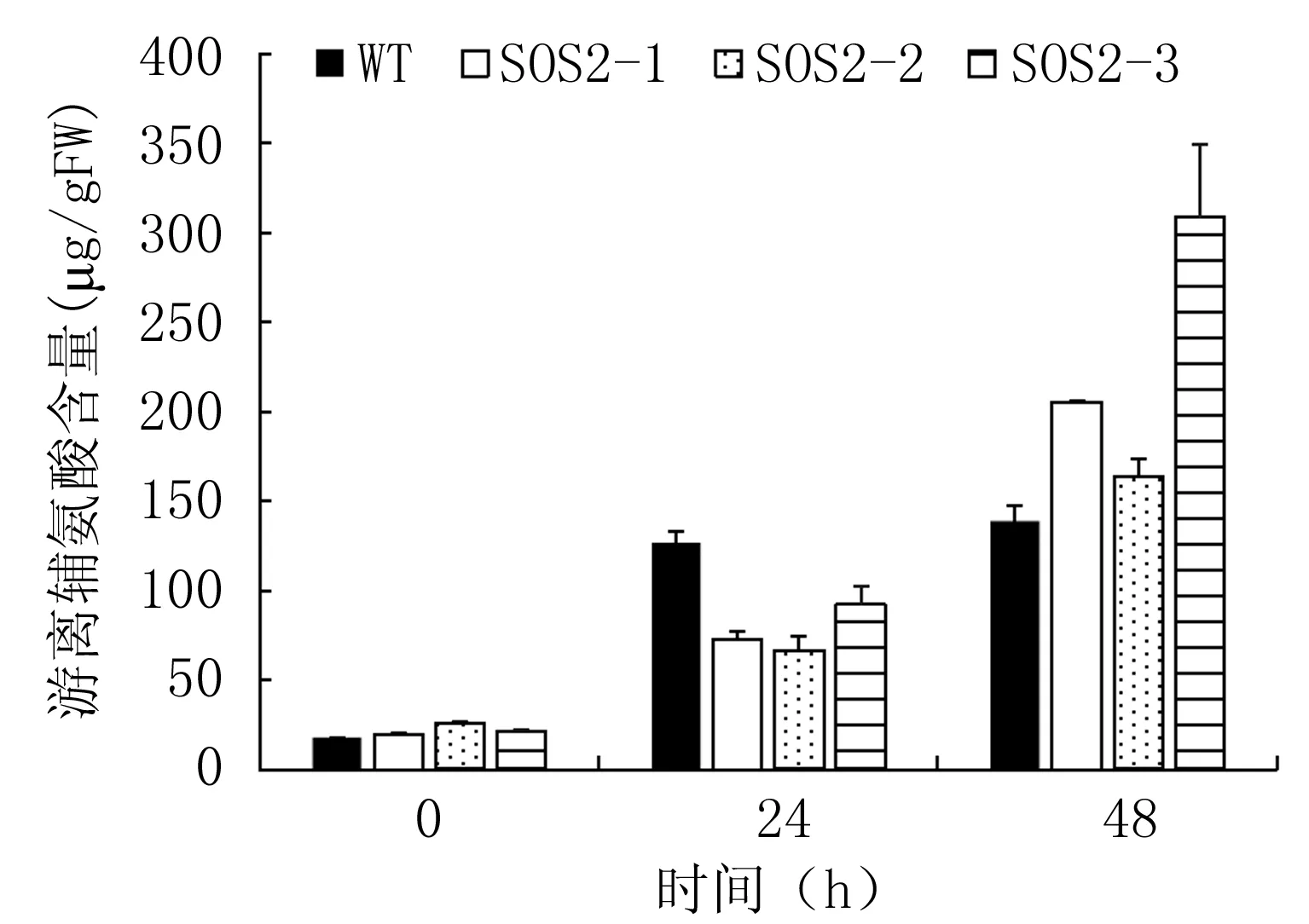
图6 250 mmol/L NaCl处理0、24、48 h后
各株系游离脯氨酸含量
2.4.2 丙二醛含量 丙二醛(MDA)是膜脂过氧化作用的产物之一,能直接反映膜受损程度[17]。耐盐植株在盐胁迫下,细胞膜的结构较稳定,透性变化小,MDA积累较少,膜脂过氧化程度低。在未经盐处理之前,AhSOS2转基因株系与对照的丙二醛含量差别很小;在经盐处理24 h时,对照的MDA含量约是SOS2-3株系的3倍;在经盐处理48 h时,对照中MDA含量与SOS2-2中的相似,但约是SOS2-1、SOS2-3株系中的2倍(图7)。
2.4.3 抗氧化酶 试验结果(图8)显示,250 mmol/L NaCl处理48 h时,AhSOS2转基因株系的超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)的活性几乎均高于对照。在未经盐处理之前,SOS2-3的抗坏血酸过氧化物酶(APX)活性是对照的6.2倍; 处理24 h时,SOS2-3株系的POD活性是对照的2倍;处理48 h时,SOS2-3株系的SOD活性比对照高,POD活性是对照的1.5倍,CAT活性是对照的1.3倍。总体来看,随着盐处理时间的延长,对照与转基因株系的抗氧化酶活性均呈递增趋势,但相比较而言,AhSOS2转基因株系的抗氧化酶活性增加速率普遍高于对照,且与AhSOS2的转录表达量呈正相关。

图7 250 mmol/L NaCl处理0、24、48 h后各株系MDA含量




图8 250 mmol/L NaCl处理0、24、48 h后各株系抗氧化酶酶活
3 讨论与结论
水稻作为人类最主要的粮食作物之一,其产量和品质很容易受到干旱、盐害等非生物胁迫的影响。SOS信号转导途径作为植物耐盐性相关的重要途径之一,在模式植物拟南芥中已有较深入的研究。已有研究证明,SOS信号途径除参与植物盐胁迫响应及抗逆过程外,还可以和其他信号途径交叉成网络来共同发挥对不同生物学过程的调控作用[18,19]。
课题组前期在花生中分离到SOS2家族基因,命名为AhSOS2。鉴于花生的遗传转化体系有待进一步完善、且转化周期较长,本研究通过农杆菌介导的方法,将AhSOS2基因转入模式植物水稻中做进一步研究。已知SnRK家族成员可不同程度地参与胁迫响应过程[20,21],尤其在盐胁迫(包括离子、氧化及渗透胁迫)响应等方面发挥重要作用[22,23],而AhSOS2作为SnRK家族的一员,推测其在抗盐及胁迫响应方面也具有相似的生物学功能。Hu等[24]证明,当NaCl浓度升高到150 mmol/L和200 mmol/L时,与对照和SOS2基因的突变体相比,MdSOS2转基因株系表现出很高的耐盐性。Zhu等[25]对培养5 d的野生型拟南芥和SOS2突变体进行50 mmol/L和100 mmol/L NaCl处理, 发现高盐抑制了植物根部和地上部的生长。本研究结果显示,未经盐处理之前,SOS2-1与SOS2-7株系的植株长势相同,结合荧光定量分析结果发现,这两个株系可能是因为AhSOS2基因转录水平相似,故植株长势及表型变化相似,因此试验中进一步选用SOS2-1进行研究。SOS2-3株系的植株表型与对照相似,推测外源片段插入位点可能与其他株系不同,还有待进一步试验确认。经250 mmol/L NaCl处理48 h后,转基因株系长势明显优于对照,只有少数叶梢出现干枯现象,而对照出现整株萎蔫及枯死现象,间接证明AhSOS2基因在水稻耐盐过程中发挥了一定的作用。
细胞膜透性的大小可以间接用组织的相对电导率来衡量,相对电导率越高,说明植物细胞膜在逆境条件下的受损伤程度越大[28]。本试验中AhSOS2转基因株系的相对电导率在经盐处理后低于对照,且SOS2-1株系比SOS2-2株系的相对电导率低,这与AhSOS2基因的转录表达量呈负相关。而且盐处理后转基因株系脯氨酸含量比对照高,丙二醛含量比对照低,可见AhSOS2基因的过量表达可通过影响逆境相关指标的变化提高受体植株的耐盐性。
研究表明,植物受到逆境胁迫时,往往质膜先受到损伤,细胞内自由基如羟自由基、超氧自由基等增多,使膜透性增加,胞内大量的无机离子和氨基酸、可溶性糖等小分子外渗[26]。为了阻止氧化损伤,耐盐性强的品种会大幅度提高其抗氧化酶系统的活性来清除氧自由基[27]。研究证明,抗氧化酶系统中各酶活与植物耐盐性呈正相关[29,30]。本试验对经盐处理后的株系进行抗氧化酶酶活测定,并结合荧光定量PCR结果分析发现,AhSOS2转基因株系的SOD、POD、CAT酶活在经盐处理48 h时均高于对照。且SOS2-3作为AhSOS2基因转录表达量最高的株系,在盐处理之前,其CAT和APX活性均高于对照,在经盐处理48 h时,其SOD、POD、CAT活性均高于对照和其他转基因株系。综合以上结果,推测AhSOS2基因对水稻在盐胁迫下的生存具有重要的作用,进一步证实了AhSOS2可参与耐盐、抗逆过程。下一步将通过表达谱分析方法,解析其上、下游互作基因,进一步构建AhSOS2的作用通路及网络调控模型,从而为全面分析AhSOS2在植物中的生物学功能、解析其作用机制奠定基础。该方面的工作对于阐明SOS2基因家族对盐害等逆境的适应及防御机制,进而培育水稻抗盐、耐逆作物新品种具有一定的指导意义。
[1] Bohnert H J, Nelson D E, Jensen R G. Adaptation to environmental stresses[J]. Plant Cell, 1995, 7: 1099-1111.
[2] Bi Y P, Liu W, Xia H, et al . EST sequencing and gene expression profiling of cultivated peanut (ArachishypogaeaL.)[J]. Genome, 2010, 53: 832-839.
[3] Shi H,Ishitani M,Kim C,et al. TheArabidopsisthalianasalt tolerance geneSOS1 encodes a putative Na+/ H+antiporter [J]. Proc. Natl. Acad. Sci.,2000,97(12):6896-6901.
[4] Shi H,Quintero F J,Pardo J M,et al. The putative plasma membrane Na+/ H+antiporter SOS1 controls long-distance Na+transport in plants[J].Plant Cell,2002,14(2):465-477.
[5] Shi H,Lee B H,Wu S J,et al. Overexpression of a plasma membrane Na+/ H+antiporter gene improves salt tolerance inArabidopsisthaliana[J].Nat. Biotechnol.,2003,21(1):81-85.
[6] Liu J,Iahitani M,Halfter U,et al.TheArabidopsisthalianaSOS2 gene encodes a protein kinase that is required for salt tolerance[J].Proc. Natl. Acad. Sci.,2000,97(7):3730-3734.
[7] Ishitani M,Liu J,Halfter U,et al.SOS3 function in plant salt tolerance requires N-myristoy lation and calcium binding[J].Plant Cell,2000,12(9): 1667-1678.
[8] Guo Y,Qiu Q S,Quintero F J,et al.Transgenic evaluation of activated mutant alleles ofSOS2 reveals a critical requirement for its kinase activity and C-terminal regulatory domain for salt tolerance inArabidopsisthaliana[J].Plant Cell,2004,16(2): 435-449.
[9] Quintero F J,Ohta M,Shi H,et al. Reconstitution in yeast of theArabidopsisSOSsignaling pathway for Na+homeostasis[J].Proc. Natl. Acad. Sci.,2002,99(13): 9061-9066.
[10] Halfter U,Ishitani M,Zhu J K.TheArabidopsisSOS2 protein kinase physically interacts with and is activated by the calcium-binding protein SOS[J]. Proc. Natl. Acad. Sci.,2000,97(7): 3735-3740.
[11] 张国嘉,侯蕾,刘炜,等. 花生AhSOS2基因的克隆及功能初探[J].作物学报,2014,40(3):405-415.
[12] Yang S J, Zhang B X ,Zhang X L. Evaluation and selection of saline-alkali tolerance of different geographical provenances ofGleditsiatriacanthos[J]. Protection Forest Science and Technology, 2008(2): 7-8, 14.
[13] Zhang Y Q, Liu S Q, Yang F J, et al. Study on the screening of salt-tolerant watermelon stock and mechanism of salt-tolerance[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2003, 12(4): 105-108.
[14] Wu C X, Wu H Y, Zhu W B, et al. Physiological reaction and salt tolerance of several kinds of wild halophytes in different salt and alkali soils[J]. Journal of Anhui Agr. Sci.,2008,36(20):8450-8452.
[15] Sanada Y, Veda H, Kuribayashi K.et al. Novel light-dark change of proline levels in halophyte (MesembryanthemumcrystallinumL.) and glyeophytes(HordeumvulgareL. andTriticumaestivumL.) leaves and roots under salt stress[J]. Plant Cell Physiol.,1995,36(6):965-970.
[16] Santa-Cruz A, Acosta M, Rus A, et al. Short-term salt tolerance mechanisms in differentially salt tolerant tomato species[J]. Plant Physiol. Biochem., 1999, 37(1): 65-71.
[17] 李合生.植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 260-262.
[18] Katiyar-Agarwal S, Zhu J, Kim K, et al. The plasma membrane Na+/H+antiporter SOS1 interacts with RCD1 and functions in oxidative stress tolerance inArabidopsis[J]. Proc. Natl. Acad. Sci.,2006,103: 18816-18821.
[19] Ji H, Pardo J M, Batelli G, et al. The salt overly sensitive (SOS)pathway: established and emerging roles[J]. Mol. Plant, 2013, 6(2): 275-286.
[20] Hwang Y S, Bethke P C, Cheong Y H, et al. A gibberellin-regulated calcineurin B in rice localizes to the tonoplast and is implicated in vacuole function[J]. Plant Physiol., 2005, 138: 1347-1358.
[21] Mahajan S, Sopory S K, Tuteja N. Cloning and characterization of CBL-CIPK signaling components from a legume (Pisumsativum)[J]. FEBS J., 2006, 273: 907-925.
[22] Weinl S, Kudla J. The CBL-CIPK Ca2+-decoding signaling network: function and perspectives[J]. New Phytol., 2009, 184: 517-528.
[23] Hrabak E M, Chan C W, Gribskow M, et al.ArabidopsisCDPK-SnRK super family of protein kinases[J]. Plant Physiol., 2003, 132:666-680.
[24] Hu D G, Li M, Luo H, et al. Molecular cloning and functional characterization ofMdSOS2 reveals its involvement in salt tolerance in apple callus andArabidopsis[J]. Plant Cell, 2012, 31: 713-722.
[25] Zhu J K, Liu J P, Xiong L M. Genetic analysis of salt tolerance inArabidopsisthaliana: evidence of a critical role for potassium nutrition[J]. Plant Cell, 1998, 10:1181-1192.
[26] 刘艳丽,许海霞,刘桂珍,等.小麦耐盐性研究进展[J].中国农学通报,2004, 24(11):202-207.
[27] 卢少云,郭振飞,彭新湘.干旱条件下水稻幼苗的保护酶活性及其与耐旱性关系[J].华南农业大学学报,1997, 18(4):21-25.
[28] Qiman Y, Li Y, Uhetaer M, et al. Effects of salt stress treatment on seed germination and seedling physiological characteristics inElaeagnusangustifoliaL.[J]. Xinjiang Agricultural Sciences, 2006, 43(2): 136-139.
[29] Feng L, Bai Z Y, Lu B S, et al. Effect of salt stress on membrane-lipid peroxidation and resistant-oxidation enzyme activities ofAcermonoandChionanthusretusus[J]. Journal of Northwest Forestry University, 2008, 23(4): 5-7.
[30] Wang Y X, Zhang B. Effects of salt stress on enzyme activity and soluble sugar content of alfalfa[J]. Xinjiang Agricultural Sciences, 2009, 46(3): 589-591.
GeneExpressionandStressResistanceAnalysisofAhSOS2TransgenicRice
Li Yingxiu1,2, Zhang Guojia1, Wang Yingying3, Wang Qingguo1, Wang Yifan1,4, Li Zhen1, Pan Jiaowen1, Liu Wei1
(1.BiotechnologyResearchCenter,ShandongAcademyofAgriculturalSciences/ShandongProvincialKeyLaboratoryofCropGeneticImprovement,EcologyandPhysiology,Jinan250100,China; 2.CollegeofLifeSciences,ShandongNormalUniversity,Jinan250014,China; 3.ShandongAcademyofAgriculturalSciences,Jinan250100,China; 4.CollegeofLifeSciences,QingdaoAgriculturalUniversity,Qingdao266000,China)
10.14083/j.issn.1001-4942.2017.09.004
2017-04-05
山东省自然科学基金面上项目“调控水稻穗发育的类受体蛋白激酶FTPK1作用机制研究”(2016ZRC02178);山东省农业科学院重大科技成果培育计划项目(2015CGPY10); 山东省农业科学院青年英才计划项目(2015—2017, 2016—2018); 山东省自然科学基金项目“黑条矮缩病毒侵染过程中水稻內源赤霉素的变化及其机制研究”(ZR2014CQ024);山东农业大学作物生物学国家重点实验室开放课题“水稻种胚基因OsESG1的生物学功能研究”(2014KF13)
李颖秀(1993—),女,硕士研究生,研究方向为植物发育生物学。E-mail:yingxiu1993@163.com
刘炜(1975—),女,研究员,研究方向为作物分子育种。E-mail:wheiliu@163.com
S511:Q786
A
1001-4942(2017)09-0019-06
