重组人白细胞介素7在HEK293细胞中稳定分泌表达
2017-10-16李向茸王兴陇李琼毅张海霞包晓婧冯若飞
李向茸, 王兴陇, 令 瑛, 徐 雷, 李琼毅, 张海霞, 包晓婧, 冯若飞
(1. 西北民族大学 生物工程与技术国家民委重点实验室, 兰州 730030; 2. 甘肃省动物细胞工程技术研究中心, 兰州 730030; 3. 西北民族大学 生命科学与工程学院, 兰州 730030)
重组人白细胞介素7在HEK293细胞中稳定分泌表达
李向茸1,2, 王兴陇3, 令 瑛3, 徐 雷3, 李琼毅3, 张海霞1,2, 包晓婧3, 冯若飞1,2
(1. 西北民族大学 生物工程与技术国家民委重点实验室, 兰州 730030; 2. 甘肃省动物细胞工程技术研究中心, 兰州 730030; 3. 西北民族大学 生命科学与工程学院, 兰州 730030)
通过构建人白细胞介素7的重组真核表达载体,转染HEK293细胞,实现IL-7在HEK293细胞中的稳定分泌表达,为生产试剂级的IL-7奠定基础。从质粒pLV-CMV-EF1-GP-rIL-7中扩增人IL-7全长基因,并将其构建于pcDNA3.1真核表达载体上。利用脂质体法将重组质粒转染HEK293细胞,经G418筛选及单克隆,获得稳定分泌表达IL-7的HEK293-rIL-7细胞系。成功构建真核表达质粒pcDNA3.1-rIL-7,并实现IL-7在HEK293细胞上的稳定分泌表达,最终获得了1株表达量较高的细胞株,命名为HEK293-IL7-2G3细胞,培养48 h的细胞上清中IL-7的含量为3.2 ng/mL。为进一步实现人白细胞介素7在哺乳动物细胞中的分泌表达及药物开发奠定基础。
白细胞介素7;转染;绿色荧光蛋白;分泌表达
AbstractThe objective of this study was to construct eukaryotic expression vector of human interleukin-7, and make it expressed in HEK293 cells.IL-7 gene was amplified by PCR from the lentivirus expression vector pLV-CMV-EF1-GPL-rIL-7, and then cloned into the pcDNA3.1 vector to construct eukaryotic expression vector pcDNA3.1-rIL-7. The constructed plasmid was transfected into the HEK293 cells via LipofectamineTM2000 separately and screened by G418 continuously. By G418 screening and monoclonal, stably secreting expression IL-7 cell line HEK293-rIL-7 was obtained, successfully constructed eukaryotic expression vector pcDNA3.1-rIL-7, and expressed in HEK293 cells. By cell cloning, one cell line with high secretory expression was obtained, named HEK293-rIL7-2G3. The content of IL-7 in the supernatant after 48 h was 3.2 ng/mL.
KeywordsIL-7; transfection; green fluorescent protein; secretory expression
白细胞介素(Interleukin, IL),简称白介素,是由巨噬细胞、淋巴细胞等产生的淋巴因子,在信息传递,免疫细胞的成熟、活化、增殖与分化及在炎症反应中起重要作用[1]。白细胞介素7(Interleukin-7, IL-7)又称淋巴生成素1(Lymphopoeitin-1, LP-1),是白细胞介素家族中的一员,属于促红细胞生成素家族Ⅰ型短链细胞因子[2]。IL-7基因全长1589 bp,位于8q12-13[3],完整的ORF区内含534个碱基对,编码177 个氨基酸,未经糖基化修饰的IL-7分子质量为17.4 ku,而成熟的IL-7蛋白分子质量约为25 ku,含3个N-糖基化位点,编码152个氨基酸[4-5]。人IL-7是由骨髓基质细胞、胸腺细胞、脾脏细胞和皮肤角化细胞等产生的糖蛋白[6],在肝、脾、胸腺等组织中亦可检测到hIL-7 mRNA的表达。IL-7为一种多效细胞因子,免疫效应广泛,对于T细胞生长、增殖及分化等多方面有重要作用[7-8]。人们试图利用IL-7 来治疗疾病,如肿瘤[9]、艾滋病[10]、乳腺癌、结肠癌、膀胱癌等[11],且在相关实验中发现,IL-7 能改善症状或有效地治疗这些疾病,为人类最终战胜这些疾病带来希望。
IL-7目前可通过重组技术制造应用于人体,国外最早应用的人重组IL-7(IL-7, CYT99007)由大肠埃希杆菌产生,现在研究应用的IL-7(CYT107)是由Cytheris SA 使用重组哺乳动物细胞培养体系制造的第二代重组人IL-7产物。现今,在全球范围内登记在册的合并IL-7应用的临床实验多达15个,应用方法均为皮下注射[2]。目前这些试验得出以下一致结论:利用IL-7进行生物治疗是安全有效的[2]。然而国内关于IL-7的研究较少,且均为大肠杆菌[12]和酵母细胞[13-15]表达,暂无IL-7上市的信息。本实验拟通过构建人IL-7基因的真核表达载体pcDNA3.1-rIL-7,转染HEK293细胞,经过G418筛选,实现IL-7在HEK293细胞中的稳定表达,为进一步实现人白细胞介素7在哺乳动物细胞中的分泌表达及药物开发奠定基础。
1 材料与方法
1.1 菌株、细胞和试剂
E.coliDH5α、慢病毒表达载体pLV-CMV-EF1-GP-rIL-7、pcDNA3.1-EGFP质粒、BL21(DE3)菌株、人胚肾细胞(HEK293)均由西北民族大学生物工程与技术国家民委重点实验室提供。
新生牛血清购自兰州民海生物工程有限公司;DMEM培养基、F12培养基、胰蛋白酶购自兰州百灵生物技术有限公司;细胞总RNA提取试剂盒、TIANScript M-MLV、TaqDNA聚合酶、高纯度质粒小提试剂盒及增强型HRP-DAB底物显色试剂盒均购自北京天根生化科技有限公司;凝胶回收试剂盒购自AXYGEN公司;EcoRⅠ内切酶、NotⅠ内切酶、T4DNA连接酶购自宝生物工程(大连)有限公司;100 bp DNA ladder、1kb DNA ladder均购自中科瑞泰生物科技有限公司; G418购自美国Gibco公司;LipofectamineTM2000脂质体购自Invitrogen公司;非预染蛋白Marker购自Bio-rad公司;PVDF 膜购自Solarbio公司;Mouse Anti-IL-7抗体、IL-7 ELISA试剂盒购自美国Abcam公司;山羊抗小鼠-HRP购自美国Jackson公司。
1.2 人IL-7引物及基因的扩增
根据pLV-CMV-EF1-GP-rIL-7的核苷酸序列和pcDNA3.1载体序列,用Primer Premier 5.0等软件设计引物YIL-7-F/R,并由上海生工生物工程有限公司进行合成(注:斜体部分为保护碱基,下划线部分分别为EcoR I及NotI酶切位点)。
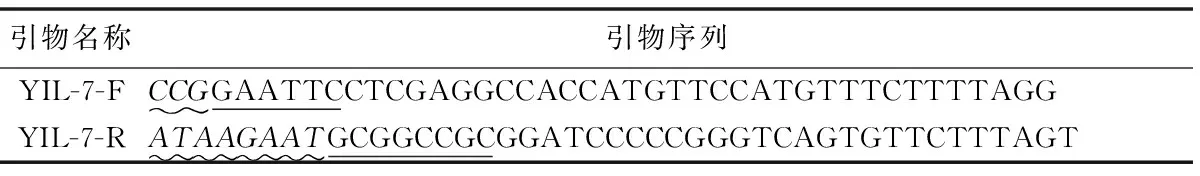
表1 引物名称及序列
以pLV-CMV-EF1-GP-rIL-7载体为模板,用IL-7基因的特异引物YIL-7-F/R进行PCR扩增,反应条件为:95℃预变性5 min;94℃变性30 s,69℃退火45 s,72℃延伸1 min,共35个循环; 72℃再延伸10 min。反应结束后,对PCR产物进行12 g/L琼脂糖凝胶电泳鉴定。
1.3 重组表达载体pcDNA3.1-rIL-7的构建
将上述PCR产物进行回收后,与pMD18-T连接,转化E.coliDH5α,构建克隆载体pMD18-T-IL-7。分别用EcoR I +NotI双酶切pMD18-T-IL-7和pcDNA3.1载体,之后分别进行纯化,然后用T4DNA连接酶连接、转化E.coliDH5α、单克隆培养后提取质粒,依次进行PCR、酶切及测序鉴定,测序鉴定完全正确的质粒命名为pcDNA3.1-rIL-7。
1.4 重组质粒pcDNA3.1-rIL-7转染HEK293细胞
1.4.1 HEK293细胞G418最佳筛选浓度的确定
将HEK293细胞按1×105cells/孔 铺于24孔板中,然后取不同浓度梯度的G418加入24孔板中,G418的浓度梯度为0、200、400、600、800和1000 μg/mL。培养10~14 d并每天观察细胞状态。
1.4.2 转染HEK293细胞
将处于对数生长期并生长良好的HEK293细胞以1×106cells/mL接种至6孔细胞培养板中,次日将细胞用无血清opti-MEM洗2遍,然后每孔加入1.5 mL opti-MEM。分别将空载质粒pcDNA3.1、阳性对照质粒pcDNA3.1-EGFP及重组质粒pcDNA3.1-rIL-7用opti-MEM稀释后按比例加入至同样用opti-MEM稀释的Lipofectamine2000中,20 min后将混合液分别逐滴加入至对应的HEK293细胞孔中,37℃、50 mL/L CO2培养箱中反应5 h,弃去转染液,每孔加入2 mL 10%新生牛血清的F12培养基培养。
1.4.3 HEK293-rIL-7细胞亚克隆
转染24 h后,吸除培养基,加入最小致死浓度的G418筛选培养基进行培养。待细胞长满后,用0.25%胰蛋白酶消化,加入最小致死浓度的G418筛选培养基进行筛选,按1个细胞/孔接种96孔板,每孔200 μL培养基,培养约14 d左右,观察细胞克隆生长情况。
1.4.4 亚克隆细胞的初检及其保存
96孔板中细胞培养14 d后,挑选1个细胞/孔的亚克隆细胞株,吸取150 μL培养基上清做ELISA检测,具体检测方法参见Abcam公司的IL-7 ELISA试剂盒(ab100574)。
将检测为阳性的亚克隆细胞株从96孔板中依次放大至24孔板、6孔板及细胞瓶中,传代过程中保证G418浓度不变,然后用0.25%胰蛋白酶将细胞消化下来,取一部分细胞继续培养,其余细胞冻存。
1.5 亚克隆细胞株的IL-7表达检测
1.5.1 荧光蛋白的表达情况
分别在转染24 h和48 h后观察细胞的生长状态以及对照组绿色荧光的表达情况,以初步判断转染效率。
1.5.2 IL-7基因的转录
参照总RNA提取试剂盒(天根)提取HEK293-rIL-7细胞总RNA,TIANScript M-MLV的反转录试剂盒合成第一链cDNA。PCR方法同1.2。反应结束后,进行12 g/L琼脂糖凝胶电泳。
1.5.3 重组蛋白的ELISA检测
标准品的稀释:向干粉中加入400 μL双蒸水,溶解粉末,配置75 ng/mL标准液;然后取8 μL上述标准液,加入到592 μL的1×Assay Diluent B中,配置标准品1(1000 pg/mL);再取200 μL上述标准液1,加入到400 μL的1×Assay Diluent B中,配置标准品2(333.3 pg/mL);依次类推,分别配置标准品3(111.1 pg/mL)、标准品4(37 pg/mL)、标准品5(12.3 pg/mL)及标准品6(4.1 pg/mL)。
检测方法参见Abcam公司的IL-7 ELISA试剂盒(ab100574)。
1.5.4 重组蛋白的Western Blotting分析
分别收集空白对照组及实验组的细胞上清,经冻干浓缩100倍后加入等量的2×SDS上样缓冲液,95℃煮沸5 min,进行SDS-PAGE分析,在15 V 30 min半干转条件下转印到PVDF膜上。取出膜用50 g/L 脱脂奶粉室温摇床封闭2 h后,分别用1∶500的Mouse Anti-IL-7抗体4℃孵育过夜。次日,再加入1∶5000山羊抗鼠IgG-HRP,室温摇床反应2 h。经PBST充分洗涤后,进行DAB显色。
2 结果
2.1 重组表达载体 pcDNA3.1-rIL-7的构建
重组质粒经内切酶(EcoR I +NotI)酶切后,出现2条清晰的电泳条带,约为5.4 kb和540 bp,与预期相符(图1);测序结果进行Blast比对,显示插入片段与GenBank中公布的人IL-7基因(J04156.1)的核苷酸序列同源性为100%;表明重组表达载体pCDNA3.1-rIL-7构建成功。
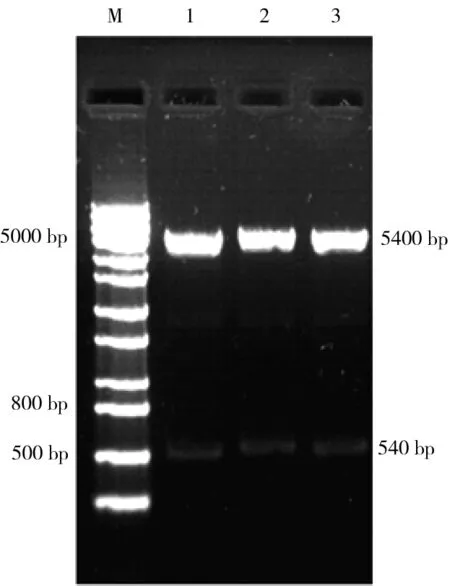
图1 pCDNA3.1-rIL-7重组质粒酶切鉴定
M: 1 kb plus DNA分子量Marker; 1~3: 重组质粒pCDNA3.1-rIL-7双酶切产物
2.2 G418最小致死浓度的筛选
加入不同浓度的G418培养14 d发现,G418浓度为600 μg/mL时,HEK293细胞全部死亡,所以HEK293细胞G418的最小致死量为600 μg/mL。
2.3 pcDNA3.1-rIL-7转染HEK293细胞
将pCDNA3.1-rIL-7与对照组pCDNA3.1-EGFP转染HEK293细胞后,在24 h就可观察到对照组出现绿色荧光,在48 h时达到最强,结果见图2。说明pCDNA3.1-rIL-7成功转染HEK293细胞。
2.4 HEK293-rIL-7细胞亚克隆及IL-7蛋白初检
将HEK293-rIL-7细胞用含600 μg/mL G418的DMEM培养基稀释,按1cell/孔接种96孔板,培养2周,在第一周后观察细胞,仅发现1个单克隆细胞株,命名为2G3,用ELISA方法检测发现,细胞上清中有rIL-7蛋白表达。结果见表2。

图2 HEK293-rIL-7细胞与对照组细胞绿色荧光观察(100×)
A、C: pcDNA3.1-rIL-7转染组24 h; B、D: pcDNA3.1-rIL-7转染组48 h; E、G: pcDNA3.1-EGFP对照组转染24 h; F、H: pcDNA3.1-EGFP对照组转染48 h

表2 ELISA初检结果
2.5 HEK293-rIL-7-2G3细胞株的IL-7表达检测
2.5.1 IL-7基因的转录
HEK293-rIL-7-2G3的细胞可扩增出IL-7基因片段(540 bp),结果见图3。说明IL-7基因在HEK293细胞中成功转录表达。

图3 HEK293-rIL-7-2G3细胞中基因的转录表达检测
M:100 bp DNA分子质量标准;1:HEK293-rIL-7-2G3试验组;2:HEK293对照组
2.5.2 IL-7的ELISA检测
将HEK293-rIL-7-2G3细胞在细胞瓶中培养2 d后,收取细胞上清,并用含10%新生牛血清的DMEM培养基稀释细胞,ELISA标准曲线及IL-7含量计算公式见图4;ELISA检测结果见表3。
2.6 Western Blotting 检测
收集各组细胞上清经冻干浓缩100倍后进行SDS-PAGE,转移至PVDF膜上进行Western Blotting分析。结果表明(图5),表达产物主要为分泌性表达,HEK293-rIL-7-2G3组在25 ku处出现特异性条带,且HEK293-rIL-7-2G3浓缩样品比非浓缩样品组条带粗很多,而HEK293上清及HEK293-EGFP上清组均无此条带出现(图5),表明IL-7基因在HEK293细胞中得到正确表达,表达的重组IL-7蛋白能够与鼠抗IL-7发生特异性结合,具有良好的反应原性。
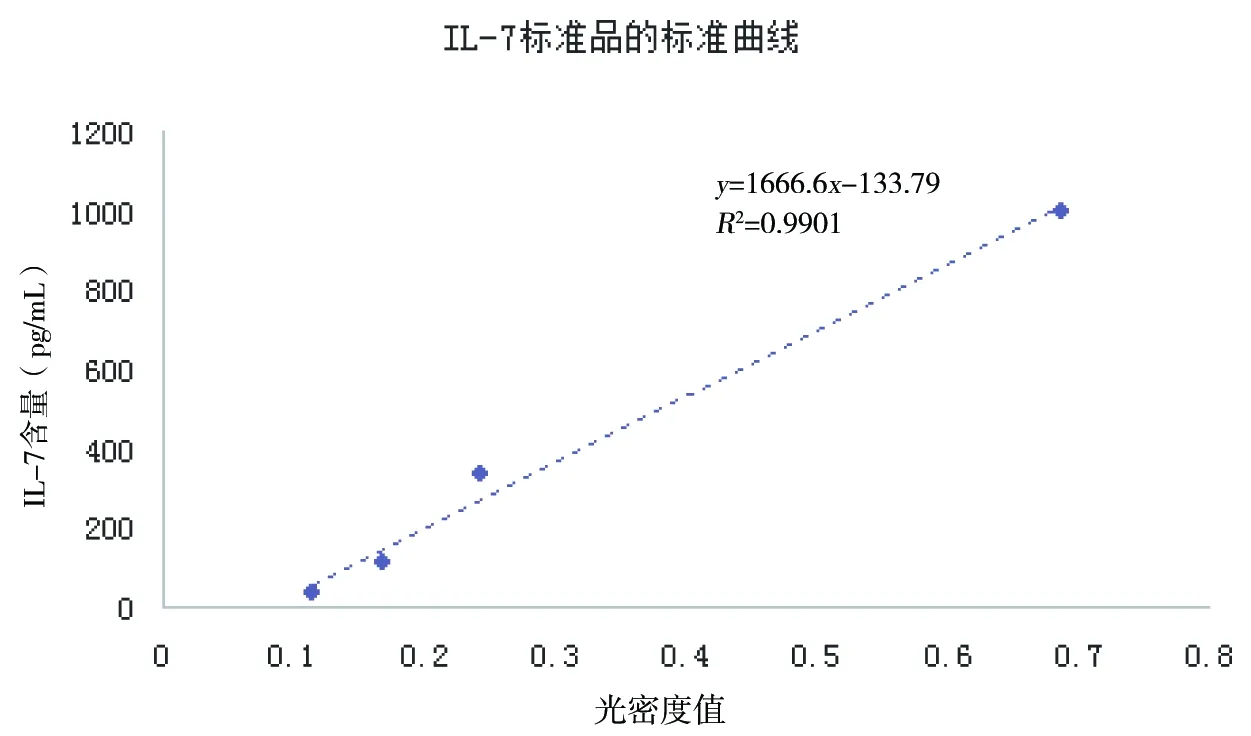
图4 IL-7标准品的标准曲线绘制
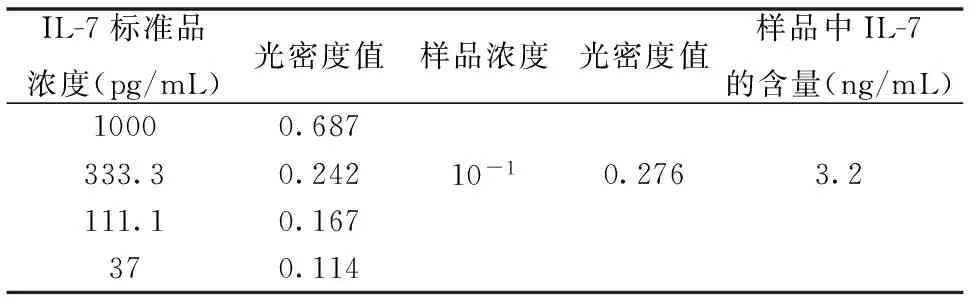
IL-7标准品浓度(pg/mL)光密度值样品浓度光密度值样品中IL-7的含量(ng/mL)10000.687333.30.24210-10.2763.2111.10.167370.114

图5重组IL-7的Western Blotting分析
Fig 5 Western Blotting analysis of recombinant IL-7 protein
1: HEK293-rIL-7-2G3浓缩上清; 2: HEK293-EGFP对照浓缩上清;3: HEK293-rIL-7-2G3裂解细胞; 4: HEK293-EGFP裂解细胞; 5: HEK293空白上清;6: HEK293裂解细胞; M: 非预染蛋白质分子质量标准
3 讨论
IL-7发现较早,但是对于其生物学功能研究近年来才开始,就目前来说,在相关分子机制上仍有所欠缺,且尚未形成产品(药品)。大肠杆菌是使用最早的表达系统,它的显著优点是成本低,易于操作,产量高[16],但是由于用大肠杆菌生产的蛋白质药物缺乏糖基化在人体内容易被降解,药效因此大大降低。另外,它容易产生内毒素和包涵体,这个问题也不容忽视。在外源蛋白表达系统中酵母表达系统是后起之秀,原核细胞操作性良好,真核系统后加工能力也超强,缺点是产量低、糖基化问题较为突出[16]。昆虫杆状病毒系统优点颇多,产品的免疫原性和功能与天然蛋白质相似,水平也高,但是其表达产物的糖基化程度低,形式单一[17];哺乳动物表达系统能够对表达产物进行翻译后修饰,使产物的结构与功能最接近天然蛋白质[18],常用的细胞株有CHO、SP2/0、BHK-21、Vero及HEK293等。李金松等[19]利用位点特异性重组系统通过FLP-In-CHO细胞表达人白细胞介素7,但因其使用的几种细胞均为鼠源性,可能有微量的鼠IL-7难以去除,影响最终产品纯度和质量。为表达人用IL-7需排除鼠IL-7对后续实验的影响,故本研究选用HEK293细胞。
将真核表达载体pcDNA3.1-IL-7和对照组载体pcDNA3.1-EGFP转染HEK293细胞,转染24 h后用显微镜观察发现转染pcDNA3.1-EGFP对照组细胞出现绿色荧光,证明质粒已成功转染入细胞中,且随着培养时间的延长,荧光细胞的数量及荧光强度也在递增,48 h后达到最强,但仍有部分细胞未发出荧光,说明有少部分细胞未转染成功,需对转染细胞进行细胞亚克隆。对HEK293-rIL-7细胞亚克隆后,仅获取了1株亚克隆细胞,经ELISA初检发现2G3中有IL-7的表达,将2G3放大培养,收集细胞沉淀及上清,通过Western Blotting及ELISA方法检测发现,IL-7蛋白主要集中在细胞上清中,为分泌性表达,在75 cm2细胞瓶中培养2 d后,检测2G3培养基上清中IL-7的含量为3.2 ng/mL。
通过对比发现,真核细胞转染组细胞IL-7的表达量要比慢病毒转导组的IL-7表达量高[20],而且同一种方法中,HEK293-rIL-7的IL-7蛋白表达量要比CHO-K1-rIL-7的IL-7蛋白表达量高[21],其中亚克隆细胞株2G3的IL-7蛋白表达量最高,达到3.2 ng/mL,本研究成功实现了IL-7蛋白在HEK293细胞中的分泌表达,但蛋白表达量相对较低,需对实验方法及细胞培养条件进一步进行优化,提高IL-7蛋白的表达水平。
[1]LUNDMARK F, DUVEFELT K, IACOBAEUS E, et al. Variation in interleukin 7 receptor α-chain (IL-7R) influences risk of multiple sclerosis[J]. Nat Genet, 2007, 39(9):1108-1113.
[2]丁 鹏, 刘永哲, 王贵强, 等. 白细胞介素-7的生物学特征及其在临床治疗中的作用和意义[J]. 中国医学前沿杂志, 2011, 3(4): 116-120.
[3]SUTHERLAND G R, BAKER E, FERNANDEZ K E, et al. The gene for human interleukin 7 (IL7) is at 8q12-13[J]. Hum Genet, 1989, 82(4):371-372.
[4]OUELLETTE T, DESTRAU S, OUELLETTE T, et al. Production and purification of refolded recombinant human IL-7 from inclusion bodies[J]. Protein Expres Purif, 2003, 30(2):156-166.
[5]彭羽瑜. 重组人白细胞介素-7及其剪接变异体蛋白的表达、复性和纯化[D]. 广州: 广东药学院, 2014.
[6]温洁霞, 仲 飞, 李秀锦, 等. 白细胞介素7的生物学特性及其在抗病毒免疫中的研究进展[J]. 畜牧与兽医, 2012(S1): 98-102.
[7]SUN L, GUO J, BROWN R, et al. Declining expression of a single epithelial cell-autonomous gene accelerates age-related thymic involution[J]. Aging Cell, 2010, 9(3): 347-357.
[8]TANI-ICHI S, SHIMBA A, WAGATSUMA K, et al. Interleukin-7 receptor controls development and maturation of late stages of thymocyte subpopulations [J]. Proc Natl Acad Sci USA, 2013, 110(2): 612-617.
[10]SIEG S F. Interleukin-7 biology in HIV disease and the path to immune reconstitution [J]. Curr HIV Res, 2012, 10 (4): 341-347.
[11]RONALD G. Improving the immune system with human IL-7 vaccine in older subjects who have had chemotherapy[EB/OL]. http://www.clinicaltrials.gov/ct2/ show/study/NCT01339000, 2016-06-16/2016-09-19.
[12]耿 梅, 陈 清, 徐丽慧, 等. 人白细胞介素7重组蛋白原核表达载体在大肠杆菌中的表达和鉴定[J]. 暨南大学学报(自然科学与医学版), 2010, 31(4):331-335.
[13]娄瑞娟, 罗利龙, 张 霞, 等. 巴斯德毕赤酵母表达系统的研究进展和前景展望[J]. 生物学杂志, 2010, 27(5): 73-76.
[14]唐元家, 余柏松. 巴斯德毕赤酵母表达系统[J]. 国外医药抗生素分册, 2002, 23(6): 246-250.
[15]李志龙, 张富春. 巴斯德毕赤酵母表达系统研究进展[J]. 生物技术通报, 2006(6): 9-13.
[16]郭广君, 吕素芳, 王荣富. 外源基因表达系统的研究进展[J]. 科学技术与工程, 2006, 6(5): 582-587.
[17]孙 阳, 张淑颖. 昆虫杆状病毒表达系统的研究及其新进展[J]. 江西农业学报, 2006, 18(5): 96-99.
[18]RAI M, PADH H. Expression systems for production of heterologous proteins[J]. Curr Science, 2001, 80(9): 1121-1128.
[19]李金松, 麻粉莲, 张 骞, 等. 人白细胞介素7在CHO细胞中的表达及活性鉴定[J]. 生物技术通讯, 2015, 26(4): 477-480.
[20]李向茸, 令 瑛, 徐 雷, 等. 白细胞介素-7基因慢病毒表达载体的构建及在CHO-K1细胞中的稳定表达[J]. 中国生物制品学杂志, 2017, 30(6): 571-576.
[21]徐 雷. IL-7真核表达载体的构建及稳定表达[D]. 兰州: 西北民族大学, 2016.
Stable secretory expression of recombinant human IL-7 in HEK293 cells
LI Xiang-rong1,2, WANG Xing-long3, LING Ying3, XU Lei3, LI Qiong-yi3,ZHANG Hai-xia1,2, BAO Xiao-jing3, FENG Ruo-fei1,2
(1. The Key Bio-engineering and Technology Laboratory of Nationality Commission, Northwest Minzu University, Lanzhou 730030; 2.Gansu Engineering Research Center for Animal Cell, Lanzhou 730030; 3. Life Science and Engineering College, Northwest Minzu University, Lanzhou 730030, China)
Q78
A
2095-1736(2017)05-0024-05
2016-08-22;
2016-09-18
教育部“长江学者和创新团队发展计划”项目(IRT13091); 2015年中央高校基本科研业务费专项(31920150075);西北民族大学中央高校基本科研业务费专项资金资助研究生项目资助(Yxm2015205)
李向茸,助理实验师,研究方向为合成生物学和分子病毒学,E-mail:491753586@qq.com
冯若飞,高级实验师,硕士生导师,研究方向为分子病毒学,E-mail:frfself@126.com
doi∶10.3969/j.issn.2095-1736.2017.05.024
