固相萃取-高效液相色谱法测定植物根际促生菌 发酵产物中3种植物激素的含量
2017-10-15陈建纲
刘 婷, 姚 拓*, 陈建纲, 刘 欢
(甘肃农业大学草业学院/草业生态系统教育部重点实验室/甘肃省草业工程 实验室/中-美草地畜牧业可持续发展研究中心,甘肃兰州 730070)
植物激素(Plant Hormones,PHs)是一类在植物体内含量极少,但在调节植物生长发育、新陈代谢等方面具有重要作用的微量有机化合物[1]。PHs不仅能由植物产生,而且许多细菌也可以产生诸如生长素(Auxins,Auxs)、赤霉素(Gibberellins,GAs)、细胞分裂素(Cytokinins,CTKs)等多种PHs类物质,从而具有促进植物生长的作用[2]。植物根际促生菌(Plant Growth Promoting Rhizobacteria,PGPR)是指存在于植物根际对植物生长有促进作用的一类有益菌[3 - 4]。近年来,国内外研究表明,PGPR不但可以通过溶磷作用促进植物生长,还可以通过固定大气中游离态的氮、拮抗病原微生物、分泌PHs等作用对植物进行促生[5 - 7]。化肥的过量施用严重地污染了土壤环境并威胁着生态平衡,微生物菌肥的研制与开发已成为目前解决化肥问题的最佳选择,PGPR优良促生菌资源的筛选是研制PGPR菌肥的最重要的前提。目前对PGPR的促生特性研究最多的是溶磷及固氮作用,对其分泌PHs特性的研究鲜有报道,主要是因为在PHs的检测方面还没有一种确定的可以同时检测多种PHs的分离分析方法。因此,确定一种高效的可以用于检测PGPR菌株发酵产物中PHs的分离分析方法,就可以为PGPR优良促生菌株资源的筛选提供相关的技术参考。
目前,微生物发酵产物中PHs的含量测定多采用高效液相色谱法(HPLC)[8 - 10]。由于发酵产物中PHs含量极低,且干扰杂质复杂,HPLC很难直接检测到PHs,因此就需要结合样品前处理技术来纯化基质。固相萃取(SPE)是20世纪70年代发展起来的一种新型样品前处理技术[11 - 13],该技术在植物样品的前处理中已经得到了广泛地应用,但是在微生物发酵产物的前处理方面还鲜有报道,利用SPE-HPLC对PGPR发酵产物中3种典型的PHs的同时检测还未见报道。本实验针对PGPR菌株发酵产物中吲哚-3-乙酸、赤霉素和玉米素这3种典型的PHs进行了测定,建立了一种可以同时测定上述3种PHs的SPE-HPLC法,并在此基础上筛选出高产PHs的PGPR菌株。
1 实验部分
1.1 仪器、试剂与材料
Agilent 1260高效液相色谱仪(美国,Agilent公司);752PC型紫外-可见分光光度计(上海光谱仪器有限公司);QF-3800氮气吹干仪(北京华盛谱信仪器有限责任公司);Agilent Bond Elut C18 固相萃取柱(500 mg,6 mL);0.45 μm亲水PTFE针式滤器(上海安谱实验科技股份有限公司)。
吲哚-3-乙酸(Indoleacetic-3-Acid,IAA)、赤霉素(Gibberellin Acid,GA3)和玉米素(trans-Zeatin,t-Z)标准品(纯度均大于98%)购自上海阿拉丁生化科技股份有限公司。依据文献方法[14],准确称取IAA、GA3和t-Z标准品各10.00 mg,分别用甲醇溶解并定容至10.00 mL,配制成1.00 g·L-1的储备溶液,置于-20 ℃的冰箱中避光保存。使用前将储备液按1∶1∶1的比例混合后,再用流动相逐级稀释,配制成系列标准溶液,于4 ℃下存放(保质期1个月)。甲醇(色谱纯,山东禹王实业有限公司化工分公司),冰乙酸(色谱纯,天津市光复精细化工研究所),实验用水为超纯水。所有试剂在使用前均用0.45 μm微孔滤膜过滤。
供试的10个PGPR菌株均由甘肃农业大学草业学院草地微生物多样性实验室提供。各菌株的学名及宿主植物见表1。
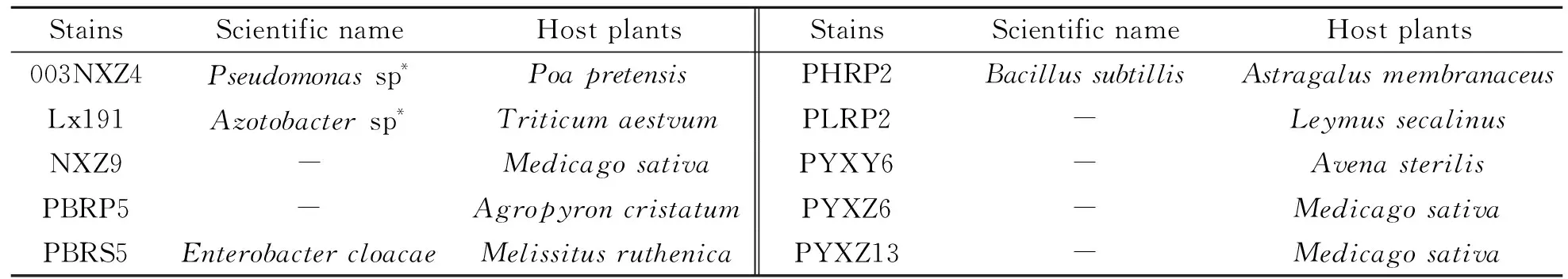
表1 供试菌株
* and -:Not identified.
1.2 样品前处理
将活化好的待测菌株接种于50 mL的LB液体培养基中,每个菌株3个重复,在避光的条件下置于28 ℃、180 r·min-1的摇床中培养。3 d后将培养基在4 ℃、5000 r·min-1的条件下离心10 min,弃去菌体收集上清液。C18固相萃取柱分别用6 mL甲醇和6 mL 10%甲醇活化,将收集的上清液缓慢注入柱内,控制流速1 mL·min-1。待样品加完,用6 mL 10%甲醇淋洗2次,弃去流出液。最后用5 mL 80%甲醇洗脱2次并收集洗脱液。将洗脱液在室温下氮气吹干,再用甲醇溶解定容在2 mL离心管中,保存于4 ℃培养箱中。
1.3 色谱条件
采用Agilent ZORBAX Eclipse Plus C18色谱柱(250×4.6 mm,5 μm),流动相采用体积比为2∶3的甲醇-水(含0.2%冰乙酸)二元混合溶剂,柱温为30 ℃,流速为1.0 mL·min-1,进样量为20 μL,检测波长为210 nm。
2 结果与讨论
2.1 HPLC定量分析方法的建立

图1 混合激素标准品的紫外(UV)光谱Fig.1 UV spectra of the mixture of hormones standards
2.1.1检测波长的选择在波长190~400 nm范围内,用紫外-可见分光光度计分别扫描标准品储备液。绘制紫外光谱图,如图1所示。3种植物激素的最大吸收波长分别为:IAA,220、280 nm;GA3,210 nm;t-Z,215 nm、260 nm。可见3种组分在波长为210 nm处都具有比较大的吸收,因此,本研究选择210 nm作为测定波长。
2.1.2流动相的选择实验采用甲醇-水为流动相。有研究表明,以甲醇-水为流动相,在水相中不添加任何添加剂时,无论怎样改变甲醇和水的比例,其色谱图峰形不好且拖尾严重,如果在此基础上加入一定量的乙酸,就可以抑制溶质的离子化,使分离得到改善[15]。本研究选择体积比为2∶3的甲醇-水(含0.2%冰乙酸)二元混合溶剂作为流动相。
2.1.3流动相流速的选择在植物激素含量测定的研究中,当流速范围在0.5~2.0 mL·min-1时,一般设置为1.0 mL·min-1。本实验在此基础上分别研究了流速为0.6、0.8、1.0、1.2、1.4 mL·min-1对激素的出峰时间的影响。结果发现,流速增加,分析时间缩短,但分离度下降,柱压升高。综合考虑分析时间、分离度与柱压,本研究选择流速为1.0 mL·min-1。
2.1.4色谱柱柱温的选择柱温分别设定为20、25、30、35、40 ℃,分析3种标准品储备液的色谱图。结果表明,柱温对色谱图峰形的影响不大,主要影响分离度和保留时间。温度升高,色谱峰前移,保留时间缩短[16]。综合考虑激素的适宜保存温度及避免分析时间过长,本研究选择30 ℃作为检测柱温。
在选定的色谱条件下,对混合的标准样品进行检测,3种植物激素可以较好地分离和检出(图2)。
2.2 方法的线性关系、检出限及定量限
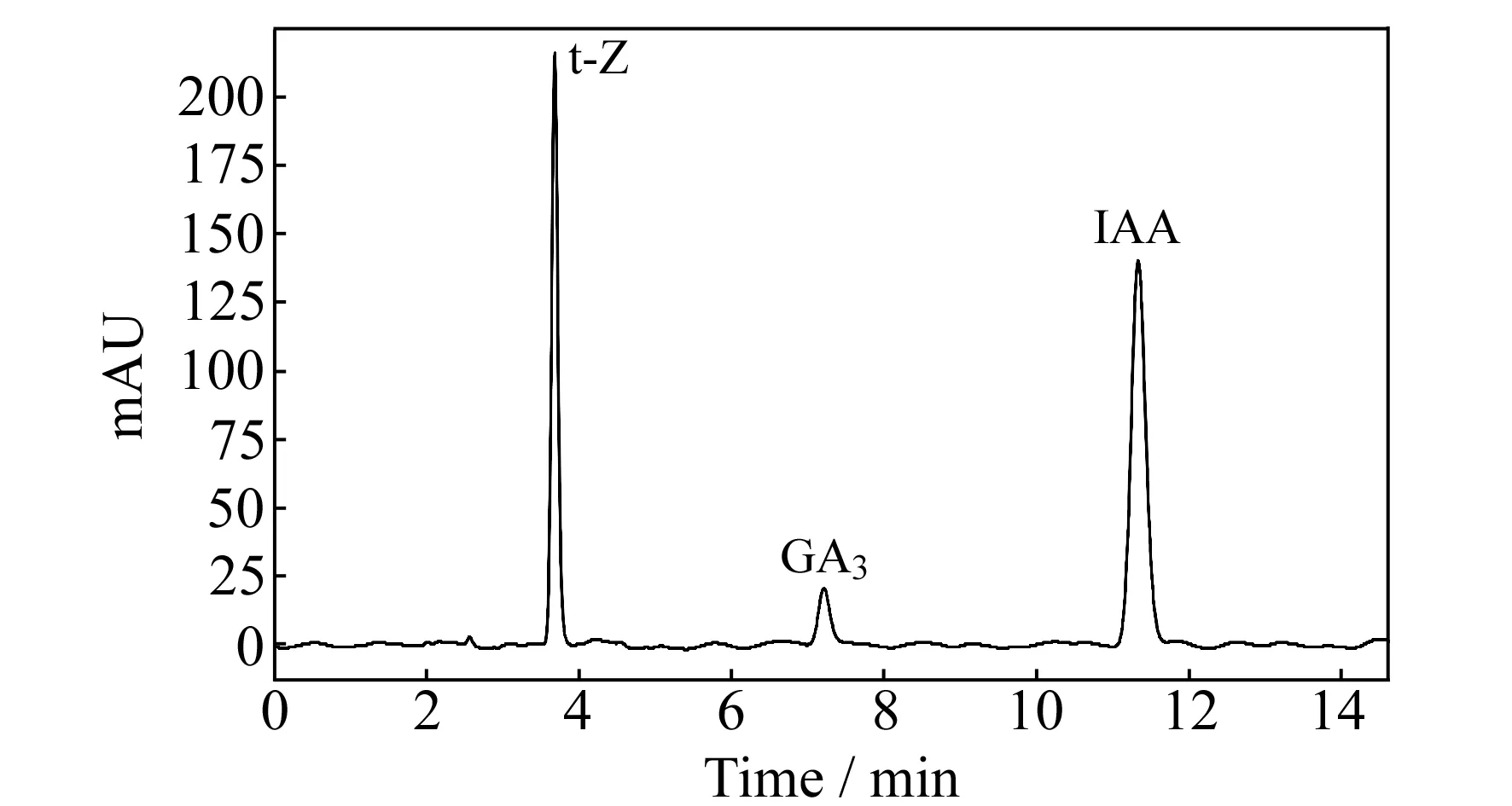
图2 混合激素标准品的色谱图Fig.2 Chromatogram of the mixture of hormones standard
将配制的不同浓度梯度的系列标准溶液按照1.2中的方法经过C18固相萃取柱纯化富集,并在1.3中已优化的色谱条件下进样分析。以峰面积为纵坐标(y),质量浓度(ng·μL-1)为横坐标(x),绘制标准曲线,计算各标准曲线的回归方程、相关系数和线性范围,结果见表2。配制混合标准溶液并逐步稀释,以信噪比(S/N)为3时所对应的化合物浓度为检出限(LOD),以信噪比(S/N)为10时所对应的化合物浓度为定量限(LOQ),结果见表2。由表2可知,3种植物激素在各自的线性范围内与峰面积呈现良好的线性关系;3种激素的检出限在0.08~0.12 ng·μL-1,定量限在 0.13~0.21 ng·μL-1,说明该方法有较高的灵敏度。

表2 PHs标准曲线的回归方程、相关系数、线性范围、检出限和定量限
2.3 方法的精密度及重复性
将混合标准溶液按照1.3的色谱条件连续进样6次,测定各自的峰面积,以峰面积为对象,计算得IAA、GA3和ZT的相对标准偏差(RSD)分别为1.27%、1.86%和0.95%,表明该方法精密度良好。
随机选取一个菌株按1.2的方法平行制备6份样品溶液,按1.3的色谱条件进样分析,记录峰面积,并计算各激素的含量,计算RSD值。3种激素的保留时间和含量的RSD值均小于3%,表明该测定方法的重复性良好。
2.4 方法的稳定性试验
随机选取通过1.2制备好的样品溶液一份,在1.3的色谱条件下分别于0、2、4、8、12、18、24、32、48、72 h进样测定。经计算3种激素的保留时间和含量的RSD值均小于3%,表明供试品溶液在72 h内稳定,仪器稳定性良好。
2.5 加标回收率试验
通过向发酵产物样品中添加激素标准品来计算回收率。精确吸取已知3种激素含量的发酵液各6份,向其中定量添加混合标准溶液,将该混合液按照1.2中的方法经过C18固相萃取柱的纯化富集,并按1.3中建立的色谱条件进行分析,根据测定结果中3种PHs的测得量计算相应的回收率和相对标准偏差,结果见表3。PGPR发酵产物中PHs的回收率比较稳定,在90.30%~104.3%以内,相对标准偏差在1.04%~2.98%之间。结果表明上述实验方法准确度较高,能应用于PGPR发酵产物中3种PHs的同时分析检测。

表3 3种PHs回收率测定结果(n=6)
2.6 PGPR发酵产物中3种PHs的含量测定
对10株PGPR菌株发酵产物中的3种PHs进行了定性和定量分析,分析结果如表4所示。由表4可知,3种PHs的含量差别很大。除菌株003NXZ4以外,其余PGPR菌株发酵产物中PHs含量均表现为t-Z>GA3>IAA。
综合分析,菌株PYXY6、PYXZ6、PLRP2、PHRP2和PBRP5的t-Z含量较高,均大于100.00 ng·μL-1,所以它们可以作为优良产t-Z的菌种资源。菌株PYXZ13、003NXZ4和PYXZ13产生GA3的能力在10个菌株当中相对较强,所以其可以作为优良产GA3的菌种资源。菌株003NXZ4和NXZ9的产IAA的量较多,它们可以作为优良产IAA的菌种资源。菌株Lx191、PBRP5、PYXZ6、PHRP2和PLRP2的3种PHs含量变化趋势相同,且都能稳定产生,因此这5个菌株可以作为同时产生3种PHs的优良菌种资源。

表4 样品中植物激素的含量(ng·μL-1)
*Data presented are in means±standard deviation(n=3).
3 结论
本研究以10株PGPR菌株为研究对象,分析检测其发酵产物中3种PHs的含量,建立了一种快速有效的同时检测IAA、GA3和t-Z的高效液相色谱法。结果表明,3种PHs在其线性范围内呈现出良好的线性关系,分析时间短,有机溶剂消耗较少,既降低了成本,又减少了环境污染。该方法有良好的精密度和准确度,检出限低,可以作为PGPR发酵产物中IAA、GA3和t-Z同时检测的常规分析方法。与此同时,筛选出高产植物激素的PGPR菌株,为丰富菌种资源库和研制微生物菌肥提供了理论依据。
