长江口芦苇和互花米草盐沼湿地蟹类洞穴分布特征及主要影响因子
2017-10-13童春富
王 琰,童春富
华东师范大学河口海岸学国家重点实验室, 上海 200062
长江口芦苇和互花米草盐沼湿地蟹类洞穴分布特征及主要影响因子
王 琰,童春富*
华东师范大学河口海岸学国家重点实验室, 上海 200062
蟹类洞穴是蟹类在潮间带盐沼生存、繁衍的特征性结构,具有重要的生态功能。洞穴分布特征及其影响因子的分析,是深入探讨蟹类及其洞穴的生态系统功能的重要基础。2015年10月,在崇明北滩单一芦苇(Phragmitesaustralis)群落,单一互花米草(Spartinaalterniflora)群落和芦苇-互花米草混合群落3种典型生境中,对蟹类洞穴的分布特征及其相关的大型底栖动物、植被、沉积物等的特征参数进行了调研与分析。结果表明,生境类型差异对蟹类洞穴分布特征及相关生境因子具有重要影响。蟹类洞穴的分布密度和开口直径在不同生境间存在显著差异(P<0.05),且单一芦苇群落生境内洞穴密度要显著高于单一互花米草群落生境(P<0.05),洞穴开口直径在单一互花米草生境要显著高于单一芦苇生境(P<0.05);大型底栖动物生物量、密度、植物地下部分生物量在不同生境间差异不显著(P>0.05),而植株密度、活植株高度、植物地上部分生物量以及沉积物含水率、pH、氧化还原电位在不同生境间存在显著差异(P<0.05)。沉积物中值粒径,总氮含量和总碳含量在不同生境间的差异随深度不同会发生变化。不同生境主要生境因子的差异是导致蟹类洞穴分布特征不同的根本原因;蟹类洞穴分布特征受多个生境因子的综合作用。筛选的生境因子的组合虽然与洞穴分布特征具有显著相关性,但相关系数较小。未来研究中需要拓展生境因子涵盖范围,加强多因子综合作用分析。
长江口;盐沼湿地;蟹类;洞穴分布;影响因子
Abstract: Crab burrows have a unique structure, which is essential for ecosystem functions and for the survival and reproduction of crabs in tidal salt marshes. Studies on the distribution characteristics of the burrows, and corresponding factors that influence such features, provide an important basis to reveal the ecosystem functions of crabs and their burrows. In October 2015, we conducted surveys on crab burrows in three typical salt marsh habitats in the northern tidal flat of Chongming Island in the Yangtze estuary, including thePhragmitesaustralishabitat,Spartinaalterniflorahabitat, andP.australis-S.alternifloramixed habitat. In each habitat, the characteristics of crab burrows and related factors, including macrobenthos, vegetation, and sediment, were surveyed. The results indicated that the type of the habitat influenced the crab burrow distributions and their related factors. Burrow densities and opening diameters were significantly different among the different habitats (P< 0.05). The burrow density inP.australishabitat was significantly higher than that inS.alterniflorahabitat (P< 0.05), whereas the burrow opening diameter inS.alterniflorahabitat was significantly greater than that inP.australishabitat (P< 0.05). There was no significant difference in biomass and density of macrobenthos, and belowground biomass of plants among the different habitats (P> 0.05). However, there were significant differences in shoot density, height, aboveground biomass of the vegetation, as well as water content, pH, and oxidation-reduction potential of the sediment among the different habitats (P< 0.05). The differences among the habitats in the total carbon content, total nitrogen content, and median particle diameter of the sediments varied with depth. The different combinations of habitat factors resulted in a variation in the distribution characteristics of crab burrows. In the present study, although the combination of several selected factors was significantly correlated with the crab burrow distribution characteristics, the coefficient was relatively low. Therefore, there could be other factors that were not included in the surveys that also affected burrow distribution characteristics. Further study should extend the scope of the factors and strengthen the comprehensive analysis.
KeyWords: Yangtze estuary; salt marsh; crabs; burrow distribution; influencing factors
盐沼湿地是河口海岸地区分布最广的生态系统类型之一,具有生物栖息地、营养物质过滤器,固碳等多种重要的生态系统服务功能[1- 3]。以蟹类为代表的潮间带掘穴生物是盐沼湿地重要的生物扰动者[4]、物质搬运者[5]、生态系统工程师(Ecosystem Engineer)[6- 7],其掘穴行为及洞穴特征是当前盐沼湿地生态学研究的重要内容[8- 11]。
蟹类洞穴是蟹类在潮间带盐沼中的特征性结构,对蟹类的生存、繁衍都有着极其重要的意义[12]。目前对蟹类洞穴的研究多集中在两个方面,一方面是对蟹类洞穴形态结构的研究,以此来推测蟹类的行为模式和生活习性[8,13- 14];另一方面是研究蟹类洞穴及其掘穴行为对沉积物理化性质以及重要物质循环过程的影响[15- 16]。蟹类洞穴分布特征及影响因子的研究,是深入研究蟹类及其洞穴生态功能的重要基础,目前相关的研究还相对较少,仅对植被特征和沉积物含水率与蟹类洞穴分布之间的关系有所探讨[17- 18]。
长江河口是世界特大型淤泥质河口,有典型盐沼湿地发育。蟹类是长江河口盐沼湿地中高潮滩大型底栖动物群落的优势类群,主要优势种为谭氏泥蟹(Ilyoplaxdeschampsi)、无齿螳臂相手蟹(Chiromantesdehaani)、天津厚蟹(Helicetientsinensis)等[19- 20]。无齿螳臂相手蟹属十足目(Decapoda)相手蟹科(Sesarmidae),早期文献记述为无齿相手蟹(Sesarmadehaani)[20- 21],属十足目方蟹科(Grapsidae)。已有学者对长江河口盐沼湿地蟹类的形态发育[22]、洞穴利用[17]、洞穴形态结构特征[23]、分布特征[24]以及摄食偏好[25- 26]等方面开展了较为深入的研究。本文拟在已有研究基础上,通过长江口典型盐沼分布区蟹类洞穴分布情况与生境因子的对应调研,揭示影响蟹类洞穴分布的主要生境因子及其作用特征,为进一步研究蟹类洞穴的生态功能奠定基础。
1 研究区域概况
研究区域位于崇明北滩,如图1所示。崇明北滩位于长江口北支南岸,该区域属北亚热带季风性气候区,年均温度为15.3℃,年均降水量为1003.7 mm[27]。该区域沉积物主要由粉砂、粘土质粉砂和砂质粉砂组成,颗粒较细[19];区域植被主要由芦苇(Phragmitesaustralis)群落、海三棱藨草(Scirpusmariqueter)群落以及互花米草(Spartinaalterniflora)群落组成,互花米草群落与芦苇群落常交错分布[28]。
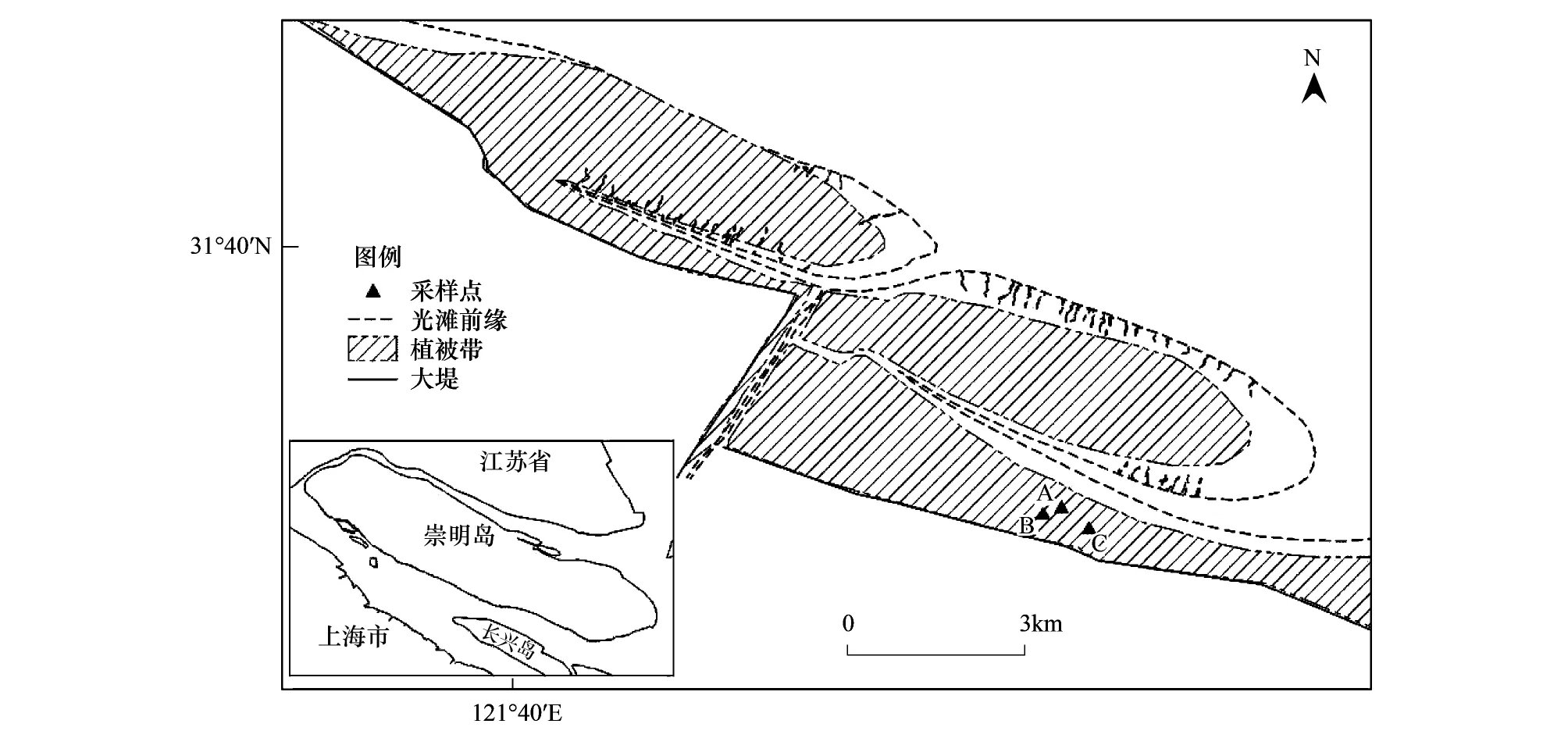
图1 崇明北滩采样位点示意图Fig.1 Map of sampling sites in the north tidal flat of Chongming Island
2 材料与方法
2.1 取样调研
2015年10月,调查者在崇明北滩高潮滩蟹类分布区,选择三种典型生境类型(A:单一互花米草群落,B:单一芦苇群落,C:芦苇-互花米草混合群落),在其中各设置5块10 m×10 m的样地。在每块样地中,调查者设置2个1 m×1 m的样方,调查记录样方中蟹类洞穴的数量和开口直径;在每块样地中,另设置2个50 cm×50 cm的样方,齐地割取样方内所有植物,同时记录样方内植株高度、密度等指标,将所有样品带回实验室进行生物量测定[29- 30];还在每个样地分别布设2个25 cm×25 cm大型底栖动物取样样方。取样时,先拣取样方内沉积物表面的大型底栖动物,然后向下挖掘至约30cm深,去除沉积物后获得底内动物样品[19]。底栖动物标本用5%的福尔马林溶液现场固定后,带回实验室进行鉴定、计数和生物量测定。沉积物柱样采用内径为50 mm的原位取土器,每块样地采两根泥柱,深度为50 cm,按10 cm长度将柱样等分为5节分别装入塑封袋,标记后带回实验室分析。采用便携式氧化还原电位计(IQ 150)现场测定记录pH和氧化还原电位等指标。
2.2 样品分析
每块样地的两组土壤柱样,其中一组用水冲洗,筛分出植物根系,在60℃烘干至恒重,测定地下生物量干重;另一组土壤样品在称重后,同样于60℃烘干至恒重,测定土壤干重,用以计算含水率。烘干后的土壤样品用马尔文激光粒度仪(MS2000)测粒度,用元素分析仪(Vario EL III)测定总碳、总氮含量。碳、氮是土壤中重要的生源要素,总碳含量能反映盐沼湿地的有机质保留能力,总氮含量能反映湿地的营养状况[31- 32]。底栖动物样品在鉴定、计数后,在60℃烘干至恒重,测定其生物量干重。植物地上部分样品同样在60℃烘干至恒重,测定生物量干重。
2.3 数据处理
采用相对多度(Relative abundance,%N),相对生物量(Relative biomass,%B)和Pinkas相对重要性指数(Index of relative importance,IRI)来反映研究区域大型底栖动物群落的组成特征[33- 34]。
相对多度:

相对生物量:
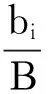
Pinkas相对重要性指数:
IRI=(%N+%B)×fi
式中,ni,bi分别为第i种生物的个体数和生物量;fi为第i种生物在各站位出现的频率;N、B分别为总个体数和总生物量。
实验数据采用统计软件包(IBM SPSS Statistics 21)进行数据处理,对数据先进行方差齐性检验,不具备方差齐性的数据需转化后再进行分析。采用单因素方差分析(one-way ANOVA)对不同生境类型间生境因子和蟹类洞穴分布密度以及开口直径的差异进行显著性分析,再选用最小显著差法(LSD)进行均数间多重比较[18]。以P<0.05表示显著差异,P<0.01表示极显著差异。蟹类洞穴特征与环境变量之间的关系采用统计软件Primer 5.2.8进行非线性回归分析。笔者用BVSTEP程序找出与目标变量匹配最好的生境因子组合,并计算相关系数;再用RELATE程序检验两者之间的相关性是否显著。所有数据在使用时需经过四次方根变换,以满足数据的正态性要求;生境因子的相关数据需要进行标准化处理,以避免量纲差异造成的影响[29]。
3 研究结果
3.1 不同生境大型底栖动物群落特征
调查期间共记录大型底栖动物15种,其中多毛类2种;昆虫3种;甲壳类3种;腹足类5种;其他2种,结果如表1所示。尖锥拟蟹守螺(Cerithidealargillierti)在芦苇生境中的相对多度和相对生物量均最高,其次是绯拟沼螺(Assiminealatericea);在互花米草生境内,相对生物量最高的大型底栖动物是尖锥拟蟹守螺,其次是天津厚蟹和绯拟沼螺,而相对多度较高的大型底栖动物主要是绯拟沼螺和尖锥拟蟹守螺;在芦苇-互花米草混合生境中,相对生物量最高的大型底栖动物是无齿螳臂相手蟹,其次是绯拟沼螺和尖锥拟蟹守螺,相对多度最高的大型底栖动物是绯拟沼螺,其次是尖锥拟蟹守螺。
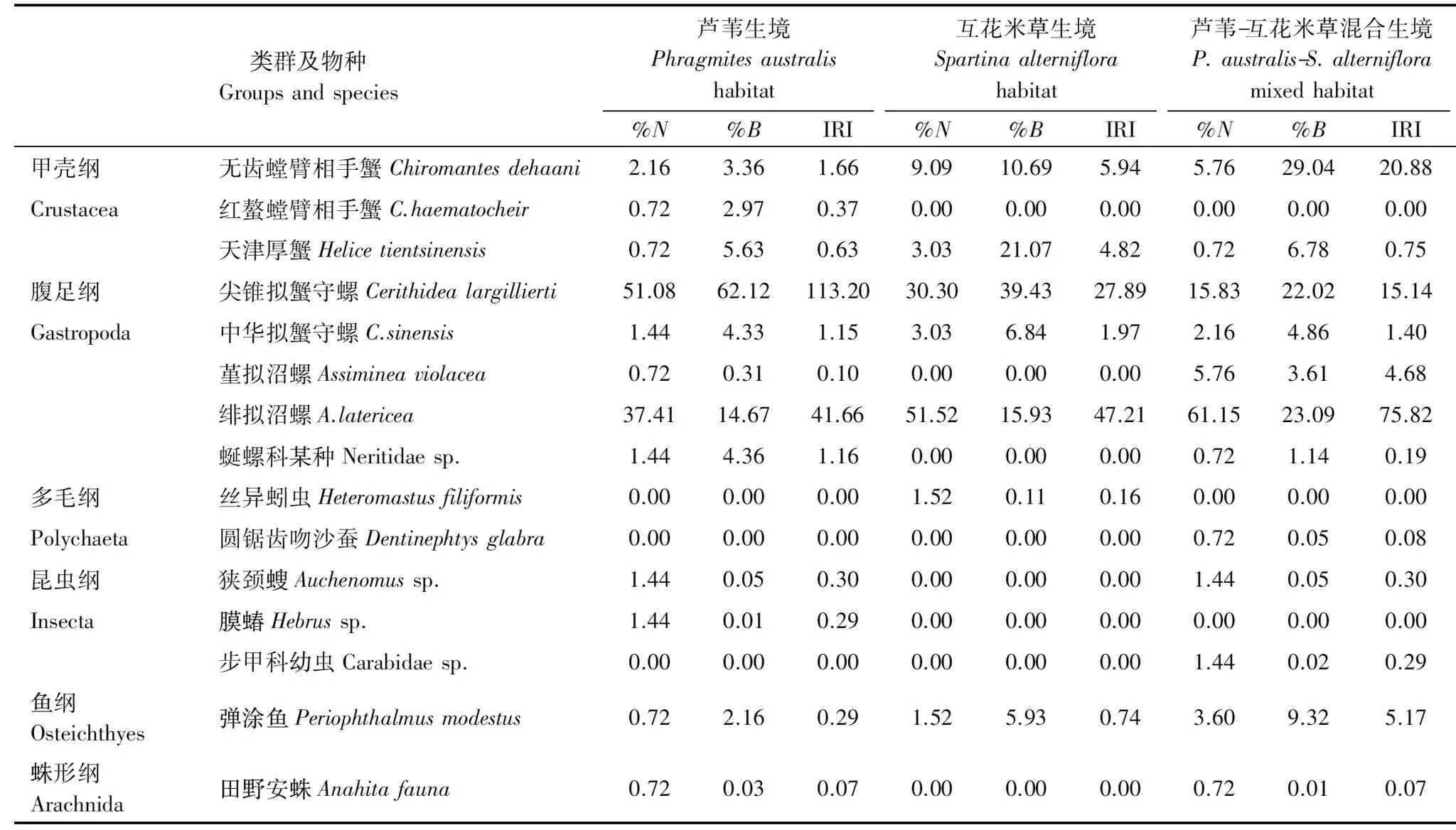
表1 不同生境大型底栖动物组成特征
%N:相对多度 Relative abundance;%B:相对生物量 Relative biomass; IRI:相对重要性指数 Index of relative importance
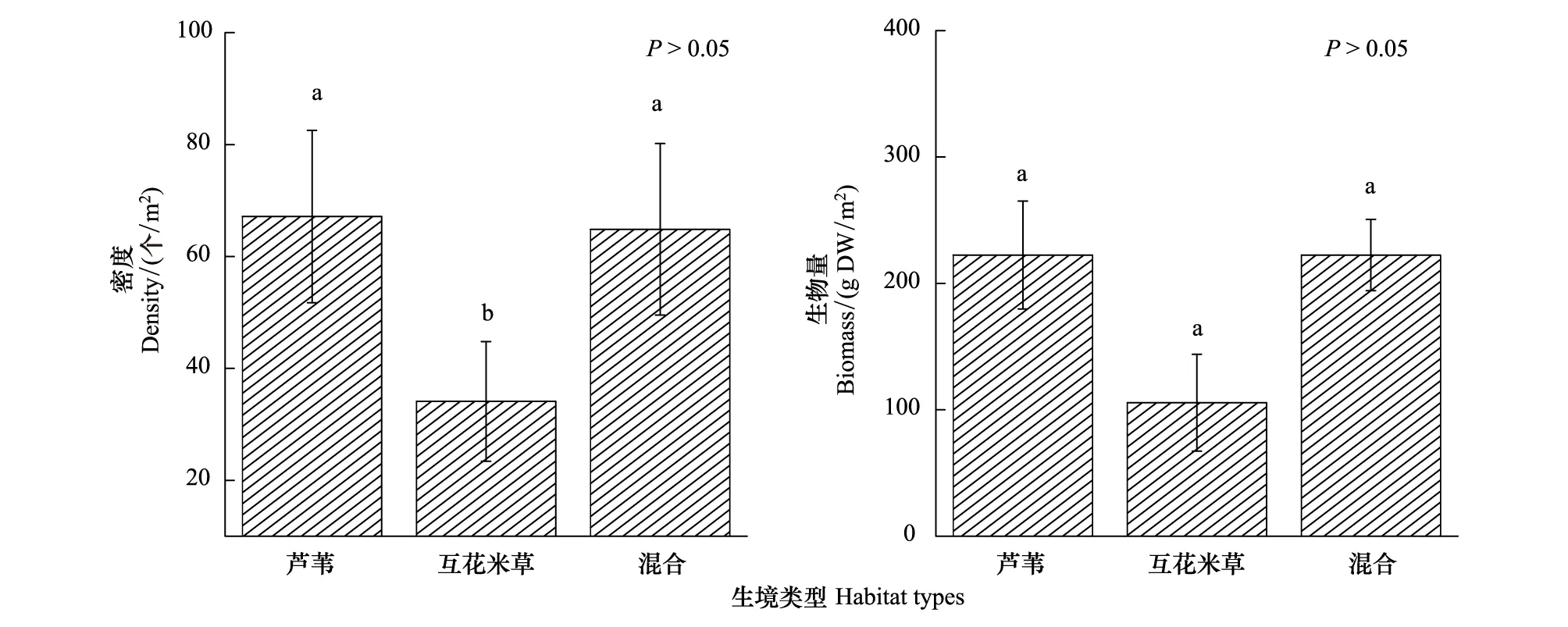
图2 不同生境类型大型底栖动物的密度和生物量(平均值±标准误)Fig.2 Density and biomass of the macrobenthos in the different habitats (means ± SE)上方标注不同小写字母的柱状图表示相互之间存在显著差异(P<0.05);DW:干重
Pinkas相对重要性指数(IRI)的结果显示,在这三种生境中IRI值排前三的大型底栖动物均为绯拟沼螺、尖锥拟蟹守螺和无齿螳臂相手蟹,但在不同生境中三者的优势度略有不同。三种生境内大型底栖动物的分布密度和生物量如图2所示。三种生境内大型底栖动物的密度和生物量均不存在显著差异(P>0.05)。不同生境两两对比结果显示,单一互花米草生境内大型底栖动物密度与单一芦苇生境内、芦苇-互花米草混合生境内的存在显著差异(P<0.05),而单一芦苇生境和芦苇-互花米草生境间不存在显著差异(P>0.05)。各生境内大型底栖动物生物量相互间均不存在显著差异(P>0.05)。具体来说,芦苇生境内密度与生物量均最高分别为(222.40±42.66)个/m2和(67.16±34.47) g DW /m2;芦苇-互花米草混合生境内密度和芦苇生境较为接近,为(222.40±28.22) 个/m2,生物量则略低,为(64.86±34.32) g DW /m2;互花米草生境内两者均最少,密度为(105.60±38.32) 个/m2,生物量为(34.10±10.70)g DW /m2。
3.2 不同生境蟹类洞穴分布特征
在3种生境中蟹类洞穴密度以及洞穴开口直径如图3所示。单一芦苇生境内洞穴的分布密度最高,平均洞穴密度为(14.3±0.93)个/m2;其次是在芦苇-互花米草混合生境,平均洞穴密度为(11.6±0.94)个/m2;在单一互花米草生境中最低,平均为(9.4±0.46)个/m2。洞穴开口直径平均值为互花米草生境>芦苇-互花米草混合生境>芦苇生境。单因素方差分析的结果表明,生境类型对洞穴分布密度存在显著影响(P<0.05),但是不同生境两两之间的对比存在差异,如图3所示。单一芦苇生境内的洞穴密度与其他两种生境间均存在显著差异(P<0.05),但单一互花米草生境和芦苇-互花米草混合生境之间洞穴密度的差异并不显著(P>0.05);洞穴开口直径受生境类型的影响极显著(P<0.01),在不同生境两两之间均存在显著差异(P<0.05),如图3所示。
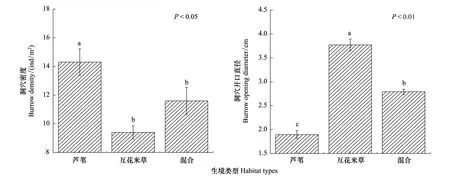
图3 不同生境类型蟹类洞穴密度及开口直径(平均值±标准误)Fig.3 Burrow densities and opening diameters in the different habitats (means±SE)上方标注不同小写字母的柱状图表示相互之间存在显著差异(P<0.05)
3.3 不同生境植被及环境因子特征
不同生境的植被特征如表2所示。方差分析结果显示植被地上生物量干重、活植株高度和植株密度在三种生境间存在显著差异(P<0.05)。植物地下生物量干重在3种生境间不存在显著差异(P>0.05)。这些植被指标在不同生境间两两对比的结果存在差异,例如植株密度和植物地上生物量干重均在单一互花米草生境和单一芦苇生境、芦苇-互花米草混合生境间存在显著差异(P<0.05),而在单一芦苇生境和芦苇-互花米草混合生境间差异不显著(P>0.05)。而活植株高度在两个单一生境间不存在显著差异(P>0.05),在芦苇-互花米草混合生境与单一芦苇生境、单一互花米草生境间差异显著(P<0.05)。
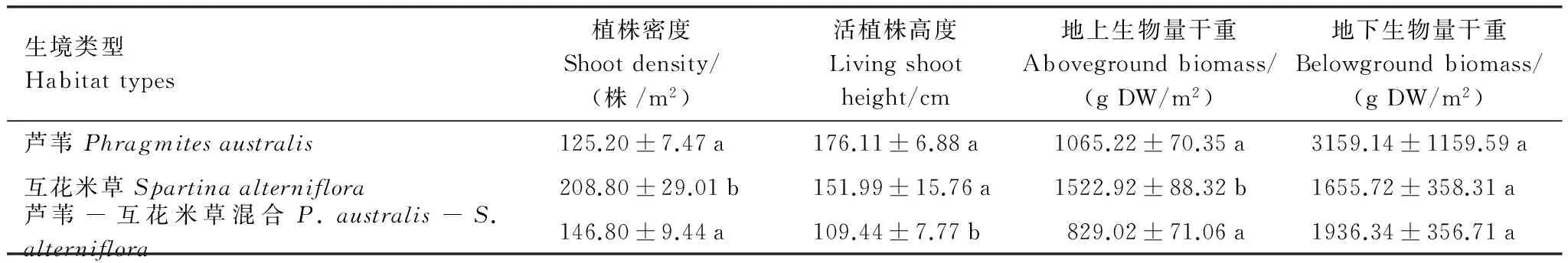
表2 不同生境植株密度、高度和生物量(均值±标准误)
表中同一列数据标注不同小写字母表示相互之间存在显著差异(P<0.05);DW:干重
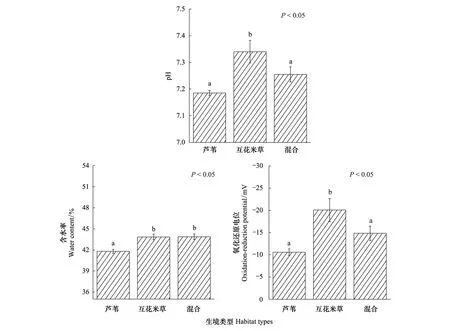
图4 不同生境类型沉积物pH、含水率和氧化还原电位(平均值±标准误)Fig.4 pH, water content and oxidation-reduction potential of the sediment in the different habitats (means ± SE)上方标注不同小写字母的柱状图表示相互之间存在显著差异(P<0.05)
不同生境沉积物理化指标如图4—图5所示。不同生境类型间土壤含水率、pH和氧化还原电位均存在显著差异(P<0.05)。芦苇生境中土壤含水率和pH都较低,氧化还原电位较高;在互花米草生境中含水率以及pH较高,氧化还原电位较低;混合生境介于两者之间。生境间沉积物性质两两比较的结果显示:单一芦苇生境和单一互花米草生境间沉积物含水率、pH、氧化还原电位均存在显著差异(P<0.05),芦苇-互花米草混合生境与单一芦苇生境、单一互花米草生境间的沉积物性质比较结果略有不同,例如含水率在单一互花米草生境和芦苇-互花米草混合生境间无显著差异(P>0.05);在单一芦苇生境和芦苇-互花米草混合生境间差异显著(P<0.05)。沉积物总碳、总氮含量和沉积物中值粒径随深度分布特征如图5所示。随着深度增加,沉积物总碳以及总氮含量都会有所下降。除了芦苇生境内总氮含量在垂向上不存在显著差异(P>0.05),其余生境内总碳、总氮含量均在垂向上存在显著差异(P<0.05);只有互花米草生境沉积物粒径在垂向上存在显著差异(P<0.05)。不同深度沉积物总碳含量、总氮含量以及中值粒径在不同生境间的差异性具有不同特征。例如表层沉积物(0—10 cm)的总碳含量在不同生境间存在显著差异(P<0.05),但在最底层(40—50 cm)差异不显著(P>0.05)。生境间两两比较的差异性也不尽相同。例如表层沉积(0—10 cm)的中值粒径在各生境相互间均不存在显著差异(P>0.05);在30—40 cm沉积物内中值粒径在单一互花米草和单一芦苇生境、芦苇-互花米草混合生境间差异显著(P<0.05),而单一芦苇和芦苇-互花米草混合生境间差异不显著(P>0.05)。

图5 不同生境沉积物总碳、总氮含量以及中值粒径变化特征Fig.5 The variation characteristics of the total carbon content, total nitrogen content and median particle diameter of the sediments in the different habitatsNL:芦苇生境 Phragmites australis habitat; NH:互花米草生境 Spartina alterniflora habitat; NM:芦苇-互花米草混合生境 P. australis-S. alterniflora mixed habitat;图中不同小写字母表示该深度处的沉积物性质在不同生境间存在显著差异(P<0.05)
3.4 蟹类洞穴分布特征与各因子的对应关系
生境因子与蟹类洞穴特征之间的最佳匹配组合如表3所示。对洞穴密度造成显著影响的生境因子组合由14个因子组成,其与蟹类洞穴密度的相关性系数为0.324,且具有极显著相关性(P=0.009<0.01);对洞穴开口直径造成显著影响的生境因子组合由11个因子组成,相关性系数为0.293,具有显著相关性(P=0.011<0.05)。植被地上部分生物量、地下部分生物量、植株密度、活植株高度、沉积物含水率、pH、氧化还原电位和大型底栖动物的多度、生物量这些因子的组合同时会对洞穴的密度以及开口直径造成影响。

表3 蟹类洞穴特征与生境因子的相关性特征
因子:1: 0—10 cm总氮含量;2: 10—20 cm总氮含量;3: 20—30 cm总氮含量;4: 30—40 cm总氮含量;5: 40—50 cm总氮含量;6: 0—10 cm总碳含量;7: 10—20 cm总碳含量;8: 20—30 cm总碳含量;9: 30—40 cm总碳含量;10: 40—50 cm总碳含量;11: 0—10 cm中值粒径;12: 10—20 cm中值粒径;13: 20—30 cm中值粒径;14: 30—40 cm中值粒径;15: 40—50cm中值粒径;16:植物地上生物量干重;17:植物地下生物量干重;18:植株密度;19:活植株高度;20:含水率;21:pH;22:氧化还原电位;23:大型底栖动物生物量;24:大型底栖动物密度
4 讨论
4.1 生境类型与蟹类洞穴分布
本文研究结果表明,长江口蟹类洞穴分布特征在不同生境间存在明显差异;生境类型对蟹类洞穴的分布密度以及开口直径具有显著影响。生境类型差异最直观的表现是植被类型的不同,如本文研究中的3种生境,具有3种不同的植被类型。国外相关研究也表明,生境类型的不同,往往会决定洞穴的空间分布特征,如有植被覆盖的生境和无植被的生境中,蟹类洞穴密度往往存在显著差异;在很多研究中,在没有植被的区域,蟹类洞穴密度很低,甚至没有分布[35- 36]。蟹类利用洞穴主要用以躲避捕食者以及应对环境胁迫[12]。相对而言,植被分布区可能比无植被分布区更有利于蟹类躲避捕食者,环境条件也更加稳定。但是,不同类型植被生境之间的差异是否也反映了这方面的特征,还有待于进一步研究。
而在很多情况下,我们研究蟹类洞穴分布特征,是期望通过蟹类洞穴密度来快捷、有效地估计蟹类的分布密度[37]。但是在某些情况下,在特定生境中,蟹类种类并不唯一,如本文研究样地中,除了无齿螳臂相手蟹外,还有一定数量的天津厚蟹和红螯螳臂相手蟹。不同种类的蟹类在洞穴利用上是否存在分化以及共用的情况,以及相互间的调配机制等,目前并不清楚。这使得根据蟹类洞穴分布密度来估算特定蟹类种类的分布密度存在较大困难。这也是未来进一步研究中亟需解决的问题。
4.2 生境因子与蟹类洞穴分布
不同生境的生境因子之间往往存在明显、甚至显著的差异,这可能是导致不同生境蟹类洞穴分布差异的关键所在。在本文研究中,通过非线性回归分析选中的影响洞穴分布的因子,主要是那些在不同生境之间存在差异的因子,且差异往往具有显著性,如植株密度、植物地上生物量干重、活植株高度以及沉积物的含水率、pH和氧化还原电位等。也有少数筛选的因子在生境间并不存在显著差异,如大型底栖动物的密度、生物量。但这些因子可能对其他因子具有重要的制约或决定作用,从而对蟹类洞穴分布具有重要影响。如已有较多研究证明大型底栖动物的存在能改变沉积物的含水率[16],总氮含量[4]、氧化还原电位[38]以及植被特征[39]。
根据本文研究结果推测,主要的生境因子可能是通过两种作用机理对洞穴分布造成影响:一种是改变沉积物基质条件直接影响蟹类掘穴的难易程度;另一种是通过影响蟹类个体的空间分布间接对洞穴密度造成影响。已有研究能较好地支持这一观点。例如,已有研究表明,植被地下部分生物量过高或过低都不利于蟹类掘穴[10,23,40- 41];同样,沉积物含水率过高、中值粒径较大的地区,土壤稳定性往往较差,会增加蟹类掘穴和维持洞穴的消耗,从而限制洞穴的分布[18,42]。此外,之前已有很多研究对影响蟹类分布的因子进行了探讨,如研究表明,氧化还原电位和生物致毒物质如硫化物,亚硝酸盐之间存在相关性,会影响蟹类的分布[43-44];沉积物酸碱度也是限制盐沼蟹类分布的重要环境因素[45];植被通过改变近地表的温度和水分,也会影响蟹类分布[17,36];而蟹类密度和洞穴分布密度之间存在显著正相关[17]。
目前相关的研究和分析,往往关注单个因子对洞穴分布产生的影响。但在生态系统中,这些因子往往是相互联系、相互制约、共同起作用的。在未来的研究中,需要考虑采用系统综合的分析研究手段,如生态建模,来研究多因子的综合作用。而从本文研究结果来看,通过非线性回归分析筛选出来的多个生境因子虽然与洞穴分布特征具有显著相关性,但是相关系数较小,由此推测尚存在其他生境因子可能也会对洞穴分布特征产生影响,在未来的研究中需要进一步拓展因子的涵盖范围,加强综合分析。
[1] Więski K, Guo H Y, Craft C B, Pennings S C. Ecosystem functions of tidal fresh, brackish, and salt marshes on the Georgia coast. Estuaries and Coasts, 2010, 33(1): 161- 169.
[2] Pennings S C. Ecology: the big picture of marsh loss. Nature, 2012, 490(7420): 352- 353.
[3] 段晓男, 王效科, 逯非, 欧阳志云. 中国湿地生态系统固碳现状和潜力. 生态学报, 2008, 28(2): 463- 469.
[4] Wang J Q, Zhang X D, Jiang L F, Bertness M D, Fang C M, Chen J K, Hara T, Li B. Bioturbation of burrowing crabs promotes sediment turnover and carbon and nitrogen movements in an estuarine salt marsh. Ecosystems, 2010, 13(4): 586- 599.
[5] Casariego A M, Luppi T, Iribarne O, Daleo P. Increase of organic matter transport between marshes and tidal flats by the burrowing crabNeohelice(Chasmagnathus)granulataDana in SW Atlantic salt marshes. Journal of Experimental Marine Biology and Ecology, 2011, 401(1/2): 110- 117.
[6] Kristensen E. Mangrove crabs as ecosystem engineers; with emphasis on sediment processes. Journal of Sea Research, 2008, 59(1/2): 30- 43.
[7] Penha-Lopes G, Bartolini F, Limbu S, Cannicci S, Kristensen E, Paula J. Are fiddler crabs potentially useful ecosystem engineers in mangrove wastewater wetlands? Marine Pollution Bulletin, 2009, 58(11): 1694- 1703.
[8] Nordhaus I, Diele K, Wolff M. Activity patterns, feeding and burrowing behaviour of the crabUcidescordatus(Ucididae) in a high intertidal mangrove forest in North Brazil. Journal of Experimental Marine Biology and Ecology, 2009, 374(2): 104- 112.
[9] Qureshi N A, Saher N U. Burrow morphology of three species of fiddler crab (Uca) along the coast of Pakistan. Belgian Journal of Zoology, 2012, 142(2): 114- 126.
[10] Wang M, Gao X Q, Wang W Q. Differences in burrow morphology of crabs betweenSpartinaalternifloramarsh and mangrove habitats. Ecological Engineering, 2014, 69(4): 213- 219.
[11] Daleo P, Iribarne O. The burrowing crabNeohelicegranulataaffects the root strategies of the cordgrassSpartinadensiflorain SW Atlantic salt marshes. Journal of Experimental Marine Biology and Ecology, 2009, 373(1): 66- 71.
[12] Warren J H. Role of burrows as refuges from sub-tidal predators of temperate mangrove crabs. Marine Ecology Progress Series, 1990, 67(3): 295- 299.
[13] Christy J H. Burrow structure and use in the sand fiddler crab,Ucapugilator(Bosc). Animal Behaviour, 1982, 30(3): 687- 694.
[14] Machado G B O, Gusmão-Junior J B L, Costa T M. Burrow morphology ofUcauruguayensisandUcaleptodactylus(Decapoda: Ocypodidae) from a subtropical mangrove forest in the western Atlantic. Integrative Zoology, 2013, 8(3): 307- 314.
[15] Fanjul E, Grela M A, Iribarne O. Effects of the dominant SW Atlantic intertidal burrowing crabChasmagnathusgranulatuson sediment chemistry and nutrient distribution. Marine Ecology Progress Series, 2007, 341(12): 177- 190.
[16] Mokhtari M, Ghaffar M A, Usup G, Cob Z C. Effects of fiddler crab burrows on sediment properties in the mangrove mudflats of Sungai Sepang, Malaysia. Biology, 2016, 5(1): 7- 18.
[17] 熊李虎, 陆健健. 长江河口湿地不同植被中无齿螳臂相手蟹的分布及其洞穴利用. 动物学杂志, 2009, 44(6): 1- 9.
[18] Wang J Q, Tang L, Zhang X D, Wang C H, Gao Y, Jiang L F, Chen J K, Li B. Fine-scale environmental heterogeneities of tidal creeks affect distribution of crab burrows in a Chinese salt marsh. Ecological Engineering, 2009, 35(12): 1685- 1692.
[19] 安传光, 赵云龙, 林凌, 李嘉尧, 崔丽丽, 马春艳. 崇明岛潮间带夏季大型底栖动物多样性. 生态学报, 2008, 28(2): 577- 586.
[20] 袁兴中, 陆健健. 长江口岛屿湿地的底栖动物资源研究. 自然资源学报, 2001, 16(1): 37- 41.
[21] 杨泽华, 童春富, 陆健健. 长江口湿地三个演替阶段大型底栖动物群落特征. 动物学研究, 2006, 27(4): 411- 418.
[22] 韩莎, 管卫兵. 无齿螳臂相手蟹形态成熟的研究//2010年中国水产学会学术年会论文摘要集. 上海: 上海海洋大学海洋科学学院, 2011: 4.
[23] Wang J Q, Bertness M D, Li B, Chen J K, Lü W G. Plant effects on burrowing crab morphology in a Chinese salt marsh: Native vs. exotic plants. Ecological Engineering, 2015, 74: 376- 384.
[24] 安传光, 赵云龙, 林凌, 吕敢堂, 陈亚瞿. 长江口九段沙潮间带大型底栖动物季节分布特征的初步研究. 水产学报, 2007, 31(Z1): 52- 58.
[25] Qin H M, Chu T J, Xu W, Lei G C, Chen Z B, Quan W M, Chen J K, Wu J H. Effects of invasive cordgrass on crab distributions and diets in a Chinese salt marsh. Marine Ecology Progress Series, 2010, 415: 177- 187.
[26] 盛强. 崇明东滩不同高程上蟹类对植物种间关系的影响[D]. 上海: 复旦大学, 2011.
[27] 王瀚强, 王淑琼, 方燕, 李恺. 崇明岛环岛芦苇地上部分固碳能力估算. 湿地科学, 2014, 12(5): 539- 543.
[28] 王淑琼, 王瀚强, 方燕, 李恺. 崇明岛滨海湿地植物群落固碳能力. 生态学杂志, 2014, 33(4): 915- 921.
[29] Tong C F, Baustian J J, Graham S A, Mendelssohn I A. Salt marsh restoration with sediment-slurry application: Effects on benthic macroinvertebrates and associated soil-plant variables. Ecological Engineering, 2013, 51: 151- 160.
[30] 严格. 崇明东滩湿地盐沼植被生物量及碳储量分布研究[D]. 上海: 华东师范大学, 2014.
[31] 卢凤艳, 安芷生. 鹤庆钻孔沉积物总有机碳、氮含量测定的前处理方法及其环境意义. 地质力学学报, 2010, 16(4): 393- 401.
[32] 王维奇, 王纯, 曾从盛, 仝川. 闽江河口不同河段芦苇湿地土壤碳氮磷生态化学计量学特征. 生态学报, 2012, 32(13): 4087- 4093.
[33] 童春富. 长江河口潮间带盐沼植被分布区及邻近光滩鱼类组成特征. 生态学报, 2012, 32(20): 6501- 6510.
[34] 纪莹璐, 赵宁, 王振钟, 季相星, 杨传平, 于子山. 乳山湾潮间带春季大型底栖动物群落结构. 应用生态学报, 2015, 26(2): 609- 615.
[35] Li W, Cui L J, Zhang M Y, Wang Y F, Zhang Y Q, Lei Y R, Zhao X S. Effect of mangrove restoration on crab burrow density in Luoyangjiang Estuary, China. Forest Ecosystems, 2015, 2(4): 21- 29
[36] Bortolus A, Schwindt E, Iribarne O. Positive plant-animal interactions in the high marsh of an Argentinean coastal lagoon. Ecology, 2002, 83(3): 733- 742.
[37] Mazumder D, Saintilan N. A comparison of sampling techniques in the assessment of burrowing crab abundance in saltmarsh and mangrove environments. Wetlands (Australia), 2010, 21(1): 1- 15.
[38] Weissberger E J, Coiro L L, Davey E W. Effects of hypoxia on animal burrow construction and consequent effects on sediment redox profiles. Journal of Experimental Marine Biology and Ecology, 2009, 371(1): 60- 67.
[39] Smith N F, Wilcox C, Lessmann J M. Fiddler crab burrowing affects growth and production of the white mangrove (Lagunculariaracemosa) in a restored Florida coastal marsh. Marine Biology, 2009, 156(11): 2255- 2266.
[40] Bertness M D. Fiddler crab regulation ofSpartinaalternifloraproduction on a New England salt marsh. Ecology, 1985, 66(3): 1042- 1055.
[41] Capehart A A, Hackney C T. The potential role of roots and rhizomes in structuring salt-marsh benthic communities. Estuaries, 1989, 12(2): 119- 122.
[42] Takeda S, Kurihara Y. The distribution and abundance ofHelicetridens(De Haan) burrows and substratum conditions in a northeastern Japan salt marsh (Crustacea: Brachyura). Journal of Experimental Marine Biology and Ecology, 1987, 107(1): 9- 19.
[43] 张贵. 溶解氧、盐度、氨氮、亚硝酸盐氮对三疣梭子蟹存活和摄饵的影响[D]. 湛江: 广东海洋大学, 2012.
[44] 石俊艳, 刘中, 丁茂昌, 国际翔. 亚硝酸盐、硫化物与氨对河蟹幼体的急性毒性实验. 辽宁大学学报: 自然科学版, 1999, 26(1): 92- 96.
[45] Teal J M. Distribution of fiddler crabs in Georgia salt marshes. Ecology, 1958, 39(2): 186- 193.
DistributioncharacteristicsofcrabburrowsinPhragmitesaustralisandSpartinaalterniflorasaltmarshesintheYangtzeEstuaryandtheirinfluencingfactors
WANG Yan,TONG Chunfu*
StateKeyLaboratoryofEstuarineandCoastalResearch,EastChinaNormalUniversity,Shanghai200062,China
上海市科委自然科学基金(15ZR1411200);教育部留学回国人员科研启动基金
2016- 07- 31; < class="emphasis_bold">网络出版日期
日期:2016- 00- 00
*通讯作者Corresponding author.E-mail: cftong@ sklec.ecnu.edu.cn
10.5846/stxb201607311570
王琰,童春富.长江口芦苇和互花米草盐沼湿地蟹类洞穴分布特征及主要影响因子.生态学报,2017,37(16):5504- 5513.
Wang Y,Tong C F.Distribution characteristics of crab burrows inPhragmitesaustralisandSpartinaalterniflorasalt marshes in the Yangtze Estuary and their influencing factors.Acta Ecologica Sinica,2017,37(16):5504- 5513.
