川西高山森林不同时期土壤转化酶和脲酶活性对模拟气候变暖的响应
2017-10-13吴福忠徐振锋杨玉莲杨万勤
张 丽,吴福忠,徐振锋,谭 波,刘 洋,杨玉莲,3,王 奥,4,杨万勤,*
1 四川农业大学生态林业研究所,高山森林生态系统定位研究站,成都 611130 2 四川省长江上游生态安全协同创新中心,成都 611130 3 绵阳师范学院,生态安全与保护四川省重点实验室,绵阳 621000 4 遵义市产品质量检验检测院,遵义 563000
川西高山森林不同时期土壤转化酶和脲酶活性对模拟气候变暖的响应
张 丽1,2,吴福忠1,2,徐振锋1,2,谭 波1,2,刘 洋1,2,杨玉莲1,2,3,王 奥1,2,4,杨万勤1,2,*
1 四川农业大学生态林业研究所,高山森林生态系统定位研究站,成都 611130 2 四川省长江上游生态安全协同创新中心,成都 611130 3 绵阳师范学院,生态安全与保护四川省重点实验室,绵阳 621000 4 遵义市产品质量检验检测院,遵义 563000
为了解气候变化对不同时期川西高山森林土壤生态过程的影响,于2010年5月—2011年4月期间,通过原状土柱移位实验,模拟理论增温1.78℃和3.52℃对岷江冷杉原始林(3582 m)土壤转化酶和脲酶活性的影响。结果表明,海拔下降284 m和559 m分别使全年平均气温实际增高1.39℃和2.64℃,但由于季节性雪被的影响,海拔降低559 m后土柱的土壤有机层和矿质土壤层的全年平均温度分别增加了0.84℃和0.82℃,而海拔降低284 m后土柱的土壤有机层和矿质土壤层的全年平均温度分别降低了0.55℃和0.56℃。随着海拔降低,土壤有机层和矿质土壤层的转化酶和脲酶活性均表现出明显的变化,且土壤有机层的变化幅度大于矿质土壤层。海拔降低284 m显著提高了两个土层生长季初期和冻结阶段(冻结初期和深冻期)的转化酶活性,而海拔降低559 m则显著提高了两个土层冻结阶段的脲酶活性。采样时期均温也在一定程度上影响了土壤转化酶和脲酶的活性,土壤有机层和矿质土壤层转化酶活性表现为从生长季初期到生长季末期显著下降,随后在冻结阶段和融化期显著升高并分别在深冻期和融化期达到全年最高;土壤脲酶活性表现为从生长季初期到深冻期显著增加,随后在融化期显著下降的过程。可见,受季节性雪被影响,不同关键时期的高山森林土壤转化酶和脲酶活性对模拟增温的响应不同。
高山森林;土壤转化酶;土壤脲酶;原状土柱移位;模拟增温;季节性雪被
Abstract: Not only do soil enzymes take part in carbon and nutrient cycles in soil ecosystems, but act as the sensitive bioindicators in indicating environmental changes. Consequently, climate change characterized by climate warming and seasonal snow cover decline might give to a certain extent effects on soil enzyme activity in high-altitude and high-latitude regions, and thereafter change the cycles of carbon and nutrients in soil ecosystems in cold biomes. However, the response of soil enzyme activity to climate warming at different critical periods remains unknown. In order to understand the effects of climate warming on soil ecological process in the alpine forest in western Sichuan, soil columns sampled from a primary Minjiang fir (Abiesfaxoniana) forest at 3582 m elevation was therefore in-situ incubated in the primary coniferous forest, transplanted and incubated in 3298 m and 3023 m sites in May 2010, respectively. Theoretically, the temperatures of soil and atmosphere would increase by 1.78 ℃ and 3.52 ℃, respectively. Based on the previous studies and simultaneous temperature monitoring, soil columns at three elevations were respectively retrieved at the early growing period (EGS), later growing period (LGS), onset of soil freezing period (OF), deeply frozen period (DF) and thawing period (TP) from August 2010 to April 2011, and the activities of invertase related to carbon cycle and urease related to nitrogen cycle in both soil organic layer (OL) and mineral soil layer (MS) were instantly measured in the lab. Different from the theoretical prediction values, annual mean air temperatures at 3298 m and 3023 m elevations were actually higher 1.39℃ and 2.64℃ than that at 3582 m elevation, respectively. As affected by seasonal snow cover, lowering 559 m elevation made the annual mean temperatures of OL and MS in soil columns increase 0.84℃ and 0.82℃, respectively, but lowering 284 m elevation made the temperatures of OL and MS in columns actually decrease 0.55℃ and 0.56℃, respectively. Regardless of soil column transplanting and sampling periods, the activities of both invertase and urease in OL were significantly higher than those in MS. Moreover, those activities in OL varied more sharply with critical periods and elevation lowering than those in MS. The activities of invertase and urease in soils fluctuated to some extent with critical periods, but the highest and lowest activities of soil enzymes varied with soil layers, enzyme types and the elevations. On the whole, the activities of invertase in both OL and MS decreased from EGS to LGS, and then increased during DF and TP. The activities of urease in both OL and MS increased from EGS to DF, and then decreased in TP. Soil column incubation with lowering 284 m elevation significantly improved the activities of invertase in both OL and MS at EGS, OF and DF, but the incubation with lowering 559 m elevation significantly improved the activities of urease in both OL and MS at DF. The elevation, soil layer, sampling period and their interactions gave strong effects on the activities of invertase and urease in the alpine forest soil, and the responses of soil invertase and urease activities in the alpine forest to simulated climate warming varied greatly with different critical periods as affected by seasonal snow cover.
KeyWords: alpine forest; soil invertase; soil urease; soil column transplanting; simulated climate warming; seasonal snow cover
以气候变暖和季节性雪被减少为主要特征的气候变化正在改变着陆地生态系统过程[1]。据IPCC(2014)预测,到21世纪末,全球平均气温将升高0.3—4.8℃,在高纬度和高海拔地区温度的增幅将更大[2]。土壤酶不仅是土壤生态系统物质循环和能量流动的重要参与者,而且是指示环境变化的敏感生物学指标之一[3-4]。温度是控制土壤酶活性的一个重要环境因子[5-6],全球气候变暖可能对陆地生态系统土壤酶活性产生影响。一方面,升高温度可以影响土壤酶的动力学,直接影响土壤酶活性[7];另一方面,升高温度也可能通过影响土壤的水热条件、土壤微生物的群落结构、微生物生物量、有机物质分解等因素间接影响土壤酶的活性[6,8-10]。已有的研究表明,土壤温度升高能增加土壤酶活性[11-13],但不同生态系统及不同种类的土壤酶对温度敏感性存在一定差异[14-17],且同一种酶在不同生态系统下对土壤温度的敏感性也表现不一致[18]。因此,未来气候变化可能对陆地生态系统中土壤酶系统产生复杂的影响,从而影响相关的土壤碳氮过程。
川西高山森林位于长江上游和青藏高原东缘,在区域气候调节、涵养水源、水土保持、生物多样性保育和全球碳循环等方面具有十分重要的作用和地位[19-20]。每年11月至次年4月,受季节性雪被等因素的影响,土壤表现出明显的季节性冻融过程,且由于气温随海拔降低而升高,因而季节性雪被和冻融循环也随海拔垂直分异连续变化[21]。这为研究高海拔森林土壤生态过程及其对环境变化的响应提供了理想的天然实验室。因此,采用原状土柱移位实验,将岷江冷杉(Abiesfaxoniana)原始林(3582 m)的原状土柱分别培养在岷江冷杉原始林(3582 m)、岷江冷杉和红桦(Betulaalbo-sinensis)混交林(3298 m)和岷江冷杉次生林(3023 m)的森林地表,研究了不同关键时期的土壤酶活性动态特征,以期深入理解全球变暖情景下的高海拔森林土壤生态过程。
1 材料与方法
1.1 研究区域概况
研究区域位于四川省理县毕棚沟自然保护区(102°53′—102°57′ E,31°14′—31°19′N,海拔2458—4619 m),地处青藏高原东缘与四川盆地的过渡带。年降雨量约850 mm,年平均气温2—4℃,最高气温23℃(7月),最低气温 -18℃ (1月)。土壤季节性冻结期为每年11月初至次年4月中旬,冻结时间长达5—6个月,土壤冻结初期和融化期间具有比较明显的冻融循环[21]。研究区域的主要森林植被类型为针叶林和针阔混交林,主要森林树种包括岷江冷杉、川西云杉(Picealikiangensisvar.balfouriana)和红桦。林下灌木主要为箭竹(Fargesiaspathacea)、高山杜鹃(Rhododendrondelavayi)、三颗针(Berberisjulianae)等;草本主要有蟹甲草(Cacaliaauriculata)、高山冷蕨(Cystopterismontana)、苔草属(Carexspp.)和莎草属(Cyperusspp.)等[21]。
1.2 样地设置与样品采集
2010年5月在岷江冷杉原始林(3582 m)内选取坡向、坡度和海拔高度基本一致(30 m×30 m)的样地,先清除地面上的植物与新鲜凋落物,再将PVC管(长20 cm、内径5 cm)垂直打入土壤中,在尽量不破坏土壤的原状结构情况下,保持PVC管上端与土壤表面平行,然后挖出装有土壤的PVC管,将两端用尼龙布封口,其中上层为土壤有机层(OL),下层为矿质土壤层(MS)。
原状土柱移位实验:将采自原始冷杉林下的原状土柱进行原位培养,其余土柱分别培养在海拔3298 m的岷江冷杉和红桦混交林(海拔降低284 m,理论气温增加1.78℃)和海拔3023 m的岷江冷杉次生林(海拔降低559 m,理论气温增加3.52℃)地表。在3个海拔梯度上分别选择5个具有代表性且环境条件基本一致的标准样地,每个样地划分3个小区,在每个小区内埋入5根已经装好土壤的PVC管,即每个海拔梯度埋设75根PVC管。
根据土壤温度动态、冬季土壤冻融过程以及前期的实验观察结果[22],于2010年8月12日生长季初期(EGS)、2010年10月17日生长季末期(LGS)、2010年12月23日冻结初期(OF)、2011年3月3日深冻期(DF)和2011年4月19日融化期(TP)进行土壤样品采集。在每个样地内的各小区采集1根PVC管,每根PVC管内的土壤分别分层处理,其中0—10 cm为土壤有机层,10—20 cm为矿质土壤层,各样地内的样品分别混匀后装入无菌样品袋低温保存,即时运回实验室。随后将每个样品去掉石块、动植物残体和根系后过2 mm筛,混匀装入保鲜袋,贮存4℃的冰箱中备用,用于土壤转化酶和脲酶活性测定。
1.3 测定方法
2010年5月,分别在样地内地表及土壤5 cm和15 cm处埋设纽扣式温度记录器(DS1923-F5#,Maxim/Dallas semiconductor Inc., USA) 连续监测空气及土壤温度,设定为每1 h记录一次数据。
土壤酶活性参照关松荫[23]的方法测定。转化酶(INV)采用3,5-二硝基水杨酸比色法测定,一个酶活性单位(EUINV)以1 g土壤样品在37℃条件下,24 h内水解产生葡萄糖的毫克数表示;土壤脲酶(URE)采用尿素比色法测定,一个酶活性单位(EUURE)以1 g土壤在37℃条件下,24 h内水解减少的尿素毫克数表示。
1.4 统计分析
采用重复测量方差分析(repeated-analysis ANOVA)检验海拔、土层、采样时期及各因子交互作用对土壤转化酶和脲酶活性的影响。采用单因素方差分析(one-way ANOVA)和Tukey法检验同一采样时期不同海拔和同一海拔的不同采样时期对土壤转化酶和脲酶活性的影响。采用Excel 2007和SPSS 16.0对实验数据进行统计与分析,显著性水平设定为P<0.05。
2 结果与分析
2.1 土壤温度特征
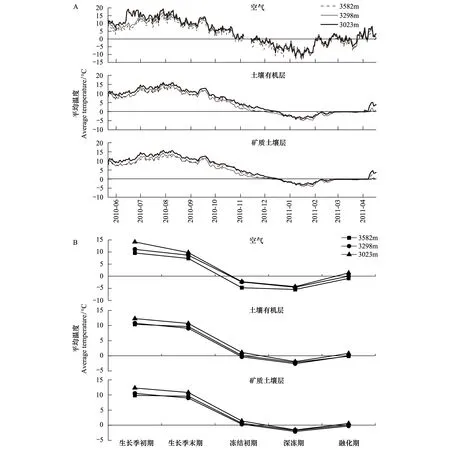
图1 3个海拔梯度的大气及土壤温度动态变化(2010-05-24—2011-04-19)Fig.1 Temperature dynamic of air and soil in three elevations from May 24, 2010 to April 19, 2011. A is daily dynamic of atmosphere temperature, and B is the temperature difference at different critical periods
2010年5月24日—2011年4月19日期间,3个海拔的森林群落中,空气和土壤温度变化特征如图1所示。随着海拔降低,即与3582 m相比,海拔降低284 m和559 m使空气温度表现出增高的趋势,全年平均气温实际增高分别为1.39℃和2.64℃。土壤温度在不同增温模式下表现出一定的差异,海拔下降284 m后土柱的土壤有机层和矿质土壤层温度在生长季初期和融化期表现为升高,而在生长季末期到深冻期则表现为下降,全年平均温度实际分别降低了0.55℃和0.56℃;海拔降低559 m,土柱的土壤有机层和矿质土壤层温度在整个研究期间均表现为升高,全年平均温度实际分别增加了0.84℃和0.82℃。
2.2 土壤转化酶活性动态
土柱原位培养、海拔降低284 m和559 m移位培养的土壤有机层和矿质土壤层的转化酶活性均随着关键时期而变化(图2)。其中,土壤有机层的转化酶活性明显高于矿质土壤层。土壤有机层的转化酶活性均表现为从生长季初期到生长季末期显著下降,随后在冻结阶段显著升高并在深冻期达到全年最高,并与土壤采样时期均温呈极显著负相关关系(表1)。土柱位移对生长季节末期的土壤有机层转化酶活性没有显著影响,但降低了其它关键时期土壤有机层的转化酶活性。不管土柱位移培养与否,矿质土壤层的转化酶活性均表现为从生长季初期到生长季末期显著下降,在随后的冻结阶段和融化期显著升高并在融化期升至全年最高。海拔降低284m提高了土壤冻结阶段(OF和DF期)的转化酶活性,但海拔降低559m降低了土壤冻结期间矿质土壤层的转化酶活性;土柱的海拔位移显著降低了生长季初期和融化期矿质土壤层的转化酶活性。海拔、土层和采样时期及其相互间的交互作用均显著影响了土壤转化酶活性(表2)。

图2 土柱海拔位移对高山森林土壤有机层和矿质土壤层转化酶活性动态的影响Fig.2 Effects of soil column transplanting on soil invertase activity in soil organic layer (OL) and mineral soil layer (MS) in the alpine forest from May 24, 2010 to April 19, 2011不同大写字母表示不同采样时期下同一海拔及土层间的土壤转化酶活性差异显著;不同小写字母表示不同海拔间同一采样时期及土层间的土壤转化酶活性差异显著(P<0.05)
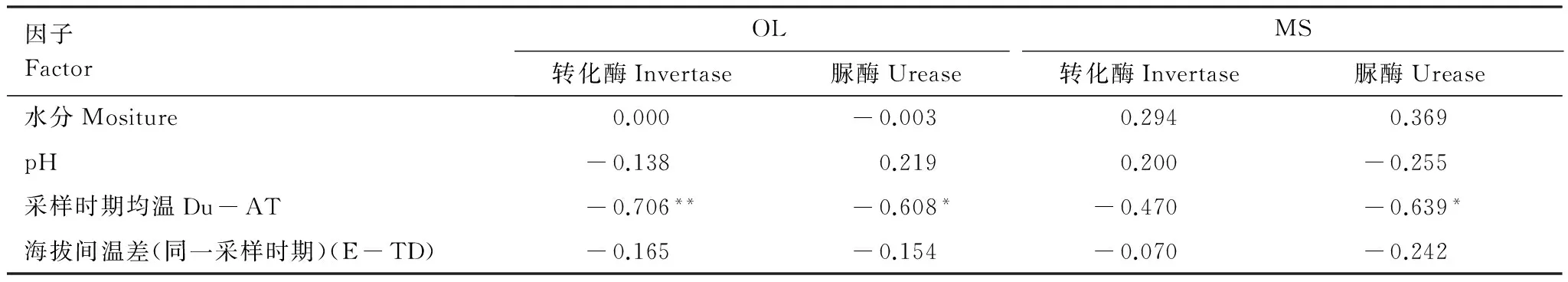
因子FactorOLMS转化酶Invertase脲酶Urease转化酶Invertase脲酶Urease水分Mositure0.000-0.0030.2940.369pH-0.1380.2190.200-0.255采样时期均温Du-AT-0.706**-0.608*-0.470-0.639*海拔间温差(同一采样时期)(E-TD)-0.165-0.154-0.070-0.242
OL: 土壤有机层; MS: 矿质土壤层; Du-AT: Duration average temperature; E-TD: Elevation temperature difference;*P<0.05;**P<0.01
2.3 土壤脲酶活性动态
土柱原位培养、海拔降低284 m和559 m移位培养的土壤有机层和矿质土壤层脲酶活性表现出从生长季初期到深冻期显著增加,随后在融化期显著降低的动态变化,且土壤有机层的脲酶活性高于矿质土壤层(图3)。土壤脲酶活性与土壤时期均温呈极显著负相关关系(表1)。土柱位移对土壤有机层脲酶活性产生了显著影响,海拔降低284 m提高了生长季初期的脲酶活性,而海拔降低559 m则提高了其他关键时期的脲酶活性。矿质土壤层在生长季末期和土壤冻结期表现出与有机层相似的趋势,而海拔降低284 m则提高了融化期的脲酶活性。海拔、土层和采样时期显著影响了土壤脲酶活性(表2)。
表2海拔、土层和采样时期对土壤转化酶和脲酶活性影响的重复方差分析结果
Table2ResultsofrepeatedmeasuresANOVAfortheeffectsofelevation,soillayer,andsamplingperiodonsoilinvertaseandureaseactivities

转化酶Invertase脲酶Urease因子Factors样本自由度df(n)误差自由度df(error)FP因子Factors样本自由度df(n)误差自由度df(error)FPE21239.012<0.001E212108.377<0.001L1120.0089<0.001L1120.0058<0.001SP448705.781<0.001SP448574.376<0.001E×L21219.271<0.001E×L21218.236<0.001E×SP84817.036<0.001E×SP84820.679<0.001L×SP448318.542<0.001L×SP44857.155<0.001E×L×SP84813.053<0.001E×L×SP84835.321<0.001
E: 海拔elevation;L: 土层soil layer; SP: 采样时期sampling period

图3 土柱海拔位移对高山森林土壤有机层和矿质土壤层脲酶活性动态的影响Fig.3 Effects of soil column transplanting on urease activity in both soil organic layer (OL) and mineral soil layer (MS) in the alpine forest from May 24, 2010 to April 19, 2011图中不同大写字母表示不同采样时期下同一海拔及土层间的土壤脲酶活性差异显著;不同小写字母表示不同海拔间同一采样时期及土层间的土壤脲酶活性差异显著(P<0.05)
3 讨论
利用土柱在自然海拔梯度上研究模拟大气温度增加对土壤温度的影响发现,不同模拟增温幅度对土壤温度的影响存在一定差异(图1)。与前人的研究结果一致,在受季节性雪被影响的高纬度高海拔地区,冬季土壤温度表现出降低的现象[24-27]。海拔降低284 m的土壤有机层和矿质土壤层温度在生长季初期和融化期表现出升高的趋势,在生长季末期、冻结期和深冻期则表现出下降的趋势。海拔降低284 m的森林群落普遍存在的雪被覆盖现象对土壤起到一定的绝缘和隔热作用,同时,雪被还可能干扰了太阳辐射对土壤的增温效应[26,28-29],从而使得海拔降低284 m的土壤温度在冬季并不随气温的增加而增加。而海拔降低559 m的雪被覆盖时间和雪被厚度均明显降低[30],土壤温度对太阳辐射响应更敏感,使得土壤平均温度升高。
土壤酶是土壤生态系统代谢的一类重要动力,主要来源于动植物的分泌及其残体和微生物的分泌。土壤酶活性是土壤生物和非生物环境变化的“感应器”[31-32],在凋落物分解、碳氮矿化、土壤养分转化和循环过程中具有重要的作用。川西高山森林土壤转化酶活性从生长季初期到生长季末期显著下降,可能是由于:1)土壤温度的急剧降低,抑制了土壤生物活性及酶合成[33-34];2)由于土柱实验排除了植物根系的影响,导致植物输入地下的有机物及根系分泌物减少,影响土壤转化酶活性[35]。由于深冻期相对稳定的环境在一定程度上有利于对低温适应性更好的物种生长[36],提高了土壤微生物群落的多样性,以及融化期凋落物的解冻等释放的胞内酶在短期内对酶活性的促发[34,37],导致转化酶活性在随后的冻结阶段和融化期表现出升高的趋势。前人的研究表明,酶活性对小幅度的土壤增温响应并不敏感[11,38-39]。本研究中,酶活性对增温的响应明显小于季节性温度变化引起的响应(表1和图1,图2), 与前人的研究结果一致[11,39]。不同模拟增温条件下土壤转化酶活性在不同采样时期表现也不一致,与土柱原位培养相比,海拔降低284 m和海拔降低559 m处的土壤转化酶活性在冻结阶段的两个土层中分别表现出升高和降低的趋势,可能是由于冻结作用导致的死亡生物细胞破裂释放出的胞内酶在短期内提高土壤酶活性[34,37],以及雪被的保温作用为那些对低温适应性更好的土壤微生物提供了较为稳定的微环境[36],改变了土壤微生物群落组成结构,更有利于增加土壤酶生产和活性。
土壤酶活性与土壤水热条件之间有着十分密切的关系,不同季节水分的差异导致了它们对增温的响应不同,如土壤蛋白酶更易受土壤水分影响,而在土壤水分保持稳定的条件下,土壤脲酶对温度的敏感性则更高[6,40]。本研究中,由于生长季内降水较多,适宜的小气候促进微生物的生长,模拟增温显著增加了土壤脲酶的活性,这一结果与徐振锋等[41]的研究相似。在冻融季节,土壤脲酶先显著升高,然后在融化期显著降低,且海拔降低559 m脲酶活性相对较高,可能是由于冻融交替作用使土壤疏松度增加,水稳性团聚体降低,促进有机物质和微生物接触进而增强酶的激活效应[42];同时,冻融交替导致土壤水分渗透压变化,大量土壤生物死亡也可促进死亡细胞内酶向土壤中释放,在短期内也提高土壤酶活性[37,43]。但当土壤融化时,强烈的淋溶作用使养分大量流失[44-45],通过限制土壤生物的生长和复苏而使土壤酶活性有所下降。
综上所述,土壤酶活性除受温度的影响外,土壤冻融格局、微生物的活性等的改变也会直接或间接影响土壤酶的活性,由于研究环境的差异,不同因子的共同作用可能导致土壤酶活性受增温的影响不同。川西高山森林土壤酶活性对季节性温度变化和不同增温幅度的响应有所差异,且土壤酶活性对温度的响应与采样时期均温呈显著的负相关关系。在土壤冻结期出现一个明显的酶活性高峰,显著高于生长季(或与之相当),表明冬季低温环境维持的土壤酶活性对川西高山森林土壤生态过程具有重要作用。
[1] Chapin III F S, Matson P A, Mooney H A. Principles of terrestrial ecosystem ecology. New York: Springer-Verlag. 2002:529 p.
[2] IPCC, 2014: Climate Change 2014: Synthesis Report. Contribution of Working Groups I, II and III to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change[Core Writing Team, R.K. Pachauri and L.A. Meyer (eds.)]. IPCC, Geneva, Switzerland, 151 pp.
[3] Sardans J, Peuelas J, Estiarte M. Warming and drought alter soil phosphatase activity and soil P availability in a Mediterranean shrubland. Plant and Soil, 2006, 289(1): 227- 238.
[4] 杨万勤, 王开运. 森林土壤酶的研究进展. 林业科学, 2004, 40(2): 152- 159.
[5] Shackle V J, Freeman C, Reynolds B. Carbon supply and the regulation of enzyme activity in constructed wetlands. Soil Biology and Biochemistry, 2000, 32(13): 1935- 1940.
[6] Tscherko D, Kandeler E, Jones T H. Effect of temperature on below-ground N-dynamics in a weedy model ecosystem at ambient and elevated atmospheric CO2levels. Soil Biology and Biochemistry, 2001, 33(4): 491- 501.
[7] Kang H, Kim S Y, Fenner N, Freeman C. Shifts of soil enzyme activities in wetlands exposed to elevated CO2. Science of the Total Environment, 2005, 337(1/3): 207- 212.
[8] Verburg P S J, Van Dam D, Hefting M M, Tietema A. Microbial transformations of C and N in a boreal forest floor as affected by temperature. Plant and Soil, 1999, 208(2): 187- 197.
[9] 吴秀臣, 孙辉, 杨万勤. 土壤酶活性对温度和CO2浓度升高的响应研究. 土壤, 2007, 39(3): 358- 363.
[10] Zogg G P, Zak D R, Ringelberg D B, White D C, MacDonald N W, Pregitzer K S. Compositional and functional shifts in microbial communities due to soil warming. Soil Science Society of America Journal, 1997, 61(2): 475- 481.
[11] Jing X, Wang Y H, Chung H, Mi Z R, Wang S P, Zeng H, He J S. No temperature acclimation of soil extracellular enzymes to experimental warming in an alpine grassland ecosystem on the Tibetan Plateau. Biogeochemistry, 2014, 117(1): 39- 54.
[12] Schindlbacher A, Schnecker J, Takriti M, Borken W, Wanek W. Microbial physiology and soil CO2efflux after 9 years of soil warming in a temperate forest-no indications for thermal adaptations. Global change biology, 2015, 21(11): 4265- 4277.
[13] Wallenstein M D, Mcmahon S K, Schimel J P. Seasonal variation in enzyme activities and temperature sensitivities in Arctic tundra soils. Global Change Biology, 2009, 15(7):1631- 1639.
[14] Allison S D, Treseder K K. Warming and drying suppress microbial activity and carbon cycling in boreal forest soils. Global Change Biology, 2008, 14(12): 2898- 2909.
[15] 李娜, 王根绪, 高永恒, 王俊峰, 柳林安.模拟增温对长江源区高寒草甸土壤养分状况和生物学特性的影响研究. 土壤学报, 2010, 47(6): 1214- 1224.
[16] 刘琳, 朱霞, 孙庚, 罗鹏, 王蓓. 模拟增温与施肥对高寒草甸土壤酶活性的影响. 草业科学, 2011, 28(8): 1405- 1410.
[17] 王学娟, 周玉梅, 王秀秀, 江肖洁, 韩士杰. 长白山苔原生态系统土壤酶活性及微生物生物量对增温的响应. 土壤学报, 2014, 51(1): 166- 175.
[18] Brzostek E R, Finzi A C. Seasonal variation in the temperature sensitivity of proteolytic enzyme activity in temperate forest soils. Journal of geophysical research, 2012, 117(G1), doi: 10.1029/2011JG001688.
[19] Yang W Q, Wang K Y, Kellomäki S, Gong H D. Litter dynamics of three subalpine forests in Western Sichuan. Pedosphere, 2005, 15(5): 653- 659.
[20] Yang W Q, Feng R F, Zhang J, Wang K Y. Carbon stock and biochemical properties in the organic layer and mineral soil under three subalpine forests in Western China. Acta Ecologica Sinica, 2007, 27(10): 4157- 4165.
[21] 谭波, 吴福忠, 杨万勤, 余胜, 刘利, 王奥, 杨玉莲. 川西亚高山/高山森林土壤氧化还原酶活性及其对季节性冻融的响应. 生态学报, 2012, 32(21): 6670- 6678.
[22] 刘金玲, 吴福忠, 杨万勤, 石培礼, 王奥, 杨玉莲, 武志超. 季节性冻融期间川西亚高山/高山森林土壤净氮矿化特征. 应用生态学报, 2012, 23(3): 610- 616.
[23] 关松荫.土壤酶及其研究方法. 北京: 农业出版社, 1986: 260- 339.
[24] Campbell J L, Mitchell M J, Groffman P M, Christenson L M, Hardy J P. Winter in northeastern North America: a critical period for ecological processes. Frontiers in Ecology and the Environment, 2005, 3(6): 314- 322.
[25] Edwards A C, Scalenghe R, Freppaz M. Changes in the seasonal snow cover of alpine regions and its effect on soil processes: A review. Quaternary International, 2007, 162- 163: 172- 181.
[26] Groffman P M, Driscoll C T, Fahey T J, Hardy J P, Fitzhugh R D, Tierney G L. Colder soils in a warmer world: A snow manipulation study in a northern hard wood forest ecosystem. Biogeochemistry, 2001, 56(2): 135- 150.
[27] Williams M W, Helmig D, Blanken P. White on green:under-snow microbial processes and trace gas fluxes through snow, Niwot Ridge, Colorado Front Range. Biogeochemistry, 2009, 95(1): 1- 12.
[28] Decker K L M, Wang D, Waite C, Scherbatskoy T. Snow removal and ambient air temperature effects on forest soil temperatures in northern Vermont. Soil Science Society of America Journal, 2003, 67(4): 1234- 1242.
[29] Gądek B, Leszkiewicz J. Influence of snow cover on ground surface temperature in the zone of sporadic permafrost, Tatra Mountains, Poland and Slovakia. Cold Regions Science and Technology, 2010, 60(3): 205- 211.
[30] 殷睿, 徐振锋, 吴福忠, 杨万勤, 李志萍, 熊莉, 肖洒, 王滨. 雪被斑块对川西亚高山两个森林群落冬季土壤氮转化的影响. 生态学报, 2014, 34(8): 2061- 2067.
[31] Baum C, Leinweber P, Schlichting A. Effects of chemical conditions in re-wetted peats on temporal variation in microbial biomass and acid phosphatase activity within the growing season. Applied Soil Ecology, 2003, 22(2): 167- 174.
[32] 杨玉莲, 吴福忠, 杨万勤, 谭波, 徐振锋, 刘洋, 康丽娜. 雪被去除对川西高山冷杉林冬季土壤水解酶活性的影响. 生态学报, 2012, 32(22): 7045- 7052.
[33] Mikan C J, Schimel J P, Doyle A P. Temperature controls of microbial respiration in arctic tundra soils above and below freezing. Soil Biology and Biochemistry, 2002, 34(11): 1785- 1795.
[34] Koponen H T, Jaakkola T, Keinänen-Toivola M M, Kaipainen S, Tuomainen J, Servomaa K, Martikainen P J. Microbial communities, biomass and activities in soils as affected by freeze thaw cycles. Soil Biology and Biochemistry, 2006, 38(7):1861- 1871.
[35] Tierney G L, Fahey T J, Groffman P M, Hardy J P, Fitzhugh R D, Driscoll C T. Soil freezing alters fine root dynamics in a northern hardwood forest. Biogeochemistry, 2001, 56(2): 175- 190.
[36] Drotz S H, Sparrman T, Nilsson M B, Schleucher J, Öquist M G. Both catabolic and anabolic heterotrophic microbial activity proceed in frozen soils. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(49): 21046- 21051.
[37] 谭波, 吴福忠, 秦嘉励, 吴庆贵, 杨万勤. 川西亚高山、高山森林土壤微生物生物量和酶活性动态特征. 生态环境学报, 2014, 23(8): 1265- 1271.
[38] Bell T H, Henry H A L. Fine scale variability in soil extracellular enzyme activity is insensitive to rain events and temperature in a mesic system. Pedobiologia, 2011, 54(2): 141- 146.
[39] Bell T H, Klironomos J N, Henry H A L. Seasonal responses of extracellular enzyme activity and microbial biomass to warming and nitrogen addition. Soil Science Society of America Journal, 2010, 74(3): 820- 828.
[40] Sardans J, Peuelas J, Estiarte M. Changes in soil enzymes related to C and N cycle and in soil C and N content under prolonged warming and drought in a Mediterranean shrubland. Applied Soil Ecology, 2008, 39(2): 223- 235.
[41] 徐振锋, 唐正, 万川, 熊沛, 曹刚, 刘庆. 模拟增温对川西亚高山两类针叶林土壤酶活性的影响. 应用生态学报, 2010, 21(11): 2727- 2733.
[42] 谯兴国, 李法云, 张营, 马溪平, 李崇, 王效举. 冻融作用对石油污染土壤酶活性和水溶性碳的影响. 农业环境科学学报, 2008, 27(3): 914- 919.
[43] Edwards K A, McCulloch J, Kershaw G P, Jefferies R L. Soil microbial and nutrient dynamics in a wet Arctic sedge meadow in late winter and early spring. Soil Biology and Biochemistry, 2006, 38(9): 2843- 2851.
[44] Hentschel K, Borken W, Matzner E. Repeated freeze-thaw events affect leaching losses of nitrogen and dissolved organic matter in a forest soil. Journal of Plant Nutrition and Soil Science, 2008, 171(5): 699- 706.
[45] Matzner E, Borken W. Do freeze-thaw events enhance C and N losses from soils of different ecosystems? A review. European Journal of Soil Science, 2008, 59(2): 274- 284.
ResponsesofsoilinvertaseandureaseactivitiesinanalpineforestofwesternSichuantosimulatedclimatewarmingatdifferentcriticalperiods
ZHANG Li1,2, WU Fuzhong1,2, XU Zhenfeng1,2, TAN Bo1,2, LIU Yang1,2, YANG Yulian1,2,3, WANG Ao1,2,4, YANG Wanqin1,2,*
1Long-termResearchStationofAlpineForestEcosystems,InstituteofEcology&Forestry,SichuanAgriculturalUniversity,Chengdu611130,China2CollaborativeInnovationCenterofEcologicalSecurityintheUpperReachesofYangtzeRiver,Chengdu611130,China3SichuanProvincialKeyLaboratoryofEcologicalSecurityandProtection,MianyangNormalUniversity,Mianyang621000,China4InstituteofProductQualityInspectionandTestingofZunyi,Zhunyi563000,China
国家自然科学基金项目(31570445, 31270498, 31500509, 31570601);教育部博士点基金项目(20105103110002);四川省教育厅重点项目(15ZA0009);四川省杰出青年学术与技术带头人培育项目(2012JQ0008)
2016- 05- 18; < class="emphasis_bold">网络出版日期
日期:2017- 03- 27
*通讯作者Corresponding author.E-mail: scyangwq@163.com
10.5846/stxb201605180960
张丽,吴福忠,徐振锋,谭波,刘洋,杨玉莲,王奥,杨万勤.川西高山森林不同时期土壤转化酶和脲酶活性对模拟气候变暖的响应.生态学报,2017,37(16):5352- 5360.
Zhang L, Wu F Z, Xu Z F, Tan B, Liu Y, Yang Y L, Wang A, Yang W Q.Responses of soil invertase and urease activities in an alpine forest of western Sichuan to simulated climate warming at different critical periods.Acta Ecologica Sinica,2017,37(16):5352- 5360.
