盐酸双氧水混合溶液制备氯铂酸的新工艺
2017-10-13孙立志
彭 伟,孙立志,孙 宝,彭 戴
盐酸双氧水混合溶液制备氯铂酸的新工艺
彭 伟,孙立志,孙 宝,彭 戴
(武汉船用电力推进装置研究所,武汉 430064)
本设计了新型的制备氯铂酸的工艺路线,即用先溶解再还原的方式将海绵铂转化成活性较高的铂粉,这种高活性铂粉可溶于盐酸双氧水中,即可制备得到不含硝酸根离子的氯铂酸。由该工艺路线合成效率高、污染低,适于用作大批量的氯铂酸生产。
盐酸 双氧水 氯铂酸 赶硝操作
0 引言
铂作为一种重要的铂族金属,具有优良的物理和化学性能,而被广泛应用于汽车工业、电子工业、石油化工、燃料电池行业、医药领域、航空航天领域、首饰行业、烟草行业等领域[1]。在医药化工领域中,铂通常的应用方式是以铂基化合物为出发点进行进一步转化,进而获得含铂的有效成分。氯铂酸是最重要的铂基化合物之一,其应用十分广泛,可用于制备含铂催化剂[2]、铂镀层[3]以及其他含铂化合物[4],还可以在分析化学中用于检验钾离子、铵离子[5]。
传统的氯铂酸合成方法为,首先由用王水将铂完全溶解,过程会产生大量的氮氧化物,为了保证溶解的效率,通常加入明显过量的王水[6]。然后向溶解了铂的溶液中分批次加入盐酸进行赶硝的操作,将过量的王水中的硝酸根除去。传统的方法中所用的赶硝操作存在明显的不足,首先赶硝操作相对来说比较耗时,其次赶硝操作又会再次产生大气污染物氮氧化物,再者硝酸根是否除尽会对产品质量造成直接的影响。
传统方法使用赶硝操作是为了将体系中多余的硝酸根除去,以保证氯铂酸产品的质量。如果通过合成工艺上的改进来彻底排除硝酸根在氯铂酸溶液中的存在,即可避免赶硝操作带来的负面影响。事实上,王水在传统的氯铂酸合成方法中主要有两方面的作用,一方面硝酸作为氧化剂,另一方面盐酸提供氯离子与铂发生配位,二者共同作用使铂氧化成氯铂酸。从氯铂酸的化学组成上来说,后者的作用必不可少,那么前者的作用是否可以通过别的氧化剂来实现替代呢?事实上,双氧水替代硝酸作为氧化剂用于合成在金属钯合成氯化钯的反应中已经有所体现[7]。双氧水作为氧化剂时,其被还原后的生成物是水,过量的双氧水还可以直接通过加热挥发的方式除去,是一种很实用的氧化剂。
从理论上来说,使用盐酸加双氧水的组合溶解铂是可行的。从基础反应的电极电势数据库中可以查到以下三个电极反应的标准电极电势:
PtCl42-+2e=Pt+4Cl-,0=0.73V (1)
PtCl62-+2e=PtCl42-+2Cl-,0=0.68V (2)
2H++H2O2+2e=2H2O,0=1.76V (3)
由电极反应(1)~(3)可以变换出铂在盐酸和双氧水存在的条件下发生溶解生成氯铂酸的反应方程式,如(4)所示:
Pt+2H2O2+4H++6Cl-=PtCl62-+4H2O (4)
那么反应(4)的标准吉布斯自由能即可由反应(1)~(3)的标准电极电势以及各自的转移电子数计算得到,结果发现△G<0。由此说明理论上铂在盐酸和双氧水存在的条件下被溶解生成氯铂酸的反应是可以自发发生的。而实验发现,普通的金属铂块或者海绵铂很难直接被盐酸和双氧水的混合溶液溶解,可能的原因是这两种形态的铂金属的比表面太小导致其反应活性不够[8]。
本文工作通过对海绵铂先溶解再还原的方式解决了海绵铂活性不够的问题,通过这一处理方式将海绵铂转化成了高活性的铂粉,该活性铂粉即可被盐酸双氧水的混合物直接溶解。具体方式为:首先利用常规的王水溶解法将海绵铂溶解成氯铂酸,然后调节氯铂酸溶液至碱性,随后加入水合肼将氯铂酸还原成大比表面积的黑色活性铂粉,通过过滤洗涤的方式对活性铂粉进行除杂的处理,最后干净的活性铂粉被含有盐酸和双氧水的溶液快速溶解,通过加热的方式除去过量的双氧水之后,即可获得不含硝酸根的氯铂酸溶液。本文所采用的盐酸双氧水溶解的方式制备氯铂酸的工艺能够降低氮氧化物的排放量,并且可以排除硝酸根的存在,相对于传统方法制备氯铂酸的工艺来说,效率和质量均得到了明显提高。
1 实验内容
1.1 原料
海绵铂(99.95%),盐酸(GR),硝酸(GR),氢氧化钠(GR),水合肼(80%,AR),双氧水(GR),去离子水。
1.2 仪器与耗材
仪器:恒温水浴磁力搅拌器(巩义市予华仪器有限责任公司,DF-101S),真空水泵(巩义市予华仪器有限责任公司,SHZ-D) ,旋转蒸发仪(上海亚荣生化仪器厂,RE52C)
耗材:2 L圆底烧瓶,250 mL圆底烧瓶,磁子,pH试纸,250 mLG5含支口砂芯漏斗,500 mL锥形瓶。
1.3 制备原理及步骤
制备的原理:使用海绵铂为铂原料,用过量王水将其溶解,再将溶解得到的氯铂酸还原成活性铂粉,最后用盐酸双氧水混合溶液将活性铂粉溶解即可得到不含硝酸根的氯铂酸溶液。
制备过程可分为六步,具体过程如下:
1) 在2 L圆底烧瓶中加入10 g海绵铂,加入过量王水后,在恒温水浴和磁力搅拌的条件下,铂粉完全溶解得到橘红色含有氯铂酸的溶液。
2) 向步骤1)的溶液加入固体氢氧化钠,调节溶液pH值至碱性,调pH过程中保持磁力搅拌。
3) 向步骤2)中碱性的含有氯铂酸的溶液中加入过量的水合肼,反应过程同时保持恒温水浴和磁力搅拌。反应结束后得到含有黑色活性铂粉和透明清液的固液混合物。
4) 用250 mLG5含支口的砂芯漏斗和500 mL锥形瓶组成的抽滤系统将步骤3)中的固液混合物进行分离,并对黑色活性铂粉进行洗涤多次以去除表面的杂质离子。
5) 将洗涤后的黑色活性铂粉转移至2 L圆底烧瓶中,加入盐酸和双氧水后,在恒温水浴和磁力搅拌的条件下,铂粉完全溶解得到橘红色的含有氯铂酸的溶液。
6) 将步骤5)获得的氯铂酸蒸发浓缩,同时加热挥发除去过量的双氧水。
1.4 结果分析和检测
1.4.1 氯铂酸溶液中铂含量的测定
方法一:称取一定量的氯铂酸溶液,用硼氢化钠将其还原成铂粉。用已知重量的G5砂芯漏斗将得到的铂粉过滤洗涤,将装有铂粉的砂芯漏斗整体烘干后,称取漏斗和铂粉的总重,通过差减法扣除漏斗本身的质量后,可获得还原得到的铂粉重量。最后将干燥铂粉的重量与称取的氯铂酸溶液的重量求比值即可得到氯铂酸溶液的铂元素含量。
方法二:称取一定量的氯铂酸溶液,按照GB/T 15072.3《贵金属合金化学分析方法金、铂、钯合金中铂量的测定高锰酸钾电流滴定法》的规定测定铂的质量分数。
1.4.2 氯铂酸溶液中杂质离子含量的测定
取一定量的氯铂酸溶液(约1 g左右),将其稀释至50 mL,用石墨炉原子吸收光谱法测定GB/T 26298-2010《氯铂酸》中规定的银(Ag)、金(Au)、钯(Pd)、铑(Rh)、铱(Ir)、铅(Pb)、镍(Ni)、铜(Cu)、铁(Fe)、锡(Sn)、铬(Cr)的含量,然后利用测定的氯铂酸溶液的铂含量的数值,将测得的溶液中的杂质元素的质量分数换算成样品中的氯铂酸为干燥纯物质状态时的杂质含量,将结果与GB/T 26298-2010《氯铂酸》中规定的数值进行对比。
2 优化工艺参数
按照前面描述的合成步骤,需要优化的工艺参数包括了王水用量、还原剂用量、盐酸和双氧水总用量、蒸发浓缩温度。
2.1 王水用量对海绵铂溶解效率的影响
已知王水溶解海绵铂发生的溶解反应如反应式(5)所示:
3Pt+18HCl+4HNO3=3H2PtCl6+4NO↑+8H2O (5)
由反应式(5)可以计算出,每溶解1 g铂需要王水(浓盐酸和浓硝酸体积配比为3:1)的体积至少为3.63 mL,即需要2.72 mL浓盐酸 (质量分数35%,密度1.179 g/mL)和0.91 mL浓硝酸 (质量分数65%,密度1.4 g/mL) ,其中浓硝酸实际只消耗0.47 mL。
在实际的铂溶解反应过程中,为了尽量提高溶解的速率,通常对反应溶液进行加热,而王水在加热的条件下自身即会发生分解同时还存在明显的挥发现象,因此实际的铂溶解反应所需的王水用量远远不止理论计算的结果。为了确定高效溶解铂所需的最少王水用量,对比了不同王水用量下海绵铂的溶解百分比。
固定海绵铂为10 g,反应温度为80℃,磁力搅拌速率为600 r/min,反应时间为30 min,分别使用了40 mL、60 mL、80 mL、100 mL、120 mL、140 mL王水进行溶解实验,结果得到的六次实验的海绵铂溶解百分比结果如图1所示。
从图1中可以看到,10g海绵铂粉使用100 mL王水可以实现半小时内完全溶解。由此可确定每克海绵铂在80℃条件下溶解所需加入王水用量为10 mL。
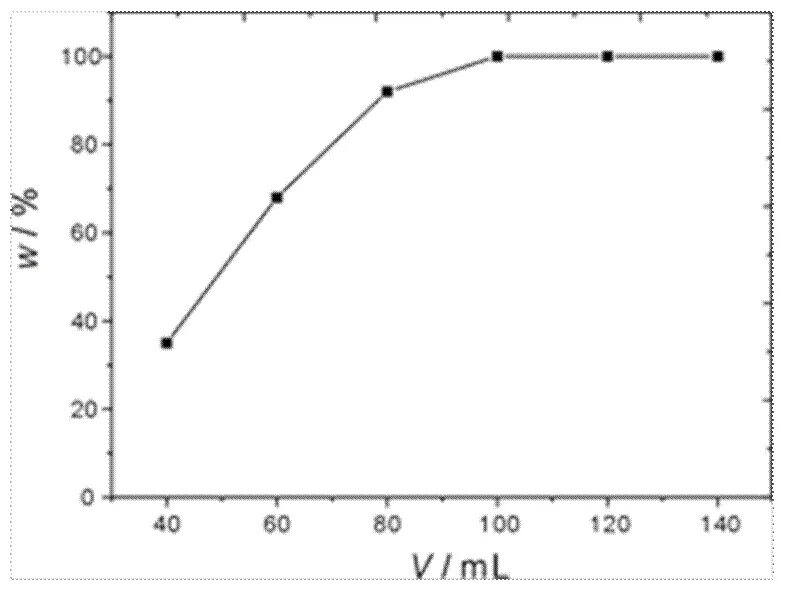
图1 不同用量的王水溶解海绵铂的溶解率
2.2 还原反应条件及还原剂用量的优化
通常来说,所用的还原剂水合肼需要在碱性条件下才能发挥其还原能力,因此王水溶解得到的含有氯铂酸的溶液需要先加入氢氧化钠调节其pH值至碱性,然后再加入水合肼进行还原。
碱性条件下,氯铂酸被水合肼还原的反应如反应式(6)所示:
PtCl62-+N2H4+4OH-=Pt+6Cl-+N2↑+4H2O (6)
由反应式(6)可以计算出,每还原得到1 g铂需要水合肼溶液(其中含80%水合肼,密度1.032 g/mL)的体积至少为0.20 mL。从理论上来说,仅需按照反应计量比加入水合肼即可实现PtCl62-的完全还原,然而在实际的还原反应过程中,为了保证还原反应充分的进行,需要对还原反应溶液进行加热,加热后的水合肼自身存在一定的挥发和分解,而产物氮气的溢出也可能带走一部分水合肼一同挥发,因此实际的水合肼用量可能比理论计算的结果略高。
为了探索出至少需要的水合肼用量,我们尝试进行了六组平行实验,六组平行实验中均固定海绵铂为10 g,将其用王水完全溶解,用氢氧化钠调节pH至碱性后,加入六种不同量的水合肼至不再产生气泡,即表示还原反应终止,这六组实验所用水合肼用量分别为1.5 mL、1.8 mL、2.1 mL、2.2 mL、2.3 mL、2.5 mL,反应温度均为80℃,反应结束后对溶液进行过滤洗涤后可得到氯铂酸还原得到的活性铂粉,得到六组实验的活性铂粉的质量,将其对水合肼的用量进行作图,结果如图2所示。
从图2中可以看出,2.2 mL水合肼可以实现完全将氯铂酸还原。由此说明了,还原得到1 g活性铂粉需要加入2.2 mL的水合肼。
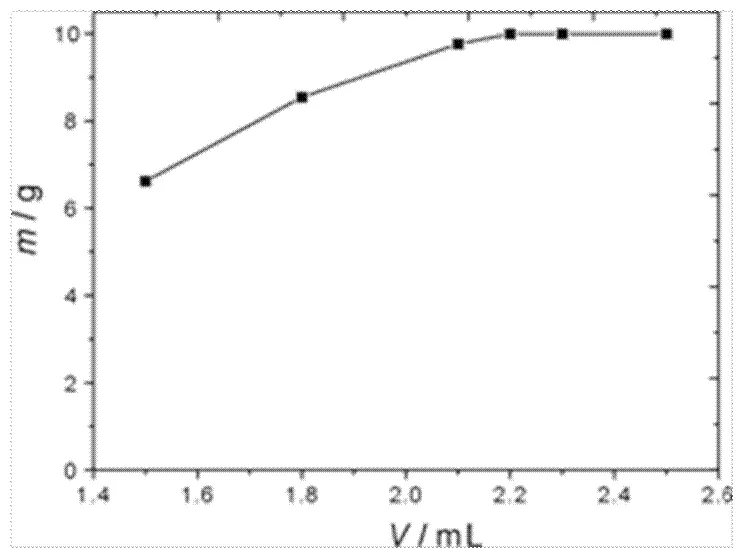
图2 不同用量水合肼还原氯铂酸后得到活性铂粉重量
2.3 盐酸双氧水用量对活性铂粉溶解效率的影响
已知盐酸和双氧水溶解活性铂粉发生的溶解反应如反应式(7)所示:
Pt+6HCl+2H2O2=H2PtCl6+4H2O (7)
由反应式(7)可以计算出,每溶解1 g铂需要2.72 mL浓盐酸 (质量分数35%,密度1.179 g/mL)和1.03 mL双氧水 (质量分数30%,密度1.13 g/mL)。也就是说所需的浓盐酸和双氧水体积比为2.64。
在实际的活性铂粉溶解反应过程中,为了尽量提高溶解的速率,通常对反应溶液进行加热,而盐酸双氧水混合物在加热的条件下本身就会存在挥发的现象,而同时盐酸和双氧水会发生相互反应以及双氧水自身分解的副反应都有可能发生,并且副反应的速率随着温度的升高而加快,因此溶解过程所需的盐酸双氧水用量远远不止理论计算的结果。为了确定高效溶解活性铂粉所需的最少盐酸双氧水用量,对比了不同盐酸双氧水用量的条件下活性铂粉的溶解百分比。
固定海绵铂为10 g,反应温度为80℃,磁力搅拌速率为600 r/min,反应时间为30 min,加入的盐酸和双氧水的体积比严格控制为2.64:1,总共尝试了六组实验,六组实验中总用量相对于理论消耗量的比值分别为1倍、2倍、3倍、4倍、5倍、6倍,结果得到的六次实验的活性铂粉溶解百分比结果如图3所示。
从图3中可以看出,3倍理论用量可以实现完全将活性铂粉完全溶解。也就是说,每克活性铂粉在80℃下溶解需要浓盐酸约8 mL、双氧水约3 mL。
2.4 蒸发浓缩温度对氯铂酸产品质量的影响
活性铂粉被盐酸双氧水的混合物完全溶解后,得到的氯铂酸的浓度相对较低,主要是因为溶解过程用到了显著过量的盐酸和双氧水;同时显著过量的盐酸残留于氯铂酸溶液中会导致酸度过高,可能会对氯铂酸溶液的实际应用过程造成影响;另外过量的双氧水也需要通过加热分解的方式进行除去。因此需要对活性铂粉溶解得到的氯铂酸溶液进行蒸发浓缩后处理,目的是增大氯铂酸浓度的同时,降低残留的盐酸含量以及消除残留的双氧水。
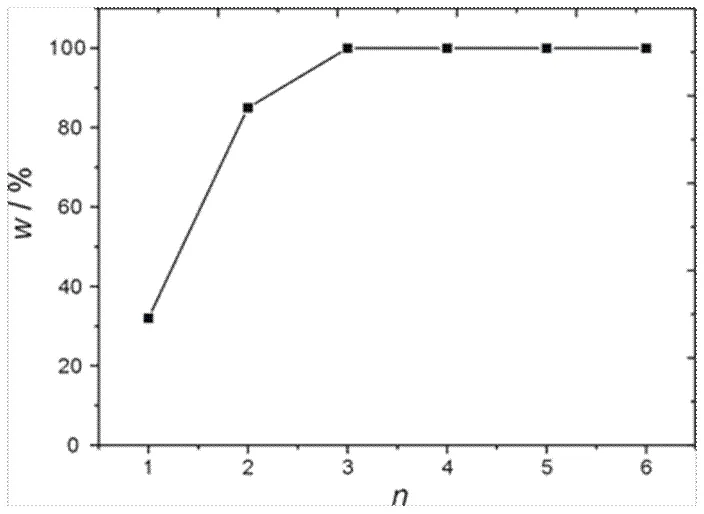
图3 不同盐酸双氧水用量溶解活性铂粉的百分比
然而,蒸发浓缩的温度高低对最终获得氯铂酸产品的质量会造成直接的影响。如果温度过低,则直接导致蒸发浓缩效率太低;如果温度过高,则会导致氯铂酸发生分解。因此需要对蒸发浓缩的温度进行优化,我们选择铂含量为1%的氯铂酸溶液进行常压蒸发浓缩2小时,对比了六种不同蒸发温度(60℃、70℃、80℃、90℃、100℃、110℃)下,最终得到的氯铂酸溶液的铂含量,结果如图4所示。
从图4中可以看出,随着蒸发浓缩温度的提高,氯铂酸溶液的铂含量越高,证实了提高温度可以提高蒸发效率。然而在100℃蒸发后得到的较浓氯铂酸溶液中出现了不溶性金属微粒,通过XRD的分析可以得知其成分为铂粉,说明了氯铂酸在高于100℃的温度下会发生分解。

图4 不同蒸发温度下获得的氯铂酸溶液的铂含量
根据以上实验结果可以确定,蒸发浓缩氯铂酸的最佳温度为90℃。事实上,为了进一步加快蒸发速率,可以考虑降低体系的气压,从而降低挥发性物质的沸点。
3 结果讨论
3.1 最终确定的工艺参数
综合以上的工艺参数优化的结果,最终确定了氯铂酸溶液制备的工艺过程,表1分别表示了三步反应的工艺参数细节。
表1 氯铂酸溶液制备过程三步反应的工艺参数
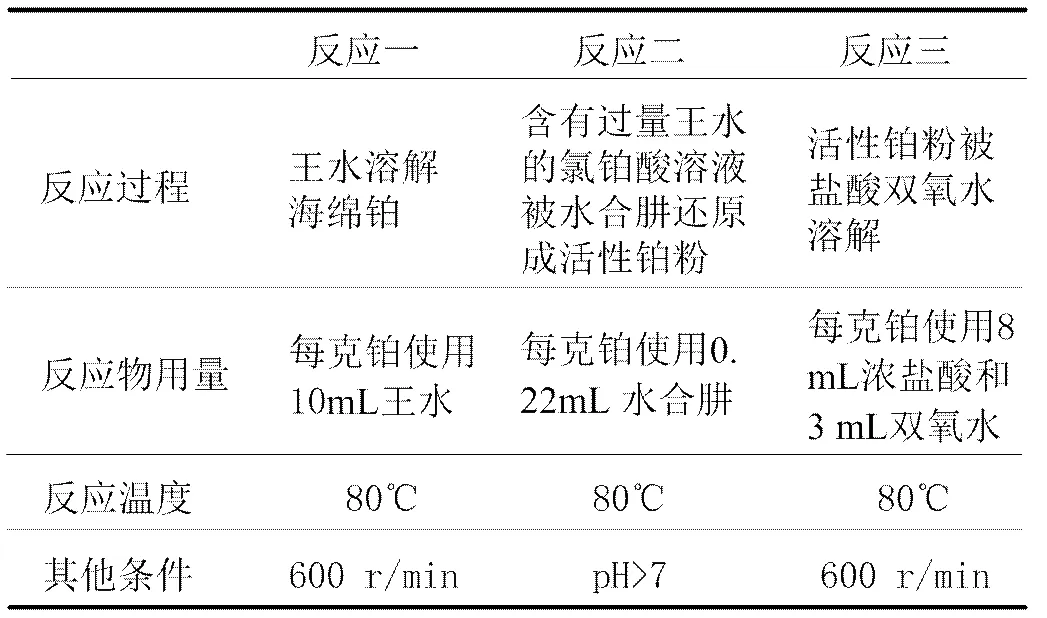
三步反应后,得到的氯铂酸溶液在90℃的条件下进行蒸发浓缩,以除去过量的双氧水和降低盐酸含量。
3.2 本工艺的优势
目前最常见的溶解技术是王水溶解法,然而王水溶解都不可避免地需要赶硝的操作,这一操作过程既繁琐又产生大量污染性氮氧化物气体,并且残留的硝酸根会对后续的产品合成和应用造成不利影响。我们使用的盐酸和双氧水溶解法制备氯铂酸溶液,不仅能够保证溶解高效的进行,还能有效避免硝酸根的影响,同时减少赶硝操作可以明显降低氮氧化物的排放量。
3.3 氯铂酸溶液产品的杂质含量检测结果
为了确保氯铂酸溶液产品的质量满足国标要求,我们按照1.4中描述的方式得到的杂质含量数据与GB/T 26298-2010规定的杂质含量进行对比,结果如表2所示。
从表2的对比结果来看,氯铂酸溶液产品的杂质含量完全符合国标要求。
4 结论
本工作设计了新型的氯铂酸溶液制备工艺,即盐酸双氧水溶解活性铂粉的制备工艺,具体为:使用常用的海绵铂作为铂原料,用合适量的王水将其溶解后,在碱性条件下用水合肼将其还原,得到的活性铂粉用合适量的盐酸双氧水可以将其高效溶解,即可得到氯铂酸溶液。由于本工艺最后获得氯铂酸溶液的步骤不涉及硝酸,因此不需要进行赶硝的操作,最后得到的氯铂酸溶液可以基本排除硝酸根的影响,同时可以明显减少污染物氮氧化物的排放量。总的来说,该新型工艺具有效率高、产品纯度高、污染小的特点,可用于氯铂酸的大批量生产。

表2 氯铂酸溶液产品的杂质含量
[1] 刘艳伟, 杨滨, 李艳. 铂族金属在现代工业中的应用[J]. 南方金属, 2009, (2): 1-3.
[2] 徐洪峰, 林治银, 邱艳玲, 等. 用于质子交换膜燃料电池的碳载铂电催化剂[J]. 催化学报, 2003, 24(2): 143-148.
[3] 张业明, 方达经, 陈志量, 等. 钛板电沉积铂工艺的研究[J]. 材料保护, 2008, 41(8): 19-21.
[4] 张有明, 卢爱茹, 张联祥, 等. 铂族固态配合物的研究(Ⅲ)氯铂酸与DB18C6、DB24C8、DB30C10及B15C5衍生物的固态配合物的合成和性质[J]. 化学研究与应用, 1993(3): 41-47.
[5] 氯铂酸, http://www.baike.com/wiki/%E6%B0%AF%E9%93%82%E9%85%B8
[6] 朱泽兵, 何键, 李学杰, 等. 金属铂溶解与废气处理装置的应用研究[J]. 贵金属, 2007, 28(S1): 47-50.
[7] 董树仁, 张军. 氯化钯的研制与应用[J]. 中国资源综合利用, 1999(8): 16-18.
[8] 张立岩, 戴伟, 卫国宾, 等. 海绵钯形态对制备硝酸钯的影响研究[J]. 石油化工, 2010, 39: 142-144.
A New Technology of Preparing Chloroplatinic Acid with Hydrochloric Acid and Hydrogen Peroxide Mixed Solution
Peng Wei, Sun Lizhi, Sun Bao, Peng Dai
(Wuhan Institute of Marine Electric Propulsion, Wuhan 430064, China)
TQ138.26
A
1003-4862(2017)06-0064-05
2017-03-03
彭伟(1987-),男,工程师。研究方向:贵金属材料。E-mail: 493084326@qq.com
