丹酚酸B抗心肌纤维化的机制研究Δ
2017-10-13罗红王春花赵玲璐杨宇陈世平徐旖旎杨红宇沈祥春贵州医科大学贵州省高等学校天然药物药理与成药性评价特色重点实验室贵阳55005贵州医科大学实验动物中心贵阳55005
罗红,王春花,赵玲璐,杨宇,陈世平,徐旖旎,杨红宇,沈祥春#(.贵州医科大学贵州省高等学校天然药物药理与成药性评价特色重点实验室,贵阳 55005;.贵州医科大学实验动物中心,贵阳 55005)
·实验研究·
丹酚酸B抗心肌纤维化的机制研究Δ
罗红1,2*,王春花1,赵玲璐1,杨宇1,陈世平1,徐旖旎1,杨红宇2,沈祥春1#(1.贵州医科大学贵州省高等学校天然药物药理与成药性评价特色重点实验室,贵阳 550025;2.贵州医科大学实验动物中心,贵阳 550025)
目的:研究丹酚酸B(Sal B)对血管紧张素Ⅱ(AngⅡ)诱导的心肌成纤维细胞增殖、Ⅲ型胶原分泌及基质金属蛋白酶9(MMP-9)、Smad2/3、Smad7蛋白表达的影响,探讨其抗心肌纤维化的作用机制。方法:将细胞分为空白对照组(培养液)、AngⅡ模型组和Sal B低、中、高浓度组(12.5、25、50 μmol/L),用空白或含药培养液培养细胞1 h后,除空白对照组外的其余各组均加入1 μmol/L的AngⅡ诱导细胞增殖,共同作用24 h。分别采用MTT法和苏木精-伊红染色法考察Sal B对细胞增殖的影响;采用Western blot法检测Sal B对细胞Ⅲ型胶原、MMP-9、Smad2/3、Smad7蛋白表达的影响。结果:与空白对照组比较,AngⅡ模型组细胞明显增殖,Ⅲ型胶原、MMP-9、Smad2/3蛋白表达明显增强,Smad7蛋白表达明显减弱,差异均有统计学意义(P<0.05);与AngⅡ模型组比较,Sal B各浓度组细胞的增殖均受到抑制,Ⅲ型胶原、MMP-9、Smad2/3蛋白表达均减弱,Smad7蛋白表达均增强,除Sal B低、中浓度组细胞Ⅲ型胶原与Sal B高浓度组细胞Smad2/3蛋白表达变化不显著外,其余各指标差异均有统计学意义(P<0.05)。结论:Sal B抗心肌纤维化的作用可能与抑制心肌成纤维细胞的增殖,下调Ⅲ型胶原、MMP-9、Smad2/3蛋白表达和上调Smad7蛋白表达有关。
丹酚酸B;心肌成纤维细胞;Ⅲ型胶原;基质金属蛋白酶9;转化生长因子β1信号通路
心肌纤维化所导致的心力衰竭、心律失常和心源性猝死等严重并发症已逐渐成为心血管疾病死亡的主要原因。而心肌成纤维细胞是心肌纤维化的主要效应细胞,当心脏受到损伤时,心肌成纤维细胞的数目增多,表型分化为肌成纤维细胞,肌成纤维细胞又通过分泌更多的Ⅰ型、Ⅲ型胶原蛋白和上调基质金属蛋白酶(MMP)的表达等方式抑制细胞外基质降解,使心肌胶原纤维成分不成比例地增多、排列紊乱,心肌间质胶原合成和降解比例失调,导致心室壁的僵硬度增加、心室壁的顺应性降低,从而严重影响心脏正常的生理功能[1]。丹酚酸B(Salvianolic acid B,Sal B)为丹参的主要水溶性成分,具有很强的抗氧化活性。本课题组前期研究表明,Sal B能显著抑制转化因子β1(Transforming growth factor β1,TGF-β1)诱导的心肌成纤维细胞的增殖[2-3],但目前对于其抗心肌纤维化的作用机制尚不清楚。因此,本研究主要从Sal B对血管紧张素Ⅱ(AngⅡ)诱导心肌成纤维细胞增殖活性,细胞Ⅲ型胶原、MMP-9蛋白表达以及TGF-β1信号通路这3个方面的影响来探索其抗心肌纤维化的作用及机制。
1 材料
1.1 仪器
ELX800酶联免疫检测仪(美国GE公司);TDL-4ZB台式自动平衡离心机(湖南星科科学仪器有限公司);BS223S电子天平(北京赛多利斯仪器系列有限公司);XDS-1B倒置显微镜(重庆光电仪器有限公司);CFX凝胶成像系统仪、电泳仪、电泳槽(美国Bio-Rad公司)。
1.2 药品与试剂
Sal B原料药(上海阿拉丁试剂有限公司,批号:46595,纯度:>98%);AngⅡ(美国Sigma公司,批号:1401558214,纯度:>97%);SP免疫组化试剂盒(北京中杉金桥生物技术有限公司,批号:PV-6002);聚丙烯酰胺凝胶电泳试剂盒、增强化学发光试剂盒(上海碧云天生物技术公司,批号:P0012AC-1、P0018A);兔源Ⅲ型胶原、Smad2/3多克隆抗体(美国ImmunoWay公司,批号:B3201、B3201);兔源波形蛋白、MMP-9、Smad7多克隆抗体(武汉博士德有限公司,批号:BM0135、2844710、12F81);山羊抗兔二抗(上海拜力生物科技有限公司,批号:2000-0003);甘油醛-3-磷酸脱氢酶(GAPDH)多克隆抗体(英国Abcam公司,批号:ab9485)。
1.3 动物
清洁级SD大鼠10只,鼠龄1~3 d,♀♂不限,由贵州医科大学实验动物中心提供,实验动物生产许可证号:SCXK-(黔)2012-001。
2 方法
2.1 心肌成纤维细胞的分离纯化
将大鼠用75%乙醇进行皮肤消毒后,固定四肢,胸部向上,用75%乙醇分别消毒胸腹部皮肤,用虹膜剪剪开胸部皮肤及肋骨,暴露心脏;取下正在搏动的心尖部份,磷酸盐缓冲液(PBS)洗净残留血污,将组织放入含有青霉素和链霉素的PBS的安瓿小瓶中,转入超净台,用虹膜剪剪成大小约1 mm×1 mm×1 mm的碎块,PBS洗3次;加入0.125%的胰酶,放入4℃冰箱进行冷消化6 h,取出吸弃胰酶;再加入0.125%的胰酶后放入培养箱进行热消化5 min,重复4次,每次都收集消化的细胞悬液。终止消化后,以离心半径为9.6 cm、1 000 r/min离心10 min,收集细胞沉淀。采用含20%胎牛血清的DMEM培养液重悬细胞,然后接种于细胞培养瓶中,90 min后进行差速贴壁,以纯化心肌成纤维细胞。
2.2 心肌成纤维细胞的鉴定
用3~5代的心肌成纤维细胞制备细胞爬片,然后以4%多聚甲醛固定,采用0.5%Triton X-100试剂破膜20 min;3%过氧化氢孵育,山羊血清封闭,依次用1∶200稀释的兔源波形蛋白多克隆抗体、山羊抗兔二抗和辣根过氧化物酶孵育后,二氨基联苯胺显色至棕黄色;乙醇梯度脱水,二甲苯透明后,中性树胶封片。显微镜下观察并拍照,若胞浆染成棕黄色则判定为阳性;并于显微镜下进行细胞计数,计算阳性细胞率。
2.3 Sal B对AngⅡ诱导心肌成纤维细胞增殖的影响
2.3.1 MTT法测定细胞增殖活性 将细胞接种于96孔板中,用DMEM培养液培养24 h后,弃原培养液,加入新鲜DMEM对细胞进行同步12 h。将细胞分为AngⅡ模型组和Sal B低、中、高浓度组,并另设只加DMEM培养液不加药物的空白对照组和只加培养液不加细胞的调零孔,每组设6个复孔。Sal B低、中、高浓度组细胞分别加入12.5、25、50 μmol/L的Sal B预处理1 h后,加入AngⅡ(终浓度为1 μmol/L);AngⅡ模型组细胞不加Sal B预处理,直接加入AngⅡ(终浓度为1 μmol/L)。培养24 h后,弃原培养液,用PBS洗细胞3次,每孔加入200 μL的二甲基亚砜(DMSO)和 20 μL的MTT溶液(5 mg/mL),继续孵育4 h。终止培养后,小心吸弃上清液,每孔加入150 μL的DMSO,振荡10 min,使结晶物充分溶解。在酶联免疫检测仪490 nm波长处测定各孔光密度(OD)值,以OD值的大小表示细胞的增殖活性。
2.3.2 苏木精-伊红(HE)染色观察细胞增殖情况 制备细胞爬片,试验设置空白对照组、AngⅡ模型组和Sal B低、中、高浓度组。Sal B低、中、高浓度组加入12.5、25、50 μmol/L的Sal B预处理1 h后,加入AngⅡ(1 μmol/L);AngⅡ模型组细胞不加Sal B预处理,直接加入AngⅡ(1 μmol/L)诱导细胞增殖。作用24 h后,弃原培养液,用PBS洗细胞3次,然后加入4%多聚甲醛固定,苏木精染色15~20 min,95%的乙醇润洗5 s,伊红染色20 min。镜检,着色满意后拍照观察细胞增殖情况。
2.4 Western blot法检测细胞中蛋白的表达
将处于对数生长期的同一批细胞接种于培养瓶中培养24 h,按“2.3”项下方法分组和给药处理。培养24 h后,弃培养上清液,用预冷的PBS漂洗细胞3次,加入裂解液和苯甲基磺酰氟裂解细胞并提取总蛋白。蛋白定量后,取总蛋白50 μg加入上样缓冲液中煮沸3 min变性。聚丙烯酰胺凝胶电泳分离蛋白,然后转至聚偏二氟乙烯膜上,3%牛血清白蛋白封闭后与兔源Ⅲ型胶原、MMP-9、Smad2/3、Smad7多克隆抗体(1∶200~1∶1 000)4℃孵育过夜,然后加入山羊抗兔二抗(1∶5 000)室温孵育90 min。增强化学发光液作用1 min后曝光,用Image Pro Plus 6.0图像分析软件对所有选择的目标条带灰度值进行分析,最后用内参GAPDH对各目标条带进行均一化处理,试验重复3次。
2.5 统计学方法
3 结果
3.1 心肌成纤维细胞的鉴定结果
免疫化学染色后,光镜下可见细胞呈梭形或多角形,细胞质被染成棕黄色,呈阳性反应,符合成纤维细胞的染色特征,且其纯度大于99%,结果见图1。
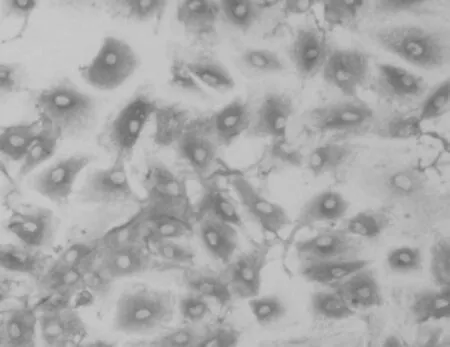
图1 心肌成纤维细胞的鉴定结果(×200)Fig 1 Identification results of cardiac fibroblasts( ×200)
3.2 Sal B对AngⅡ诱导心肌成纤维细胞增殖的影响结果
3.2.1 MTT试验结果 与空白对照组比较,AngⅡ模型组细胞的OD值明显升高(P<0.01),提示加入AngⅡ后可促进细胞增殖;与AngⅡ模型组比较,Sal B低、中、高浓度组细胞的OD值均显著降低(P<0.05或P<0.01),提示Sal B预处理可抑制AngⅡ诱导的心肌成纤维细胞的增殖。空白对照组、AngⅡ模型组和Sal B低、中、高浓度组细胞的OD值分别为0.49±0.03、0.64±0.04、0.55±0.01、0.54±0.01、0.51±0.04(n=6)。
3.2.2 HE染色结果 HE染色后,可见细胞的胞核被染成蓝色或淡蓝色,胞浆为淡红色,细胞形态饱满,细胞膜完整。与空白对照组比较,AngⅡ模型组细胞增生活跃,胞体稍微增大,数量明显增多;与AngⅡ模型组比较,Sal B各浓度组细胞的数量明显减少,结果见图2。
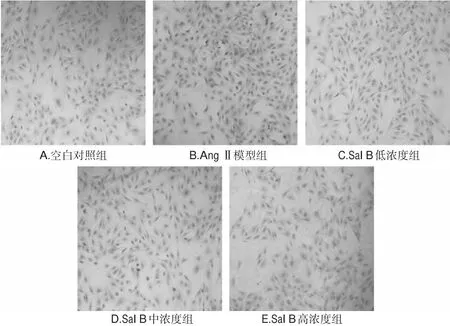
图2 各组细胞的HE染色观察结果(×200)Fig 2 Results of HE staining of cells in each group( ×200)
3.3 Sal B对AngⅡ诱导心肌成纤维细胞中蛋白表达的影响结果
与空白对照组比较,AngⅡ模型组细胞中Ⅲ型胶原、MMP-9和Smad2/3蛋白表达均显著增强(P<0.05),Smad7蛋白表达显著减弱(P<0.05);与AngⅡ模型组比较,Sal B低、中浓度组细胞中MMP-9、Smad2/3蛋白表达和Sal B高浓度组细胞中Ⅲ型胶原、MMP-9蛋白表达均显著减弱(P<0.05),Sal B各浓度组细胞中Smad7蛋白表达均显著增强(P<0.05)。蛋白电泳结果见图3,测定结果见表1。
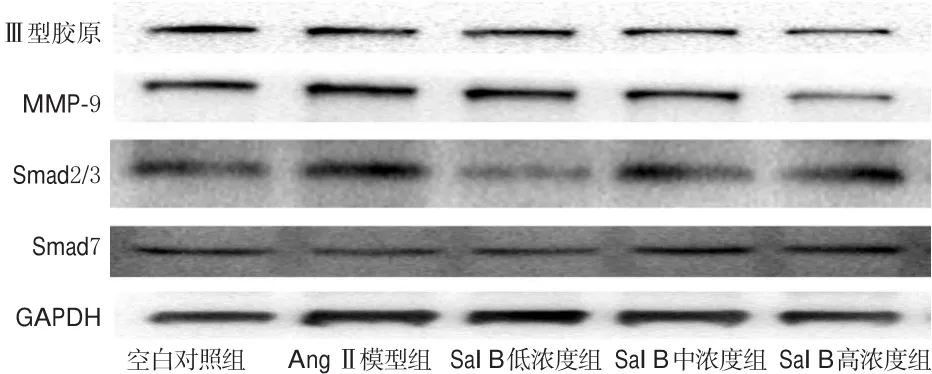
图3 各组细胞中Ⅲ型胶原、MMP-9、Smad2/3、Smad7蛋白表达电泳图Fig 3 Electrophoresis chart of protein expressions of typeⅢ collagen,MMP-9,Smad2/3,Smad7 of cells in each group
表1 各组细胞Ⅲ型胶原、MMP-9、Smad2/3、Smad7蛋白表达测定结果(±s,n=3)Tab 1 Determination results of protein expressions of typeⅢ collagen,MMP-9,Smad2/3,Smad7 of cells in each group(±s,n=3)

表1 各组细胞Ⅲ型胶原、MMP-9、Smad2/3、Smad7蛋白表达测定结果(±s,n=3)Tab 1 Determination results of protein expressions of typeⅢ collagen,MMP-9,Smad2/3,Smad7 of cells in each group(±s,n=3)
注:与空白对照组比较,*P<0.05;与AngⅡ模型组比较,#P<0.05Note:vs.blank control group,*P<0.05;vs.AngⅡ model group,#P<0.05
组别空白对照组AngⅡ模型组Sal B低浓度组Sal B中浓度组Sal B高浓度组Smad7 1.00±0.00 0.44±0.01*0.52±0.22#0.95±0.01#1.40±0.04#浓度,μmol/L 1 12.5 25 50Ⅲ型胶原1.00±0.00 2.19±0.48*1.19±0.30 1.10±0.35 0.91±0.30#MMP-9 1.00±0.00 1.35±0.040*0.72±0.01#0.70±0.01#0.59±0.02#Smad2/3 1.00±0.00 1.70±0.16*0.42±0.01#0.76±0.15#1.69±0.28
4 讨论
心肌纤维化是各种心血管疾病发生发展中心脏组织的共同病理改变,心肌纤维化导致的并发症已成为心血管疾病死亡的主要原因。心肌纤维化的发生发展都与心肌成纤维细胞增殖、过度分泌胶原及MMP有着十分紧密的联系[3]。Sal B抗心肌纤维化的作用在一些动物实验中已被证实[4],但是其对心肌成纤维细胞的作用目前报道较少。过度的胶原沉积是心肌纤维化最主要也是最重要的特点,减少胶原蛋白的表达也是评价抗纤维化药物最直观的指标之一[5]。本研究结果显示,Sal B可以明显减少细胞中Ⅲ型胶原的产生,从而发挥其抗心肌纤维化的作用。
MMP及其抑制剂维持着心脏组织中细胞外基质的动态平衡,当MMP活性增高、MMP抑制剂活性降低时,细胞外基质降解减少,最终造成胶原的过度沉积[6]。因此,抑制MMP-9的活性可以改善心肌纤维化的程度。本研究结果显示,低、中、高浓度的Sal B均可降低细胞中MMP-9蛋白的表达。
TGF-β1信号通路是目前已知的最强的促纤维化信号通路之一。该信号通路上调可以促进心肌成纤维细胞增殖,并促进其分化为心肌成纤维细胞,从而促进胶原的合成、抑制胶原的降解,最终导致细胞外基质的积聚,并可介导炎症因子白细胞介素6产生,促进心肌纤维化的发展[7]。在TGF-β1信号通路中,TGF-β1受体主要是通过磷酸化Smads蛋白调节纤维化基因的表达,促进纤维化发展[8]。Smads蛋白可以分为3种,即受体调节Smads蛋白、共同介质型Smads蛋白和抑制性Smads蛋白。Smad2/3是受体调节Smads蛋白,与受体结合后,可上调TGF-β1信号通路相关蛋白的表达;Smad7是抑制性Smads蛋白,可竞争性地结合TGF-β1受体,阻止受体调节Smads蛋白磷酸化,从而阻断TGF-β1信号通路效应[9]。本研究结果显示,Sal B可以明显下调Smad2/3蛋白的表达、上调Smad7的表达,抑制心肌成纤维细胞的异常增殖,减少Ⅲ型胶原和MMP-9的表达,从而发挥其抗心肌纤维化的作用。在本研究中,关于加入AngⅡ后细胞中Smad2/3、Smad7的变化规律与文献[10]报道基本相符,但是加入Sal B后Smad2/3的变化趋势却是随着Sal B浓度的增加而增强。笔者猜测可能由于低浓度是Sal B抑制细胞中Smad2/3蛋白表达的最佳浓度,在此浓度下Smad2/3蛋白的表达水平最低。关于Sal B抑制AngⅡ诱导细胞增殖后细胞中Smad2/3蛋白表达的变化规律还需要设计更多的试验进行验证。
综上所述,Sal B抗心肌纤维化的作用机制可能与其抑制心肌成纤维细胞的增殖,下调细胞Ⅲ型胶原、MMP-9、Smad2/3蛋白的表达及上调Smad7蛋白的表达有关,但其更多的作用机制有待进一步证实。
[1] Akoum N,Marrouche N.Assessment and impact of cardiac fibrosis on atrial fibrillation[J].Curr Cardiol Rep,2014,16(8):1-7.
[2] Schuetze KB,McKinsey TA,Long CS.Targeting cardiac fibroblasts to treat fibrosis of the heart:focus on HDACs[J].J Mol Cell Cardiol,2014,doi:10.1016/j.yjmcc.
[3] 罗红,杨红宇,沈祥春.丹酚酸B对TGF-β1诱导心肌成纤维细胞增殖的影响[J].中国药房,2014,25(3):202-204.
[4] Csepe TA,Kalyanasundaram A,Hansen BJ,et al.Fibrosis:a structural modulator of sinoatrial node physiology and dysfunction[J].Front Physiol,2015,doi:10.3389/fphys.
[5] Li N,Wang HX,Han QY,et al.Inhibition of proteasome activity by low-dose bortezomib attenuates angiotensinⅡ-induced abdominal aortic aneurysm in Apo E-/-mice[J].Sci Rep,2015,doi:10.1038/srep15730.
[6]Zhang D,Chen X,Wang Q,et al.Role of the MAPKs/TGF-β1/TRAF6 signaling pathway in postoperative atrial fibrillation[J].PLoS One,2017,12(3):e0173759.
[7] Miura S,Nakayama A,Tomita S,et al.Comparison of aldosterone synthesis in adrenal cells,effect of various AT1 receptor blockers with or without atrial natriuretic peptide[J].Clin Exp Hypertens,2015,37(5):353-357.
[8] He HB,Yang XZ,Shi MQ,et al.Comparison of cardioprotective effects using salvianolic acid B and benazepril for the treatment of chronic myocardial infarction in rats[J].Naunyn Schmiedebergs Arch Pharmaco,2008,378(3):311-322.
[9] Kong P,Christia P,Frangogiannis NG.The pathogenesis of cardiac fibrosis[J].Cell Mol Life Sci,2014,71(4):549-574.
[10] Jian B,Na Z,Ying H,et al.Metformin inhibits angiotensinⅡ-induced differentiation of cardiac fibroblasts into myofibroblasts[J].PLoS One,2013,8(9):e72120.
Study on the Mechanism of Anti-myocardial Fibrosis of Salvianolic Acid B
LUO Hong1,2,WANG Chunhua1,ZHAO Linglu1,YANG Yu1,CHEN Shiping1,XU Yini1,YANG Hongyu2,SHEN Xiangchun1(1.The High Educational Key Laboratory of Guizhou Province for Natural Medicinal Pharmacology and Druggability,Guizhou Medical University,Guiyang 550025,China;2.The Laboratory Animal Center of Guizhou Medical University,Guiyang 550025,China)
OBJECTIVE:To study the effects of salvianolic acid B(Sal B)on angiotensinⅡ(AngⅡ)-induced cardiac fibroblast proliferation,secretion of type Ⅲ collagen,protein expressions of matrix metalloproteinase 9(MMP-9),Smad2/3,Smad7,and explore its mechanism of anti-myocardial fibrosis.METHODS:Cells were divided into blank control group(culture medium)Ang Ⅱ model group,Sal B low-dose,medium-dose,high-dose groups(12.5,25,50 μmol/L).After cultured 1 h by blank or drug-containing culture,except for blank control group,cells in other groups were added 1 μmol/L Ang Ⅱ to induce proliferation.for 24 h.MTT method and hematoxylin-eosin staining method were adopted investigate the effect of Sal B on proliferation.Western blot method was adopted to detect the effects of Sal B on protein expressions of typeⅢ collagen,MMP-9,Smad2/3,Smad7.RESULTS:Compared with blank control group,cells in AngⅡ model group were significantly proliferated,protein expressions of typeⅢ collagen,MMP-9,Smad2/3 were obviously enhanced,protein expression of Smad7 was obviously weakened,with statistical significances(P<0.05).Compared with Ang Ⅱ model group,the cell proliferation in Sal B groups were inhibited,protein expressions of typeⅢ collagen,MMP-9,Smad2/3 were weakened,while protein expression of Smad7 was enhanced.Except the pro-tein expression of typeⅢ collagen in Sal B low-dose and medium-dose groups,the protein expression of Smad2/3 in Sal B high-dose group did not change significantly,other indexes had statistical significances(P<0.05).CONCLUSIONS:The anti-myocardial fibrosis effect of Sal B may be associated with inhibiting the proliferation of cardiac fibroblasts,down-regulating protein expressions of typeⅢ collagen,MMP-9,Smad2/3 and up-regulating protein expression of Smad7.
Salvianolic acid B;Cardiac fibroblasts;TypeⅢ collagen;Matrix metalloproteinase 9;Transforming growth factor β1signaling pathway
R541
A
1001-0408(2017)28-3900-04
2017-02-23
2017-08-12)
(编辑:林 静)
国家自然科学基金资助项目(No.81560588);贵州省科技合作计划项目(No.黔科合LH字〔2016〕7356号);贵州省科学技术基金项目(No.黔科合JZ字〔2015〕2002号);贵州省高层次创新型人才培养项目(No.黔科合人才〔2015〕4029号);贵州医科大学2015年高等学校大学生创新创业训练计划项目(No.201510660007)
*实验师,硕士。研究方向:心血管药理学。电话:0851-86908928。E-mail:luohong1011@163.com
#通信作者:教授,博士生导师,博士。研究方向:心血管药理学。电话:0851-88416149。E-mail:shenxiangchun@126.com
DOI 10.6039/j.issn.1001-0408.2017.28.04
