乌司他丁对脑缺血再灌注大鼠脑组织JNK及细胞凋亡的影响
2017-10-12刘庆杰白宏英
刘庆杰 白宏英
1)永城市人民医院神经内科,河南 永城 476600 2)郑州大学第二附属医院神经内科,河南 郑州 450014
·论著 科研之窗·
乌司他丁对脑缺血再灌注大鼠脑组织JNK及细胞凋亡的影响
刘庆杰1)白宏英2)
1)永城市人民医院神经内科,河南 永城 476600 2)郑州大学第二附属医院神经内科,河南 郑州 450014
目的 探讨乌司他丁对脑缺血再灌注大鼠缺血侧脑组织c-Jun氨基末端激酶(JNK)蛋白表达及凋亡细胞数的影响。方法 36只雄性清洁SD大鼠按随机平均原则分成3组:假手术组(12只)、脑缺血再灌注组(对照组,12只)、脑缺血再灌注+乌司他丁治疗组(治疗组,12只)。大鼠局灶性脑缺血再灌注损伤模型采用大脑中动脉线栓法制作。采用RT-PCR法检测大鼠脑组织JNK的表达,采用 TUNEL法检测大鼠脑组织凋亡细胞数。结果 与假手术组相比,对照组和治疗组大鼠脑组织皮质区JNK的表达明显升高,凋亡细胞数均明显增加(P均<0.05)。与对照组相比,治疗组大鼠脑组织JNK的表达明显下降,凋亡细胞数均明显减少(均P<0.05)。结论 乌司他丁可下调缺血再灌注大鼠脑组织JNK的表达并抑制其细胞凋亡,乌司他丁抑制细胞凋亡可能与抑制JNK传导通路相关。
乌司他丁;脑缺血再灌注;c-Jun氨基末端激酶;细胞凋亡
本研究观察乌司他丁对大鼠脑缺血再灌注后缺血侧脑组织JNK蛋白的表达及凋亡细胞数的影响,探讨乌司他丁抑制细胞凋亡的可能机制及相关通路。
1 材料与方法
1.1 材料
1.1.1 动物与分组:清洁级健康雄性SD大鼠 36只,体质量220~300 g,由郑州大学动物中心提供。随机分为假手术组、脑缺血再灌注组(对照组)、脑缺血再灌注+乌司他丁干预组(治疗组),每组12只。
1.1.2 主要仪器及试剂:RT-PCR图像分析系统(大连Jim-X Scientific D140);电泳仪(北京市六一仪器厂 DYY-6C);PCR Gene Amp system(美国 Applied Biosystems 2700);图像采集系统(德国Lecia 显微照相系统);乌司他丁(广东天普生化医药股份有限公司,国药准字号H19990133);TUNEL试剂盒(罗氏ZK-8005),PCR试剂盒(EasyTaq DNA Polymerase,北京全式金生物技术有限公司AP111-12),Rt试剂盒(EasyScript First-Strand cDNA Synthesis SuperMix,北京全式金生物技术有限公司AE301-02)。
1.2 方法
1.2.1 动物模型制作及处理:采用改良Zea-Longa线栓法[1]制作大鼠大脑中动脉局灶缺血模型。大脑中动脉缺血2 h后将线栓抽至颈外动脉处并固定再灌注24 h,成功完成缺血再灌注模型制作。假手术组只分离颈总动脉、颈内动脉、颈外动脉和迷走神经不结扎不插线栓。于缺血2 h后应用Longa法[1]对其进行神经功能评分。0分:无神经功能缺损症状;1分:右侧前爪伸展不完全;2分:爬行时向右侧转圈;3分:爬行时身体向右侧倾倒;4分:意识丧失,行走不能。1~3分为造模成功,0、4分大鼠剔除。治疗组于再灌注开始时给予乌司他丁2万U/kg腹腔注射;假手术组及对照组用相同剂量的生理盐水替代。
1.2.2 JNK表达的检测:每组随机抽取6只大鼠,于冰块上行快速断头取脑,液氮冷冻后保存于-80 ℃冰箱中备用,采用RT-PCR法检测大鼠病变侧脑组织JNK的表达。将大鼠缺血侧脑组织常规研磨提取总RNA。JNK大小为343 bp,上游引物:5′-AGCCTTGTCCTTCGTGTC-3′,下游引物:5′-AAAGTGGTCAACAGAGCC-3′,内参照β-actin产物大小为568 bp,上游引物:CCCATCTATGAGGGTTAC,下游引物:GGAAGGTGGACAGTGAG。严格按照北京全式金生物技术有限公司RT-PCR和TRIZOL试剂盒说明书提供方法进行标准检测。扩增条件:94 ℃预变性2 min,1个循环;94 ℃变性30 s,反应35个循环;52 ℃退火35 s,72 ℃延伸2 min,共30个循环;72 ℃总延伸10 min。最后进行电泳测定,在紫外线投射仪下对跑好的电泳条带进行观察并照相,用图像记录仪和分析系统对所得条带进行光密度(OD)扫描分析,JNK的水平用JNK和DNA β-actin的DNA条带灰度值比值表示。
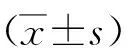
2 结果
2.1 各组大鼠脑组织JNK表达比较 与假手术组(0.395±0.053)相比,对照组(1.384±0.145)和治疗组(0.587±0.079)大鼠脑组织皮质区JNK的表达明显升高。与对照组相比,治疗组大鼠脑组织JNK的表达明显下降(P<0.05)。见图1。
2.2 各组大鼠脑组织凋亡细胞数比较 与假手术组[(5.60±0.89)个/HP]相比,对照组[(51.4±3.95)个/HP]和治疗组[(26.8±3.14)个/HP]凋亡细胞数均明显增加(均P<0.05)。与对照组相比,治疗组凋亡细胞数均明显减少(P<0.05)。 见图2。

图1 JNK mRNA的表达 1:假手术组;2:缺血再灌注组;3:治疗组
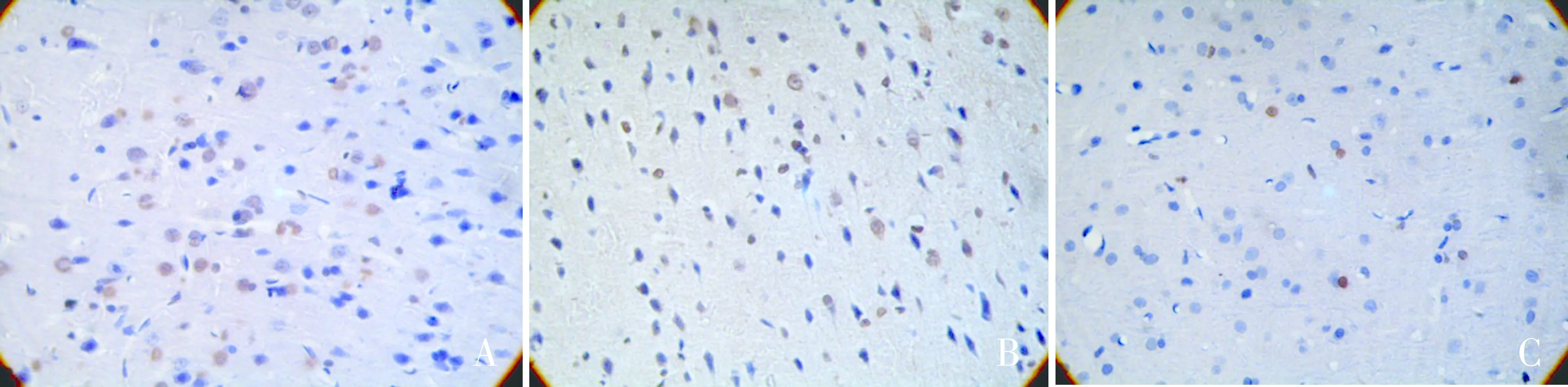
图2 各组脑组织Tunel 阳性细胞数(×400) A:假手术组;B:缺血再灌注组;C:治疗组
3 讨论
缺血再灌注是一病理过程,其特征是初始限制一个器官的血液供应,随后恢复灌注和伴随的氧气恢复,再灌注存在加重缺血性损伤可能。缺血器官代谢供需的不平衡导致严重的组织缺氧和微血管功能障碍,再灌注进一步促进了先天的适应性免疫反应的活性和细胞死亡程序。缺血和再灌注导致细胞死亡程序的激活,特别是缺血阶段转录调控基因表达发生重大变化,再灌注的特点是自身免疫反应,包括自然抗体识别新抗原和随后激活补体系统的自身免疫。缺血和再灌注激活多种细胞死亡程序,包括细胞凋亡、自噬相关性细胞死亡、坏死。细胞凋亡是一个半胱天冬酶信号级联反应,导致细胞死亡的一个独立的程序,表现为细胞及胞核的收缩,其核细胞膜一直保持完整性,这个过程一直被视为免疫刺激性低于坏死。最近的研究表明,来自于凋亡细胞释放的细胞外ATP通过泛连蛋白半通道扮演“找到我”信号吸引吞噬细胞[2]。抑制细胞凋亡可能在缺血再灌注损伤的治疗策略上有一定前途。
JNK是脑缺血再灌注损伤过程中炎症反应和凋亡的重要调控中介[3],脑缺血后,JNK信号通路高度激活,促进缺血相关基因的转录,最终导致神经元的损伤和功能障碍。阻断JNK信号通路已被证明具有保护神经细胞免受脑缺血再灌注损伤的作用,促进神经元存活。JNK的信号级联由上游激酶和磷酸酶之间的平衡进行调节[4]。JNK通路是丝裂原活化蛋白激酶(MAPK)级联反应,包含多种家族酶系,其中MAPK激酶激酶(MLKs/MAPKKK)激活MAPK激酶4/7(MKK4/7),MKK4/7进一步磷酸化JNK 183位苏氨酸残基和185位酪氨酸残基使其激活。抑制MLK3和MKK4/7阻止上游激酶级联涉及JNK失活。Akt称为神经保护蛋白质,可通过阻断上游激酶下调JNK的活性。在脑缺血状态下Akt通过磷酸化SEK 180位丝氨酸使其失活进一步抑制ASK1-SEK1-JNK2 信号通路[5]。有报道显示,PI3K/Akt信号级联反应在PC12细胞中可以通过抑制MLK3进一步下调MKK-7负性调节JNK通路。与此同时,缺血预处理雌激素可上调Akt活性的表达,这被认为Akt在缺血诱导的损伤中具有保护作用[6]。磷酸酶可通过直接对其183位苏氨酸残基和185位酪氨酸残基去磷酸化调节JNK的活性[7]。急性氧化应激已经证实可导致MKP-7从胞核到胞质的重新分配和胞质JNK的减少。p53是DNA损伤应答反应中的重要组成部分,其在细胞周期阻滞和细胞凋亡中发挥重要作用。上游激活的JNK通路通过调节p53的稳定性和转录进而激活p53,JNK2与p53结合则阻止其退化和增加其稳定性,诱导细胞凋亡。细胞死亡的另外一个机制为促凋亡Bcl-2家族的转换。作为促凋亡Bcl-2家族的一员,Bim是一种BH3-only蛋白,其功能为对DNA损伤起应答和促进凋亡。报道显示,Bim是以JNK依赖的方式被磷酸化的[8],JNK1和JNK2可以使另一BH3-only促凋亡蛋白成员Bid在其苏氨酸59位处发生磷酸化,进而参与caspase凋亡级联反应。
乌司他丁相对分子量约为6 700,由143个氨基酸组成,是一种糖蛋白,属蛋白酶抑制剂,对多种酶有抑制作用,具有抑制炎症介质释放及清除氧自由基的作用,多应用于肺部疾病和胰腺炎的治疗,其在脑血管病的作用集中在其抗炎和抗氧化方面的作用机制,至于其在细胞凋亡方面的作用及机制报道相对较少。本次实验结果显示,对照组凋亡细胞数与假手术组相比明显增加,表明缺血再灌注可引起细胞凋亡,并进一步说明模型制作成功;乌司他丁治疗组凋亡细胞数与缺血再灌注组相比明显减少,表明乌司他丁可以抑制缺血再灌注后细胞凋亡。
[1] Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[2] Chekeni FB,Elliott MR,Sandilos JK,et al.Pannexin 1 channels mediate 'find-me' signal release and membrane permeability during apoptosis[J].Nature,2010,467(7 317):863-867.
[3] Svensson C,Part K,Künnis-Beres K,et al.Pro-survival effects of JNK and p38 MAPK pathways in LPS-induced activation of BV-2 cells[J].Biochem Biophys Res Commun,2011,406(3):488-492.
[4] Xie P,Guo S,Fan Y,et al.Atrogin-1/MAFbx enhances simulated ischemia/reperfusion-induced apoptosis in cardiomyocytes through degradation of MAPK phospha-tase-1 and sustained JNK activation[J].Biol Chem,2009,284(9):5 488-5 496.
[5] Song JJ,Lee YJ.Dissociation of Akt1 from its negative regulator JIP1 is mediated through the ASK1-MEK-JNK signal transduction pathway during metabolic oxidative stress:a negative feedback loop[J].Cell Biol,2005,170(1):61-72.
[6] Nakamagoe M,Tabuchi K,Uemaetomari I,et al.Estra-diol protects the cochlea against gentamicin ototoxicity through inhibition of the JNK pathway[J].Hear Res,2010,261(1/2):67-74.
[7] Schwertassek U,Buckley DA,Xu CF,et al.Myristoy-lation of the dual-specificity phosphatase c-JUN N-terminal kinase (JNK) stimulatory phosphatase 1 is necessary for its activation of JNK signaling and apoptosis[J].FEBS J,2010,277(11):2 463-2 473.
[8] Bivik C,Ollinger K.JNK mediates UVB-induced apopto-sis upstream lysosomal membrane permeabilization and Bcl-2 family proteins[J].Apoptosis,2008,13(9):1 111-1 120.
(收稿2017-01-06)
责任编辑:关慧
Effects of ulinastatin on the expression of c-Jun N-terminal kinase and apoptosis in rats with cerebral ischemia-reperfusion injury
Liu Qingjie*,Bai Hongying
*Department of Neurology,the People’s Hospital of Yongcheng City,Yongcheng 476600,China
ObjectiveTo investigate the effects of ulinastatin on the expression of c-Jun N-terminal kinase (JNK) and apoptosis in rats with cerebral ischemia-reperfusion injury.MethodsThirty-six male clean SD rats were divided into three groups by the random number method:sham operation group (SO group,n=12),cerebral ischemia-reperfusion group (I/R group,n=12),cerebral ischemia-reperfusion plus ulinastatin treatment group (treatment group,n=12).The focal cerebral ischemia-reperfusion injury models were established by using suture-occluded method to block middle cerebral artery.The expression of JNK was detected by using RT-PCR method and the number of apoptosis was detected by TUNEL method.ResultsCompared with the SO group,the treatment group and control group showed high expression of JNK on cortex area and high number of apoptosis (allP<0.05).Both the expression of JNK and the number of apoptosis in the treatment group were significantly less than those in the control group (allP<0.05).ConclusionUlinastatin can down-regulate the expression of JNK in brain tissues and can suppress apoptosis which may be related to inhibit JNK conduction path.
Ulinastatin;Ischemia-reperfusion;C-Jun N-terminal kinase;Apoptosis
R-332
A
1673-5110(2017)17-0004-03
10.3969/j.issn.1673-5110.2017.17.002
刘庆杰(1982—),男,硕士,主治医师。研究方向:脑血管病。Email:lqj820@126.com
