T1DM患者直系亲属ZnT-8A、IA-2A、IAA、GADA、ICA检测及3年发病风险分析
2017-10-11李彦青董自杰孙晓慧赵鸿斌
李彦青,董自杰,孙晓慧,赵鸿斌
(1.河北省石家庄市第一医院 检验科,河北 石家庄,050000;2.河北省石家庄市第三医院 检验科,河北 石家庄,050000;3.河北省石家庄市第一医院 生殖医学科,河北 石家庄,050000)
T1DM患者直系亲属ZnT-8A、IA-2A、IAA、GADA、ICA检测及3年发病风险分析
李彦青1,董自杰2,孙晓慧3,赵鸿斌1
(1.河北省石家庄市第一医院 检验科,河北 石家庄,050000;2.河北省石家庄市第三医院 检验科,河北 石家庄,050000;3.河北省石家庄市第一医院 生殖医学科,河北 石家庄,050000)
目的探讨1型糖尿病(T1DM)患者直系亲属ZnT-8A、IA-2A、IAA、GADA、ICA检测及3年发病风险的临床价值。方法采用放射免疫沉淀法检测T1DM患者(n=80)及其直系亲属(n=100)与正常受试者(n=100)血清中锌转运蛋白8抗体(ZnT-8A)阳性率,同时采用免疫印迹试剂法检测胰岛细胞抗体(ICA)、谷氨酸脱羧酶抗体(GADA)、蛋白酪氨酸磷酸酶自身抗体(IA-2A)、胰岛素自身抗体(IAA),对不同组合抗体联合检测效果用ROC曲线评价,同时分析直系亲属中3年发病情况。结果T1DM组患者ZnT-8A、IA-2A、IAA、GADA、ICA血清抗体检出率均显著高于直系亲属组和健康组(P<0.05),且直系亲属组上述血清抗体检出率显著高于健康组(P<0.05)。5种抗体联合检测总阳性率最高为91.25%,其中2种、3种和4种抗体联合总阳性率最高,分别为83.75%、87.5%和90.0%。5种抗体联合检测法的ROC曲线下面积(AUC)最大,各种抗体联合检测法AUC无显著差异,但均显著高于ZnT-8A抗体单独检测(P<0.05)。3年随访调查中2例ZnT-8A和GADA抗体阳性直系亲属被诊断为T1DM,其余个体在随访期间无发病症状。结论5种抗体联合检测能够提高T1DM临床诊断率,其中ZnT-8A和GADA抗体组合检测,对糖尿病及时、准确分型具有重要价值,还可作为T1DM直系亲属流行病学的筛选指标。
T1DM;直系亲属;自身抗体;发病风险
ABSTRACT:ObjectiveTo investigate the clinical value of detection of ZnT-8A,IA-2A,IAA,GADA and ICA and 3-year onset risk in direct relatives of patients with type 1 diabetes mellitus (T1DM).MethodsThe positive rates of serum zinc transporter 8 antibody (ZnT-8A) in T1DM patients (n=80),their direct relatives (n=100) and normal subjects (n=100) were detected by radioimmunoprecipitation assay.The islet cell antibody (ICA),glutamic acid decarboxylase antibody (GADA),protein tyrosine phosphatase autoantibody (IA-2A) and insulin autoantibody (IAA) were detected by Western Blot.The combined detection efficacy of different antibodies was evaluated with ROC curve and the 3-year onset of direct relatives was analyzed.ResultsThe antibodies detection rates of serum ZnT-8A,IA-2A,IAA,GADA and ICA were significantly higher in T1DM group than direct relatives group and healthy group (P<0.05),and the detection rates of above antibodies were significantly higher in direct relatives group than the healthy group (P<0.05).The highest total positive rate detected by the five antibodies was 91.25%,and the highest total positive rates detected by the combination of 2,3 and 4 antibodies were 83.75%,87.5% and 90.0%,respectively.The areaunder ROC (AUC) of the 5 antibodies was the largest but there was no significant difference in AUC among different combinations of antibodies.All positive rates detected by combined antibodies were significantly higher than that of detection of ZnT-8A antibody alone (P<0.05).During 3-year follow-up,direct relatives with ZnT-8A and GADA were diagnosed with T1DM,and there were no symptoms in the other individuals.ConclusionThe combined detection of 5 antibodies can improve the diagnosis rate of T1DM.The combined detection of Zn T-8A and GADA is of great value in timely and accurate classification of diabetes mellitus,and they also can be used as indicators for epidemiological screening of direct relatives of T1DM patients.
KEYWORDS:T1DM:direct relatives;autoantibodies;onset risk
胰岛素依赖性糖尿病即1型糖尿病(T1DM),是由于胰岛素β细胞自身免疫破坏导致胰岛素分泌缺陷所引起的自身免疫性疾病[1]。根据世界卫生组织(WHO)一项多国儿童糖尿病调查项目结果[2]显示,中国儿童(<15岁)T1DM的每年发病率为0.57/10万,虽然发病率较低,但中国糖尿病患者人群基数大,1型糖尿病患者数量庞大。目前研究[3-4]显示,T1DM患者体内常存在多种自身抗体,包括胰岛细胞抗体(ICA)、谷氨酸脱羧酶抗体(GADA)、蛋白酪氨酸磷酸酶自身抗体(IA-2A)、胰岛素自身抗体(IAA)等自身抗体在T1DM发病前数年出现,成为T1DM自身免疫反应的重要预测和诊断标志。目前研究[5]认为,联合GADA、IA-2A、IAA检测能够提高T1DM诊断的敏感性,但仍然存在部分漏诊患者,导致患者采用不适合的治疗方式,从而严重影响患者身心健康,给患者及家庭和社会带来沉重经济负担。
近年来,锌转运蛋白8抗体(ZnT-8A)在新诊断T1DM患者中阳性率高达60%~80%,且在GADA、IA-2A、IAA检测误诊或漏诊患者中还具有26%的阳性率[6]。国内研究[7]报道显示,ZnT-8A在T1DM新发病例和高风险人群(一级亲属)阳性检出率较高,提示ZnT-8A对于T1DM特别是其他自身抗体阴性的患者具有重要的诊断价值。本研究通过检测T1DM患者及其直系亲属与健康人血清ZnT-8A、IA-2A、IAA、GADA和ICA,同时对直系亲属与健康血清中抗体阳性受试者进行为期3年随访调查,分析ZnT-8A、IA-2A、IAA、GADA和ICA抗体发病风险,为T1DM预防和实施早期治疗提供理论基础,现报告如下。
1 资料与方法
1.1 一般资料
选取2012年2月—2014年1月本院收集的T1DM患者80例,所有患者均符合1999年世界卫生组织关于T1DM诊断标准[8],患者有酮症中毒症状表现,经葡萄糖耐量试验(OGTT)和胰岛素释放实验检查显示胰岛素功能异常,其中男54例,女26例,年龄5~58岁,平均年龄(29.54±8.69)岁,发病病程1个月~14年。排除继发性糖尿病、妊娠糖尿病及其他自身免疫性疾病患者。选取100例上述T1DM患者的非糖尿病直系亲属,其中男62例,女38例,年龄11~55岁,平均年龄(28.67±7.69)岁。另选取同期100例体检正常者为健康对照组,其中男59例,女41例,年龄8~54岁,平均(27.38±7.85)岁。对所有正常者进行询问及糖尿病排查,均无家族病史和其他自身免疫性疾病史,空腹和餐后2 h血糖检查正常。所有受试者均取得知情同意,3组受试者在性别构成、年龄无显著性差异(P>0.05),具有可比性。
1.2 方法
分别抽取患者空腹肘静脉血5 mL,快速分离血清后,按照时间顺序编号分别装于0.5 mL试管中,于-80℃冰箱中保存。ZnT-8A采用放射免疫沉淀法进行检测,试剂盒由深圳亚辉龙生物制剂有限公司提供,采用S35标记放射配位体法标记S35-ZnT-8A,用pH值7.4 TBST缓冲液稀释至每分钟脉冲放射计数(CPM)值为20 000 CPM/25 μL,并加入96孔板中,每孔25 μL,然后每孔加入2 μL待测血清,每次检测设置双复孔标本和质控血清,标记抗原与待测血清均匀混合置于4 ℃冰箱中振荡过夜。然后每孔中加入25 μL 50%蛋白A琼脂糖沉淀抗原抗体复合物,盖膜与4℃冰箱中振荡1 h,加入200 μL TBST溶液洗涤PVDF过滤板中沉淀物,真空泵抽干燥后,重复以上操作3次,调换平板方向后,继续洗涤4次,37 ℃干燥箱中烘干,每孔加入50 μL闪烁液-20,置于2450 Microplate Couter闪烁计数仪计数每分钟脉冲数(CPM)值,每孔计数2 min。ZnT-8A抗体指数=(标本CPM值-阴性CPM值)/(阳性CPM值-阴性CPM值),其中>0.015为抗体阳性。
采用免疫印迹试剂法检测GADA、IAA、IA-2A和ICA,试剂盒由深圳伯劳特生物制品有限公司提供,检测仪器为GC-1200γ(安徽中科中佳)计数仪,严格按照试剂盒说明书进行操作。利用聚丙烯酰氨凝胶电泳将GADA、IAA、IA-2A和ICA蛋白抗原按分子量大小依次分开,通过电转移至印迹膜上,与待测血清反应,然后加入含辣根过氧化物酶标记的二抗和显色剂,在相应抗原区带会出现显色带,能够判断各种自身抗体。阳性判断标准:40 Kd、64 Kd及120 Kd条带中其中一条带阳性或同时阳性则ICA阳性,5.8 Kd条带显示阳性则为IAA阳性;65 Kd条带显示阳性则为GADA阳性;125 Kd条带显示阳性则为IA-2A阳性 。同时分别进行2种及以上抗体组合并与ZnT8A单独检测进行诊断试验评价。
1.3 统计学分析
应用SPSS 21.0统计软件进行统计学分析,计量资料采用均数±标准差表示,计数资料采用百分率表示,组间比较采用χ2检验,如某一格的期望值<5则用Fisher精确概率法,采用ROC曲线分析评价诊断试验,曲线下面积比较采用Z检验,检验显著性α=0.05。
2 结 果
2.1 3组受试者血清ZnT-8A、IA-2A、IAA、GADA、ICA检出率比较
T1DM组患者血清ZnT-8A、IA-2A、IAA、GADA、ICA检出率分别为47.5%、36.25%、41.25%、48.75%和36.25%,直系亲属组血清ZnT-8A、IA-2A、IAA、GADA、ICA检出率分别为12.0%、11.0%、8.0%、18.0%和6.0%,健康组血清ZnT-8A、IA-2A、IAA、GADA、ICA检出率分别为1.0%、2.0%、1.0%、2.0%和0%,T1DM组上述血清抗体检出率均显著高于直系亲属组和健康组(P<0.05),且直系亲属组上述血清抗体检出率显著高于健康组(P<0.05)。
2.2 T1DM患者不同血清抗体组合诊断率比较
对80例T1DM患者进行不同血清抗体组合诊断,其中选择2种(ZnT-8A和GADA)、3种(ZnT-8A、AA和GADA)、4种(ZnT-8A、IAA、GADA和ICA)和5种血清抗体组合联合检测的最高阳性率分别为83.75%(67/80)、87.5%(70/80)、90.0%(72/80)和91.25%(73/80)。见表1。
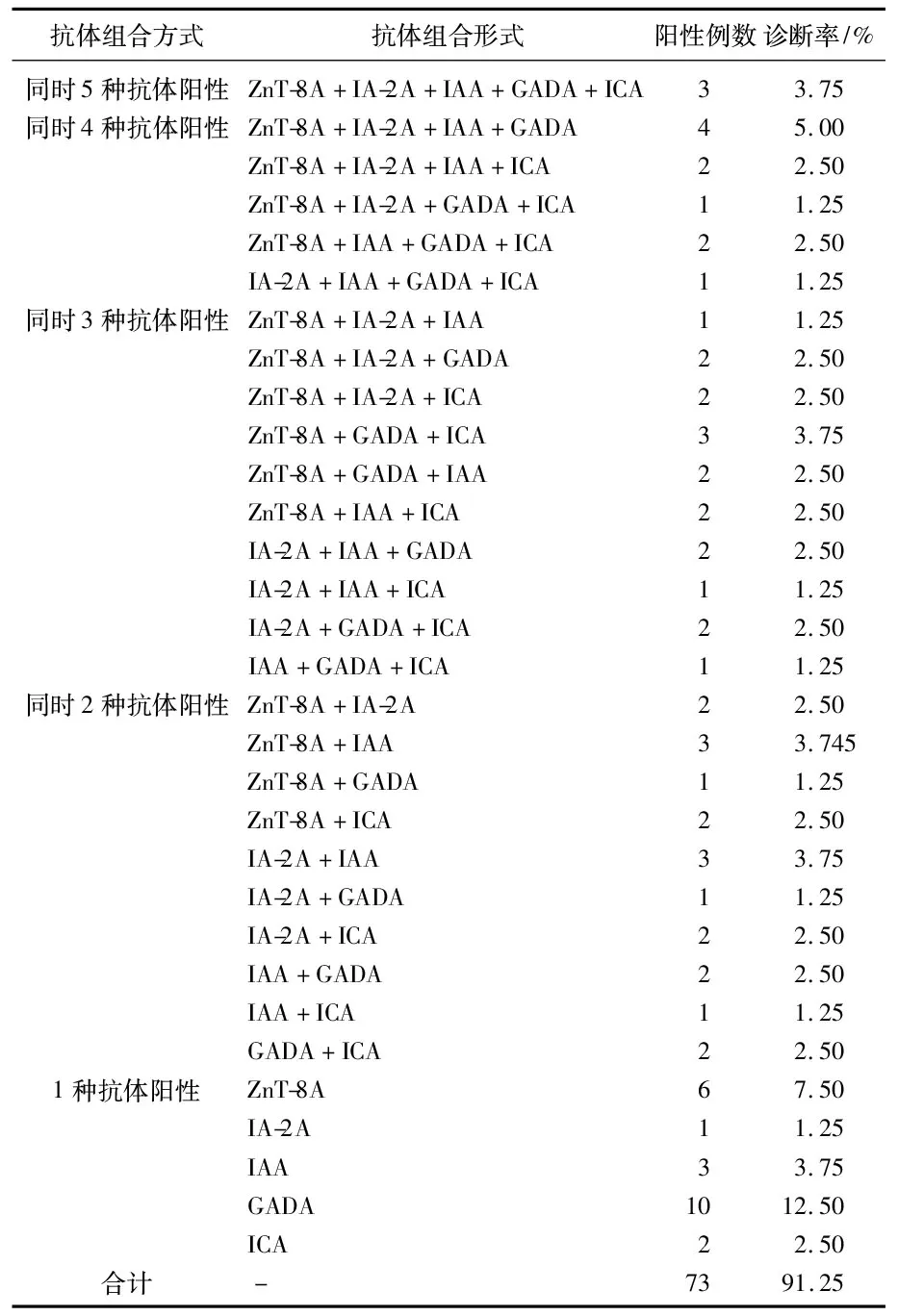
表1 80例T1DM患者各种血清抗体组合诊断率比较
2.3 多种抗体联合检测效果比较
将ZnT-8A单侧检测和多种抗体联合检测法的诊断率进行比较,经ROC曲线分析显示,ZnT-8A+IA-2A+IAA+GADA+ICA联合检测法的ROC曲线下面积(AUC)最大,为0.807,将单独ZnT-8A抗体检测与ZnT-8A联合一种或以上抗体检测法的AUC进行Z检验比较,单独ZnT-8A抗体检测与ZnT-8A联合一种或以上抗体检测法的AUC均有显著差异(P<0.05),而各种联合检测法AUC差异均无统计学意义(P>0.05)。见表2。

表2 多种抗体联合检测效果比较
2.4 直系亲属人群抗体阳性3年内发病风险分析
100例T1DM患者直系亲属个体中,ZnT-8A阳性12例,IA-2A阳性11例,IAA阳性8例,GADA阳性18例,ICA阳性6例,其中2例患者为2种抗体(ZnT-8A和GADA)阳性。3年随访调查中发现,1例患者在随访20个月被诊断为T1DM,另1例患者在随访25个月被诊断为T1DM,其余抗体阴性的直系亲属个体在随访期间无发病症状。
3 讨 论
Ⅰ型糖尿病分为自身免疫性和特发性两种亚型,确诊自身免疫性糖尿病依赖于患者外周血检测胰岛β细胞抗原特异性自身抗体,目前检测包括GADA、ICA、IA-2A、IAA和ZnT-8A等抗体指标[9]。在谷氨酸代谢转变成γ氨基丁酸(GABA)过程中,谷氨酸脱酸酶(GAD)发挥着限速酶作用,而GADA作为T1DM患者早期出现的抗体之一,患者表现出典型临床症状前就长时间存在于机体内[10]。研究[11]显示,GADA早期出现会抑制GAD的作用,使抑制性神经递质生成受到抑制,导致胰岛细胞功能受损,因此临床上对于GADA检测能够作为胰岛素细胞受损指标之一。于磊等[12]研究显示,在成年人糖尿病患者的随机调查中发现,81%GADA患者在10年后仍然保持GADA阳性,且在初次诊断T1DM患者中阳性率可达60%~80%。ICA作为一种血清中免疫球蛋白,通过结合胰岛细胞浆成分或微粒对胰岛细胞产生毒性作用,是T1DM发生、发展、演变的标志性抗体、也是1型糖尿病的诊断依据之一,常作为β细胞的自身免疫损害指标之一,起病初期阳性检出率较高,但随着病程延长,TCA阳性检出率明显下降[13-14]。
IA-2A属于蛋白酪氨酸磷酸酶样跨膜蛋白,为T1DM患者ICA重要组成成分,主要结合相对分子大小为40 KD的胰岛细胞抗原或微粒,在青少年T1DM患者发病初期IA-2A阳性检出率较高,随着年龄增长其阳性检出率较低,但在机体存在时间较长[15]。IAA主要与胰岛素进行特异性结合形成抗原抗体复合物,使胰岛素失去生物活性,临床IAA检测可以为T1DM治疗及其预后提供指导,同时也是胰岛素药物治疗的敏感性指标之一[16]。何应中等[17]报道显示,国内不同年龄段儿童及青少年T1DM患者IAA阳性检出率存在显著差异,<2岁儿童IAA阳性检出率为85%,2~5岁儿童IAAA阳性检出率为70%,而5~15岁年龄段T1DM患者IAA阳性检出率仅为40%。ZnT-8A是新发现的一种T1DM自身抗原,主要由胰岛β细胞表达,其Zn2+与胰岛素分泌代谢有密切联系,其中机制为将Zn2+从细胞质中运输到胰岛素分泌囊泡中,2个Zn2+和6个胰岛素分子结合形成胰岛素结晶形式分泌出囊泡[18]。Zn在胰岛素产生和分泌等方面起到调节作用,在胰岛素合成和成熟过程中起着重要作用,同时能够激活胰岛中相邻A细胞内K-ATP通道导致胰高血糖素合成受到抑制[19]。张成诗等[20]研究显示,在2岁T1DM患者血清中能够检测到ZnT-8A表达,说明患者从出生至T1DM进展过程中,ZnT-8A表达逐渐呈现上升的趋势。
本研究结果显示,在T1DM患者及其直系亲属中,ZnT-8A、IA-2A、IAA、GADA和ICA这5种抗体以GADA抗体检出率最高,其次为ZnT-8A,而IA-2A、IAA和ICA抗体在T1DM检出率均显著高于直系亲属检出率,说明ZnT-8A和GADA抗体在T1DM患者中较常见,ZnT-8A和GADA作为T1DM患者高度特异性蛋白,在T1DM患者胰岛素功能评估及预后具有重要意义。本研究通过对ZnT-8A抗体单独检测和多种抗体组合检测的诊断效率进行评价,结果显示各种抗体检测互有交叉重叠,具有多种抗体组合形式,检测抗体种类越多,检出率越高,同时在T1DM患者IA-2A、IAA、GADA和ICA均呈阴性时,而ZnT-8A单独呈现阳性例数为6例(8.22%),说明单独对ZnT-8A的检测可使T1DM自身抗体阴性的患者率降低。ZnT-8A单独检测及联合1种、2种、3种和4种抗体联合检测时,其AUC值分别为0.654、0.724、0.758、0.769和0.807,而临床上中等诊断准确度AUC值必须达到0.7以上,说明单独对ZnT-8A进行检测,并不能达到临床诊断的标准,应该联合其他抗体进行检测,根据ROC曲线分析得到,检测抗体种类越多,AUC值越大,诊断准确率越高,其中对ZnT-8A、IA-2A、IAA、GADA、ICA抗体联合检测阳性率高达91.25%。根据多种抗体联合检测诊断率比较,而2种、3种、4种和5种抗体检测准确率无显著差异(P>0.05),虽然5种抗体联合诊断准确率较高,容易增加临床实际工作和增加患者经济负担,且与其他组合诊断检测多有重合,因此在临床诊断过程中优先选择GADA和ZnT-8A联合检测。刘香萍等[21]研究结果显示,ZnT-8A联合检测T1DM患者GADA、IAA和IA-2A自身抗体检测能够提高自身免疫性的总阳性率,且对未表现出明显风险因素的个体进行单个T1DM自身抗体能够增加预测价值,提示ZnT-8A联合多种抗体检测对发病后患者胰岛素功能破坏和评估干预β细胞特异性自身反应或重建β细胞具有重要诊断作用。通过对100例T1DM患者直系亲属个体中血清中抗体检测发现,ZnT-8A阳性12例,IA-2A阳性11例,IAA阳性8例,GADA阳性18例,ICA阳性6例,其中2例患者为2种抗体(ZnT-8A和GADA)阳性,并在3年随访调查中发现,1例患者在随访20个月被诊断为T1DM,另1例患者在随访25个月被诊断为T1DM,说明ZnT-8A和GADA抗体联合检测对T1DM诊断和发病风险预测具有重要临床价值。临床上能够及时和准确预测T1DM的发生,对尚未出现典型症状患者进行早期干预,能够预防胰岛素进一步受到损害,最大程度保持胰岛β细胞体积,阻止或减缓T1DM发生和发展。
综上所述,临床上仅仅对某一种抗体进行检测,可能存在检测手段的局限性,同时考虑T1DM患者发病过程,不同血清抗体出现时间及其检测特异性不一致,在检测过程中可能存在误诊或漏诊情况。ZnT-8A、IA-2A、IAA、GADA和ICA联合检测能够提高临床诊断率,而考虑到临床实际工作和经济因素,可以优先考虑ZnT-8A和GADA联合检测,不仅可以提高实验室的诊断率,对糖尿病早期准确分型具有重要价值,同时也可以作为T1DM直系亲属发病风险预估的指标之一。
[1] 毛佳,顾榕,杨涛.1型糖尿病胰岛功能保护的治疗前景[J].中华糖尿病杂志,2013,5(2):68-72.
[2] 毛凤星,栗达.儿童青少年1型糖尿病的营养治疗[J].中国临床医生,2015,43(10):9-12.
[3] 冯希云,任艳杰,赵跃斌,等.胰岛自身抗体与抗内皮细胞抗体在糖尿病中的研究进展[J].中国药物与临床,2016,16(7):1009-1010.
[4] 杨敏,辛颖,张丽华,等.1型糖尿病患儿胰岛自身抗体与甲状腺自身免疫的关系[J].实用儿科临床杂志,2012,27(20):1572-1575.
[5] 黄干,杨涛,刘煜,等.中国胰岛自身抗体检测标准化计划报告:检测方法调查及准确性评估[J].中国糖尿病杂志,2016,8(12):723-728.
[6] 邹婧,刘煜.锌转运蛋白8表位与1型糖尿病的研究进展[J].中华糖尿病杂志,2015,7(4):263-265.
[7] 汪茂荣,姚平.2型糖尿病家系非糖尿病一级亲属代谢综合征及相关组分患病率的临床研究[J].中国糖尿病杂志,2014,22(11):984-986.
[8] 廖春梅.成人隐匿性自身免疫性糖尿病的临床特征分析[J].医学临床研究,2013,30(12):2414-2417.
[9] 张青青,顾愹,杨涛.胰岛自身抗体检测及其临床应用[J].广东医学,2012,33(18):2703-2705.
[10] 刘秀娟,陈江平,梁淑英,等.糖尿病患者谷氨酸脱羧酶抗体测定的价值[J].国际医药卫生导报,2012,18(5):609-611.
[11] 罗说明,黄干,李霞,等.不同胰岛自身抗体阳性1型糖尿病临床特征分析[J].中国实用内科杂志,2012,32(1):49-52.
[12] 于磊,金国玺,毕娅欣,等.糖尿病自身抗体监测在GADA阳性LADA诊治中的意义[J].中华全科医学,2013,11(1):33-35.
[13] 李翠,李丽.胰岛自身抗体测定对糖尿病分型的临床意义[J].现代中西医结合杂志,2013,22(1):85-86.
[14] 周晖,李正康,徐晓明,等.胰岛自身抗体和生化指标在糖尿病分型诊断中的应用价值[J].重庆医学,2016,45(21):2909-2913.
[15] 施云,沈捷,顾愹,等.1型糖尿病患者人类白细胞抗原Ⅰ类基因与胰岛功能及胰岛自身抗体的关系[J].中华糖尿病杂志,2013,5(7):392-397.
[16] 顾熔,王知笑,杨慧,等.中国汉族1型糖尿病HLA基因与4种胰岛自身抗体关系的研究[J].中国糖尿病杂志,2012,20(12):881-888.
[17] 何应中,韩昵薇,邹焰,等.5种胰岛自身抗体在糖尿病患者血清中检测的临床意义[J].国际检验医学杂志,2015,36(6):768-769.
[18] 黄干,孙贵中,杨琳,等.锌转运体8自身抗体和蛋白酪氨酸磷酸酶自身抗体对成人隐匿性自身免疫糖尿病患者胰岛功能的影响[J].中华医学杂志,2015,95(20):1563-1567.
[19] 马昂,王丽宏,车慧,等.成人隐匿性自身免疫糖尿病血清学抗体的诊断意义[J].东南大学学报:医学版,2015,34(5):825-827.
[20] 张成诗,吴兵,魏光明.糖尿病自身抗体联合检测在糖尿病分型中的应用价值研究[J].中国实验诊断学,2014(6):931-933.
[21] 刘香萍,郑信华,陈莉萍,等.锌转运体8自身抗体在1型糖尿病诊断及风险预测中的应用[J].广东医学,2013,34(3):378-380.
DetectionofZnT-8A,IA-2A,IAA,GADAandICAand3-yearonsetriskofdirectrelativesofpatientswithtype1diabetesmellitus
LIYanqing1,DONGZijie2,SUNXiaohui3,ZHAOHongbin1
(1.ClinicalLaboratory,ShijiazhuangFirstHospital,Shijiazhuang,Hebei,050000;2.ClinicalLaboratory,ShijiazhuangThirdHospital,Shijiazhuang,Hebei,050000;3.DepartmentofReproductiveMedicine,ShijiazhuangFirstHospital,Shijiazhuang,Hebei,050000)
R 587.1
A
1672-2353(2017)17-026-05
10.7619/jcmp.201717008
2017-02-18
赵鸿斌
