花生壳基和木屑基生物炭对离子型染料和Pb(Ⅱ)的吸附性能研究*
2017-10-11徐雪斌丁竹红陈逸珺
徐雪斌 丁竹红# 胡 忻 陈逸珺
(1.南京工业大学环境科学与工程学院,江苏 南京 211816;2.生命分析化学国家重点实验室,南京大学现代分析中心,江苏 南京 210093)
花生壳基和木屑基生物炭对离子型染料和Pb(Ⅱ)的吸附性能研究*
徐雪斌1丁竹红1#胡 忻2陈逸珺2
(1.南京工业大学环境科学与工程学院,江苏 南京 211816;2.生命分析化学国家重点实验室,南京大学现代分析中心,江苏 南京 210093)
采用花生壳和木屑为原材料分别在300、600 ℃限氧条件下热裂解制备4种生物炭,研究了其对阳离子型染料亚甲基蓝(MB)、阴离子型染料刚果红(CR)和重金属Pb(Ⅱ)的吸附等温线和吸附动力学效应以及生物炭上Pb(Ⅱ)的解吸再生效应。结果表明,相比Freundlich方程,生物炭对MB和Pb(Ⅱ)的吸附等温线更符合Langmuir方程。其中,生物炭对MB的吸附受到表面含氧官能团和平均孔径影响,对Pb(Ⅱ)的吸附机制以离子交换或共沉淀为主。相比Langmuir方程,生物炭对CR的吸附等温线更符合Freundlich方程,吸附机制主要以疏水作用为主。300 ℃热裂解花生壳制备的生物炭对MB吸附效果最好,最大吸附量达28.0mg/g;600 ℃热裂解制备的生物炭对CR吸附效果最好;300、600 ℃热裂解花生壳制备的生物炭对Pb(Ⅱ)吸附效果均较好,最大吸附量分别为63.7、73.2mg/g。生物炭对MB、CR和Pb(Ⅱ)的吸附基本在24h内达到平衡,相比准一级动力学模型,吸附过程均更符合准二级动力学模型。0.1mol/L盐酸能有效解吸4种生物炭吸附的Pb(Ⅱ)。生物炭的吸附效果和吸附机制与生物炭制备时的热裂解温度和原材料种类关系密切。
生物炭 染料Pb(Ⅱ) 吸附 解吸
Abstract: Biochars were derived from peanut shell and saw dust through the pyrolysis under limited-oxygen condition at 300 ℃ and 600 ℃,respectively. Adsorption isotherm and kinetics of cationic dye methylene blue (MB),anionic dye Congo red (CR) and heavy metal Pb(Ⅱ) onto biochars,as well as desorption of Pb(Ⅱ) from biochars were investigated. Results showed that isothermal adsorption curves of MB and Pb(Ⅱ) onto biochars were better consistent with Langmuir model while CR better obeyed Freundlich model. The adsorption capacity of MB onto biochars was affected by the number of surface functional groups and the average pore diameter of biochars. The adsorption mechanism of Pb(Ⅱ) onto biochars was ionic interaction or coprecipitation. The adsorption mechanism of CR was hydrophobic reaction. The biochar derived from peanut shell under 300 ℃ was the optimum adsorbent on MB and its maximum adsorption capacity was 28.0 mg/g. The biochar derived under 600 ℃ had the optimum adsorption effects on CR. Biochars derived from peanut shell under 300 ℃ and 600 ℃ were the optimum adsorbent on Pb(Ⅱ) and their adsorption capacity were 63.7,73.2 mg/g,respectively. Adsorption of MB,CR and Pb(Ⅱ) onto biochar reached equilibrium in 24 h basically and the process better obeyed the pseudo-second-order kinetic model compared with pseudo-first-order kinetic model. The adsorbed Pb(Ⅱ) could be desorbed when treated with 0.1 mol/L HCl. The adsorption capacity of MB,CR and Pb(Ⅱ) onto biochars were closely related to the pyrolysis temperature and types of raw materials.
Keywords: biochar; dye; Pb(Ⅱ); adsorption; desorption
水体污染是我国严重的环境问题之一[1]。因而污水治理的新技术和新方法一直是环境研究广泛关注的热点领域[2]。近年来生物炭在污水治理等领域的应用受到广泛的关注。生物炭是一种难溶、稳定、高度芳香化且富含碳素的黑色蓬松状固态物质[3],具有制备成本低、原料来源广、过程简单、可资源化等优点[4]。生物炭制备原料包括秸秆、稻壳、果壳、排泄物、木屑、竹屑、泥屑等[5-9]。生物炭表面具有多级孔隙结构和丰富的有机含氧官能团,且比表面积较大,在吸附重金属类污染物方面具有巨大潜能[10-13]。同时,生物炭表面电荷密度高[14],对有机污染物也有较好的吸附效果[15]。生物炭对水中有机物或重金属的吸附研究已有报道[16-17],但目前缺少将生物炭对有机物和重金属吸附的比较及其吸附机制的研究。
本研究选取了花生壳和木屑两种生物质原料,分别在300、600 ℃热裂解制备了4种生物炭,研究了其对重金属Pb(Ⅱ)、阳离子染料亚甲基蓝(MB)以及阴离子染料刚果红(CR)的吸附能力,并探究其吸附机制,为开发低成本高效新型吸附剂提供理论依据,也为农林废弃物的资源化利用提供有益帮助。
1 材料与方法
1.1 实验材料
MB(分子式为C16H24ClN3O3S,分子量为373.9,溶于水后呈阳离子形态)和CR(分子式为C32H22N6Na2O6S2,分子量为696.7,溶于水后呈阴离子形态)均为分析纯,且均以超纯水配置成2 000 mg/L储备液。利用Pb(NO3)2(分析纯)和超纯水配置5 000 mg/L Pb(Ⅱ)储备液。
实验所用生物炭原料花生壳和木屑分别来自田间和锯木场。原料清洗后置于烘箱70 ℃恒温干燥24 h,烘干后进行粉碎;再置于马弗炉中以N2为载气,分别以300、600 ℃热裂解2 h;取出后用蒸馏水充分洗涤直至洗涤液清澈;用尼龙筛网过滤后置于烘箱70 ℃恒温干燥,保存待用。花生壳和木屑经300、600 ℃热裂解制备的生物炭分别记为PN3、PN6、SD3和SD6。
1.2 测定方法
采用BET比表面积分析仪(ASAP2020)测定比表面积、孔径和孔隙容积;采用元素分析(EA)仪(Vario MICRO)测定C、H、N含量;采用Boehm滴定法测定表面含氧官能团含量;采用傅立叶红外光谱(FT-IR)仪(NEXUS870)测定红外图谱;采用电荷漂移法测定零电荷点;将生物炭灰化后并用王水消解,使用电感耦合等离子发射光谱(ICP-OES)仪(Optima 5300DV)测定消解液中金属元素浓度,从而计算生物炭中金属元素含量;采用ICP-OES仪直接测定Pb(Ⅱ)浓度;采用紫外—可见光分光光度计(T-6)测定MB(波长663 nm、pH=7.0)和CR(波长448 nm、pH=7.3)浓度。
1.3 实验方法
1.3.1 吸附等温线实验
配制1、5、10、20、30、50 mg/L Pb(Ⅱ)溶液用于SD3和SD6吸附;配制20、30、50、100、200、300、500 mg/L Pb(Ⅱ)溶液用于PN3和PN6吸附;配制5、25、50、75、100、150 mg/L MB和CR溶液用于PN3、PN6、SD3和SD6吸附。根据文献报道,生物炭吸附MB的最佳pH为7.0~9.0,吸附CR的最佳pH为5.0~8.0,吸附Pb(Ⅱ)的最佳pH为4.5~5.5[18-21]。本实验中吸附质初始溶液的pH符合以上范围,因而不用调节初始溶液pH。将0.05 g生物炭与25 mL吸附质溶液于50 mL离心管中混合,在(22±1) ℃条件下反应24 h,测定平衡溶液的Pb(Ⅱ)、MB和CR浓度以及pH。同时,设置空白样,空白样中0.05 g生物炭与25 mL去离子水混合,调节pH至4.5~5.5,在相同条件下反应24 h。实验所获得的数据通过Langmuir方程和Freundlich方程拟合,其计算公式分别见式(1)和式(2)。
ce/Qe=1/(QmKL)+ce/Qm
(1)
lnQe=lnKF+(1/n)lnce
(2)
式中:ce为平衡质量浓度,mg/L;Qe为平衡吸附量,mg/g;Qm为最大吸附量,mg/g;KL为Langmuir吸附平衡常数,L/mg;KF为Freundlich吸附平衡常数,mg1-1/n·L1/n/g;n为与吸附强度相关的特征常数。
1.3.2 吸附动力学实验
设置吸附时间为1、5、10、20、30、60、120、240、480、960、1 440 min,MB、CR和Pb(Ⅱ)溶液初始质量浓度分别为200、25、100 mg/L(若吸附质吸附较慢,可适当延长吸附时间)。将0.05 g生物炭与25 mL吸附质溶液于50 mL离心管中混合,在(22±1) ℃条件下反应,于设置的时间点取样测定MB、CR和Pb(Ⅱ)浓度及pH。实验所测的数据通过准一级动力学模型和准二级动力学模型拟合,其计算公式分别见式(3)和式(4)。
ln(Qe-Qt)=lnQe-k1×t
(3)
t/Qt=1/(k2×Qe2)+t/Qe
(4)
式中:Qt为t时刻的吸附量,mg/g;t为吸附时间,h;k1为准一级吸附动力学常数,h-1;k2为准二级吸附动力学常数,g/(mg·h)。
1.3.3 Pb(Ⅱ)解吸实验
吸附饱和的生物炭用超纯水清洗3遍,离心,烘干,加入0.1 mol/L的盐酸5 mL,在(22±1) ℃下洗脱1 h,洗脱两次,测定解吸液中Pb(Ⅱ)浓度,并计算解吸效率。
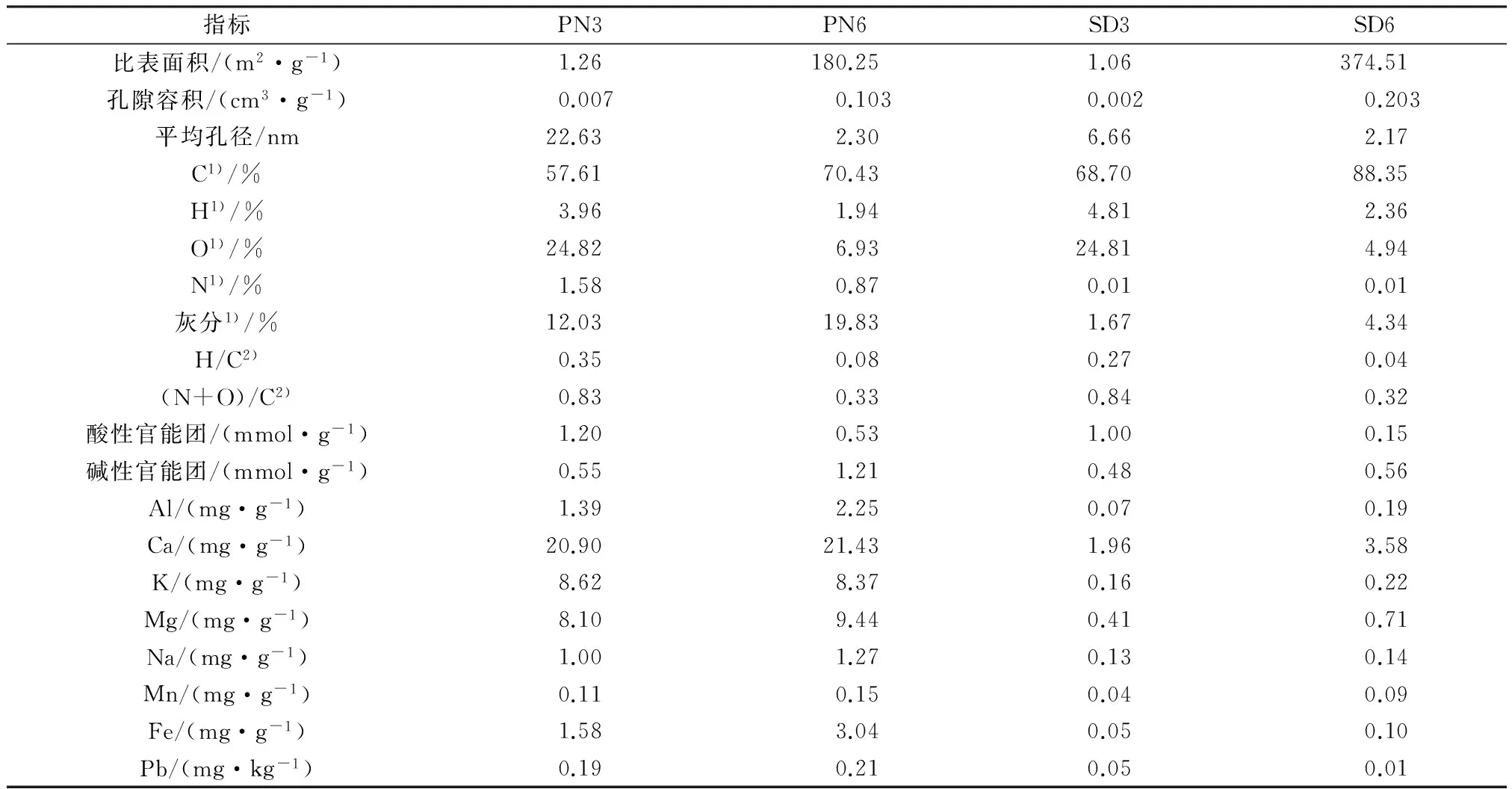
表1 生物炭基本理化性质
注:1)C、H、O、N和灰分均以质量分数计,O质量分数由差减法算得;2)H/C和(N+O)/C为摩尔比。
2 结果与分析
2.1 生物炭表征
2.1.1 基本理化性质
生物炭的基本理化性质见表1。由表1可以看出,4种生物炭的平均孔径介于2~50 nm,这说明其孔结构主要为中孔。生物炭的孔径都随着热裂解温度的升高而减小。在热裂解温度为300 ℃时,花生壳和木屑基生物炭的平均孔径差异较大,这可能是纤维素、木质素等物质还未完全碳化,从而导致生物炭平均孔径主要由原料本身性质决定。在热裂解温度为600 ℃时,花生壳基和木屑基生物炭的平均孔径差异较小,此时原料中的纤维素、木质素等物质已完全碳化,孔径较大的结构已破裂。
4种生物炭的C质量分数均大于50%。其中,C最高的为SD6(88.35%);H最高的为SD3(4.81%),N最高的为PN3(1.58%)。花生壳基和木屑基生物炭随着热裂解温度升高,C质量分数均随之升高,但木屑基生物炭上升幅度更大,这是因为花生壳中无机矿物含量较高,而无机矿物可通过吸附作用与有机质形成致密的复合体,从而对有机碳起到物理保护作用,使花生壳中有机质的碳化程度低于木屑[22]。
H/C可以反映芳香族的C含量[23],(N+O)/C可以评估生物炭表面的亲水性和极性[24]。根据H/C和(N+O)/C可以看出,600 ℃热裂解的生物炭的H/C和(N+O)/C较低,相比300 ℃热裂解的生物炭,表面极性官能团损失,逐渐形成高度碳化的芳香环结构[25],且亲水性大大降低。
随着热裂解温度升高,生物炭表面酸性官能团含量降低,碱性官能团含量升高。花生壳基和木屑基生物炭中的金属含量也有所不同。
2.1.2 FT-IR分析
4种生物炭的FT-IR分析结果如图1所示。300 ℃热裂解的生物炭在1 031 cm-1处出现芳香族C—O键的伸缩振动峰,而600 ℃热裂解的生物炭并未出现此峰,这说明随着热裂解温升高,生物炭中纤维素和半纤维素显著减少[26]。SD3在1 693 cm-1处出现了木质素中C=C键的伸缩振动峰,SD6却并未出现此峰,说明随着热裂解温升高,木质素显著减少。300 ℃热裂解的生物炭在1 430~1 604 cm-1处出现了一系列—COOH振动峰;在2 927 cm-1处出现—CH2—的振动峰,而这些振动峰在600 ℃热裂解的生物炭中并未出现,这说明600 ℃热裂解的生物炭的非极性组分和非极性键消失[27]。300 ℃热裂解的生物炭在3 436 cm-1处出现—OH的伸缩振动峰,而600 ℃热裂解的生物炭并未出现此峰,说明600 ℃热裂解的生物炭已经脱去—OH。此外,600 ℃热裂解的生物炭在890 cm-1附近出现芳香族C—H键的振动峰,说明此时生物炭存在芳香环。总体来看,600 ℃热裂解的生物炭中含氧官能团大量减少,芳香环结构形成。

图1 生物炭的FT-IR图谱Fig.1 FT-IR spectra of biochars
2.1.3 零电荷点分析
测定零电荷点时,绘制了初始pH与终止pH的折线图,如图2所示,随着初始pH升高,终止pH随之升高,并大致在5.0~10.0达到暂时平衡,但在终止pH大于10后又开始增加。由图2可以看出,SD3和SD6的零电荷点大约在6.0附近,PN3的零电荷点大约在8.5,PN6的零电荷点大约在10.0。
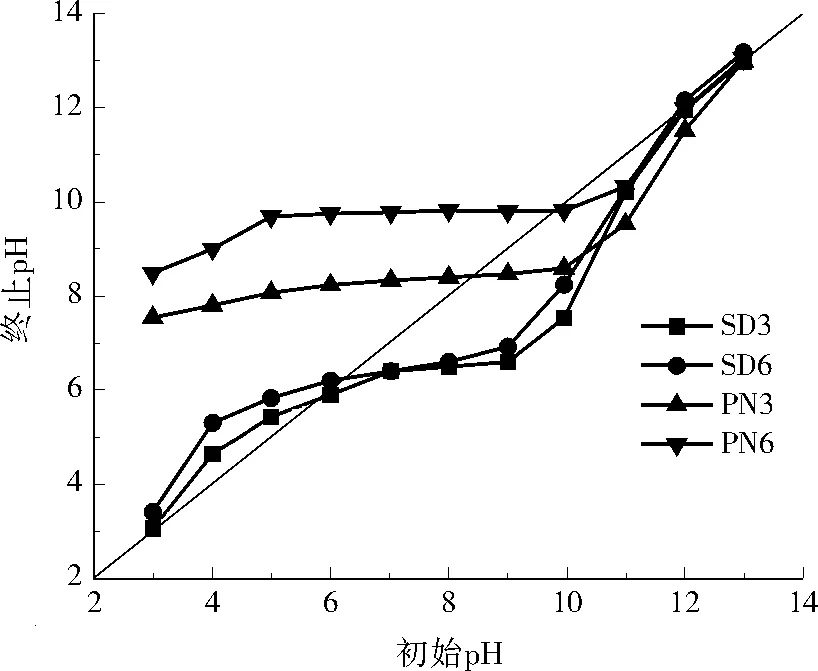
注:图中斜线为pH平分线(初始pH=终止pH),折线与斜线的交点即为零电荷点。
图2生物炭的零电荷点
Fig.2 Zero charge point of biochars
2.2 生物炭吸附实验
2.2.1 吸附等温线
4种生物炭吸附MB、CR和Pb(Ⅱ)的吸附等温线如图3所示。4种生物炭对MB的平衡吸附量随着平衡浓度升高而升高,然后趋于稳定。4种生物炭对MB的平衡吸附量表现为PN3>PN6>SD6>SD3,其中PN3对MB的最大吸附量达到了28.0 mg/g。相比Freundlich方程,Langmuir方程能更好地描述生物炭对MB的吸附等温线(见表2)。结合生物炭表征结果推断,生物炭对MB的吸附效果受到生物炭表面含氧官能团和平均孔径影响。4种生物炭中PN3的H/C最高,(N+O)/C较高,说明PN3中含有较多的—OH、—COOH,能与MB结合;且PN3的平均孔径最大,MB更易进入PN3内部与PN3表面活性基团结合。
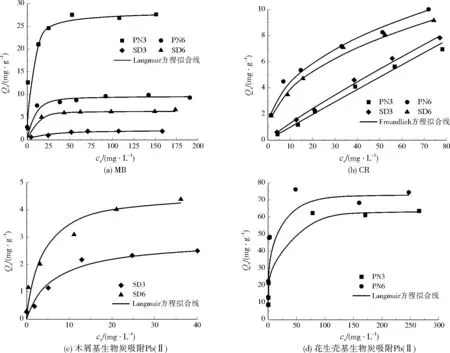
图3 生物炭吸附MB、CR、Pb(Ⅱ)的吸附等温线Fig.3 Adsorption isotherm curves of MB,CR and Pb(Ⅱ) onto biochars
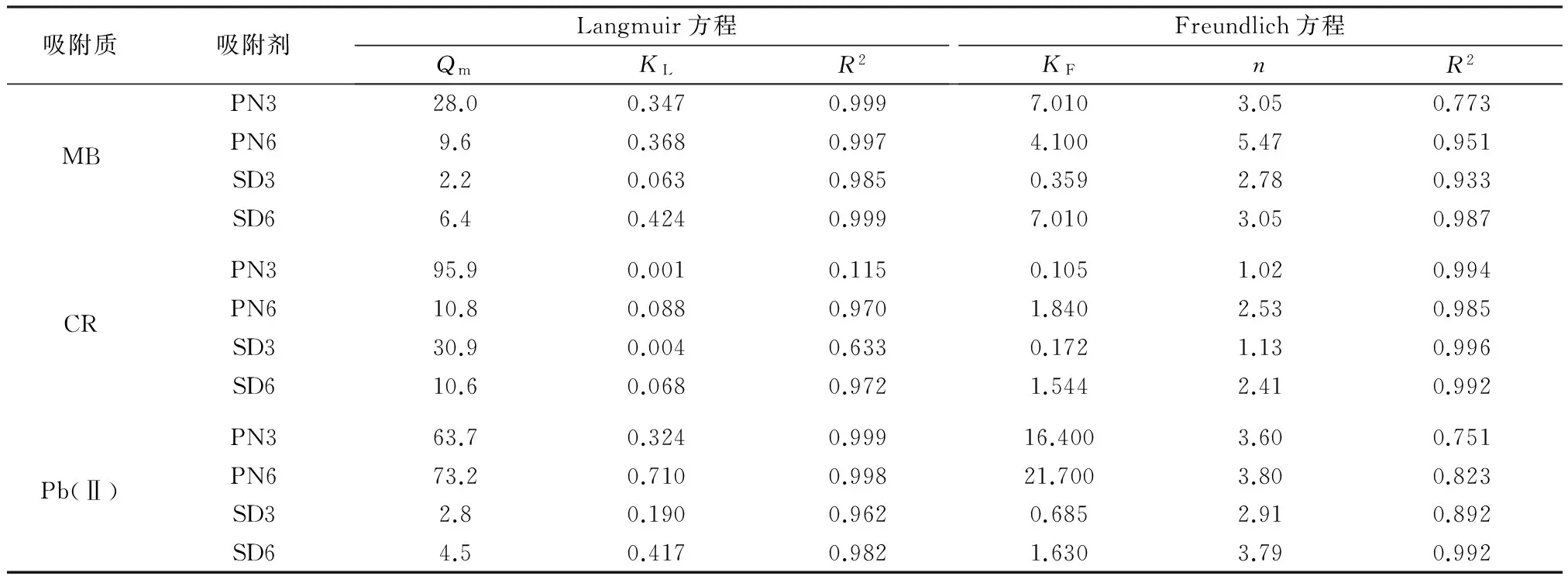
吸附质吸附剂Langmuir方程QmKLR2Freundlich方程KFnR2PN328.00.3470.9997.0103.050.773MBPN69.60.3680.9974.1005.470.951SD32.20.0630.9850.3592.780.933SD66.40.4240.9997.0103.050.987PN395.90.0010.1150.1051.020.994CRPN610.80.0880.9701.8402.530.985SD330.90.0040.6330.1721.130.996SD610.60.0680.9721.5442.410.992PN363.70.3240.99916.4003.600.751Pb(Ⅱ)PN673.20.7100.99821.7003.800.823SD32.80.1900.9620.6852.910.892SD64.50.4170.9821.6303.790.992
4种生物炭对CR的平衡吸附量随着平衡浓度的升高而升高,且升高速度较快。生物炭对CR的吸附等温线更符合Freundlich方程(见表2)。PN6和SD6的平衡吸附量明显高于PN3和SD3,这可能与生物炭比表面积大小有关。再结合生物炭基本理化性质和FT-IR分析,发现600 ℃热裂解的生物炭芳香环结构较多,疏水性较大,对CR吸附效果也较好,说明生物炭对CR的吸附可能以疏水作用为主。
4种生物炭对Pb(Ⅱ)的吸附平衡量随着平衡浓度升高而升高,然后趋于稳定。生物炭对Pb(Ⅱ)的吸附等温线更符合Langmuir方程(见表2)。花生壳基生物炭对Pb(Ⅱ)的吸附效果要优于于木屑基生物炭,这可能与生物炭的零电荷点有关。PN3和PN6的零电荷点较大,对Pb(Ⅱ)的吸附效果较好,其最大吸附量分别为63.7、73.2 mg/g,而SD3和SD6的最大吸附量分别仅为2.8、4.5 mg/g。生物炭基本理化性质和FT-IR分析发现,PN3和PN6中均含有较多矿质元素,PN6中几乎没有含氧官能团,而PN3中含氧官能团较多,但PN3和PN6的最大吸附量相差不大。此外,花生壳基生物炭吸附过程中,Ca2+、K+、Mg2+和Na+释放总量与Pb(Ⅱ)吸附量几乎相等。以上表明,花生壳基生物炭吸附过程中,矿质元素起主要作用,吸附机制可能为离子交换或共沉淀。
2.2.2 吸附动力学
根据2.2.1节的结果,分别选择对MB、CR和Pb(Ⅱ)吸附效果好的生物炭,研究其吸附动力学。由图4可以看出,生物炭对3种吸附质的吸附量都随着吸附时间的延长而增加直至平衡。在吸附时间未达到3 h时,MB、CR和Pb(Ⅱ)吸附量均迅速增加;吸附时间超过3 h时,MB、CR和Pb(Ⅱ)吸附量均缓慢增加,最终趋于稳定。生物炭对3种吸附质的吸附基本能在24 h内达到平衡。
分别用准一级动力学模型和准二级动力学模型对吸附动力学数据进行拟合,拟合参数见表3。相比准一级动力学模型,生物炭吸附MB、CR和Pb(Ⅱ)均更符合准二级动力学模型。此外,准二级动力学模型计算的饱和吸附量比准一级动力学模型更接近实验值。
2.2.3 Pb(Ⅱ)解吸研究
生物炭吸附MB和CR后,经过再次热裂解,可再次用于吸附;而吸附Pb(Ⅱ)后的生物炭不能通过热裂解方式再生;且Pb(Ⅱ)具有回收利用价值,因此本研究只考虑Pb(Ⅱ)的解吸。用0.1 mol/L的盐酸解吸吸附Pb(Ⅱ)后的4种生物炭,结果如图5所示。PN3、PN6、SD3和SD6的第1次解吸效率分别为74.32%、87.70%、93.97%、91.27%;经过两次解吸,累积解吸效率分别达到86.41%、93.89%、97.49%、95.79%。两次解吸后,大部分Pb(Ⅱ)可以从生物炭上解吸。
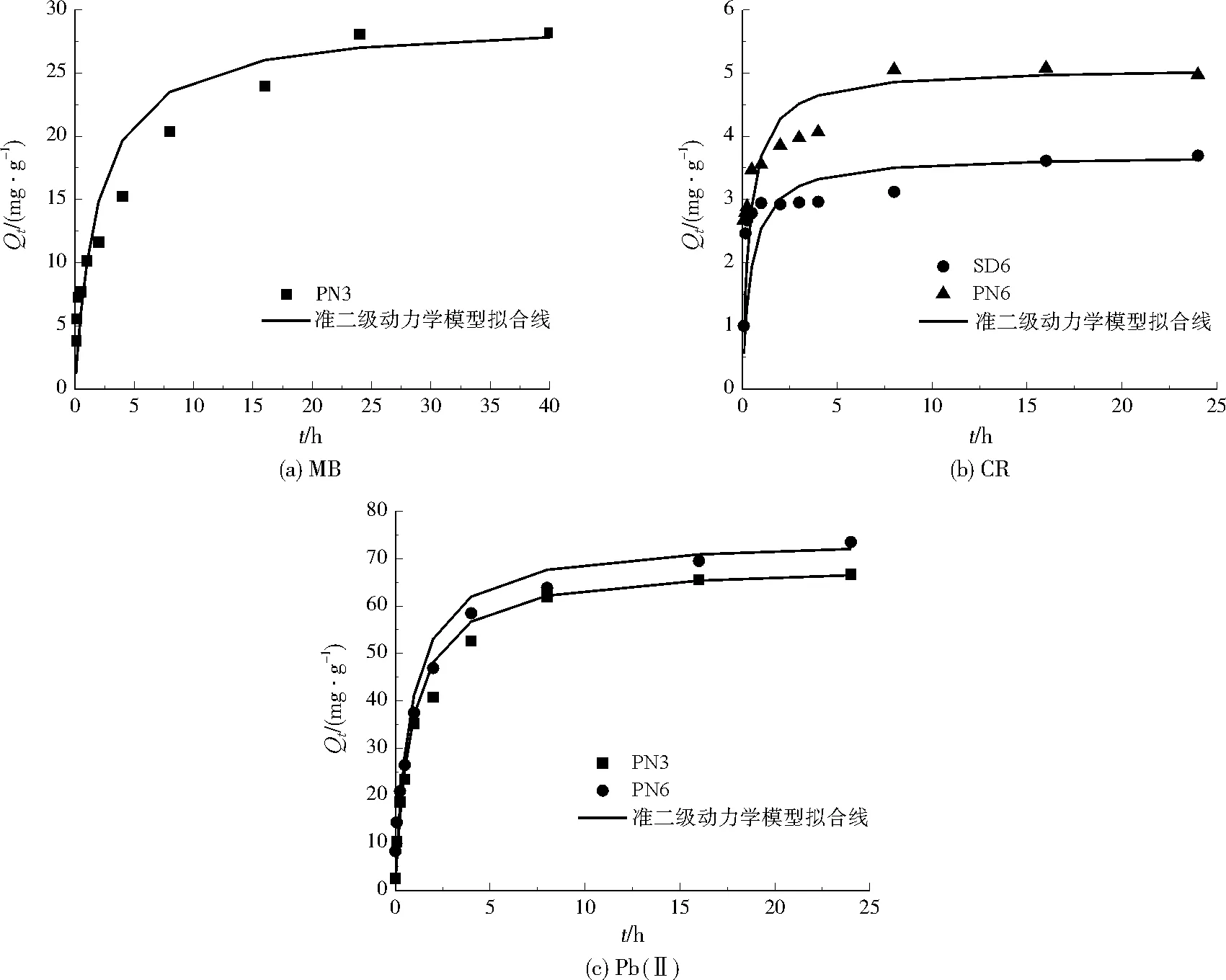
图4 生物炭吸附MB、CR和Pb(Ⅱ)的吸附动力学曲线Fig.4 Adsorption kinetic curves of MB,CR and Pb(Ⅱ) onto biochars
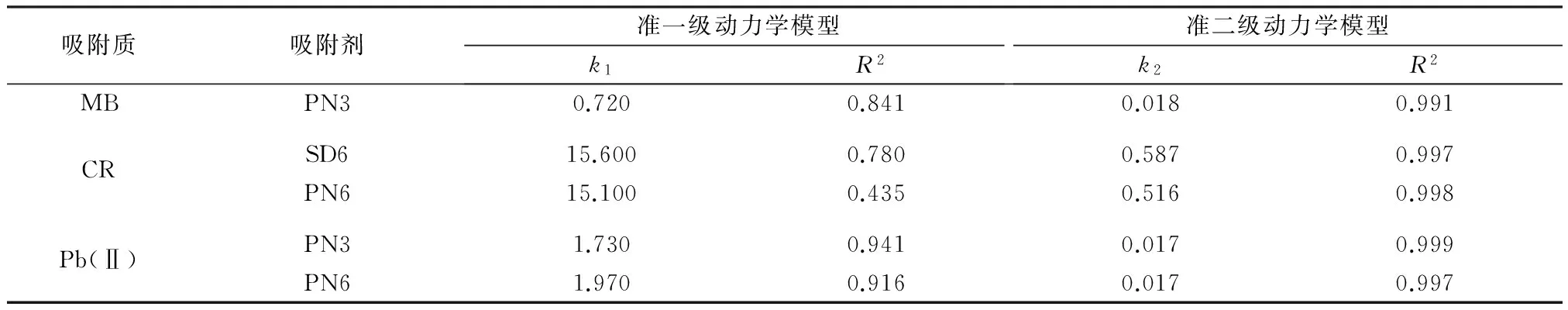
吸附质吸附剂准一级动力学模型k1R2准二级动力学模型k2R2MBPN30.7200.8410.0180.991CRSD615.6000.7800.5870.997PN615.1000.4350.5160.998Pb(Ⅱ)PN31.7300.9410.0170.999PN61.9700.9160.0170.997
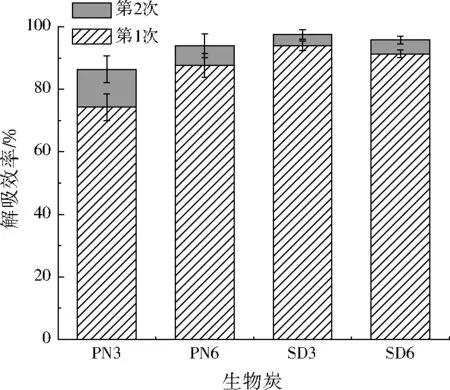
图5 生物炭的Pb(Ⅱ)解吸实验结果Fig.5 Desorption results of Pb(Ⅱ) from biochars
3 结 论
(1) 热裂解温度高的生物炭平均孔径小,表面含氧官能团少,芳香环结构多。
(2) 4种生物炭对MB的吸附更符合Langmuir方程,其中PN3对MB的最大吸附量可达28.0 mg/g。生物炭对MB的吸附可能受到表面含氧官能团和平均孔径影响。
(3) 4种生物炭对CR的吸附更符合Freundlich方程,其中SD6和PN6的吸附效果较好。生物炭对CR的吸附效果可能受比表面积影响,吸附机制主要以疏水作用为主。
(4) 4种生物炭对Pb(Ⅱ)的吸附更符合Langmuir方程,其中花生壳基生物炭吸附效果明显优于木屑基生物炭。花生壳基生物炭吸附Pb(Ⅱ)的可能机制是离子交换或共沉淀。
(5) 生物炭对MB、CR和Pb(Ⅱ)的吸附量随吸附时间的变化更符合准二级动力学方程,且吸附在24 h内基本能达到平衡。
(6) 0.1 mol/L盐酸能有效解吸生物炭吸附的Pb(Ⅱ)。
[1] DING Y,LIU Y G,LIU S B,et al.Competitive removal of Cd(Ⅱ) and Pb(Ⅱ) by biochars produced from water hyacinths:performance and mechanism[J].RSC Advances,2016,6(7):5223-5232.
[2] DING Z H,HU X,ZIMMERMAN A R,et al.Sorption and cosorption of lead(Ⅱ) and methylene blue on chemically modified biomass[J].Bioresource Technology,2014,167(3):569-573.
[3] 林雪原,荆延德,巩晨,等.生物炭吸附重金属的研究进展[J].环境污染与防治,2014,36(5):83-87.
[4] XU X Y,CAO X D,ZHAO L.Comparison of rice husk- and dairy manure-derived biochars for simultaneously removing heavy metals from aqueous solutions:role of mineral components in biochars[J].Chemosphere,2013,92(8):955-961.
[5] LOU L P,LIU F X,YUE Q K,et al.Influence of humic acid on the sorption of pentachlorophenol by aged sediment amended with rice-straw biochar[J].Applied Geochemistry,2013,33(6):76-83.
[6] PARK J H,OK Y S,KIM S H,et al.Competitive adsorption of heavy metals onto sesame straw biochar in aqueous solutions[J].Chemosphere,2016,142:77-83.
[7] PUGA A P,ABREU C A,MELO L A,et al.Cadmium,lead,and zinc mobility and plant uptake in a mine soil amended with sugarcane straw biochar[J].Environmental Science & Pollution Research,2015,22(22):1-9.
[8] SUGASHINI S.Performance of ozone treated rice husk carbon (OTRHC) for continuous adsorption of Cr(Ⅵ) ions from synthetic effluent[J].Journal of Environmental Chemical Engineering,2013,1(1/2):79-85.
[9] INYANG M I,GAO B,YAO Y,et al.A review of biochar as a low-cost adsorbent for aqueous heavy metal removal[J].Critical Reviews in Environmental Science and Technology,2016,46(4):406-433.
[10] CHUN Y,SHENG G Y,CHIOU C T,et al.Compositions and sorptive properties of crop residue-derived chars[J].Environmental Science & Technology,2004,38(17):4649-4655.
[11] NOVAK J M,BUSSCHER W J,LAIRD D L,et al.Impact of biochar amendment on fertility of a southeastern coastal plain soil[J].Soil Science,2009,174(2):105-112.
[12] SOHI S,CLEAT R,GRAHAM M,et al.Long-term balance in heavy metal adsorption and release in biochar derived from sewage sludge[C].Vienna:EGU General Assembly,2014.
[13] CHEN T,ZHOU Z Y,HAN R,et al.Adsorption of cadmium by biochar derived from municipal sewage sludge:impact factors and adsorption mechanism[J].Chemosphere,2015,134:286-293.
[14] LIU B,CHEN L,XIAO J.Black carbon increases cation exchange capacity in soil[J].Soil Science Society of America Journal,2006,70(5):1719-1730.
[15] SMERNIK R J,KOOKANA R S,SKJEMSTAD J O.NMR characterization of13C-benzene sorbed to natural and prepared charcoals[J].Environmental Science & Technology,2006,40(6):1764-1769.
[16] SUN L,CHEN D M,WAN S G,et al.Performance,kinetics,and equilibrium of methylene blue adsorption on biochar derived from eucalyptus saw dust modified with citric,tartaric,and acetic acids[J].Bioresource Technology,2015,198:300-308.
[17] SHI L,ZHANG G,WEI D,et al.Preparation and utilization of anaerobic granular sludge-based biochar for the adsorption of methylene blue from aqueous solutions[J].Journal of Molecular Liquids,2014,198(1):334-340.
[18] 吴海露,车晓冬,丁竹红,等.山核桃、苔藓和松针基生物质炭对亚甲基蓝及刚果红的吸附性能研究[J].农业环境科学学报,2015,34(8):1575-1581.
[19] LI G T,ZHU W Y,ZHANG C Y,et al.Effect of a magnetic field on the adsorptive removal of methylene blue onto wheat straw biochar[J].Bioresource Technology,2016,206:16-22.
[20] 郭素华,许中坚,李方文,等.生物炭对水中Pb(Ⅱ)和Zn(Ⅱ)的吸附特征[J].环境工程学报,2015,9(7):3215-3222.
[21] WANG H Y,GAO B,WANG S S,et al.Removal of Pb(Ⅱ),Cu(Ⅱ),and Cd(Ⅱ) from aqueous solutions by biochar derived from KMnO4treated hickory wood[J].Bioresource Technology,2015,197:356-362.
[22] KNUDSEN J N,JENSEN P A,LIN W G,et al.Sulfur transformations during thermal conversion of herbaceous biomass[J].Energy & Fuels,2004,18(3):810-819.
[23] XIAO X,CHEN Z M,CHEN B L.H/C atomic ratio as a smart linkage between pyrolytic temperatures,aromatic clusters and sorption properties of biochars derived from diverse precursory materials[J].Scientific Reports,2016,6:22644.
[24] 陈静文,张迪,吴敏,等.两类生物炭的元素组分分析及其热稳定性[J].环境化学,2014,33(3):417-422.
[25] 孔露露,周启星.新制备生物炭的特性表征及其对石油烃污染土壤的吸附效果[J].环境工程学报,2015,9(5):2462-2468.
[26] ZHANG G X,ZHANG Q,SUN K,et al.Sorption of simazine to corn straw biochars prepared at different pyrolytic temperatures[J].Environmental Pollution,2011,159(10):2594-2601.
[27] HOSSAIN M K,STREZOV V,CHAN K Y,et al.Influence of pyrolysis temperature on production and nutrient properties of wastewater sludge biochar[J].Journal of Environmental Management,2011,92(1):223-228.
AdsorptionofaqueousionicdyesandPb(Ⅱ)ontobiocharsderivedfrompeanutshellandsawdust
XUXuebin1,DINGZhuhong1,HUXin2,CHENYijun2.
(1.SchoolofEnvironmentalScienceandEngineering,NanjingTechUniversity,NanjingJiangsu211816;2.StateKeyLaboratoryofAnalyticalChemistryforLifeScience,CenterofMaterialAnalysis,NanjingUniversity,NanjingJiangsu210093)
徐雪斌,男,1991年生,硕士研究生,研究方向为重金属和有机污染物的生物炭吸附。#
。
*国家自然科学基金重大研究计划培育项目(No.91543129)。
10.15985/j.cnki.1001-3865.2017.09.001
2016-04-27)
