不同黄化程度对杂柑幼苗生长及光合作用的影响
2017-09-27严巧巧孙国超罗近予汪志辉
熊 博,严巧巧,孙国超,邱 霞,叶 霜,廖 玲,罗近予,代 琳,汪志辉,*
(1.四川农业大学 园艺学院,四川 成都 611130; 2.四川工程职业技术学院,四川 德阳 618000)
不同黄化程度对杂柑幼苗生长及光合作用的影响
熊 博1,严巧巧2,孙国超1,邱 霞1,叶 霜1,廖 玲1,罗近予1,代 琳1,汪志辉1,*
(1.四川农业大学 园艺学院,四川 成都 611130; 2.四川工程职业技术学院,四川 德阳 618000)
为了研究不同黄化程度对柑橘幼苗生长及光合作用的影响,以黄果柑、不知火幼苗为材料,分析黄化苗、花叶苗和绿叶苗的生长量、叶绿素含量、光合及叶绿素荧光参数的变化。结果表明,叶片黄化抑制了幼苗的正常生长,黄化苗的生长量显著低于绿叶苗;黄化苗叶片中游离脯氨酸(Pro)、丙二醛(MDA)、可溶性糖(SS)和可溶性蛋白质(SP)含量均显著增加;叶片黄化显著降低了叶片叶绿素a(Chl a)、叶绿素b(Chl b)、类胡萝卜素(Car)含量和光合作用气体交换参数(气孔导度、胞间CO2浓度、蒸腾速率),改变了叶绿素的组成比例。黄化苗的PSⅡ最大光化学效率(Fv/Fm)、光化学猝灭系数(qP)和非光化学猝灭系数(NPQ)显著低于绿叶苗,导致净光合速率(Pn)显著降低,但花叶苗Fv/Fm下降程度较小。研究表明,叶片黄化抑制了黄果柑、不知火幼苗的正常生长,降低了光合能力。
黄果柑;不知火;黄化;幼苗;光合作用
黄化(etiolation)是指多数植物在黑暗中生长时呈现黄色的现象,在被子植物中广泛存在。植物形态、生长量的变化是黄化对植物伤害的最终反映,叶片黄化导致叶面积减小,从而造成植株矮化[1]、生长势减弱,甚至死亡[2]。
目前,国内外学者的研究重点大多集中在黄化与植物营养关系上。铁营养缺乏易诱发叶片失绿症,导致芒果叶片黄化[3]。罗维钢等[4]研究表明,宿根蔗黄化苗根系活力微弱、矿质元素含量不足、营养贫乏,不能从土壤吸收矿质元素。唐仕云等[5]发现,叶片喷施硫酸亚铁能使蔗株黄白苗转绿。龙光霞等[6]研究发现,强酸性土壤中铝和锰过多,是诱发甘蔗幼苗失绿的主要原因,而陈桂芬等[7]对黄化蔗地土壤和植株的矿质元素进行分析,认为植株体内铁、锰营养不平衡可能是导致宿根甘蔗幼苗黄化的主要原因。同时,水稻[8]、小麦[9]、玉米[10]、甘蓝[11-12]等作物叶片黄化对光合作用影响的研究相对较多。然而,不同黄化程度对柑橘幼苗生长和光合作用影响的报道还较少。
针对相同条件下黄果柑、不知火种子萌芽后存在叶片完全黄化(黄化苗)、不完全黄化(花叶苗)和正常(绿叶苗)植株,且发芽后20 d叶片仍不转绿、30 d后黄化苗和花叶苗逐渐萎蔫的现象,通过对比分析黄化苗、花叶苗和绿叶苗生长及叶片光合作用等相关指标,探讨不同黄化程度对柑橘幼苗生长及光合作用的影响,为柑橘实生苗的正常生长和幼苗黄化现象的分子机制研究提供理论依据。
1 材料与方法
1.1 试验材料
将黄果柑、不知火种子置于石英砂中进行发芽(29 ℃),发芽后幼苗放入人工气候箱中,培养条件为光照强度800 μmol·m-2·s-1,光周期12 h∶12 h(L/D),光照时温度(25±1)℃,夜间温度(20±1)℃,空气相对湿度50%~60%。
于萌芽后20 d,选取黄果柑和不知火黄化苗、花叶苗和绿叶苗为试验材料,对幼苗生长指标及光合作用参数进行测定,并对叶片进行采样,立即用液氮处理,保存于超低温冰箱中(-80 ℃)备用。
1.2 生长量及叶绿素含量的测定
生物量测定:分别把待测新鲜植株地上部和地下部置于105 ℃的烘箱中杀青30 min,然后80 ℃烘干,精确称取质量;根长和株高用游标卡尺进行测量;叶绿素含量的测定采用Moran等[13]的方法。重复3次,取平均值。
1.3游离脯氨酸、丙二醛、可溶性糖及可溶性蛋白质含量测定
脯氨酸(Pro)的测定采用Delauney等[14]的方法;丙二醛(MDA)含量的测定采用Hodges等[15]的方法;可溶性糖(SS)、可溶性蛋白质(SP)含量分别采用硫酸-蒽酮比色法、考马斯亮蓝G-250染色法[16]。
1.4 光合参数及叶绿素荧光特性的测定
于晴天9:30—13:00,选取自植株基部算起第3片完全展开叶片并避开主脉,用便携式光合仪(Li-6400)测定净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间 CO2浓度(Ci)等指标及光合有效辐射(PAR)等光合参数。设定参数为:光照强度800 μmol·m-2·s-1,CO2浓度400 μmol·mol-1,温度25 ℃。
叶绿素荧光特性测定:于9:30—13:00,选取自植株基部算起第3片完全展开功能叶并避开主脉,采用便携式光合仪(Li-6400),CO2浓度400 μmol·mol-1,测定叶片叶绿素荧光参数[17]。先测定光下最大荧光(Fm’)和最小荧光(Fo’),然后将叶片暗适应 30 min,测定初始荧光(Fo)、稳态荧光(Fs)和最大荧光(Fm)。通过以上测定的叶绿素荧光参数计算出光系统Ⅱ(PSⅡ)最大光化学效率(Fv/Fm)=(Fm-Fo)/Fm、光化学猝灭系数(qP)=(Fm’-Fs)/(Fm’-Fo’)和非光化学猝灭系数(NPQ)=(Fm-Fm’)/Fm’[18]。
1.5 数据分析
采用Excel 2016和SPSS 20 软件对试验数据进行方差分析。
2 结果与分析
2.1 黄化对黄果柑和不知火生长的影响
由表1可见,叶片黄化导致黄果柑与不知火幼苗单株干质量、地上和地下部干质量、根长及株高均显著低于绿叶苗,B-E、B-M、H-E、H-M幼苗干质量分别降低了21.8%、15.8%、32.1%和23.9%,说明叶片黄化在一定程度上阻碍了黄果柑、不知火幼苗的正常生长。叶片黄化对不知火、黄果柑幼苗根长和株高的影响存在较大差异,不同黄化程度的不知火幼苗株高均大于黄果柑,但幼苗根长小于黄果柑。
2.2黄化对黄果柑和不知火叶片游离脯氨酸、丙二醛、可溶性糖及可溶性蛋白质含量的影响
由表2可知,随着黄化程度的加深,黄果柑、不知火叶片中游离脯氨酸(Pro)、丙二醛(MDA)、可溶性糖(SS)和可溶性蛋白质(SP)含量均显著增加。不知火黄化苗和花叶苗中MDA含量分别为绿叶苗的1.87、1.52倍,而黄果柑黄化苗、花叶苗中MDA含量分别为绿叶苗的1.79、1.40倍,表明黄化导致叶片脂质过氧化作用。
2.3黄化对黄果柑和不知火光合色素含量的影响
由表3可见,黄果柑、不知火叶绿素a(Chl a)、叶绿素b(Chl b)、类胡萝卜素(Car)含量及光系统反应中心色素的组成比例均随叶片黄化而显著降低(P<0.05);表现黄化苗和花叶苗Chl a、Chl b和Car含量差异不显著,均显著低于绿叶苗(P<0.05)。表明叶片黄化导致叶绿体受到一定程度损伤,影响了光合色素的合成或导致光合色素降解。
表1黄化对黄果柑和不知火生长的影响
Table1Effect of etiolation on growth ofCitruscultivars of Huangguogan and Shiranuhi
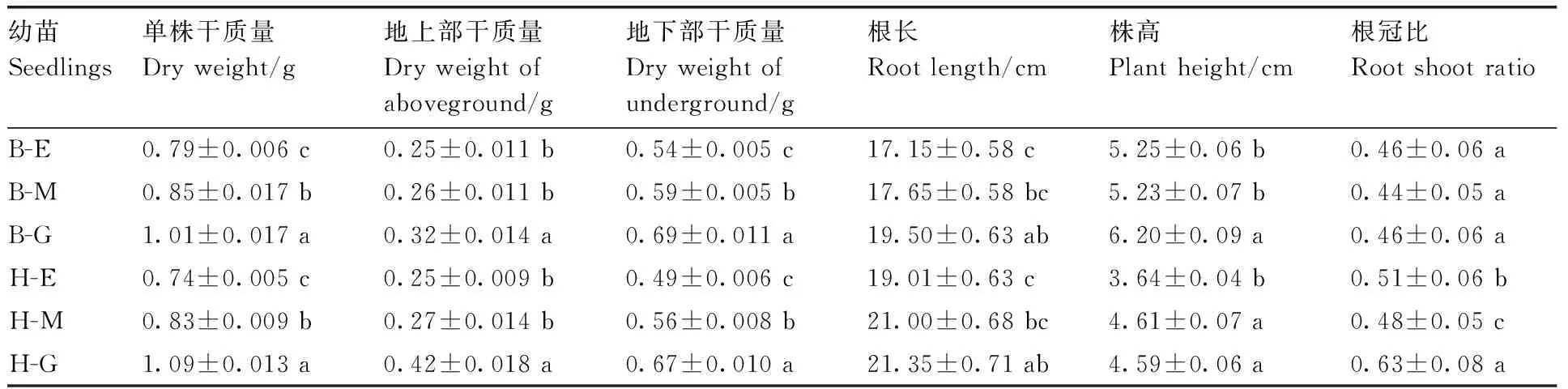
幼苗Seedlings单株干质量Dryweight/g地上部干质量Dryweightofaboveground/g地下部干质量Dryweightofunderground/g根长Rootlength/cm株高Plantheight/cm根冠比RootshootratioB-E0.79±0.006c0.25±0.011b0.54±0.005c17.15±0.58c5.25±0.06b0.46±0.06aB-M0.85±0.017b0.26±0.011b0.59±0.005b17.65±0.58bc5.23±0.07b0.44±0.05aB-G1.01±0.017a0.32±0.014a0.69±0.011a19.50±0.63ab6.20±0.09a0.46±0.06aH-E0.74±0.005c0.25±0.009b0.49±0.006c19.01±0.63c3.64±0.04b0.51±0.06bH-M0.83±0.009b0.27±0.014b0.56±0.008b21.00±0.68bc4.61±0.07a0.48±0.05cH-G1.09±0.013a0.42±0.018a0.67±0.010a21.35±0.71ab4.59±0.06a0.63±0.08a
B-E,不知火-黄化苗;B-M,不知火-花叶苗;B-G,不知火-绿叶苗;H-E,黄果柑-黄化苗;H-M,黄果柑-花叶苗;H-G,黄果柑-绿叶苗。表格内同列中不同字母表示在5%水平上差异显著,所有数据均为平均值及其标准误。下同。
B-E, Shiranuhi-etiolated seedlings; B-M, Shiranuhi-multicoloured seedlings; B-G, Shiranuhi-green seedlings; H-E, Huangguogan-etiolated seedlings; H-M, Huangguogan-multicolored seedlings; H-G, Huangguogan-green seedlings. Values in each column with different letters are significantly different atP=0.05 level. The same as below.
表2黄化对黄果柑和不知火叶片渗透调节物质及丙二醛含量的影响
Table2Effect of etiolation on osmotic adjustment substance and MDA contents in leaves ofCitruscultivars of Huangguogan and Shiranuhi
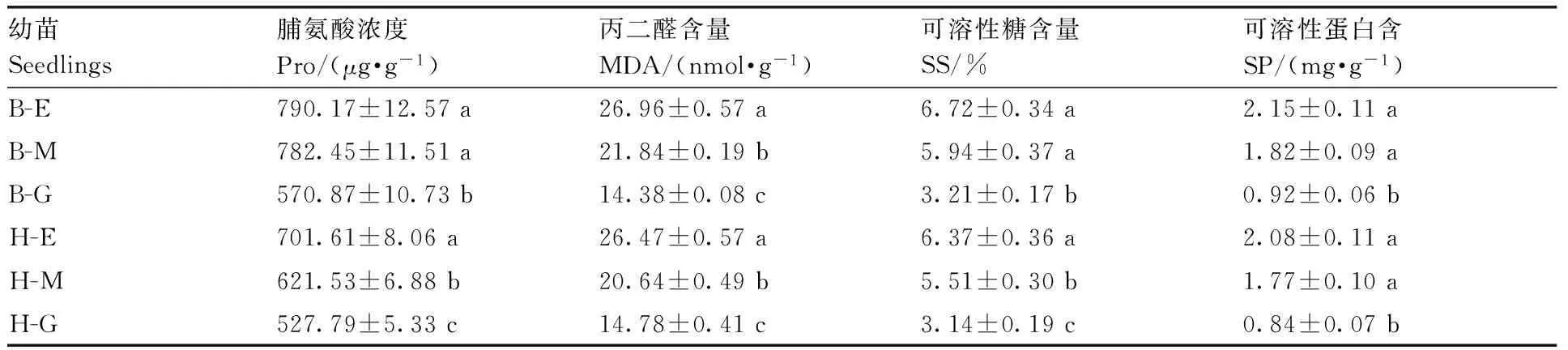
幼苗Seedlings脯氨酸浓度Pro/(μg·g-1)丙二醛含量MDA/(nmol·g-1)可溶性糖含量SS/%可溶性蛋白含SP/(mg·g-1)B-E790.17±12.57a26.96±0.57a6.72±0.34a2.15±0.11aB-M782.45±11.51a21.84±0.19b5.94±0.37a1.82±0.09aB-G570.87±10.73b14.38±0.08c3.21±0.17b0.92±0.06bH-E701.61±8.06a26.47±0.57a6.37±0.36a2.08±0.11aH-M621.53±6.88b20.64±0.49b5.51±0.30b1.77±0.10aH-G527.79±5.33c14.78±0.41c3.14±0.19c0.84±0.07b
表3黄化对黄果柑和不知火光合色素含量的影响
Table3Effect of etiolation on the photosynthetic pigment contents ofCitruscultivars of Huangguogan and Shiranuhi
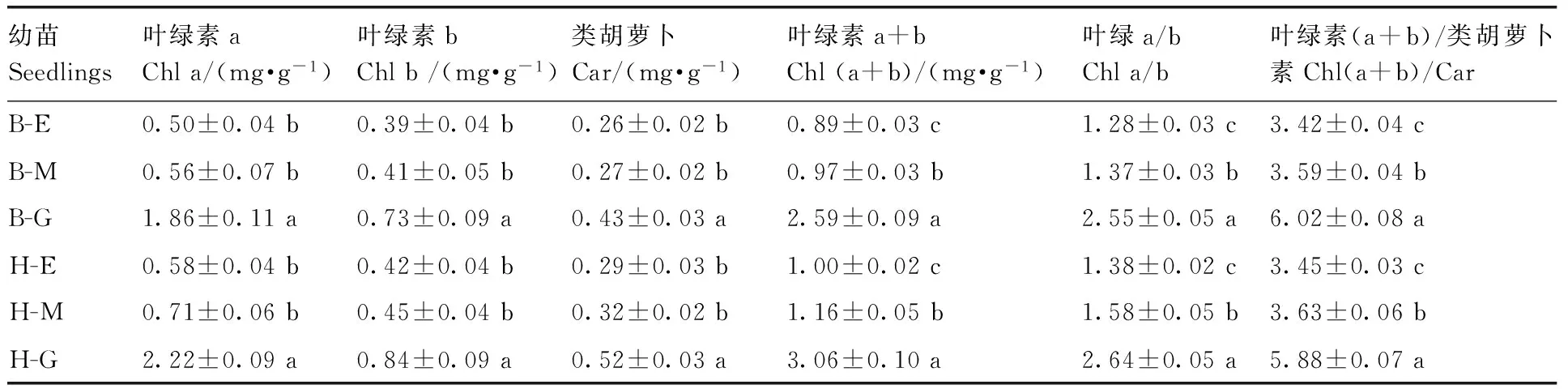
幼苗Seedlings叶绿素aChla/(mg·g-1)叶绿素bChlb/(mg·g-1)类胡萝卜Car/(mg·g-1)叶绿素a+bChl(a+b)/(mg·g-1)叶绿a/bChla/b叶绿素(a+b)/类胡萝卜素Chl(a+b)/CarB-E0.50±0.04b0.39±0.04b0.26±0.02b0.89±0.03c1.28±0.03c3.42±0.04cB-M0.56±0.07b0.41±0.05b0.27±0.02b0.97±0.03b1.37±0.03b3.59±0.04bB-G1.86±0.11a0.73±0.09a0.43±0.03a2.59±0.09a2.55±0.05a6.02±0.08aH-E0.58±0.04b0.42±0.04b0.29±0.03b1.00±0.02c1.38±0.02c3.45±0.03cH-M0.71±0.06b0.45±0.04b0.32±0.02b1.16±0.05b1.58±0.05b3.63±0.06bH-G2.22±0.09a0.84±0.09a0.52±0.03a3.06±0.10a2.64±0.05a5.88±0.07a
2.4不同黄化程度对黄果柑和不知火光合作用的影响
由表4可知,不同黄化程度的黄果柑、不知火叶片光合参数存在一定的差异,叶片黄化对净光合速率(Pn)、胞间CO2浓度(Ci)、蒸腾速率(Tr)的影响较大,呈现绿叶苗(G)>花叶苗(M)>黄化苗(E);B-E、H-E、H-M的净光合速率均为负值,分别为-1.296、-1.048和-1.044 μmol·m-2·s-1,显著低于B-G和H-G;不知火、黄果柑绿叶苗暗呼吸速率分别为-1.90、-1.45 μmol·m-2·s-1(表5),均低于黄化叶片的净光合速率,表明黄化叶片具有一定的光合能力,但光合能力较弱。
2.5净光合速率与光合色素的相关性
Pn与光合色素的相关性见图1,相关系数在0.589 9~0.794 7,Pn与不同色素含量及组成相关系数大小不同,Pn与Chl (a+b)/Car相关系数最大(0.794 7),Pn与Car相关系数最小(0.589 9),表明净光合速率不仅与叶绿素含量有关,还与光合色素的组成有关。
2.6黄化对黄果柑和不知火叶绿素荧光特性的影响
由图2可知,黄化苗叶绿素初始荧光(Fo)、最大荧光(Fm)、可变荧光(Fv)、光化学猝灭系数(qP)和非光化学猝灭系数(NPQ)都显著下降,黄化苗<花叶苗<绿叶苗,PSⅡ潜在活性(Fo/Fv)则与之相反,黄化苗>花叶苗>绿叶苗;不知火和黄果柑幼苗叶片Fo、Fm、Fv、qP、NPQ均呈现黄化苗<花叶苗<绿叶苗,且差异显著(P<0.05);黄化苗和花叶苗的Fv/Fm均下降,黄化苗显著低于绿叶苗,但花叶苗Fv/Fm下降程度较小。结果表明,黄果柑、不知火的光化学活性均受到叶片黄化的不同程度的抑制。
表4黄化对黄果柑和不知火光合作用气体交换参数的影响
Table4Effect of etiolation on photosynthetic gas exchange parameters ofCitruscultivars of Huangguogan and Shiranuhi
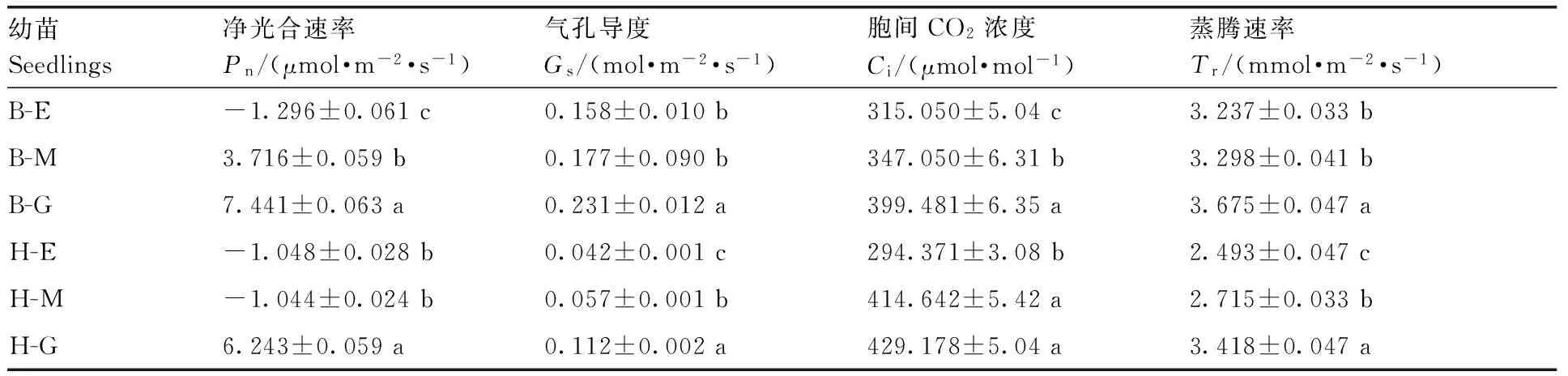
幼苗Seedlings净光合速率Pn/(μmol·m-2·s-1)气孔导度Gs/(mol·m-2·s-1)胞间CO2浓度Ci/(μmol·mol-1)蒸腾速率Tr/(mmol·m-2·s-1)B-E-1.296±0.061c0.158±0.010b315.050±5.04c3.237±0.033bB-M3.716±0.059b0.177±0.090b347.050±6.31b3.298±0.041bB-G7.441±0.063a0.231±0.012a399.481±6.35a3.675±0.047aH-E-1.048±0.028b0.042±0.001c294.371±3.08b2.493±0.047cH-M-1.044±0.024b0.057±0.001b414.642±5.42a2.715±0.033bH-G6.243±0.059a0.112±0.002a429.178±5.04a3.418±0.047a
表5黄果柑和不知火绿叶苗的光响应参数
Table5Light response parameters of green seedlings ofCitruscultivars of Huangguogan and Shiranuhi

幼苗Seedlings表观量子率AQY/(mol·mol-1)最大净光合速率Pnmax/(μmol·m-2·s-1)光饱和点LSP/(μmol·m-2·s-1)光补偿点LCP/(μmol·m-2·s-1)暗呼吸速率Rd/(μmol·m-2·s-1)R2B-G0.0557.64250846-1.900.9938H-G0.0358.45765232-1.450.9988
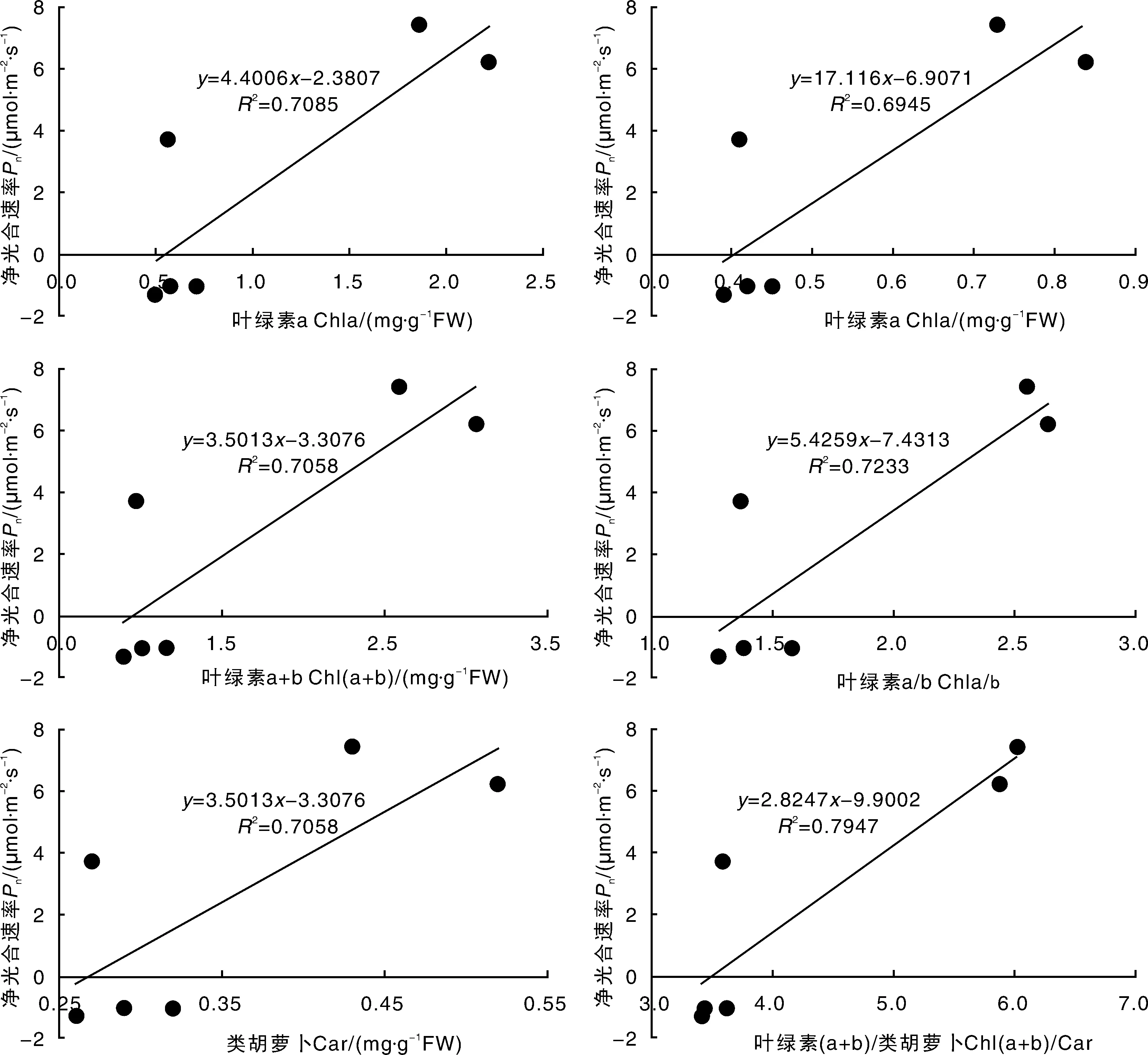
图1 净光合速率与叶绿素含量的相关性Fig.1 Correlation coefficients between net photosynthetic rate (Pn) and pigment contents
3 讨论
绿色植物的生长发育和产量形成主要依赖于光合作用固定CO2合成有机物,光合作用的强弱直接决定了生物产量和经济产量的高低[19]。本试验表明,叶片黄化抑制了黄果柑、不知火幼苗的正常生长,黄化苗的生长量显著低于绿叶苗,虽然不知火黄化苗、花叶苗和绿叶苗株高分别大于黄果柑,但幼苗根长均小于黄果柑,说明叶片黄化对不同柑橘品种的根长、株高的影响存在一定的差异。
Campos等[20]研究发现,渗透调节物质Pro和SS的积累增加,有助于清除植株体内的活性氧,避免细胞膜质过氧化。渗透调节物质积累是清除活性氧、维持生物膜结构和功能正常而采取的一种有效防御措施[21]。本研究发现,黄化对黄果柑、不知火叶片渗透调节物质的影响存在差异,从增长幅度看,SP>SS>Pro。黄化苗MDA含量均显著升高,表明叶片黄化导致活性氧物质的积累,黄化幼苗可能存在细胞膜质过氧化作用。同时,不知火、黄果柑自身也可能存在一种对叶片黄化的应答调控机制,但不同品种存在一定的差异,这有待进一步研究。
光合作用是植物有机物质积累、生长发育的基础,叶片光合效率与自身因素如叶绿素含量、叶片厚度、叶片成熟程度密切相关[22],又受光照强度[23]、气温、空气相对湿度、土壤含水量[24-25]等外界因子影响。本研究发现,黄化苗叶片叶绿素a、叶绿素b和类胡萝卜素含量显著降低,可能是因为叶片黄化导致脂质过氧化作用,造成叶绿体结构和叶绿素合成前体遭到了破坏,进而影响了光合色素的合成或导致光合色素降解。在叶绿素含量基本一致的情况下,不同柑橘品种黄化苗净光合速率存在较大差异,这也说明光合色素含量并不是影响光合效率的唯一因素[26]。相关性分析表明,Pn与Chl (a+b)/Car相关系数最大,所以Pn不仅与叶绿素含量有关,还与光合色素的组成有关。
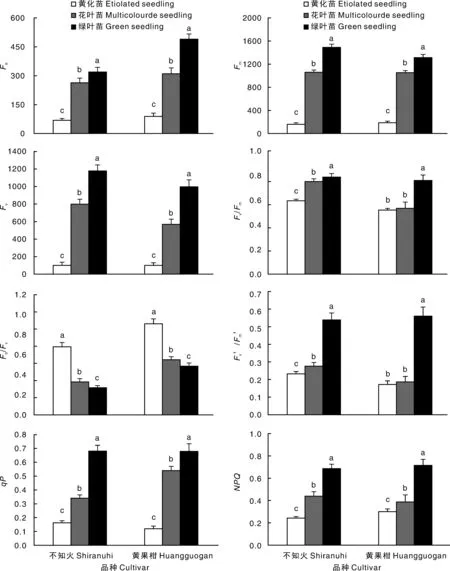
同一品种不同类型间没有相同小写字母表示差异显著(P<0.05)The bars with differnt lowercase letters showed significant difference (P<0.05)图2 黄化对黄果柑和不知火叶绿素荧光特性的影响Fig.2 Effect of etiolation on chlorophyll fluorescence characteristics of Citrus cultivars of Huangguogan and Shiranuhi
研究还发现,黄果柑、不知火黄化苗的Pn均为负值,但都分别高于绿叶苗的暗呼吸速率,黄化显著降低了叶片的Gs、Ci和Tr。另有研究发现,Tr的大小在一定程度上反映了植物调节水分损失的能力及适应逆境的能力[27],表明叶片黄化抑制了黄果柑、不知火的光合作用,虽然黄化苗具有一定的光合能力,但净光合速率为负值,光合作用所产生的能量远不能满足正常生长发育所需。
本研究发现,随着叶绿素含量的下降,黄化苗、花叶苗Fo、Fm、Fv、qP和NPQ都显著下降,说明黄化苗、花叶苗叶片将更多的光能用于光化学电子传递,但光合电子传递速率较低,大部分光能则要通过热耗散途径进行消耗,导致黄化苗光能利用效率和Pn显著降低。Fv/Fm反映的是最大光化学效率,是判定光抑制的重要指标[28-29],而黄化苗和花叶苗的Fv/Fm均出现下降,黄化苗显著低于绿叶苗,但花叶苗Fv/Fm下降程度较小,说明叶片黄化对黄果柑、不知火幼苗造成明显的光抑制,但Fv/Fm对叶片不完全黄化反应不灵敏,这与前人的研究结果一致[30-32]。
综上所述,叶片黄化导致幼苗生物量、叶绿素含量及光合能力下降,叶片积累大量脯氨酸和可溶性蛋白质参与渗透调节。虽然黄化苗具有一定的光合能力,但黄化苗的细胞结构和功能的完整性遭到破坏,光合作用所产生的能量远不能满足正常生长所需,是黄化苗不能正常生长的重要原因。
[1] 胡志峰, 郁继华. UV-B辐射对黄化番茄幼苗生长及光合作用的影响[J]. 甘肃农业大学学报, 2014, 49(5): 75-79. HU Z F, YU J H. Effects of UV-B on growth and photosynthesis in etiolation type tomato seedling[J].JournalofGansuAgriculturalUniversity, 2014, 49(5): 75-79. (in Chinese with English abstract)
[2] 曹辰兴, 张松, 郭红芸, 等. 黄瓜无毛突变体叶片叶绿体超微结构与光合特性[J]. 园艺学报, 2002, 29(2): 145-148. CAO C X, ZHANG S, GUO H X, et al. Ultrastructure and photosynthetic characters of leaf chloroplast in glabrous cucumber[J].ActaHorticulturaeSinica, 2002, 29(2): 145-148. (in Chinese with English abstract)
[3] 黄台明, 薛进军, 方中斌, 等. 红壤土施石灰过量导致芒果发生缺铁失绿症的矫正试验[J]. 广西农学报, 2008, 23(1): 15-22. HUANG T M, XUE J J, FANG Z B, et al. A rectification experiment on iron-deficiency chlorosis of mango resulted from excessive lime application[J].JournalofGuangxiAgriculture, 2008, 23(1): 15-22. (in Chinese with English abstract)
[4] 罗维钢, 刘要鑫, 仇惠君, 等. 宿根甘蔗黄化苗根系活力及其营养特性研究[J]. 南方农业学报, 2013, 44(6): 930-933. LUO W G, LIU Y X, QIU H J, et al. Root activity and nutrition characteristics of etiolated seedling roots in ratoon sugarcane[J].JournalofSouthernAgriculture, 2013, 44(6): 930-933. (in Chinese with English abstract)
[5] 唐仕云, 谭裕模 杨荣仲, 等. 喷施微肥对宿根甘蔗黄白苗的影响初报[J]. 广西农业科学, 2008, 39(2): 187-191. TANG S Y, TAN Y M, YANG R Z, et al. Effects of spraying microelement fertilizer on yellow and white plants in ratoon cane[J].GuangxiAgriculturalSciences, 2008, 39(2): 187-191. (in Chinese with English abstract)
[6] 龙光霞, 黄渝岚, 何红, 等. 甘蔗幼苗失绿的土壤营养特性初探[J]. 南方农业学报, 2011, 42(8): 931-934. LONG G X, HUANG Y L, HE H, et al. Characterizing nutrient status of soils causing chlorosis in sugarcane seedlings[J].JournalofSouthernAgriculture, 2011, 42(8): 931-934. (in Chinese with English abstract)
[7] 陈桂芬, 唐其展, 黄玉溢, 等. 宿根甘蔗幼苗黄化的原因初探[J]. 南方农业学报, 2012, 43(1): 50-52. CHEN G F, TANG Q Z, HUANG Y Y, et al. Primary research on causes and mechanism of young shoot etiolation in ratoon sugarcane crop[J].JournalofSouthernAgriculture, 2012, 43(1): 50-52. (in Chinese with English abstract)
[8] 王志军, 谢宗铭, 田又升, 等. 膜下滴灌水稻黄化叶片光合特性及叶绿素荧光参数分析[J]. 西北农业学报, 2015, 24(2): 59-65. WANG Z J, XIE Z M, TIAN Y S, et al. Analysis of photosynthetic characteristics and chlorophyll fluorescence kinetic parameters of rice yellowish leaves under condition of drip irrigation with plastic film mulching[J].ActaAgriculturaeBoreali-occidentalisSinica, 2015, 24(2): 59-65. (in Chinese with English abstract)
[9] 安旭尧, 刘聪, 朱传杰, 等. 黄化小麦近等基因系遗传背景、光合和农艺性状分析[J]. 麦类作物学报,2015, 35(11): 1476-1482. AN X Y, LIU C, ZHU C J, et al. Evaluation and analysis of main photosynthetic properties and agronomic characteristics of three xantha wheat NILs[J].JournalofTriticeaeCrop, 2015, 35(11): 1476-1482. (in Chinese with English abstract)
[10] 徐冬平, 刘永明, 汪静, 等. 玉米全生育期黄化材料的光合性能分析[J]. 植物科学学报, 2014, 24(1):67-73. XU D P, LIU Y M, WANG J, et al. The photosynthesis characteristics analysis on a yellow green maize[J].PlantScienceJournal, 2014, 24(1):67-73. (in Chinese with English abstract)
[11] 杨冲, 张扬勇, 方智远, 等. 甘蓝叶色黄化突变体YL-1的光合生理特性及其叶绿体的超微结构[J]. 园艺学报, 2014, 41(06): 1133-1144. YANG C, ZHANG Y Y, FANG Z Y, et al. Photosynthetic physiological characteristics and chloroplast ultrastructure of yellow leaf mutant YL-1 in cabbage[J].ActaHorticulturaeSinica, 2014, 41(06): 1133-1144. (in Chinese with English abstract)
[12] 肖华贵, 杨焕文, 饶勇, 等. 甘蓝型油菜黄化突变体的叶绿体超微结构、气孔特征参数及光合特性[J]. 中国农业科学, 2013, 46(4): 715-727. XIAO H G, YANG H W, RAO Y, et al. Analysis of chloroplast ultrastructure, stomatal characteristic parameters and photosynthetic characteristics of chlorophyll reduced mutant inBrassicanapusL.[J].ScientiaAgriculturaSinica, 2013, 46(4): 715-727. (in Chinese with English abstract)
[13] MORAN R, PORASH D. Chlorophyll determination in intact tissues using N, N-dimethylformamide[J].PlantPhysiology, 1980, 65(3): 478-479.
[14] DELAUNEY A J, VERMA D P S. Proline biosynthesis and osmoregulation in plants[J].PlantJournal, 1993, 4(2): 215-223.
[15] HODGES D M, DELONG J M, FORMEY C F, et al. Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds[J].Planta, 1999, 207(4): 180-198.
[16] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2002: 164-165.
[17] DAI Y J, SHEN Z G, LIU Y, et al. Effects of shade treatments on the photosynthetic capacity, chlorophyll fluorescence and chlorophyll content ofTetrastigmahemsleyanumDiels et Gilg[J].EnvironmentalandExperimentalBotany, 2009, 65(3): 177-182.
[18] GAO M, QI Y, SONG W, XU H. Effects of di-n-butyl phthalate and di (2-ethylhexyl) phthalate on the growth, photosynthesis, and chlorophyll fluorescence of wheat seedlings[J].Chemosphere, 2016, 151: 76-83.
[19] 温国泉, 刘永贤, 农梦玲, 等. 不同植物生长调节剂对南方淮山药叶片光合作用的影响[J]. 西南农业学报, 2016, 29 (7): 1590-1594. WEN G Q, LIU Y X, NONG M L, et al. Effects of plant growth regulators (combination) on leaf photosynthesis of yam in South China[J].SouthwestChinaJournalofAgriculturalSciences, 2016, 29 (7): 1590-1594. (in Chinese with English abstract)
[20] CAMPOS M K F, CARVALHO K, SOUZA F S, et al. Drought tolerance and antioxidant enzymatic activity in transgenic ‘Swingle’ citrumelo plants over-accumulating proline[J].EnvironmentalandExperimentalBotany, 2011, 72(2): 242-250.
[21] 王海珍, 韩路, 徐雅丽, 等. 土壤水分梯度对灰胡杨光合作用与抗逆性的影响[J]. 生态学报, 2017, 37(2): 1-11. WANG H Z, HAN L, XU Y L, et al. Effect of soil water gradient on photosynthetic characteristics and stress resistance of pruinosa in the Tarim Basin, China[J].ActaecologicaSinica, 2017, 37(2): 1-11. (in Chinese with English abstract)
[22] 张媛, 邵建柱, 刘兴菊, 等. 我国板栗光合作用研究进展[J]. 西北林学院学报, 2007, 22 (5): 53-56. ZHANG Y, SHAO J Z, LIU X X, et al. Advances in photosynthesis researches on Chinese chestnut[J].JournalofNorthwestForestryUniversity, 2007, 22 (5): 53-56. (in Chinese with English abstract)
[23] 叶子飘, 于强. 冬小麦旗叶光合速率对光强度和CO2浓度的响应[J]. 扬州大学学报, 2008, 29 (3): 33-37. YE Z P, YU Q. Photosynthetic response to irradiance and CO2concentration for flag leaves of winter wheat[J].JournalofYangzhouUniversity, 2008, 29 (3): 33-37. (in Chinese with English abstract)
[24] 王磊, 胡楠, 张彤, 等. 干旱和复水对大豆叶片光合及叶绿素荧光的影响[J]. 生态学报, 2007, 27(9) : 3630-3636. WANG L, HU N, ZHANG T, et al. Effect of drought and rewatering on photosynthesis and chlorophyll fluorescence of the soybean leaf[J].ActaecologicaSinica, 2007, 27(9): 3630-3636. (in Chinese with English abstract)
[25] 须晖, 高洁, 王蕊, 等. 番茄幼苗叶绿素荧光参数对水分胁迫的响应[J]. 中国农学通报, 2011, 27(10): 189-193. XU H, GAO J, WANG R, et al. Response of water stress on chlorophyll fluorescence parameters of tomato seedlings[J].ChineseAgriculturalScienceBulletin, 2011, 27(10): 189-193. (in Chinese with English abstract)
[26] 董彦红, 赵志成, 张旭, 等. 分根交替滴灌对管栽黄瓜光合作用及水分利用效率的影响[J]. 植物营养与肥料学报, 2016, 22(1): 269-276. DONG Y H, ZHAO Z C, ZHANG X, et al. Improvement of alternate partial root-zone drip irrigation on photosynthesis and water use efficiency of cucumbers[J].JournalofPlantNutritionandFertilizer, 2016, 22(1): 269-276. (in Chinese with English abstract)
[27] 廖玲, 曹淑燕, 荣毅, 等. 不同砧木对黄果柑光合特性、光合作用关键酶及其基因表达的影响[J]. 浙江农业学报, 2016,28(5): 769-775. LIAO L, CAO S Y, RONG Y, et al. Effects of different rootstocks on photosynthetic characteristics, activities and gene expression of key enzymes of photosynthesis in Huangguogan[J].ActaAgriculturaeZhejiangensis, 2016, 28(5): 769-775. (in Chinese with English abstract)
[28] 毕焕改, 董绪兵, 刘培培, 等.CsRCA超表达对高温胁迫下黄瓜幼苗光合作用的影响[J]. 应用生态学报, 2016, 27(7): 2308-2314. BI H G, DONG X B, LIU P P, et al. Influence of over expression ofCsRCAon photosynthesis of cucumber seedlings under high temperature stress[J].ChineseJournalofAppliedEcology, 2016, 27(7): 2308-2314. (in Chinese with English abstract)
[29] ZHOU W, SUI Z, WANG J, et al. Effects of sodium bicarbonate concentration on growth, photosynthesis, and carbonic anhydrase activity of macroalgaeGracilariopsislemaneiformis,Gracilariavermiculophylla, andGracilariachouae(Gracilariales, Rhodophyta)[J].PhotosynthesisResearch, 2016, 128(3): 259-270.
[30] HEERDEN P D R V, STRASSER R J, KRÜGER G. Reduction of dark chilling stress in N2-fixing soybean by nitrate as indicated by chlorophyll a fluorescence kinetics[J].PhysiologiaPlantarum, 2004, 121(2): 239-249.
[31] STRAUSS A J, KRÜGER G, STRASSER R J, et al. Ranking of dark chilling tolerance in soybean genotypes probed by the chlorophyll a fluorescence transient O-J-I-P[J].EnvironmentalandExperimentalBotany, 2006, 56(2): 147-157.
[32] 杨兴洪, 邹琦, 赵世杰. 遮荫和全光下生长的棉花光合作用和叶绿素荧光特征[J]. 植物生态学报, 2005, 29(1): 8-15. YANG X H, ZOU Q, ZHAO S J. Photosynthetic characterisitics and chlorophyll fluorescence in leaves of cotton plants grown in full light and 40% sunlight[J].ActaPhytoecologicaSinica, 2005, 29(1): 8-15. (in Chinese with English abstract)
(责任编辑张 韵)
Effectofdifferentdegreesofetiolationongrowthandphotosynthesisofhybridcitrus
XIONG Bo1, YAN Qiaoqiao2, SUN Guochao1, QIU Xia1, YE Shuang1, LIAO Ling1, LUO Jinyu1, DAI Lin1, WANG Zhihui1,*
(1.CollegeofHorticulture,SichuanAgriculturalUniversity,Chengdu611130,China; 2.SichuanEngineeringTechnicalCollege,Deyang618000,China)
In order to study the effect of different etiolation degrees onCitrusseedling growth and photosynthesis,Citruscultivars Huangguogan and Shiranuhi seedlings were used as the materials, to analyze the changes of seedling biomass, chlorophyll content, photosynthetic parameters and chlorophyll fluorescence characteristics of etiolated, multicoloured and green seedlings. The results showed that the normal growth ofCitruscultivars Huangguogan and Shiranuhi seedlings was inhibited by etiolation, and the growth of etiolated seedlings was significantly lower than that of green seedlings. The contents of free proline (Pro), malondialdehyde (MDA), soluble sugar (SS) and soluble protein (SP) were significantly increased in the leaves of etiolated seedlings. Seedling etiolation could significantly reduce the content of chlorophyll a, chlorophyll b, carotenoid and photosynthetic gas exchange parameters (stomatal conductance, intercellular CO2concentration, transpiration rate), and change the composition ratio of the chlorophyll. Maximal photochemical efficiency (Fv/Fm), photochemical quenching (qP), and non-photochemical quenching (NPQ) of etiolated seedlings were significantly lower than those of green seedlings, but theFv/Fmof multicoloured seedlings was decreased slightly. This study indicated that seedling etiolation inhibited the normal growth and photosynthetic capacity ofCitrusseedlings.
Huangguogan; Shiranuhi; etiolation; seedlings; photosynthesis
S666.9
:A
:1004-1524(2017)09-1506-09
熊博,严巧巧,孙国超,等.不同黄化程度对杂柑幼苗生长及光合作用的影响[J].浙江农业学报,2017,29(9): 1506-1514.
10.3969/j.issn.1004-1524.2017.09.12
2017-03-20
四川省科技厅项目(2016NZ0056);四川省教育厅项目(14CZ0002)
熊博(1988—),男,四川达州人,硕士研究生,主要从事果树栽培理论与技术研究。E-mail: xiongbo200977@163.com
*通信作者,汪志辉,E-mail: wangzhihui318@126.com
