ALK在肺腺癌中表达情况的分析及靶向治疗
2017-09-27刘丽波韩志峰薛锦儒
刘丽波,苗 帅,韩志峰,薛锦儒,辛 华,杨 斌*
(1.吉林大学第四医院 肿瘤内科,吉林 长春130011;2.吉林大学中日联谊医院 a.老年病科;b.胸外科)
ALK在肺腺癌中表达情况的分析及靶向治疗
刘丽波1,苗 帅2a,韩志峰2b,薛锦儒2b,辛 华2b,杨 斌2b*
(1.吉林大学第四医院 肿瘤内科,吉林 长春130011;2.吉林大学中日联谊医院 a.老年病科;b.胸外科)
表皮生长因子受体(EGFR)突变检测及其EGFR-TKI的使用是非小细胞肺癌(NSCLC)治疗史上里程碑式的进展[1]。继EGFR之后,间变性淋巴瘤激酶(ALK)重排也己成为NSCLC尤其是肺腺癌中一个非常重要的分子亚型[2]。2007年Soda 等[3]首次在1 例肺腺癌组织标本中扩增出一种致瘤的变异融合基因—棘皮动物微管相关类蛋白4-间变性淋巴瘤激酶(EML4-ALK)。随后国内外多项研究发现该融合基因是除EGFR 突变及K-Ras 突变外的另一个重要的酪氨酸激酶抑制剂的作用靶点[4,5]。但鉴于ALK重排发生的阳性率较低,采用FISH方法作为筛选手段价格昂贵。本研究采用特定的检测流程,从特定的腺癌人群中筛选出EML4-ALK融合基因阳性的患者,现将结果报告如下。
1 材料与方法
1.1 研究对象
选取吉林大学中日联谊医院及吉林大学第四医院2013-2015年手术切除和经皮肺穿刺活检病理确诊的不吸烟或轻度吸烟96例肺腺癌患者石蜡包埋组织。年龄32-77岁,平均年龄59岁;男性23例(24.0%),女性73例(76.0%)。所有病例术前均未行化疗、放疗或靶向治疗。一生中吸烟< 100支定义为不吸烟。按2009 国际肺癌研究学会( IASLC) 公布的第7 版肺癌TNM 分期标准:Ⅰ期6例,Ⅱ期12 例,Ⅲ期65 例,Ⅳ期13例。
采用实体瘤疗效评价标准评价疗效(RECIST,1.0 版),疗效判定包括完全缓解(CR),部分缓解(PR),疾病稳定(SD)及疾病进展(PD)。总缓解率(ORR)包括 CR 和PR。疾病控制率(DCR)包括 CR、PR和SD。本研究经吉林大学中日联谊医院伦理委员会及吉林大学第四医院伦理委员会批准。
1.2 方法
1.2.1 DNA 提取及定量 石蜡包埋组织切片经二甲苯脱蜡及无水乙醇脱水后,采用FFPE gDNA Miniprep Kit(BIOMIGA公司) 提取基因组DNA,所有步骤按照说明书进行操作。DNA 提取后,用Nano-Drop fluorospectrometer(ND-1000,Thermal Fisher 公司) 检测浓度,并且评估DNA质量。选取260/280比值在1.8-2.0之间的DNA样品进行实验。
1.2.2 用PCR-荧光探针法(ARMS)检测肺癌组织中EGFR、KRAS基因突变,按试剂盒说明进行。
1.2.3 荧光原位杂交技术(FISH)检测EML4-ALK融合基因 (1) FISH 检测:采用直接法,Vysis LSI ALK 双色分离重排探针试剂购自美国雅培公司。切片行常规二甲苯脱蜡,100%、85%和70%乙醇依次梯度水化,蛋白酶K(80 mg/ml,pH 2.0) 消化处理;4%中性甲醛固定后,再行70%、85%和100%乙醇梯度脱水,加入5 μl探针于组织切片上;置于原位杂交仪( DAKO公司)中,75℃变性10 min,37℃杂交16 h;然后将切片置洗涤液Ⅰ(0.4×SSC,0.3%NP-40)1min,洗涤液Ⅱ(2×SSC,0.1% NP-40)1 min去除多余探针,室温暗处干燥加DAPI染色,封固,暗处放置20 min后在荧光显微镜(Olympus公司)100倍油镜下观察,分别在DAPI、FITC、RHOD 通道下观察细胞内荧光信号并拍照记录。
(2)结果判定方法:至少观察50个肿瘤细胞,如果50个肿瘤细胞中至少有25个存在分离信号(>50%)则直接判断为ALK FISH阳性;如果这50个细胞中分离信号细胞为5-25个(10%-50%),则再重复计数50个细胞,若这100个肿瘤细胞中,超过15个肿瘤细胞存在分离信号(15%),则判定为ALK FISH阳性。
1.2.4 统计学方法 应用SPSS 19.0 软件进行统计学分析,EML4-ALK 各组间表达水平与各临床病理参数之间的比较采用χ2检验、连续校正χ2检验或Fisher 精确概率。P<0.05为差异有统计学意义。
1.2.5 克里唑替尼靶向治疗 (1)靶向治疗对象:选取荧光原位杂交(FISH)检测ALK融合基因阳性患者行克里唑替尼靶向治疗。(2)药物及剂量:克里唑替尼由美国辉瑞公司提供,250毫克,每日两次口服。(3)靶向治疗疗效分析:①.选取靶向治疗开始后8周考察患者对克里唑替尼靶向治疗的反应率。②.选取8周、6个月及1年为时间点考察客观缓解率(ORR)和疾病控制率(DCR),其中疗效判定按标准的实体瘤反应评价标准分类(RECIST)。
2 结果
2.1 对96例不吸烟或轻度吸烟肺腺癌患者进行了EML4-ALK、EGFR、KRAS的检测,发现在中国肺腺癌患者中各种基因所占比例:EGFR(39/96,43.3%)、KRAS (20/96,20.8%)、EML4-ALK (8/96,8.3%)。
2.2 37例EGFR突变及KRAS突变双野生型患者8例ALK阳性(21.6%,8/37)。统计分析显示,ALK阳性患者与ALK阴性患者年龄无差异(52.5岁vs.58岁,P=0.083)。男性和女性患者中ALK阳性率无差异(2/10,20.0%;6/27,22.2%,P=1.000 )。不同分期患者ALK阳性率也未见差异(P=1.000)。8例ALK阳性肿瘤中,6例(75.0%)为红绿分离信号,2例(25.0%)为单红信号。见表1。
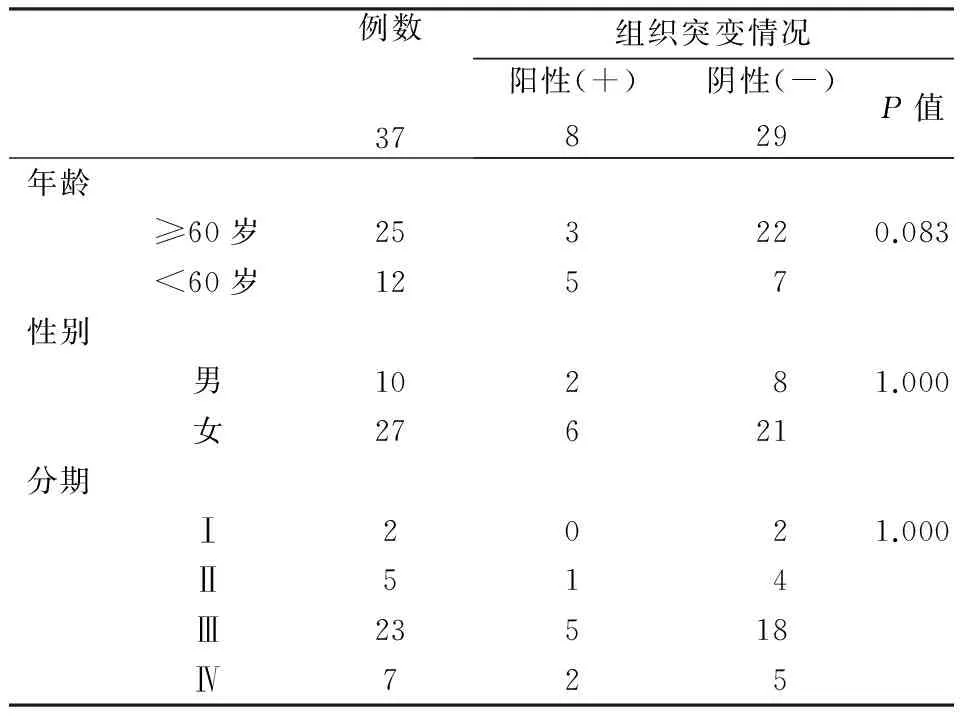
表1 EML4-ALK融合基因阳性患者的临床特征与阳性率的关系
2.3 靶向治疗结果,因病例数较少无法进行克里唑替尼的客观缓解率(ORR)和疾病控制率(DCR)的统计学分析,单纯进行临床疗效观察,每6-8周随访一次,截止随访时间1年,其中CR 1例,PR 3例,SD 2例,PD 2例。客观缓解率(ORR)和疾病控制率(DCR)分别为50%和75%。患者耐受性良好,生存质量明显提高。
3 讨论
间变性淋巴瘤激酶是目前非小细胞肺癌中研究较多的驱动基因[6]。ALK基因位于人类2号染色体短臂2p23区,它可与5号染色体上的启动子序列NPM(nucleophosmin)转位进行融合,导致ALK激酶的组成性激活。目前,ALK基因的异常激活驱动着多种肿瘤的形成,其活化形式包括基因重排,突变和基因扩增等。依赖ALK基因异常来驱动其生长被称为“ALKOMA”,这一类肿瘤拥有共同的驱动靶点,并能从ALK靶向治疗中获益。EML4基因断裂后与ALK基因的24号外显子融合,形成EML4-ALK融合基因;EML4断裂位点不同可以与ALK形成不同的EML4-ALK融合基因变体。
ALK融合基因检测目前有FISH、RT-PCR和IHC等三种主要检测手段,各种方法各有其优缺点。本研究采用原位免疫荧光法进行检测以期达到最准确的结果。
既往研究显示,EML4-ALK 融合基因在东亚地区肺癌患者中的发生率约为3%-7%,且更易表达于肺腺癌这一组织学亚型中[7]。林小梅等[8]报道在102 例国人NSCLC 患者中发现EML4-ALK融合基因的阳性表达率为7.8% (8/102),且EML4-ALK 阳性患者中腺癌占62.5%。Shaw等[9]通过大样本临床研究发现欧美人群EML4-ALK 的阳性表达率为13.5%(19/141),EML4-ALK 融合基因型者多为年轻男性、不吸烟或轻度吸烟的腺癌患者。而在本研究中EML4-ALK融合基因阳性表达率为8.3%,由于本研究中EML4-ALK 融合基因阳性患者样本量较小,表现出其在年轻女性患者中多见,与既往研究结果不相符[10],因此仍需大样本资料作进一步研究。许多临床前研究都证实ALK抑制剂能显著抑制具有EML4-ALK融合基因的肿瘤生长[11]。多个临床试验也已证实克里唑替尼可以给具有ALK重排的患者带来非常明显的获益[12,13],然而并不是所有的ALK重排患者都能从克里唑替尼治疗中获益。
本研究中96例肺腺癌不吸烟或轻度吸烟患者进行了EML4-ALK、EGFR、KRAS的检测,发现在中国北方肺腺癌患者中各种基因所占比例:EGFR (39/96,43.3%)、KRAS (20/96,20.8%)、EML4-ALK(8/96,8.3%)。37例EGFR突变及KRAS突变双野生型患者8例ALK阳性(21.6%,8/37)。ALK阳性患者与ALK阴性患者年龄无差异,与文献报道不一致[14],可能与病例数较少有关。男性和女性患者中ALK阳性率无差异,但从数量上看女性患者多于男性患者。不同分期患者ALK阳性率未见差异,但从表中所见ALK阳性患者多分期较晚。
因本组病例数较少,无法进行克里唑替尼的总缓解率(ORR)和疾病控制率(DCR)的统计学分析,单纯进行临床疗效观察,每6-8周随访一次,截止随访时间1年,其中CR1例,PR3例,SD2例,PD2例。客观缓解率(ORR)和疾病控制率(DCR)分别为50%和75%。尤其其中一例完全缓解的患者,为一中年女性,右下肺腺癌,双侧胸膜转移伴大量胸腔积液,给予克里唑替尼治疗8周后,胸腔积液完全消失,6个月后右肺肿物减小50%以上,且伴有中心坏死,表现出非常好的治疗效果。
包括激酶抑制剂在内的抗肿瘤药物的一个主要问题是毒性作用,最常见的不良反应为恶心、呕吐、乏力、腹泻。本组患者未见严重毒性反应,总体耐受性良好。
通过本研究我们获得了在我国北方特定的人群中(肺腺癌不吸烟或轻度吸烟,EGFR、KRAS双野生型)EML4-ALK的表达情况,同时通过对ALK阳性患者的靶向治疗,观察了克里唑替尼靶向治疗的疗效和毒性反应,为我国北方ALK阳性患者的靶向治疗积累了一定的经验,未来的研究需要提高样本量或开展多中心合作,并需要大量的随访研究,为EML4-ALK融合基因的研究提供更充分的依据。随着EML4-ALK 抑制剂克里唑替尼靶向治疗的逐渐开展,将给这类亚型的肺癌患者带来新的个体化靶向治疗机会[15,16]。
[1]Sequist LV,Martins RG,Spigel D,et al.First-line gefitinib in patients with advanced non-small-cell lung cancer harboring somatic EGFR mutations[J].J Clin Oncol,2008,26(15):2442.
[2]Sasaki T,Rodig SJ,Chirieac LR,et al.The biology and treatment of EML4-ALK in non-small-cell lung cancer [J].Eur J Cancer,2010,46(10) :1773.
[3]Soda M,Choi YL,Enomoto M,et al.Identification of the transforming EML4-ALK fusion gene in non-small-cell lung cancer[J].Nature,2007,448(7153):561.
[4]Fukuyoshi Y,Inoue H,Kita Y,et al.EML4-ALK fusion transcript is not found in gastrointestinal and breast cancers[J].Br J Cancer,2008,98(9):1536.
[5]Inamura K,Takeuchi K,Togashi Y,et al.EML4-ALK fusion is linked to histological characteristics in a subset of lung cancers[J].J Thorac Oncol,2008,3(1):13.
[6]Paik JH,Choi CM,Kim H,et al.Clinicopathologic implication of ALK rearrangement in surgically resected lung cancer:a proposal of diagnostic algorithm for ALK-rearranged adenocarcinoma[J].Lung Cancer,2012,76(3):403.
[7]Horn L,Pao W.EML4-ALK:honing in on a new target in nonsmall-cell lung cancer[J].J Clin Oncol,2009,27(26):4232.
[8]林小梅,莫娟梅,邹 敏,等.EGFR 突变的非小细胞肺癌患者EML4-ALK 融合基因的检测及其临床特征分析[J].中国病理生理杂志,2012,28(6):1135.
[9]Shaw AT,Yeap BY,Mino-Kenudson M,et al.Clinical features and outcome of patients with non-small-cell lung cancer who harbor EML4-ALK[J].J Clin Oncol,2009,27(26):4247.
[10]Doval D,Prabhash K,Patil S,et al.Clinical and epidemiological study of EGFR mutations and EML4-ALK fusion genes among Indian patients with adencarcinoma of the lung[J].Onco Targets Ther,2015,8:117.
[11]Sasaki T,Rodig SJ,Chirieac LR,et al.The biology and treatment of EML4-ALK non-small-cell lung cancer [J].Eur J Cancer,2010,46(10):1773.
[12]Shaw AT,Yeap BY,Solomon BJ,et al.Effect of crizotinib on overall survival in patients with advanced non-small-cell lung cancer harbouring ALK gene rearrangement:A retrospective analysis[J].Lancet Oncol,2011,12(11):1004.
[13]Ou SH,Bartlett CH,Mino-Kenudson M,et al.Crizotinib for the treatment of ALK-rearranged non-small cell lung cancer:A success story to usher in the second decade of molecular targeted therapy in oncology[J].Oncologist,2012,17(11):1351.
[14]Bang YJ.Treatment of ALK-positive non-small-cell lung cancer [J].Arch Pathol Lab Med,2012,136(10):1201.
[15]Sudhindra A,Ochoa R,Santos ES.Biomarkers,prediction,and prognosis in non-small-cell lung cancer:A platform for personalized treatment[J].Clin Lung Cancer,2011,12(6):360.
[16]Langer CJ.Individualized therapy for patients with non-small-cell lung cancer:Emerging trends and challenges[J].Crit Rev Oncol Hematol,2012,83(1):130.
吉林省卫生计生委(2014ZC045);吉林省科技厅国际合作处(3D513N203430)
*通讯作者
1007-4287(2017)09-1343-03
2016-04-11)
